Купити Кальцинована соду, натріое вуглекислий, карбонат натрію за найкращою ціною в Україні
Натрій вуглекислий, карбонат натрію, кальцинована сода
Час роботи: Пн-Пт 8:00 — 21:00, Сб-Нд 9:00 — 18:00
Обід з 12.00 до 13.00
Карбонат натрію, 3OC2Na10h3O (також відомий як карбонат натрію, миюча сода, кальцинована сода та кристали соди) являє собою неорганічну сполуку з формулою Na2CO3 та її різними гідратами. Всі форми є білі, без запаху, водорозчинні солі, які дають помірно лужні розчини у воді. Історично склалося так, що його витягали із золи рослин, які ростуть на багатих натрієм ґрунтах. Оскільки зола цих багатих натрієм рослин помітно відрізнялася від деревної золи (яка колись використовувалася для виробництва поташу), карбонат натрію став відомий як «кальцинована сода». Він виробляється у великих кількостях з хлориду натрію і вапняк методом Сольвея. Карбонат натрію одержують у вигляді трьох гідратів і у вигляді безводної солі:
декагідрат карбонату натрію (натрон), Na2CO310h3O, який легко виводиться з утворенням моногідрату.
гептагідрат карбонату натрію (не відомий у мінеральній формі), Na2CO37h3O.
моногідрат карбонату натрію(Термонатрит), Na2CO3h3O. Також відомий як кристалічний карбонат.
безводний карбонат натрію, також відомий як кальцинована сода, утворюється при нагріванні гідратів. Він утворюється також при нагріванні (прожарюванні) гідрокарбонату натрію, наприклад, на заключній стадії процесу Сольвея.
Декагідрат утворюється з водних розчинів, що кристалізуються в діапазоні температур від -2,1 до +32,0 °C, гептагідрат у вузькому діапазоні від 32,0 до 35,4 °C і вище цієї температури утворюється моногідрат. У сухому повітрі декагідрат і гептагідрат втрачають воду, утворюючи моногідрат. Повідомлялося про інші гідрати, наприклад з 2,5 одиницями води на одиницю карбонату натрію («пентагідрат»).
Сода для миття посуду
Декагідрат карбонату натрію (Na2CO310h3O), також відомий як миюча сода, є найбільш поширеним гідратом карбонату натрію, що містить 10 молекул кристалізаційної води.
Це білекристалічна тверда речовина;
Це один із небагатьох карбонатів металів, розчинних у воді;
Він лужний; він перетворює червоний лакмусовий папірець на синій;
Він має миючі властивості завдяки процесу омилення, який робить жири і жири змішуються з водою.
Деякі поширені області застосування карбонату натрію (або пральної соди) включають:
Карбонат натрію (або сода для прання) використовується як очищувальний засіб для побутових цілей, таких як прання одягу. Карбонат натрію входить до складу сухих мильних порошків.
Він використовується для видалення тимчасової та постійної жорсткості води. (Див. Пом’якшення води).
Він використовується у виробництві натрію сполук, таких як бура.
Виробництво скла
Карбонат натрію служить флюсом для кремнезему, знижуючи температуру плавлення суміші до чогось досяжного без спеціальних матеріалів.
 Це «содове скло» слабо розчинне у воді, тому всуміш розплаву додають трохи карбонату кальцію, щоб зробити скло нерозчинним. Пляшкове та віконне скло (содово-вапняне скло) виготовляється шляхом плавлення таких сумішей карбонату натрію, карбонату кальцію та кварцового піску (діоксид кремнію (SiO2)). Коли матеріали нагріваються, карбонати виділяють вуглекислий газ. Таким чином, карбонат натрію є джерелом натрію оксиду. Натрієво-вапняне скло протягом століть було найпоширенішою формою скла.
Це «содове скло» слабо розчинне у воді, тому всуміш розплаву додають трохи карбонату кальцію, щоб зробити скло нерозчинним. Пляшкове та віконне скло (содово-вапняне скло) виготовляється шляхом плавлення таких сумішей карбонату натрію, карбонату кальцію та кварцового піску (діоксид кремнію (SiO2)). Коли матеріали нагріваються, карбонати виділяють вуглекислий газ. Таким чином, карбонат натрію є джерелом натрію оксиду. Натрієво-вапняне скло протягом століть було найпоширенішою формою скла.Жорстка вода містить розчинені сполуки, зазвичай сполуки кальцію чи магнію. Карбонат натрію використовується для видалення тимчасової та постійної жорсткості води.
Оскільки карбонат натрію розчинний у воді, а карбонат магнію та карбонат кальцію нерозчинні, перший використовується для пом’якшення води шляхом видалення Mg 2+ та Ca 2+. Ці іони утворюють тверді нерозчинні опади при обробці карбонат-іонами.
Вода пом’якшується, тому що вона більше не містить розчинених іонів кальцію та іонівмагнію.
Карбонат натрію має кілька застосувань на кухні, в основному тому, що він є міцнішою основою, ніж харчова сода (бікарбонат натрію), але слабше лугу (який може відноситися до гідроксиду натрію або, рідше, гідроксиду калію). Лужність впливає на вироблення клейковини в тесті, що замішується, а також покращує підрум’янювання за рахунок зниження температури, при якій відбувається реакція Майяра. Щоб скористатися першим ефектом, карбонат натрію, таким чином, є одним з компонентів кансуї (Кан), розчину лужних солей, що використовуються для приготування японського рамена локшина має характерний смак і жувальною текстурою; аналогічне рішення використовується в китайській кухні для приготування ламіану з аналогічних причин. Кантонські пекарі аналогічним чином використовують карбонат натрію як замінник лужної води, щоб надати місячним тістечкам їх характерну текстуру та покращити підрум’янення. У німецькій кухні (і в більш широкому розумінніцентральноєвропейській кухні) хліб, такий як крендельки та булочки зі лугом, традиційно оброблені лугом для поліпшення підрум’янювання, можна натомість обробити карбонатом натрію; карбонат натрію не викликає такого сильного підрум’янювання, як луг, але набагато безпечніше та простіше в роботі.
Карбонат натрію використовується у виробництві порошку шербету. Відчуття охолодження та шипіння виникає в результаті ендотермічної реакції між карбонатом натрію та слабкою кислотою, зазвичай лимонною кислотою, що виділяє газоподібний діоксид вуглецю, яка відбувається, коли шербет зволожується слиною.
Карбонат натрію також знаходить застосування в харчовій промисловості як харчова добавка (Е500) в якості регулятора кислотності, засоби проти стеження, розпушувача і стабілізатора. Він також використовується у виробництві снюсу для стабілізації рН кінцевого продукту.
Хоча він менш схильний до хімічних опіків, ніж луг, все ж необхідно бути обережним при роботі зкарбонатом натрію на кухні, оскільки він викликає корозію алюмінієвого посуду, посуду та фольги.
Карбонат натрію також використовується як відносно міцна основа в різних областях. Як звичайна луг, вона переважна в багатьох хімічних процесах, тому що вона дешевша за гідроксид натрію і набагато безпечніша в обігу.
Наприклад, він використовується як регулятор рН для підтримки стабільних лужних умов, необхідних для дії більшості проявників фотоплівки. Це також поширена добавка у басейнах та акваріумній воді для підтримки бажаного рН та карбонатної жорсткості (KH). Забарвити волоконно-реактивні барвники, карбонат натрію (часто під ім’ям, наприклад, кальцинованої соди фіксатив або кальцинованої соди активатор) служить для забезпечення належного хімічного зв’язування барвника з целюлозу (рослинні) волокна, як правило, перш ніж фарбувати (за краватку)барвники), змішаного з барвником (фарба для малювання), або після фарбування (для занурення фарбування). Він також використовується в процесі пінної флотації для підтримки сприятливого рН як поплавковий кондиціонер, крім CaO та інших слабоосновних сполук.
Попередник інших з’єднань
Бікарбонат натрію (NaHCO 3) або харчова сода, що також входить до складу вогнегасників, часто утворюється з карбонату натрію.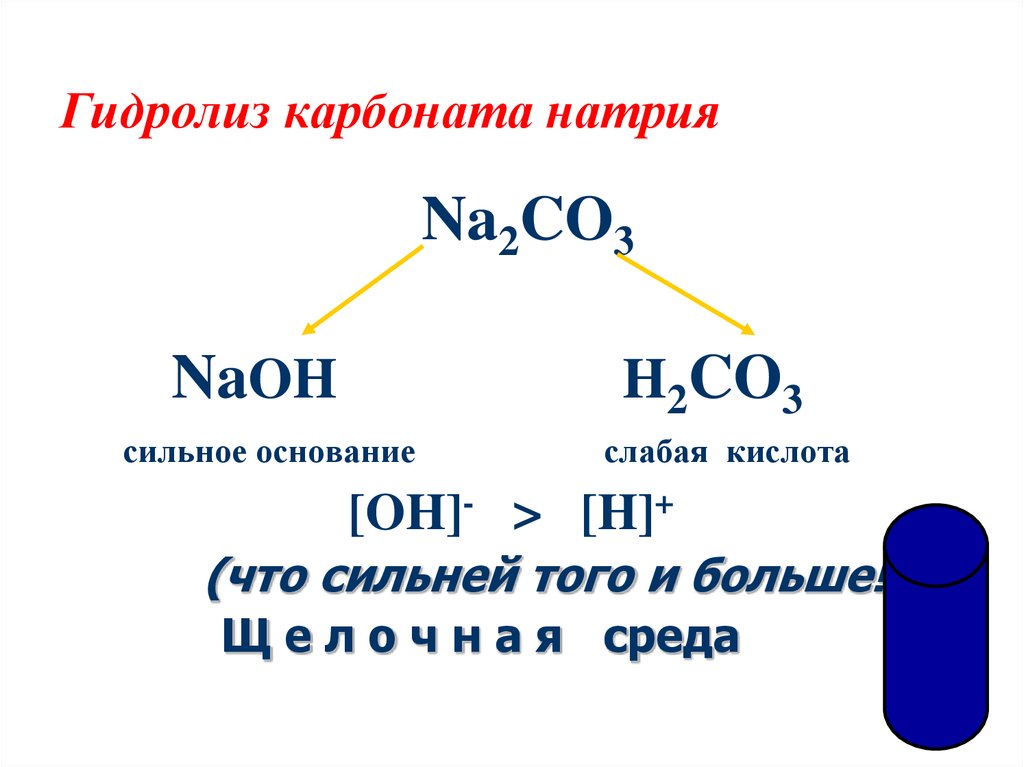 Хоча NaHCO3 сам по собі є проміжним продуктом процесу Сольвея, нагрівання, необхідне для видалення аміаку, що забруднює його, розкладає деяку кількість NaHCO3, що робить більш економічним взаємодія готового Na2CO3 з CO2.:
Хоча NaHCO3 сам по собі є проміжним продуктом процесу Сольвея, нагрівання, необхідне для видалення аміаку, що забруднює його, розкладає деяку кількість NaHCO3, що робить більш економічним взаємодія готового Na2CO3 з CO2.:
Na2CO3 + CO2 + h3O → 2NaHCO3
У зв’язаній реакції карбонат натрію використовується для отримання бісульфіту натрію (NaHSO 3), який використовується для «сульфітного» методу відокремлення лігніну від целюлози. Ця реакція використовується для видалення сірки діоксиду з димових газів на електростанціях:
Na 2 CO3 + SO 2 + h3o → NaHCO3+ NaHSO 3
Ця програма стала більш поширеною, особливо там, де станції повинні дотримуватися суворих заходів контролю за викидами.
Карбонат натрію використовується бавовняною промисловістю для нейтралізації сірчаної кислоти, необхідної для кислотного відшарування пухнастого бавовняного насіння.
Різне
Карбонат натрію використовується в цегляній промисловості як змочуючий агент для зменшення кількості води, необхідної для екструдування глини. При лиття він називається «зв’язуючою речовиною» і використовується для того, щоб вологий альгінат прилипав до жельованого альгінату. Карбонат натрію використовується в зубних пастах, де діє як піноутворювач і абразив, а також для тимчасового підвищення рН порожнини рота.
При лиття він називається «зв’язуючою речовиною» і використовується для того, щоб вологий альгінат прилипав до жельованого альгінату. Карбонат натрію використовується в зубних пастах, де діє як піноутворювач і абразив, а також для тимчасового підвищення рН порожнини рота.
Карбонат натрію також використовується при обробці та дубленні шкур тварин.
Фізичні властивості
Зустрічається як природний мінерал
Структура моногідрату при 346 До.
Карбонат натрію розчинний у воді і може зустрічатися природним чином у посушливих регіонах, особливо в покладах корисних копалин (евапоритах), що утворюються під час випаровування сезонних озер. Родовища мінерального натрону видобувалися на дні сухих озер в Єгипті з давніх часів, коли натрон використовувався при приготуванні мумій і ранньому виробництві скла.
Безводна мінеральна форма карбонату натрію трапляється досить рідко і називається натритом. Карбонат натрію також викидається з Ол Дойне Ленгаї, унікального вулкану Танзанії, і передбачається, що в минулому він вивергався з інших вулканів, але через нестабільність цих мінералів на поверхні землі, ймовірно, буде зруйновано. Всі три мінералогічні форми карбонату натрію, а також дигідрат гідрокарбонату натрію тринатрію також відомі з ультралужних пегматитових порід, які зустрічаються, наприклад, на Кольському півострові вРосії.
З позаземної погляду відомий карбонат натрію зустрічається рідко. Відкладення були ідентифіковані як джерело яскравих плям на Церері, внутрішнього матеріалу, який було піднято на поверхню. У той час як на Марсі є карбонати, і очікується, що вони будуть включати карбонат натрію, відкладення ще доведеться підтвердити, ця відсутність пояснюється тим, що деякі пояснюють глобальним переважанням низького pH в водному марсіанському грунті.
Видобуток корисних копалин
Трона, дигідрат гідрокарбонату тринатрію (Na 3 HCO 3 CO 3·2H 2 O), видобувається в кількох районах США та забезпечує майже все внутрішнє споживання карбонату натрію. Великі природні родовища, виявлені в 1938 році, такі як родовище поблизу Грін-Рівер, штат Вайомінг, зробили видобуток корисних копалин більш економічним, ніж промислове виробництво в Північній Америці. У Туреччині є значні запаси трону; із запасів поблизу Анкари було вилучено два мільйони тонн кальцинованої соди.Він також видобувається з деяких лужних озер, таких як озеро Магаді Кенії, шляхом днопоглиблювальних робіт. Гарячі солоні джерела постійно поповнюють запаси солі в озері, тому за умови, що швидкість виїмки не перевищує швидкість поповнення, джерело є повністю стійким.
Барила та келп
Декілька «галофітних» (солостійких) видів рослин і видів морських водоростей можуть бути оброблені з отриманням нечистої форми карбонату натрію, і ці джерела переважали в Європі та інших країнах до початку 19 століття. Наземні рослини (як правило, скловарні або солончаки) або морські водорості (як правило, види фукусів) були зібрані, висушені та спалені. Потім золу «вилочували» (промивали водою) з утворенням розчину лугу. Цей розчин був прокип’ячений досуха для отримання кінцевого продукту, який називався «кальцинована сода»; ця дуже стара назва походить від арабського слова сода, у свою чергу, застосовується до соди сальсола, одного з багатьох видівприбережних рослин, зібраних для виробництва. «Барила» — комерційний термін, що застосовується до нечистої форми поташу, що отримується з прибережних рослин або ламінарії.
Наземні рослини (як правило, скловарні або солончаки) або морські водорості (як правило, види фукусів) були зібрані, висушені та спалені. Потім золу «вилочували» (промивали водою) з утворенням розчину лугу. Цей розчин був прокип’ячений досуха для отримання кінцевого продукту, який називався «кальцинована сода»; ця дуже стара назва походить від арабського слова сода, у свою чергу, застосовується до соди сальсола, одного з багатьох видівприбережних рослин, зібраних для виробництва. «Барила» — комерційний термін, що застосовується до нечистої форми поташу, що отримується з прибережних рослин або ламінарії.
Концентрація карбонату натрію в кальцинованій соді варіювалася в дуже широких межах: від 2-3 відсотків для форми, отриманої з морських водоростей («ламінарія»), до 30 відсотків для кращої барили, виготовленої з рослин солянки в Іспанії. Рослинні та водоростеві джерела кальцинованої соди, а також пов’язаного з нею лужного «поташу», до кінця 18 століття ставали дедалі неадекватнішими, і посилився пошук комерційно життєздатних шляхів синтезу кальцинованої соди із солі та інших хімічних речовин.
Процес Леблану
Основна стаття: Процес Леблана
У 1792 році французький хімік Ніколя Леблан запатентував процес отримання карбонату натрію із солі, сірчаної кислоти, вапняку та вугілля. На першому етапі хлорид натрію обробляють сірчаною кислотою в Мангеймському процесі. Внаслідок цієї реакціїутворюється сульфат натрію (соляний осад) та хлористий водень:
2NaCl + h3SO4 → Na2SO4 + 2HCl
Соляний осад та подрібнений вапняк (карбонат кальцію) були зменшені шляхом нагрівання з використанням вугілля. Це перетворення включає дві частини. По-перше, це карботермічна реакція, в результаті якої вугілля, що є джерелом вуглецю, перетворює сульфат на сульфід:
Na2SO4 + 2C → Na2S + 2CO2
Друга стадія-це реакція з утворенням карбонату натрію та сульфіду кальцію:
Na 2 S + CaCO 3 → Na 2 CO3 + CaS
Ця суміш називається чорною золою. Кальциновану соду витягають із чорної золи водою. При випаровуванні екстракту утворюється твердий карбонат натрію. Цей процес екстракції називався вилуговуванням.
Цей процес екстракції називався вилуговуванням.
Соляна кислота, отримана в результаті процесу Леблана, була основним джерелом забруднення повітря, а побічний продукт кальцію сульфіду також створював проблеми з видаленням відходів. Тим не менш, він залишався основним методом виробництва карбонату натрію до кінця1880-х років.
Процес Сольвея
Основна стаття: Процес Сольвея
У 1861 році бельгійський промисловий хімік Ернест Сольвей розробив метод отримання карбонату натрію шляхом першої взаємодії хлориду натрію, аміаку, води та двоокису вуглецю з утворенням бікарбонату натрію та хлориду амонію:
NaCl + Nh4 + CO2 + h3O → NaHCO3 + Nh5Cl
Отриманий бікарбонат натрію потім перетворювали на карбонат натрію шляхом його нагрівання, вивільняючи воду і вуглекислий газ:
2NaHCO3 → Na2CO3 + h3O + CO2
Тим часом аміак був регенерований з побічного продукту амонію хлориду шляхом обробки його вапном (оксидом кальцію), що залишилася після утворення вуглекислого газу:
2Nh5Cl + CaO → 2Nh4 + CaCl2 + h3O
Процес Сольвея переробляє свій аміак. Він споживає лише розсіл та вапняк, а хлорид кальцію є його єдиним відходом. Цей процес значно економічніший, ніж процес Леблана, у якому утворюються два продукту життєдіяльності-сульфид кальцію і хлористий водень. ПроцесСольвея швидко став домінувати у виробництві карбонату натрію по всьому світу. До 1900 90% карбонату натрію вироблялося методом Сольвея, а останній завод з переробки Леблана закрився на початку 1920-х років.
Він споживає лише розсіл та вапняк, а хлорид кальцію є його єдиним відходом. Цей процес значно економічніший, ніж процес Леблана, у якому утворюються два продукту життєдіяльності-сульфид кальцію і хлористий водень. ПроцесСольвея швидко став домінувати у виробництві карбонату натрію по всьому світу. До 1900 90% карбонату натрію вироблялося методом Сольвея, а останній завод з переробки Леблана закрився на початку 1920-х років.
Другий етап процесу Сольвея, нагрівання бікарбонату натрію, використовується в невеликих масштабах домашніми кухарями та в ресторанах для приготування карбонату натрію в кулінарних цілях (включаючи кренделі та лужну локшину). Метод привабливий для таких користувачів, тому що бікарбонат натрію широко продається як харчова сода, а температури, необхідні (від 250 °F (121 °C) до 300 °F (149 °C)) для перетворення харчової соди в карбонат натрію, легко досягаються у звичайних кухонних печах.
Процес Хоу
Цей процес був розроблений китайським хіміком Хоу Дебангом у 1930-х роках. Більш ранній побічний продукт парового риформінгу двоокис вуглецю прокачували через насичений розчин хлориду натрію та аміаку для отримання бікарбонату натрію в результаті цих реакцій:
Більш ранній побічний продукт парового риформінгу двоокис вуглецю прокачували через насичений розчин хлориду натрію та аміаку для отримання бікарбонату натрію в результаті цих реакцій:
гл.4+2h3O → СП2 + 4h3
3h3 + N2 → 2nh4
nh4 + СП2 + h3O → nh5HCO3
nh5HCO3 + NaCl → nh5Cl + НаХКО3
Бікарбонат натрію збирали у вигляді осаду через його низьку розчинність, а потім нагрівали приблизно до 80 °C (176 °F) або 95 °C (203 °F) для отримання чистого карбонату натрію, аналогічного останньої стадії процесу Сольвея. До розчину, що залишився, хлоридів амонію і натрію додають більше хлориду натрію; також у цей розчин закачують більше аміаку за температури 30-40 °C. Потім температуру розчину знижують до температури нижче 10 °C. Розчинність хлориду амонію вище, ніж у натрію хлориду при 30 °C, і нижче при 10 °C. Через цю залежну від температури різниці розчинності та ефекту загальних іонів хлорид амонію осаджується у розчині хлориду натрію.
Китайська назва процесу Хоу, lianhe zhijian fa (联合制碱法), означає «метод лужного виробництва у поєднанні»: процес Хоу пов’язаний з процесом Хабера і забезпечує кращу економію атомів за рахунок виключення виробництва хлориду кальцію,оскільки аміак більше не потребує регенерації. Побічний продукт хлорид амонію може продаватися як добрива.
Побічний продукт хлорид амонію може продаватися як добрива.
Купити Сода кальцинована, карбонат натрію, 25 кг у Мелітополі від компанії «АГРОНОМ-МЕЛІТОПОЛЬ»
Карбонат натрію (також відомий як сода або кальцинована сода), Na2CO3 є натрієвою сіллю вугільної кислоти. Це найчастіше відбувається у вигляді кристалічного гептагидрата, з утворенням білого порошку, моногідрату. Карбонат натрію всередині країни добре відомий своєю повсякденного використання, як для пом’якшення води. Може бути витягнутий з попелу багатьох рослин.
У побуті він використовується як для пом’якшення води при пранні. Кальцинована сода може бути використана для видалення мастила, масла і винних плям. Карбонат натрію також використовується в якості засобу для видалення накипу в котлах.
Кальцинована сода застосовується у виробництві всіх видів скла, включаючи: кришталь, медичне і оптичне скло, піноскло, склоблоки. Сода є незамінним компонентом у целюлозно — паперовій та електронній галузях промисловості, у виробництві пральних і миючих порошків, при варінні мила. Без соди неможливо було б виготовлення керамічної плитки, емалей, в металургії (як чорною, так і кольоровою) використовується у виробництві цинку, свинцю, хрому, стронцію, вольфраму.
Без соди неможливо було б виготовлення керамічної плитки, емалей, в металургії (як чорною, так і кольоровою) використовується у виробництві цинку, свинцю, хрому, стронцію, вольфраму.
У побуті ця хімічна сполука використовується як миючий засіб для видалення жиру. Також можна відзначити її застосування для прання, пом’якшення води, миття скляної, порцелянової і фаянсової посуду, а також емальованих виробів.
Кальцинована сода зареєстрована в якості добавки Е500. У харчовій промисловості вона вживається в якості розпушувача, який запобігає грудкуванню та злежуванню. Також використовують соду як регулятор кислотності.
Застосування у СІЛЬСЬКОМУ ГОСПОДАРСТВІ
Щоб овочі і фрукти були смачними і натуральними, без усякої хімії, використовуйте народні методи. Для боротьби з різними шкідниками і в якості профілактики, застосовується кальцинована сода, шкоди не принесе, а от користь (на відро 4-6 чайних ложок і 40 гр. господарського мила).
Цим засобом обробляйте хворі насадження (від борошнистої роси) раз у 7 днів, кропити не можна під час дощу і сильної спеки.
В якості профілактики раз або два в весняно–літній сезон можна застосовувати цей засіб.
Для обробки полунички від сірої гнилі сода теж не замінима. Беремо відро з водою і ложечку соди і поливаємо раз на півмісяця.
Також сода допомагає при боротьбі з листоедом. Робимо розчин з 10 літрів води, ложки соди і бруска зеленого мила. Цим і кропимо рослини з тильної сторони, раз в тиждень поки, всі комахи не загинуть.
Але надмірне використання соди, може принести не користь, а шкоду. Так як її надлишок у ґрунті призведе до порушення обміну речовин, а це в свою чергу зашкодить здоров’ю рослин і, як наслідок, буде поганий урожай.
А любителям розводити на дачі троянди, порада для їх омолодження. Склад соди, води, нашатирного спирту і солі Эпсона. Цим складом кропити троянди раз в 10 днів. Якщо кущ молодий виключіть спирт.Борошнистою росою також страждають квіти і їх потрібно обробляти содовим розчином (на 10-ти літрове відро води 4 столові ложки).
У боротьбі з непотрібною травою сода також ваш союзник, вона нешкідлива і менш токсична. Висококонцентрованим розчином соди з водою потрібно обробити ділянки, де необхідно видалити траву. Цю процедуру потрібно робити при жаркій погоді.
Висококонцентрованим розчином соди з водою потрібно обробити ділянки, де необхідно видалити траву. Цю процедуру потрібно робити при жаркій погоді.
Характеристики
Інформація для замовлення
Видео с вопросами: Определение распространенных применений карбоната натрия
Стенограмма видео
Что из следующего не является распространенным применением карбоната натрия? (A) Карбонат натрия является основным ингредиентом чистящих средств для духовок и растворов для прочистки стоков. (B) Карбонат натрия используется для смягчения воды путем удаления ионов магния и кальция. (C) Карбонат натрия добавляют к кремнезему и другим соединениям при производстве стекла. (D) Растительный материал кипятят в растворе карбоната натрия при производстве бумаги. Или (Е) карбонат натрия используется для отверждения волокон, а также для окрашивания и печати в текстильной промышленности.
Каждый год производится большое количество карбоната натрия или Na2CO3. Это связано с тем, что он легко растворяется в воде и образует слабоосновный раствор, устойчивый к разложению. Вариант ответа (А) предполагает использование карбоната натрия для очистки духовок и прочистки стоков; однако для этих типов чистящих средств требуется гораздо более едкое химическое вещество, такое как гидроксид натрия. А поскольку мы знаем, что карбонат натрия является слабоосновным соединением, мы можем сказать, что вариант ответа (А) не является распространенным использованием карбоната натрия.
Это связано с тем, что он легко растворяется в воде и образует слабоосновный раствор, устойчивый к разложению. Вариант ответа (А) предполагает использование карбоната натрия для очистки духовок и прочистки стоков; однако для этих типов чистящих средств требуется гораздо более едкое химическое вещество, такое как гидроксид натрия. А поскольку мы знаем, что карбонат натрия является слабоосновным соединением, мы можем сказать, что вариант ответа (А) не является распространенным использованием карбоната натрия.
Вариант ответа (B) гласит, что карбонат натрия используется для смягчения воды путем удаления ионов магния и кальция. Мы знаем, что карбонат натрия хорошо растворим в воде, но когда он реагирует с растворенными ионами магния, карбонат магния выпадает из раствора в осадок, удаляя магний из воды. А когда карбонат натрия реагирует с ионами кальция, происходит аналогичная реакция осаждения, удаляя ионы кальция из воды. А поскольку мы знаем, что карбонат натрия удаляет из воды ионы магния и кальция, мы знаем, что вариант ответа (В) не может быть правильным.
В промышленности стекло производится путем смешивания трех основных компонентов. Песок, который в основном состоит из диоксида кремния, является основным компонентом. Поскольку диоксид кремния имеет очень высокую температуру плавления, для снижения температуры плавления также добавляют карбонат натрия. А поскольку карбонат натрия может изменить химический состав стекла, в качестве стабилизатора добавляется известь. Но поскольку карбонат натрия является основным компонентом, добавляемым в кремнезем для производства стекла, мы знаем, что вариант ответа (С) не может быть правильным.
Бумага производится в промышленности путем отделения целлюлозных волокон от растительной массы. Поскольку многие из этих растительных материалов очень жесткие, их необходимо варить в растворе карбоната натрия. Карбонат натрия используется, потому что он растворим в воде и является щелочным, что облегчает расщепление растительной мякоти. И из-за этого мы можем сказать, что карбонат натрия обычно используется для производства бумаги. Итак, мы можем исключить выбор ответа (D).
Итак, мы можем исключить выбор ответа (D).
Вариант ответа (E) гласит, что карбонат натрия используется для отверждения волокон, а также для окрашивания и печати в текстильной промышленности. И снова из-за водорастворимых и основных свойств карбоната натрия его можно использовать для ускорения химической реакции между волокнами и красителями. Итак, поскольку карбонат натрия используется в качестве фиксирующего агента для отверждения волокон, а также для их окрашивания, мы можем исключить вариант ответа (Е), потому что это обычное использование карбоната натрия.
Итак, поскольку варианты ответов с (B) по (E) являются общими вариантами использования карбоната натрия, мы можем правильно выбрать вариант ответа (A). Карбонат натрия является основным ингредиентом чистящих средств для духовок и растворов для прочистки стоков.
Свойства важных соединений — Карбонат натрия: неорганическая химия Примечания к исследованию IIT/JEE Unacademy
Карбонат натрия, широко известный как кальцинированная сода, представляет собой неорганическое химическое соединение. Его получают из Троны, двойной соли, содержащей гидрокарбонат натрия и карбонат натрия. Он производится после серии процессов, при которых происходит испарение соленой воды на берегу озера.
Его получают из Троны, двойной соли, содержащей гидрокарбонат натрия и карбонат натрия. Он производится после серии процессов, при которых происходит испарение соленой воды на берегу озера.
Его часто называют стиральной содой, наиболее важным из всех основных тяжелых химикатов. Карбонат натрия растворим в воде. Большое преимущество карбоната натрия перед гидроксидом натрия заключается в том, что карбонат натрия не вызывает коррозии. Поэтому с ним безопаснее обращаться.
Карбонат натрия можно использовать по-разному. Вот некоторые из них:
- Карбонат натрия используется для производства буры, фосфата натрия, жидкого стекла и многих других соединений натрия
- Натрий используется в качестве смачивающего агента в кирпичной промышленности
- Для изготовления мыла, бумаги и моющих средств используется карбонат натрия
- Карбонат натрия является формовочным и абразивным агентом для изготовления зубной пасты
- Жесткая вода состоит из магния и ионы кальция осаждаются карбонатом.
 В этой ситуации карбонат натрия используется в качестве смягчителя воды
В этой ситуации карбонат натрия используется в качестве смягчителя воды - Карбонат натрия используется в качестве модификатора pH
- Для стандартизации кислот он используется в качестве лабораторного реагента и аналитического реагента
- Карбонат натрия используется для удаления примесей из расплавленных металлов.
- Натрий также используется для получения металлов титана из тетрахлорида титана. делается с помощью натрия, когда он сочетается с бензофеноном.
Существует несколько этапов образования карбоната натрия. Они следующие:
- На первом этапе хлорид натрия реагирует с двуокисью углерода, водой и аммиаком, образуя бикарбонат натрия.
NaCl+h3O+CO2+Nh4→Nh5Cl+NaHCO3
- На следующем этапе бикарбонат натрия разлагается на карбонат натрия ] x [HCO3] > ksp NaHCO3
Но KHCO3 нельзя получить методом Сольве, так как карбонат натрия растворим в воде.
Свойства основных соединений – карбоната натрия
Существуют некоторые физические и химические свойства важных соединений – карбоната натрия. Они перечислены ниже:
Физические свойства карбоната натрия следующие:
- Формула карбоната натрия: Na2CO3
- Молекулярная масса карбоната натрия 105,9888 г/моль, плотность карбоната натрия 2,54 г/см3
- температура кипения карбоната натрия 160 ℃, а его температура плавления 851 ℃
- Карбонат натрия не имеет запаха
- Карбонат натрия представляет собой белое кристаллическое твердое вещество
- Карбонат натрия растворим в воде.
Химические свойства карбоната натрия следующие:
- Реакция с разбавленной HCl –
Na2CO3 + 2HCl разбав. → 2NaCl + CO2+ h3O
- С водой и двуокисью углерода
Na2CO3 (насыщенный) + h3O + CO2 → 2NaHCO3
- Реакция с фтористым водородом (разбавленным)
Na2CO3 + 2HF→ 2NaF + h3O + CO2
- На воздухе:
NaCO3•10h3O→Na2CO3•h3O+ промывка, следовательно, потеря веса при воздействии воздуха.

- Эффект отопления
NACO3 • 10H3O → NA2CO3 • H3O+9H3O
AT 375K
NACO3 • 10H3O → NA2CO3+H3O
Более 375K
9002 9002 3CO3+H3O. два атома натрия, 1 атом углерода и три атома кислорода. Это ионное соединение, которое при диссоциации дает 2 катиона натрия (Na+) и 1 анион карбоната (CO3-2).
Уравнение реакцииh3CO3 (угольная кислота) является слабой кислотой, а 2NaOH (гидроксид натрия) является сильным основанием. Таким образом, карбонат натрия (Na2CO3) получается из слабой кислоты и сильного основания. Карбонат натрия является основной солью.
h3CO3 + 2NaOH → Na2CO3 + 2h3O
ЗаключениеКарбонат натрия представляет собой органическое химическое соединение, известное как кальцинированная сода. Карбонат натрия имеет различное применение в повседневной жизни и в производстве различных промышленных товаров. Он имеет некоторые физические и химические свойства, такие как реакция с разбавленной HCl или его температура кипения и плавления.


 В этой ситуации карбонат натрия используется в качестве смягчителя воды
В этой ситуации карбонат натрия используется в качестве смягчителя воды

