Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
Пользуйтесь нашим приложением
Что можно получить из бензойной кислоты: разбираем варианты и способы
Бензойная кислота (химическая формула С6Н5СООН) – органическое соединение, которое представляет собой карбоновую кислоту из ряда ароматических соединений (аренов). В каталоге нашего сайта её можно найти по ссылке: https://teh-impex.ru/katalog/raw-material/benzoic-acid/ .
В каталоге нашего сайта её можно найти по ссылке: https://teh-impex.ru/katalog/raw-material/benzoic-acid/ .
Сегодня промышленная бензойная кислота широко применяется в лакокрасочной индустрии, производстве шин. Но она известна науке ещё с 16 века, тогда удалось её выделить из бензойной смолы. В 19 веке активно использовалась в консервации фруктов из-за её противогрибковых свойств. Физически бензойная кислота представляет собой белые кристаллы, плохо растворимые в воде, но при этом хорошо растворимые в эфире, спиртах и хлороформе. В химической промышленности из данного органического соединения получают много важных химических веществ, которые используют в химическом производстве:
- Бензол;
- Бензоилхлорид;
- Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры;
- Фенол;
- Соли бензойной кислоты: бензоаты натрия, калия, кальция и т.д.
Получение бензола из бензойной кислоты.
Бензол (C6H6) из бензойной кислоты получают её взаимодействием с гидроксидом натрия (при этом надёжнее использовать натронную известь – смесь NaOH и Ca(OH)2)). Реакция начнётся только при прокаливании смеси данных веществ. Формула реакции выглядит следующим образом:
Реакция начнётся только при прокаливании смеси данных веществ. Формула реакции выглядит следующим образом:
C6H5-COOH + 2NaOH—>C6H6 + Na2CO3 + h3O.
Получение бензоилхлорида из бензойной кислоты.
В лабораторных условиях бензоилхлорид (C7H5CIO) становится продуктом реакции раствора бензойной кислоты и пентахлорида фосфора:
С6Н5СООН + РСI5 → C7H5CIO + POCI3 + HCI.
В промышленном производстве используется другая технология. Там проводят фосгенирование, то есть взаимодействие соединения с фосгеном (дихлорангрдридом угольной кислоты – СОСI2), в качестве катализатора реакции выступает хлорид железа (III), химическая формула FeCI3:
С6Н5СООН + СОСI2 → C7H5CIO + CO2 + HCI.
Получение бензоатных пластификаторов из бензойной кислоты.
В качестве бензоатных пластификаторов чаще всего выступают эфиры, такие как гликоль, диэтиленгликоль или триэтиленгликоль. Получают их в два этапа. Сначала из бензойной кислоты путём конденсации с метанолом (Ch4OH) в кислой среде выводят метилбензоат (C6H5COOCh4), то есть её метиловый эфир:
С6H5COOH + Ch4OH → C6H5COOCh4 + h3O.
Затем с помощью реакции переэтерификации, то есть обмена структурными единицами между сложными эфирами и гидоксильными группами спиртов, с подходящим гликолем (двухатомным спиртом) на выходе имеем бензоатный пластификатор.
Получение фенола из бензойной кислоты.
На производстве фенол получают путём окисления бензойной кислоты в газообразном состоянии при температуре в 200 – 400°С и твердых катализаторов (к примеру сульфата меди (II), CuSO4). Продуктами реакции являются помимо фенола ещё и бензол, и дифенилоксид. Фенол же, в свою очередь, может быть синтезирован в циклогексанол, который является отправной точкой в производстве нейлона.
Получение бензоатов из бензойной кислоты.
Соли бензойной кислоты нашли своё широкое применение в качестве пищевых и косметических консервантов, а также ингибиторов коррозии. Получение бензоатов происходит однотипно, так как является типовой реакцией взаимодействия карбоновых кислот с основаниями. Бензойная кислота смешивается с каким-нибудь основанием, на выходе имеем её соль и воду. Вот пример реакции этой кислоты с гидроксидом натрия:
Вот пример реакции этой кислоты с гидроксидом натрия:
C6H5-COOH + NaOH—> C7H5O2Na + h3O.
Подводя итог всему вышесказанному, можно смело утверждать, что бензойная кислота является одним из важнейших сырьевых компонентом в химической и нефтехимической промышленности.
What, How to Balance & FAQs – Lambda Geeks
Соляная кислота – это сильная реактивная кислота, которая имеет тенденцию взаимодействовать с такими основаниями, как карбонат натрия. Давайте подробно изучим их реакцию.
HCl + Na 2 CO 3 является фундаментальной реакцией между сильной кислотой и слабым основанием. Соляная кислота обычно образуется из водного раствора газообразного хлороводорода. Карбонат натрия (Na 2 CO 3 ), также известный как стиральная сода, представляет собой неорганическое химическое вещество, которое смешивается с водой и выглядит как белое кристаллическое твердое вещество без запаха.
В этом изделии должны быть приведены различные характеристики этой реакции, такие как продукты, тип реакции, титрование, энтальпия реакции и т. д.
д.
Хлорид натрия образуется вместе с водой и двуокисью углерода, , при взаимодействии HCl с Na 2 CO 3 .
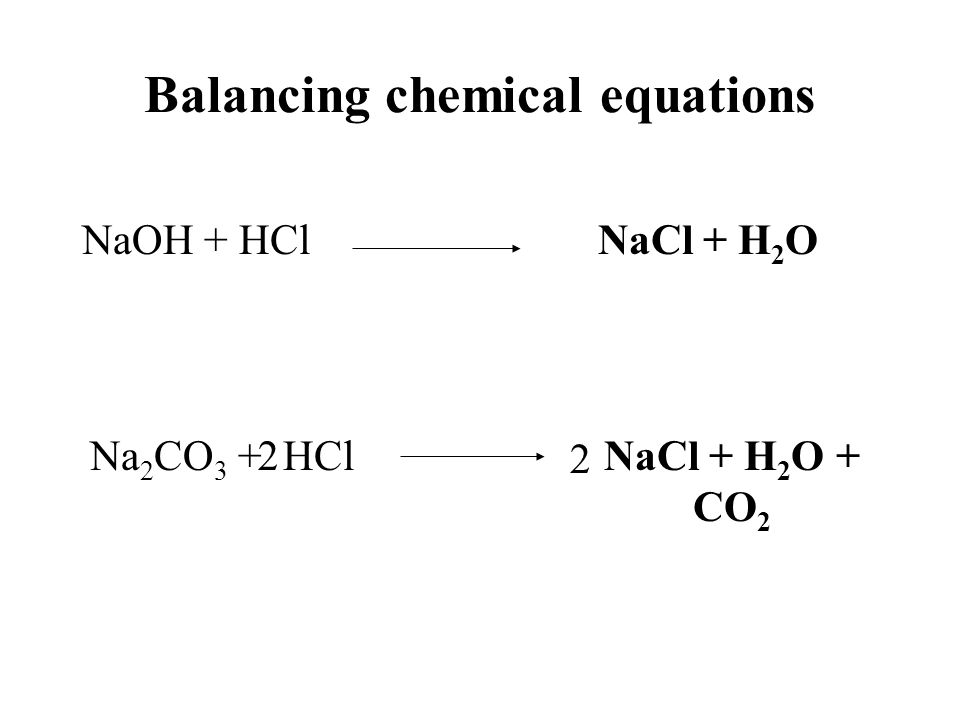
2HCl (водный) + Na 2 CO 3 (aq) —> 2NaCl (aq) + H 2 O (l) + CO 2 (g )
What type реакции HCl + Na 2 CO 3HCl + Na 2 CO 3 представляет собой кислотно-основную реакцию, также называемую реакцией нейтрализации, где HCl является сильной кислотой, а Na 2 CO 3 — слабое основание.
Как сбалансировать HCL + NA 2 CO 3Уравнение дисбаланта: HCL + NA 2 CO 3 = NACL + H 2 O + CO 2 5
Для уравнивания вышеупомянутой реакции применяются следующие шаги:
- Чтобы реакция была сбалансированной, количество атомов каждого элемента, присутствующего как на стороне реагента, так и на стороне продукта, должно быть равным.

| Atoms | Reactant Side | Product Side |
|---|---|---|
| Sodium | 2 | 1 |
| Chlorine | 1 | 1 |
| Carbon | 1 | 1 |
| Водород | 1 | 2 |
| Кислород | 3 | 3 |
- Стехиометрические коэффициенты добавляются к несбалансированным атомам со стороны реагента и продукта по мере необходимости.

- Чтобы сбалансировать атом натрия, NaCl умножают с коэффициентом 2.
- Атомы углерода и кислорода уже уравновешены с обеих сторон реакции.
- Наконец, атом водорода уравновешивается путем умножения HCl с коэффициентом 2.
- Следовательно, сбалансированное химическое уравнение:
- 2HCL + NA 2 CO 3 = 2NACL + H 2 O + CO 2
.
.
.
.
.
.
..
.
.
.
.
.
.
.
.
.
.
.
.
.
. + Na 2 CO 3 Титрование подпадает под категорию сильнокислотного титрования слабым основанием и может быть проведено следующим образом.
Аппаратура и необходимые химикаты
Бюретка 50 мл, пипетка, коническая колба 250 мл, мерная колба, штатив для бюретки, химический стакан, воронка, дистиллированная вода, соляная кислота, карбонат натрия
Индикатор
Это титрование проводится с использованием индикатора метилового оранжевого, чтобы отметить конечную точку с физическим переходом в растворе.
Процедура
- Стандартный раствор Na 2 CO 3 готовят путем растворения нескольких граммов его в дистиллированной воде.
- Бюретка заполняется стандартизированным раствором Na 2 CO 3 после ее промывки и ополаскивания.
- Раствор HCl с помощью пипетки переносят в чистую промытую колбу для титрования и добавляют к ней 2 капли метилового оранжевого.
- Раствор карбоната натрия добавляют в колбу для титрования по каплям. Колбу энергично встряхивают до изменения цвета раствора на светло-розовый. Это изменение цвета указывает на конечную точку реакции.
- Затем отмечают окончательные показания и количество Na 2 CO 3 раствора, используемого для нейтрализации раствора HCl.
- Предыдущие шаги повторяются до тех пор, пока не будут получены три согласующихся показания.

- Объем требуемого химического вещества рассчитывается с использованием формулы M 1 V 1 = M 2 V 2
Суммарное ионное уравнение HCl + Na 2 CO 3 IS: CO 3 2- (AQ) + 2H + (AQ) = H 2 O (L) + CO 2 2 2 2 O (L) + CO 6 2. (g)
Ниже приведены шаги для получения суммарного ионного уравнения:
- Во-первых, полное сбалансированное уравнение записывается вместе с их физическими состояниями.
- 2HCl (водный) + Na 2 CO 3 (AQ) = 2NACL (AQ) + H 2 O (L) + CO 2 (G )
 в ионы. Таким образом, Сбалансированное чистое ионное уравнение между HCL и NA 2 CO 3 После устранения ионов зрителей следующим образом:
в ионы. Таким образом, Сбалансированное чистое ионное уравнение между HCL и NA 2 CO 3 После устранения ионов зрителей следующим образом: - CO 3 2- (AQ) + 2H 2H 2H3H 2H3H 2H3H 2H3 + (водн.) = Н 2 O (L) + CO 2 (G)
- СОЗДАНИЯ СОЗДАНИЯ
- СОЗДА , так как HCl отдает протон с образованием иона Cl – .
- Конъюгатная кислота CO 3 2- Ион HCO 3 — С NA 2 CO 3 Диспасы в воде до формы NA CO 3 .0307 + и СО 3 2- ионы.
- Дипольные взаимодействия и London Dispersion Forces -это межмаскоростные силы.

- Ионные электростатические силы притяжения существуют между молекулами Na 2 CO 3 .
Энтальпия реакции HCl + Na 2 CO
0 7 -2 кДж/моль.
Значения энтальпии связейCompounds Number of moles Bond Enthalpy, ΔH⁰ f (kJ/mol) HCl 2 -167.15 Na 2 CO 3 1 -1157.3 NaCl 2 -407.25 H 2 O 1 -285.  8
8CO 2 1 -393.5 - Энтальпия реакции рассчитывается с использованием формулы: ΔH⁰ F (реакция) = σ ΔH⁰ F (Продукты) — σ ΔH⁰ F (Реакты) σ ΔH⁰ F (Реакты) 0014
- Изменение энтальпии = [2*(-407,25) + 1*(-285,8) + 1*(-393,5)] – [2*(-167,15) + 1*(-1157,3)] = -2,2 кДж/ моль
HCl + Na 2 CO 3 которое просто нейтрализуется основанием, что приводит к образованию соли .
Is HCl + Na 2 CO 3 a Полная реакцияHCl + Na 2 CO 3 является полной реакцией, так как реагирующие соединения завершаются и полностью расходуются при равновесии с образованием стабильной соли с пузырьками CO 2 2 Выделяется газ .
Is HCl + Na 2 CO 3 Экзотермическая или эндотермическая реакция Таким образом, дальнейшая реакция невозможна.
Таким образом, дальнейшая реакция невозможна. HCl + Na 2 CO 3 является экзотермической реакцией , так как изменение энтальпии этой реакции отрицательно, и энергия выделяется в виде тепла.
Is HCl + Na 2 CO 3 a Окислительно-восстановительная реакцияHCl + Na 2 CO 3 наблюдается как со стороны реагента, так и со стороны продукта.
Is HCl + Na 2 CO 3 a Реакция осажденияHCl + Na 2 CO 3 не является реакцией осаждения, поскольку полученный NaCl представляет собой соль, которая легко растворяется в воде, а не образует осадок.
Is HCl + Na 2 CO 3 a Обратимая или необратимая реакцияHCl + Na 2 CO 3 реакция не может быть получена с образованием необратимых продуктов реакции.
Is HCl + Na 2 CO 3 Реакция замещения Образовавшийся углекислый газ свободно покидает раствор, сильно сдвигая равновесие вперед.
Образовавшийся углекислый газ свободно покидает раствор, сильно сдвигая равновесие вперед. HCl + Na 2 CO 3 представляет собой двойную реакцию замещения молекулярных и ионообменных частей.
Механизм двойного вытеснения ЗаключениеРеакция Na 2 CO 3 с HCl представляет собой хорошо известный самопроизвольный процесс нейтрализации с выделением газа, который приводит к образованию соли NaCl. Образование солей в значительной степени используется в производстве различных химикатов в самых разных отраслях промышленности, прямо или косвенно. Он также демонстрирует медицинские приложения.
Ответ: Карбонат натрия (Na2CO3) доступен в очень
Учебники / Химия / Химия 11 / Глава 4 / Задача 110П
4 5 1 292 Отзывы
Проблема 110P
Карбонат натрия (\(\mathrm{Na}_{2} \mathrm{CO}_{3}\)) доступен в очень чистой форме и может использоваться для стандартизации растворов кислот.
 Какова молярность раствора HCl, если для реакции с 0,256 г \(\mathrm{Na}_{2} \mathrm{CO}_{3}\) требуется 28,3 мл раствора?
Какова молярность раствора HCl, если для реакции с 0,256 г \(\mathrm{Na}_{2} \mathrm{CO}_{3}\) требуется 28,3 мл раствора?Пошаговое решение:
Шаг 1 из 3
Цель задачи — найти молярность раствора HCl.
Дано:
Объем раствора = 28,3 мл = 0,0283 л
Масса = 0,256 г
Сбалансированное уравнение реакции:
Шаг 2 из 3
Глава 4, проблема 110P решена
Просмотреть полное решениеШаг 3 из 3
Другие растворы
34P: ?Сбалансируйте следующие уравнения и напишите соответствующие ионные.

Химия Химия 11 издание
4 / 5 из 5 отзывов
Посмотреть весь материал
35P: ?Приведите пример комбинированной окислительно-восстановительной реакции, разложения р…
Химия Химия 11 издание
4 / 5 из 4 отзывов
Посмотреть весь материал
36P: Все реакции горения являются окислительно-восстановительными реакциями.
 Правда или ложь? Объяснять.
Правда или ложь? Объяснять.Химия Химия 11 издание
4 / 5 из 5 отзывов
Посмотреть весь материал
37P: Что такое степень окисления? Как он используется для определения окислительно-восстановительных реак…
Химия Химия 11 издание
4 / 5 из 3 отзывов
Посмотреть весь материал
38P: ?(a) Без обращения к рисунку 4.
 11. подскажите степени окисления…
11. подскажите степени окисления…Химия Химия 11 издание
4 / 5 из 6 отзывов
Посмотреть весь материал39P: Как организована серия занятий? Как это используется в исследовании…
Химия Химия 11 издание
4 / 5 из 5 отзывов
Посмотреть весь материал
исчисление: ранние трансцендентальные функции: Силовая серия 9{3}}\)
Исчисление: ранние трансцендентальные функции: Плоские кривые и параметрические уравнения
? В упражнениях 1-18 нарисуйте кривую, представленную параметрическими уравнениями (укажите ориентацию кривой), и напишите соответствующую прямуюХимия: центральная наука: Реакции в водном растворе
?Водные растворы трех различных веществ, AX, AY и AZ, представлены тремя диаграммами. Определите каждое вещество как стро
Определите каждое вещество как строХимия: центральная наука: Основные понятия химической связи
? Здесь показана часть двумерной «плиты» NaCl(s) (см. рис. 8.2), в которой ионы пронумерованы. (a) Какие цветные шары должныХимия: центральная наука: Молекулярная геометрия и теории связи
?Определенная молекула \(\mathrm{AB}_{4}\) имеет форму качелей. Из какого фундаментального геомаСтатистика: обоснованные решения с использованием данных: Распределение вероятности Пуассона
Ураганы во Флориде С 1900 по 2014 год (115 лет) Флорида пострадала от 31 прямого попадания крупных ураганов (категории 3–5). Предположим, что это была типичная статистика. Информированные решения с использованием данных: Нормальное распределение вероятностей
?В задачах 7–9 нарисуйте нормальную кривую с указанными параметрами. Затем найдите вероятность случайной величины X. Закрасьте область, представляющую
Закрасьте область, представляющуюСтатистика: обоснованные решения с использованием данных: Вывод о двух стандартных отклонениях совокупности
?В задачах 9–14 предположим, что совокупности распределены нормально. Проверить предложенную гипотезу. 14. s1 7 s2 на уровне значений a = 0,05Статистика: обоснованные решения с использованием данных: Выполняет тест на случайность
? Своевременные рейсы Следующие данные представляют статус прибытия рейса 0715 American Airlines из аэропорта Рональда Рейгана в Вашингтоне, округ Колумбия, в ЧикагоСтатистика: обоснованные решения с использованием данных: Вывод о показателях центральной тенденции
• Определите эффективность знакового теста в разделе 15.1 как для больших, так и для малых выборок. На что указывают эти значения?Химия: центральная наука: Электрохимия
?Для каждой из следующих сбалансированных окислительно-восстановительных реакций (i) определить степени окисления для всех элементов в реагентах aХимия: центральная наука: Переходные металлы и координационная химия
Напишите формулы для каждого из следующих соединений, обязательно используя скобки для обозначения координационной сферы: (а) гексаамминхром(III) nЛюди также купили
78: Ограничивающие реагенты (раздел) Гидроксид алюминия реагирует с сернистым.
 ..
..Химия Химия: молекулярный подход 3 издание
4 / 5 из 5 отзывов
Посмотреть весь материал
15E: Объясните геометрическую изомерию алкенов. Как свойства ге…
Химия Химия: молекулярный подход 3 издание
4 / 5 из 4 отзывов
Посмотреть весь материал
33BB: Общие дни рожденияСвяжите вероятность того, что или 25 случайно выбранных дней.
 ..
..Статистика Элементарная статистика 12 издание
3 / 5 из 4 отзывов
Посмотреть весь материал
13RE: ?12-20. Оценка серии Оценить следующую бесконечную серию или…
Исчисление Исчисление: ранние трансцендентальные 1 издание
4 / 5 из 4 отзывов
Просмотреть весь материал
12DQ: Вы делаете две версии одного и того же объекта из одного и того же материала.


 09.15
09.15



 8
8 Таким образом, дальнейшая реакция невозможна.
Таким образом, дальнейшая реакция невозможна.  Образовавшийся углекислый газ свободно покидает раствор, сильно сдвигая равновесие вперед.
Образовавшийся углекислый газ свободно покидает раствор, сильно сдвигая равновесие вперед.  Какова молярность раствора HCl, если для реакции с 0,256 г \(\mathrm{Na}_{2} \mathrm{CO}_{3}\) требуется 28,3 мл раствора?
Какова молярность раствора HCl, если для реакции с 0,256 г \(\mathrm{Na}_{2} \mathrm{CO}_{3}\) требуется 28,3 мл раствора?
 Правда или ложь? Объяснять.
Правда или ложь? Объяснять. 11. подскажите степени окисления…
11. подскажите степени окисления… Определите каждое вещество как стро
Определите каждое вещество как стро Закрасьте область, представляющую
Закрасьте область, представляющую ..
.. ..
..