Аммиак: способы получения и химические свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
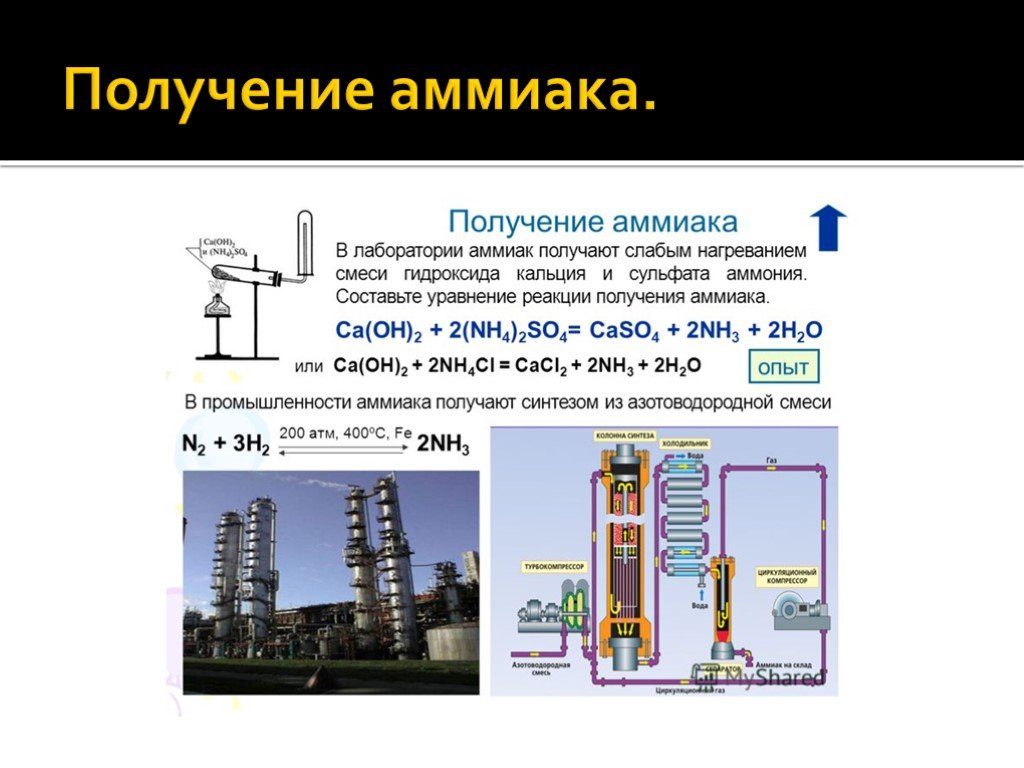
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.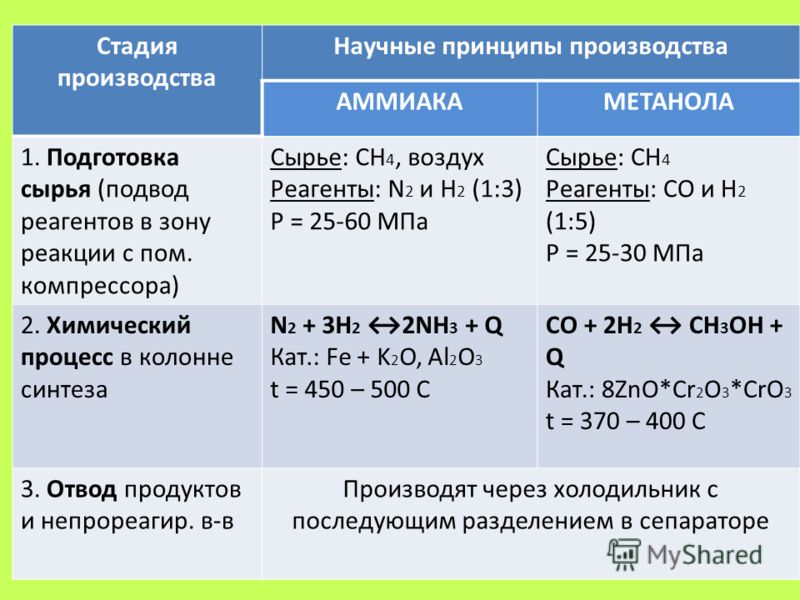
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
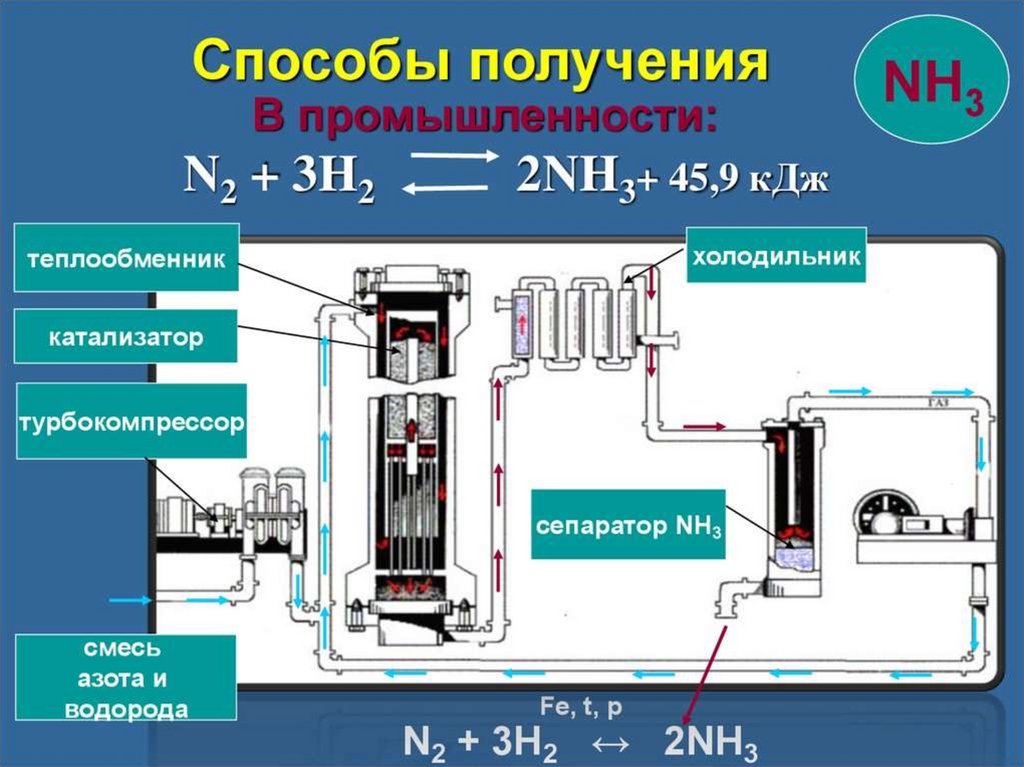
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.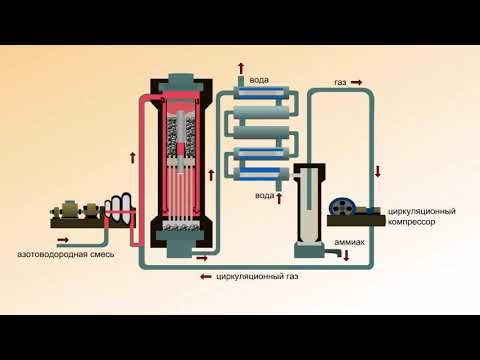
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов.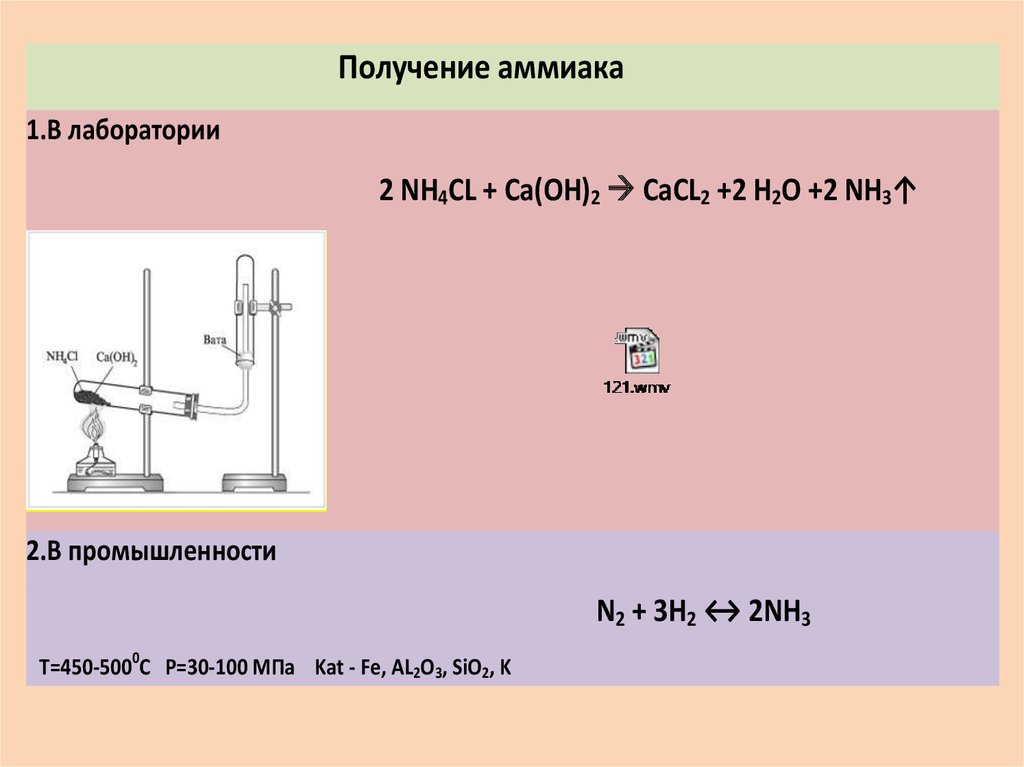 При этом азот окисляется, как правило, до простого вещества.
При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Понравилось это:
Нравится Загрузка…
Аммиак из молнии | Наука и жизнь
Аммиак из молнии
Все новости ›
Новый метод синтеза аммиака может сделать химическое производство чище.
Если два химических вещества никак не хотят друг с другом реагировать, а нам всё-таки очень хочется, чтобы они вступили в реакцию, то мы можем использовать несколько универсальных способов добиться желаемого. Для начала стоит попробовать просто нагреть реакционную смесь – как правило, при высокой температуре молекулы становятся более активными. Это похоже на приготовление обычного супа: в холодной воде его не особо-то и сваришь.
Плазмохимический способ получения аммиака в лаборатории. (Фото: Case Western Reserve University)
Но температура помогает не всегда, и тогда на помощь обычно призывается универсальная химическая палочка-выручалочка – катализатор. С его помощью можно проводить реакции, невозможные с точки зрения школьного учебника по химии. Проблема в том, что для каждой химической реакции нужен свой, особый и, как правило, дорогой катализатор.
Дорогостоящий катализатор или сложное оборудование, работающее при высоких температурах и давлениях, окупятся лишь в том случае, если производить вещества в очень больших количествах, сотнями тысяч и миллионами тонн в год. Собственно, по этому принципу и работает крупнотоннажная химическая промышленность. Один из таких классических примеров – синтез аммиака из азота и водорода по Габеру–Бошу, изобретённый ещё в начале XX века, и до сих пор используемый без каких-либо существенных изменений.
Собственно, по этому принципу и работает крупнотоннажная химическая промышленность. Один из таких классических примеров – синтез аммиака из азота и водорода по Габеру–Бошу, изобретённый ещё в начале XX века, и до сих пор используемый без каких-либо существенных изменений.
Несмотря на то, что в этом процессе используется давление выше сотни атмосфер, температура в полтысячи градусов и водород, который ещё нужно получить, например, путём конверсии природного газа, по своей эффективности синтез по Габеру–Бошу до сих пор превосходит все альтернативные методы. Но лидерство не может продолжаться бесконечно долго, и даже такого мастодонта химического синтеза могут потеснить даже не в очень отдалённом будущем.
Однако мы не упомянули ещё один способ выполнить «труднопроводимую» реакцию, который проще встретить в природе, чем в промышленности – плазмохимический синтез. В естественной среде плазма образуется, например, во время разряда молний, в результате такие «безразличные» друг к другу в обычных условиях газы, как азот и кислород, отлично вступают в реакцию с образованием оксида азота.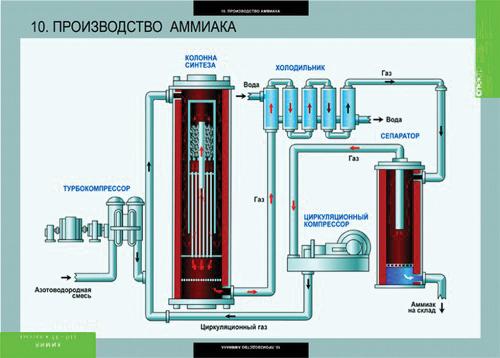 Кстати говоря, искусственную молнию – дуговой разряд – в начале XX века использовали два норвежца, Самуэль Эйде и Кристиан Биркеланд, как раз для того, чтобы окислить азот кислородом – так можно было в прямом смысле из воздуха получать азотную кислоту в промышленности. Однако искромётный плазменно-химический норвежский стартап быстро погас, не выдержав конкуренции с методом Габера–Боша – электричество, которого для плазменного синтеза нужно очень много, тогда стоило сильно дороже природного газа.
Кстати говоря, искусственную молнию – дуговой разряд – в начале XX века использовали два норвежца, Самуэль Эйде и Кристиан Биркеланд, как раз для того, чтобы окислить азот кислородом – так можно было в прямом смысле из воздуха получать азотную кислоту в промышленности. Однако искромётный плазменно-химический норвежский стартап быстро погас, не выдержав конкуренции с методом Габера–Боша – электричество, которого для плазменного синтеза нужно очень много, тогда стоило сильно дороже природного газа.
Но времена меняются: ископаемых ресурсов становится всё меньше, планета страдает от глобального потепления, а в моде ветряки, солнечные панели и самокаты на аккумуляторах. Всё это постепенно возвращает интерес к «электрическим» технологиям крупного химического производства, о которых практически забыли почти на сотню лет. Да и в целом нет ничего плохого в том, чтобы иметь возможность построить небольшой завод, которому для производства того же аммиака нужен разве что воздух и солнечный свет.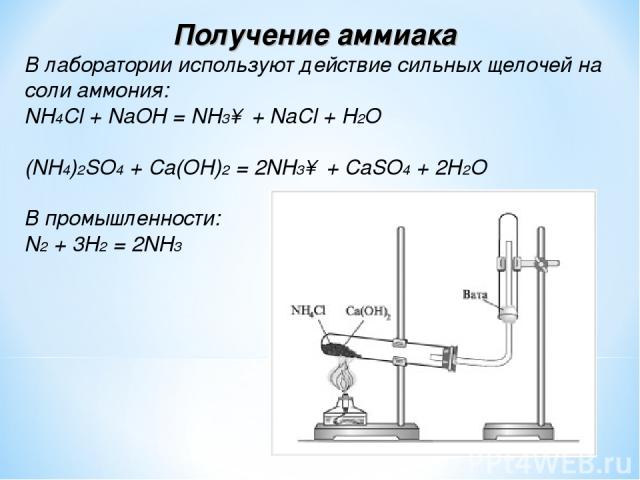 К этому нас может приблизить недавнее исследование, опубликованное в свежем выпуске Science Advances
К этому нас может приблизить недавнее исследование, опубликованное в свежем выпуске Science Advances
Авторам статьи удалось синтезировать аммиак с помощью электрической дуги буквально в стакане с водой. Суть метода достаточно проста. В непосредственной близости от поверхности воды размещается металлическая трубка, которая, с одной стороны, выполняет функцию электрода, а с другой – позволяет прокачивать сквозь неё азот, который мы и превращаем в аммиак. Если создать между электродом и водой в сосуде большую разность потенциалов, то возникает электрическая дуга – миниатюрная молния, постоянно бьющая в водоём. Так как же происходит синтез?
Как мы помним, плазма – это ионизированный газ, в котором в том числе существуют свободные электроны. Когда электроны из плазмы попадают, условно говоря, в воду, то часть из них сольватируется – между молекулами воды и электроном на очень короткое время образуется временный и очень непрочный союз.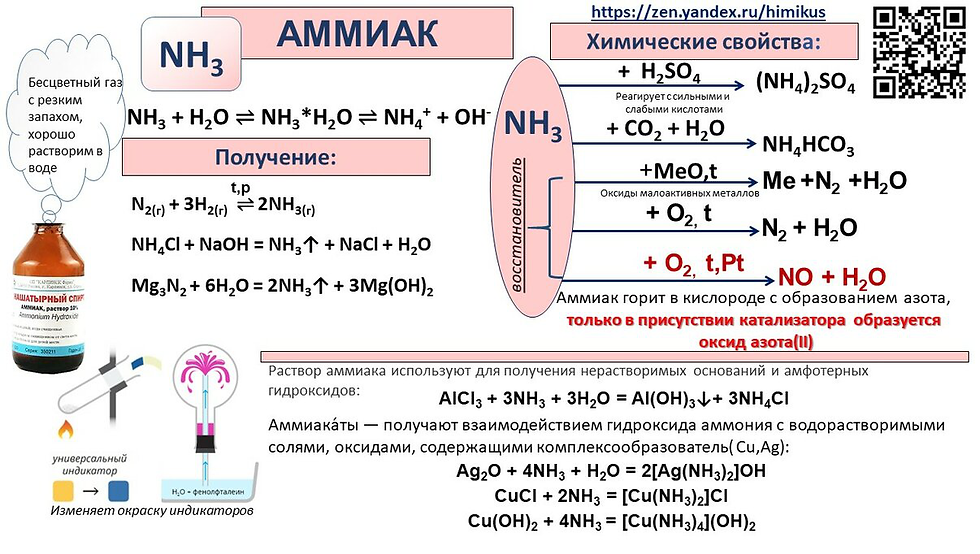
Идеальная мишень для таких электронов – ионы водорода, их концентрацию в воде отражает такой известный индикатор, как pH. Когда ион водорода присоединяет электрон, он превращается в нейтральную, но тоже очень активную частицу – радикал. Водородным радикалам также не терпится с кем-нибудь прореагировать: если два радикала прореагируют друг с другом, то получится молекула водорода, а если на пути водородных радикалов встретятся молекулы азота, то им не останется выбора, кроме как стать молекулами аммиака, а это нам и нужно!
В отличие от других альтернативных методов синтеза аммиака, плазменный способ не требует ничего, кроме воды, азота и источника напряжения. Нет нужды в использовании катализаторов, высокого давления и других промышленных атрибутов. С другой стороны, у этого метода тот же недостаток, что и у процесса Эйде и Биркеланда: на электрическую дугу нужно тратить много электроэнергии, и в результате по энергоэффективности плазмохимический аммиак всухую проигрывает классическому Габеру–Бошу.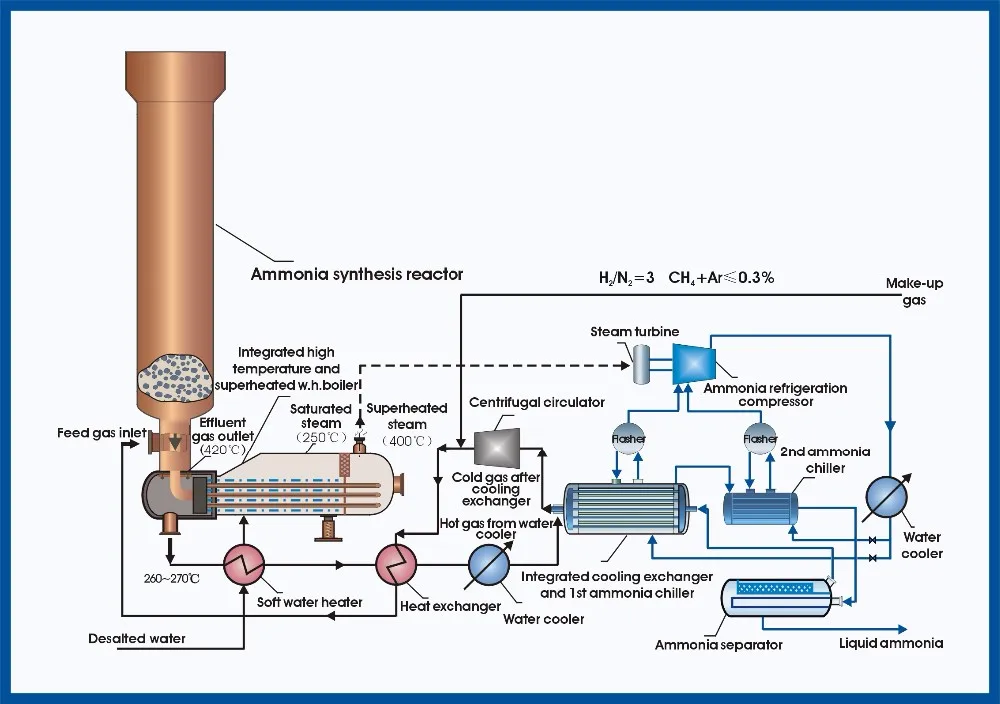
Однако у плазмохимического процесса есть своё преимущество – для него не нужно строить сложную инфраструктуру, как в случае с обычным заводом, а если вдобавок использовать возобновляемые источники электроэнергии, то можно организовать весьма чистое с точки зрения экологии химическое производство.
По материалам Science Advances.
16 января 2019
Автор: Максим Абаев
- Молнии преследуют морские суда
- Электронно-пучковая плазма режет хитин
- Птичий холод
Процесс Габера — Промышленное производство аммиака, производственный процесс
Аммиак является ведущим
химическая промышленность в мире
потому что аммиак используется для приготовления большего количества химикатов, а также используется в лабораторных масштабах. В этом
учебник мы собираемся охватить следующие производства аммиака.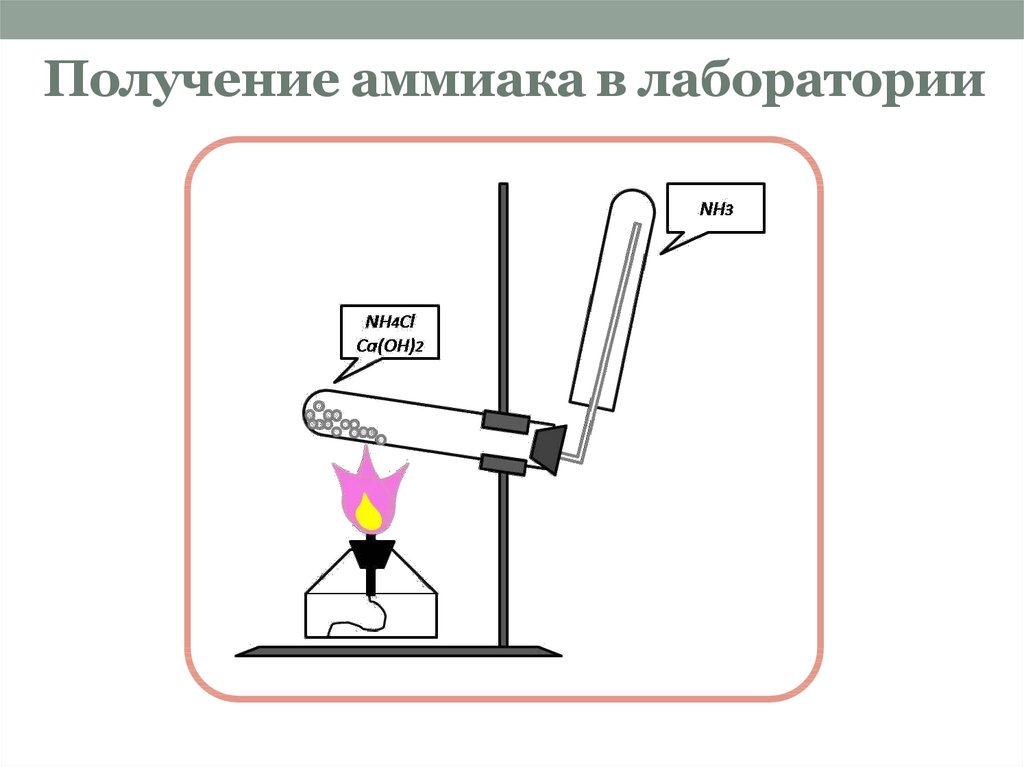
- Объяснение аммиака
- Процесс производства аммиака от сырья до конечного продукта
- Использование аммиака в химической промышленности и лабораториях
Объяснение газообразного аммиака
Аммиак представляет собой соединение с молекулярной формулой NH 3 . Это бесцветный газ при комнатной температуре. В В лабораториях аммиак встречается в виде водного раствора гидроксида аммония (NH 4 OH). Аммиак — очень токсичное соединение и должны использовать его очень осторожно, чтобы предотвратить травмы.
Получение газообразного аммиака в
лаборатория
Химия аммиака
Аммиак — очень ядовитый, с резким удушливым запахом, бесцветный газ. Аммиак является основным газом, и в лаборатории его обнаруживают в виде водного раствора гидроксида аммония. Аммиак очень хорошо растворяется в воде.
Процесс производства аммиака, процесс Габера
В этом разделе мы обсуждаем, как сырье превращается в аммиак и какие условия (оптимальные условия) необходимо поддерживать
для получения желаемого продукта. Реакции, связанные с образованием аммиака, объясняются на каждом этапе.
Реакции, связанные с образованием аммиака, объясняются на каждом этапе.
Сырье в процессе Габера
- Газообразный азот (N 2 )
- Газообразный водород (H 2 )
Извлечение сырья из источников
- Азот получают из воздуха.
- Водород получают из природного газа или переработки нефти.
Получение газообразного азота из воздуха
Повышение давления и температуры воздуха. Затем воздух может быть преобразован в жидкую фазу. Этот жидкий воздух делается дробным дистилляция. От этого метода отделяют N 2 .
Получение газообразного водорода из природного газа
- Природный газ – углеводород, в основном содержащий метан (Ч 4 ) газ.
- В нашем случае газ метан реагирует с паром.
- Реакция протекает при температуре 700-1000 0 С с помощью катализатора.
- Эта полная реакция является эндотермической реакцией.

CH 4(г) + H 2 O (г) → CO (г) + 3H 2(г)
CO + H 2 O (г) → H 2(г) + CO 2(г)
Реакция водорода и азота
Водород и азот реагируют друг с другом с образованием аммиака в качестве продукта. Но эта реакция обратима. После запуска реакции начинается обратная реакция через некоторое время с возвратом газообразных водорода и азота. Прямая реакция – это экзотермическая реакция.
Теплота реакции
Стандартная энтальпия реакции составляет -46 кДж моль -1 . Это значение важно при проектировании новой технологической установки Хабера для рассчитать энергозатратность процесса.
Условия реактора
- Обратимая реакция
- Потребности в катализаторе (содержат железо в катализаторе)
Катализаторы, используемые в процессе Габера
- Оксид железа. K 2 O (s) , Al 2 O 3(s) используются в качестве проявителей катализатора.

- Железная пыль. K 2 O (s) , Mo или Ca используются в качестве проявителей катализатора.
Температура в процессе Хабера
Прямая реакция является экзотермической. Следовательно, использование низкой температуры увеличит прямую реакцию и даст более высокий процент аммиак. Но низкая температура уменьшит скорость реакции. Таким образом, производители должны ждать много времени, чтобы взять продукт. Принимая во внимание как количество продукта, так и производительность, определяют температуру.
400 0 C — 450 0 Применяется температура C.
Давление в процессе Хабера
В прямой реакции две молекулы получаются при взаимодействии четырех молекул. (одна молекула N 2 + три молекулы H 2 ).
Следовательно, давление уменьшается из-за уменьшения количества молекул. При этом объем уменьшается за счет уменьшения
количество молекул. Таким образом, повышение давления ускорит реакцию (производит больше NH 3 ).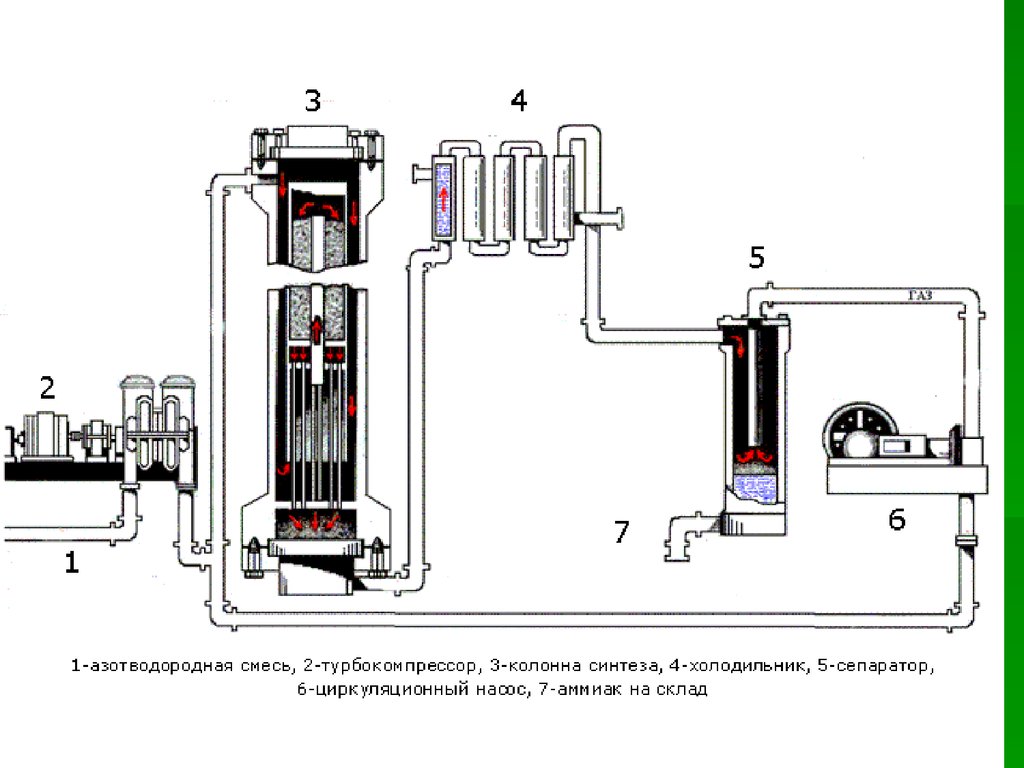 Но оборудование, доступное для высокого давления, стоит дорого. Кроме того, создание высокого давления требует больших затрат.
Но оборудование, доступное для высокого давления, стоит дорого. Кроме того, создание высокого давления требует больших затрат.
Поэтому внутри реактора должно поддерживаться давление около 200 атм.
Реакция получения аммиака
Экзотермическая реакция
1:3 N 2 : H 2 объемное соотношение
Реакция не доходит до завершения. Следовательно, остаются N 2(g) & H 2(г) с NH 3(г) в продукте. Здесь продукт охлаждается. При охлаждении продукта аммиак становится жидким состояние из газообразного состояния. Но N 2(г) и H 2(g) находятся в газообразном состоянии.
В качестве конечного продукта выделяется жидкий аммиак.
Непрореагировавшие азот и аммиак повторно направляются в реакцию.
Равновесие реакции водорода и азота
Можно ли получить больше аммиака, увеличивая количество реагентов?
- Избыток реагентов сдвинет константу равновесия вправо.
 Отсюда больше N 2(г) и
H 2(g) даст больше NH 3(g) .
Отсюда больше N 2(г) и
H 2(g) даст больше NH 3(g) . - Но большее количество реагентов повысит давление в реакторе. Поэтому для высокого давления приходится применять доступные по цене устройства. Это приводит к высокой стоимости.
- Кроме того, добавление большего количества реагентов будет стоить больше денег.
Можно ли получить больше аммиака, снизив температуру?
- Снижение температуры означает снижение тепла в реакторе
- Прямая реакция NH 3 производство является экзотермической реакцией.
- Следовательно, отвод тепла от реактора сдвинет константу равновесия вправо, что даст большую Продукт NH 3(g) .
- Уменьшение тепловыделения Уменьшение энергии реагентов .
- Чтобы произошла реакция, молекулы должны иметь энергию активации. В противном случае молекулы, имеющие энергия активации будет только реагировать.
- Уменьшение энергии вызывает уменьшение числа молекул , обладающих энергией активации.

- Следовательно, скорость реакции упадет. Произведение аммиака в единицу времени (в сутки, в месяц) уменьшится.
- Производители не могут долго ждать.
- Тогда нельзя применять очень низкую температуру.
Применение аммиака
Аммиак широко используется в промышленных и бытовых масштабах.
- Для производства мочевины
- Для производства азотной кислоты
- Для промышленности взрывчатых материалов
- Производство удобрений
- Для предотвращения коагуляции натурального латекса.
- В качестве хладагента
- В качестве дезинфицирующего средства
Загрязнение окружающей среды аммиачной промышленностью
Аммиачная промышленность может вызвать несколько загрязнений окружающей среды из-за своей продукции и физических условий.
- Добавление газа NH 3(g) в атмосферу загрязняет воздух.
- Аммиак растворяется в воде, и вода становится щелочной.
 Это убьет рыбу в реках и других водотоках.
Это убьет рыбу в реках и других водотоках. - Из-за высоких температур в окружающую среду добавляется тепло. Температура окружающей среды будет повышена.
- Углеродная пыль выбрасывается в окружающую среду в результате получения H 2 из нефти.
- Если H 2 получен электролизом NaCl (водн.) , атмосфера может быть загрязнена выбросом Cl 2 .
Как отделить аммиак от непрореагировавшего азота и водорода?
Температура кипения аммиака выше, чем у водорода и азота. Таким образом, мы можем легко сжижать аммиак путем повышения давления, в то время как водород и азот остаются в газообразном состоянии. Так жидкий азот можно отделить от непрореагировавшего водорода и азота.
Повышение эффективности установки
Процесс Габера осуществляется при температуре 530-560 0 C. Поэтому продукты, выходящие из реактора, имеют большую теплоемкость. Это тепло может быть использовано для предварительного нагревания реагентов, азота и водорода. Это уменьшит потребление энергии заводом и экономично.
Это уменьшит потребление энергии заводом и экономично.
Можем ли мы внедрить процесс Хабера на нефтяном заводе?
На нефтеперерабатывающих заводах в результате переработки получают газообразный водород и газообразный аммиак. Но произведенный аммиак существует в виде водного раствора с HCl. Итак, аммиак реагирует с HCl с образованием хлорида аммония ( NH 4 Кл ). Если мы хотим восстановить аммиак из хлорида аммония, мы можем добавить водный раствор NaOH в водный раствор NH 4 Cl раствор при нагревании.
Что является источником водорода в процессе Хабера
Газообразный водород производится в основном в нефтяной промышленности мира. Этот газообразный водород хранится и используется во многих промышленных целях.
Почему железный порошок используется при производстве аммиака?
При использовании катализатора или проявителя катализатора мы должны увеличить площадь поверхности, чтобы повысить эффективность процесса катализатора.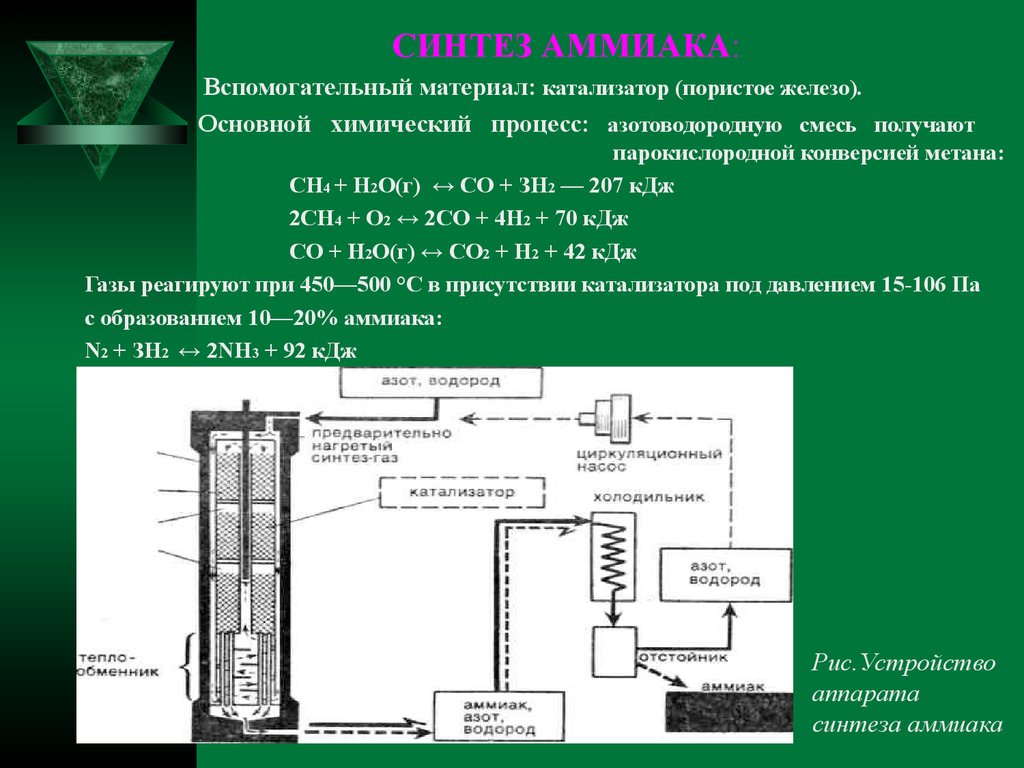 Тогда когда железо 9Используется порошок 0225 , поскольку он имеет большую площадь поверхности, чем кусок железа.
Тогда когда железо 9Используется порошок 0225 , поскольку он имеет большую площадь поверхности, чем кусок железа.
в процессе Габера водород получают путем реакции с метаном
Газообразный водород можно получить путем конверсии метана с водяным паром. В этом процессе происходят следующие реакции.
- CH 4(г) + H 2 O (г) = CO(г) + H (г)
- Полученный водород следует отделять в процессе разделения.
что является газообразным продуктом процесса Хабера?
Аммиак является газообразным продуктом процесса Габера. Это конечный продукт процесса Хабера.
Является ли процесс Хабера эндотермическим?
Реакция азота и водорода является экзотермической реакцией (в стандартном состоянии ее значение составляет -46 кДж моль -1 ). Таким образом, мы можем сказать, что реакция процесса Габера является экзотермической реакцией.
производство аммиака из азота и кислорода
Кислород не используется в качестве сырья при производстве аммиака. Но при разделении азота также можно отделить газообразный кислород.
Но при разделении азота также можно отделить газообразный кислород.
Какое сырье используется в качестве источника водорода и азота в производстве аммиака в процессе Хабера?
- Водород: из нефтяной промышленности
- Азот: путем фракционной перегонки жидкого воздуха.
Руководства по производству аммиака
Процесс производства и производства мочевиныПроизводство и процесс производства азотной кислотыИдентификация аммиака и солей аммонияИспытание газообразного аммиакаОбразование фотохимического смога и его воздействиеЗагрязнение окружающей среды в результате промышленной деятельности
Достижение скорости промышленного синтеза аммиака в условиях, близких к температуре окружающей среды, за счет модифицированных соотношений масштабирования на ограниченной двойной площадке
1. Haber F., van Oordt G., Über die Bildung von Ammoniak den Elementen. З. Анорг. хим. 44, 341–378 (1905). [Google Scholar]
2. Дженнингс Дж. Р. Каталитический синтез аммиака: основы и практика. Нью-Йорк: Plenum Press, 1991. [Google Scholar]
Дженнингс Дж. Р. Каталитический синтез аммиака: основы и практика. Нью-Йорк: Plenum Press, 1991. [Google Scholar]
3. Смиль В. Детонатор демографического взрыва. Природа 400, 415 (1999). [Google Scholar]
4. Эртль Г. Реакции на поверхностях: от атомов к сложности (Нобелевская лекция). Ангью. хим. Междунар. Эд. англ. 47, 3524–3535 (2008). [PubMed] [Google Scholar]
5. Чен Дж. Г. и др.. Преобразование азота за счет ископаемого топлива. Наука 360, 873 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Норсков Дж. К., Чен Дж. Г., «Устойчивый синтез аммиака — изучение научных проблем, связанных с открытием альтернативных, устойчивых процессов производства аммиака» (Министерство энергетики США, 2016 г.) .
7. Йе Л., Наяк-Люк Р., Баньярес-Алькантара Р., Цанг Э. Реакция: производство «зеленого» аммиака. Химия 3, 712–714 (2017). [Google Scholar]
8. Андерсен С. З. и др.. Строгий протокол электрохимического синтеза аммиака с количественными измерениями изотопов.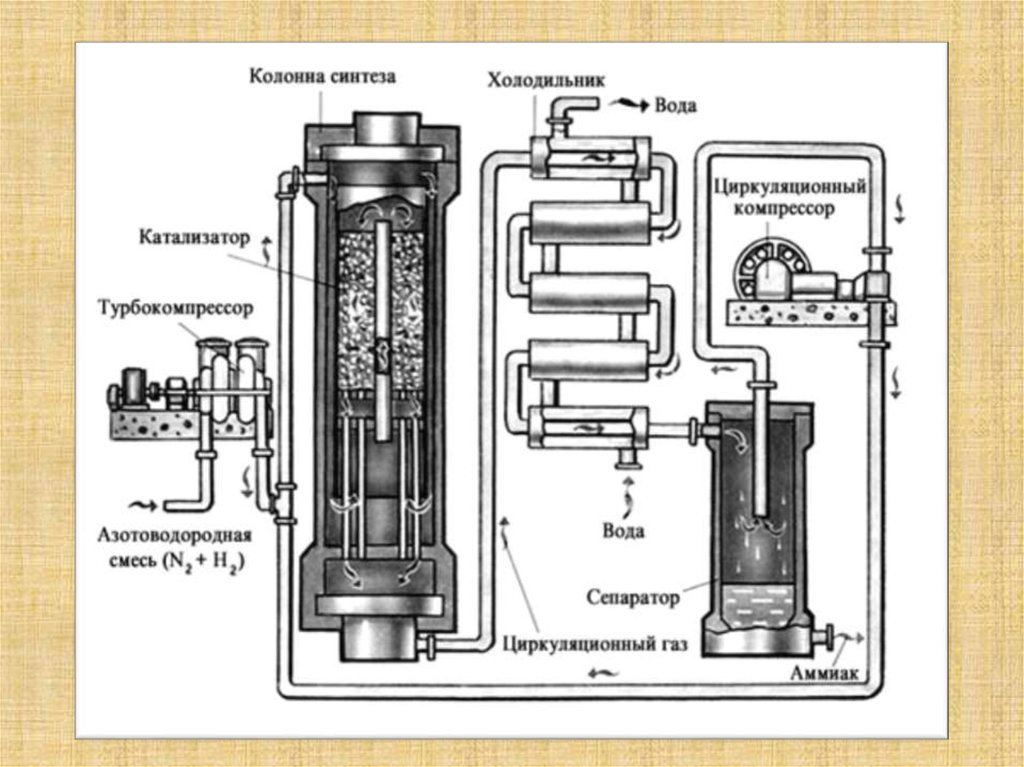 Природа
570, 504–508 (2019). [PubMed] [Google Scholar]
Природа
570, 504–508 (2019). [PubMed] [Google Scholar]
9. Suryanto BHR, et al.. Проблемы и перспективы катализа электровосстановления азота до аммиака. Нац. Катал. 2, 290–296 (2019). [Академия Google]
10. МакФарлейн Д. Р. и др. Дорожная карта для экономики аммиака. Джоуль 4, 1186–1205 (2020). [Google Scholar]
11. Ван Л. и др. Озеленение аммиака в направлении завода по переработке солнечного аммиака. Джоуль 2, 1055–1074 (2018). [Google Scholar]
12. Хонкала К. и др. Синтез аммиака на основе расчетов из первых принципов. Наука 307, 555–558 (2005). [PubMed] [Google Scholar]
13. Медфорд А. Дж. и др.. От принципа Сабатье к прогностической теории гетерогенного катализа переходных металлов. Дж. Катал. 328, 36–42 (2015). [Академия Google]
14. Абильд-Педерсен Ф. и др. Масштабные свойства энергий адсорбции водородосодержащих молекул на поверхностях переходных металлов. физ. Преподобный Летт. 99, 016105 (2007). [PubMed] [Google Scholar]
15. Ван Сантен Р. А., Нейрок М., Шетти С. Г., Теория реактивности поверхностей переходных металлов: анализ линейной энергии активации по Бренстеду-Эвансу-Полани. хим. преп.
110, 2005–2048 (2010). [PubMed] [Google Scholar]
Ван Сантен Р. А., Нейрок М., Шетти С. Г., Теория реактивности поверхностей переходных металлов: анализ линейной энергии активации по Бренстеду-Эвансу-Полани. хим. преп.
110, 2005–2048 (2010). [PubMed] [Google Scholar]
16. Че М., Нобелевская премия по химии 1912 к Сабатье: органическая химия или катализ? Катал. Сегодня 218–219, 162–171 (2013). [Google Scholar]
17. Перес-Рамирес Дж., Лопес Н. Стратегии разрыва отношений линейного масштабирования. Нац. Катал. 2, 971–976 (2019). [Google Scholar]
18. Guo X., et al.. Прямое неокислительное превращение метана в этилен, ароматические соединения и водород. Наука 344, 616–619 (2014). [PubMed] [Google Scholar]
19. Xiao J., Pan X., Guo S., Ren P., Bao X., К основам замкнутого катализа в углеродных нанотрубках. Варенье. хим. соц. 137, 477–482 (2015). [PubMed] [Академия Google]
20. Громмет А.Б., Феллер М., Клайн Р. Химическая реактивность в условиях наноограничения. Нац. нанотехнологии.
15, 256–271 (2020). [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
21. Ван М. Г. и др. Механизм ускоренной реакции водообразования в условиях межфазного удержания. Катал. 10, 6119–6128 (2020). [Google Scholar]
22. Тан Л., Мэн С., Дэн Д., Бао С., Катализ конфайнмента с двумерными материалами для преобразования энергии. Доп. Матер. 31, e16 (2019). [PubMed] [Академия Google]
23. Guo S., et al.. Исследование электронного эффекта углеродных нанотрубок в катализе: синтез NH(3) с наночастицами Ru. Химия 16, 5379–5384 (2010). [PubMed] [Google Scholar]
24. Муарравис В., Плессиус Р., ван дер Влугт Дж. И., Рек Дж. Н. Х., Эффекты ограничения в катализе с использованием четко определенных материалов и клеток. Фронт хим. 6, 623 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Легаре М. А. и др.. Фиксация и восстановление азота бором. Наука 359, 896–900 (2018). [PubMed] [Google Scholar]
26. Wellendorff J., et al.. Функционалы плотности для науки о поверхности: разработка модели обменной корреляции с оценкой байесовской ошибки. физ. Преподобный Б. Конденс. Материя Матер. физ.
85, 235149 (2012). [Google Scholar]
физ. Преподобный Б. Конденс. Материя Матер. физ.
85, 235149 (2012). [Google Scholar]
27. Медфорд А. Дж. и др. Катализ. Оценка достоверности рассчитанных скоростей каталитического синтеза аммиака. Наука 345, 197–200 (2014). [PubMed] [Google Scholar]
28. Ван Т. и др.. Рациональный дизайн селективных металлических катализаторов для аминирования спирта аммиаком. Нац. Катал. 2, 773–779(2019). [Google Scholar]
29. Ван Т., Ли Г., Цуй X., Абильд-Педерсен Ф., Идентификация материалов с высоким содержанием земли для селективного дегидрирования легких алканов в олефины. проц. Натл. акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 118, e2024666118 (2021). [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Dahl S., et al.. Роль шагов в активации N2 на Ru(0001). физ. Преподобный Летт. 83, 1814–1817 (1999). [Google Scholar]
31. Haber F., «Nobel Prize Lecture 1918» в Nobel Lectures: Chemistry 1901–1921 (Эльзевир, Амстердам, 1966). [Google Scholar]
32. Бош К.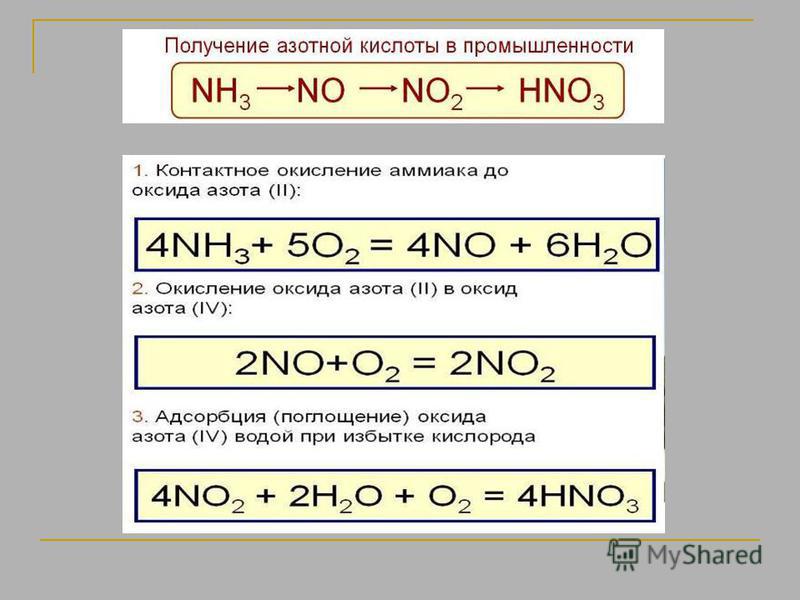 , «Нобелевская лекция 1931 года» в Нобелевских лекциях: химия 1922–1941 (Эльзевир, Амстердам, 1966). [Google Scholar]
, «Нобелевская лекция 1931 года» в Нобелевских лекциях: химия 1922–1941 (Эльзевир, Амстердам, 1966). [Google Scholar]
33. Vojvodic A., et al.. Исследование пределов: процесс Габера-Боша при низком давлении и температуре. хим. физ. лат. 588, 108–112 (2014). [Google Scholar]
34. Сун Г., Соте П., Метастабильные структуры в кластерном катализе из первых принципов: структурный ансамбль в условиях реакции и реактивность, запускаемая метастабильностью. Варенье. хим. соц. 140, 2812–2820 (2018). [PubMed] [Академия Google]
35. Сун Г., Александрова А. Н., Соте П., Pt 8 кластер на оксиде алюминия под давлением водорода: зависимая от носителя реконструкция из первых принципов глобальной оптимизации. Дж. Хим. физ. 151, 194703 (2019). [PubMed] [Google Scholar]
36. Гуо Х., Соте П., Александрова А. Н., Инициируемая реагентом изомеризация флюсового кластерного катализатора посредством динамической связи. Дж. Физ. хим. лат. 11, 3089–3094 (2020). [PubMed] [Google Scholar]
37.


 Отсюда больше N 2(г) и
H 2(g) даст больше NH 3(g) .
Отсюда больше N 2(г) и
H 2(g) даст больше NH 3(g) .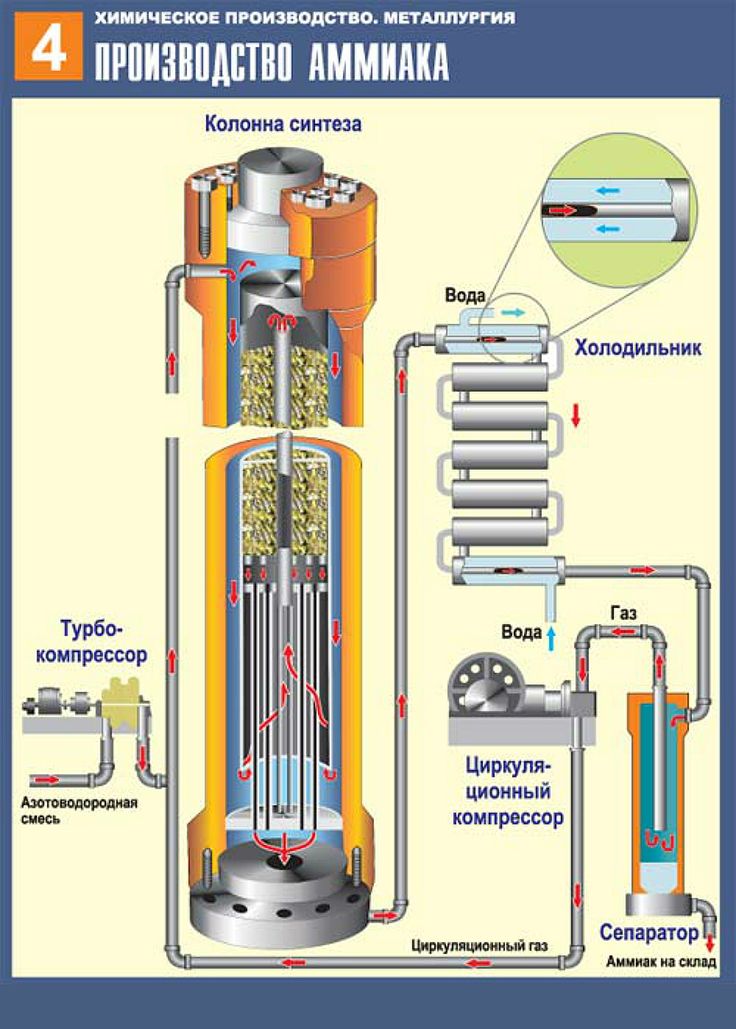
 Это убьет рыбу в реках и других водотоках.
Это убьет рыбу в реках и других водотоках.