Химия щелочных металлов и их соединений
Щелочные металлы
1. Положение в периодической системе химических элементов
2. Электронное строение и закономерности изменения свойств
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и фосфором
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие со слабыми кислотами
7.2.6. Взаимодействие с солями
Оксиды щелочных металлов
2. Химические свойства
2.1. Взаимодействие с кислотными и амфотерными оксидами
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотами
Пероксиды щелочных металлов
1. Химические свойства
1.1. Взаимодействие с водой
1.2. Взаимодействие с кислотными и амфотерными оксидами
1.3. Взаимодействие с кислотами
1.4. Разложение
1.5. Взаимодействие с восстановителями
1.6. Взаимодействие с окислителями
Гидроксиды щелочных металлов (щелочи)
1. Способы получения
2. Химические свойства
2.1. Взаимодействие щелочей с кислотами
2.2. Взаимодействие щелочей с кислотными оксидами
2.3. Взаимодействие щелочей с амфотерными оксидами и гидроксидами
2.4. Взаимодействие щелочей с кислыми солями
2.5. Взаимодействие щелочей с неметаллами
2.6. Взаимодействие щелочей с металлами
2.7. Взаимодействие щелочей с солями
2.9. Диссоциация щелочей
2.10. Электролиз щелочей
Соли щелочных металлов
Щелочные металлы
Положение в периодической системе химических элементов
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns1, на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается
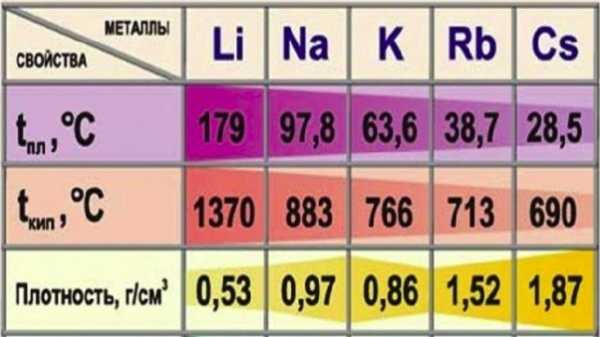
Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.
Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.
Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия
Сильвин KCl — хлорид калия
Сильвинит NaCl · KCl
Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия
Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:
Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения темпе-ратуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов
.Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
6Li + N2 = 2Li3N
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
2Na + 2C = Na2C2
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
K + O2 = KO2
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой. Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например, калий реагирует с
2K0 + H2+O = 2K+OH + H20
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например, натрий бурно реагирует с соляной кислотой:
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например, при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода
:8Na + 5H2SO4(конц.) → 4Na2SO4 + H2S + 4H2O
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодейст-вии с концентрированной азотной кислотой образуется оксид азота (I):
8Na + 10HNO3 (конц) → N2O + 8NaNO3 + 5H2O
С разбавленной азотной кислотой образуется молекулярный азот:
10Na + 12HNO3 (разб)→ N2 +10NaNO3 + 6H2O
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют
Например, при взаимодействии лития с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирет с образованием фенолята натрия и водорода:
2C6H5OH + 2Na → 2C6H5ONa + H2↑
Метанол с натрием образуют метилат натрия и водород:
2СН3ОН + 2Na → 2 CH3ONa + H2↑
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например, хлорметан с натрием образует этан и хлорид натрия:
2CH3Cl + 2Na → C2H6 + 2NaCl
2.6. В расплаве щелочные металлы могут вытеснять менее активные металлы из солей. Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, натрий вытесняет алюминий из расплава хлорида алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Способы получения
Оксиды щелочных металлов (кроме лития) можно получить только косвенными методами: взаимодействием натрия с окислителями в расплаве:
1. Оксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
10Na + 2NaNO3 → 6Na2O + N2 ↑
2. Взаимодействием натрия с пероксидом натрия:
2Na + Na2O2 → 2Na2O
3. Взаимодействием натрия с расплавом щелочи:
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития:
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами:
Например, оксид натрия взаимодействует с оксидом фосфора (V):
3Na2O + P2O5 → 2Na3PO4
Оксид лития взаимодейсвует с амфотерным оксидом алюминия:
Na2O + Al2O3 → 2NaAlO2
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например, оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например, оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
2Na2O + O2 = 2Na2O2
Пероксиды щелочных металлов
Химические свойства
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные, так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой. При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
Na2O2 + 2H2O (хол.) = 2NaOH + H2O2
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами.
Например, пероксид натрия реагирует с углекислым газом с образовани-ем карбоната натрия и кислорода:
2Na2O2 + CO2 = 2Na2CO3 + O2↑
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
Na2O2 + 2HCl = 2NaCl + H2O2
При нагревании пероксиды, опять-таки, диспропорционируют:
2Na2O2 + 2H2SO4 (разб.гор.) = 2Na2SO4 + 2H2O + O2↑
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
2Na2O2 = 2Na2O + O2↑
5. При взаимодействии с восстановителями пероксиды проявляют окис-лительные свойства.
Например, пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Na2O2 + CO = Na2CO3
Пероксид натрия с сернистым газом также вступает в ОВР с образовани-ем сульфата натрия:
Na2O2 + SO2 = Na2SO4
2Na2O2 + S = Na2SO3 + Na2O
Na2O2 + 2H2SO4 + 2NaI = I2 + 2Na2SO4 + 2H2O
Na2O2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + Na2SO4 + 2H2O
3Na2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8NaOH + 2H2O
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например, при взаимодействии с подкисленным раствором пермангана-та калия пероксид натрия образует соль и молекулярный кислород:
5Na2O2 + 8H2SO4 + 2KMnO4 = 5O2 + 2MnSO4 + 8H2O + 5Na2SO4 + K2SO4
Гидроксиды щелочных металлов (щелочи)
Способы получения
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гид-ридов и некоторых других бинарных соединений с водой также образуют-ся щелочи.
Например, натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например, карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Химические свойства
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид калия с фосфорной кислотой реагирует с образова-нием фосфатов, гидрофосфатов или дигидрофосфатов:
3KOH + H3PO4 → K3PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
KOH + H3PO4 → KH2PO4 + H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид натрия с углекислым газом реагирует с образова-нием карбонатов или гидрокарбонатов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2(избыток) → NaHCO3
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
2KOH + 2NO2 + O2 = 2KNO3 + H2O
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
Еще пример: гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
NaOH + Al(OH)3 → Na[Al(OH)4]
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
KOH + KHCO3 → K2CO3 + H2O
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2)+ 2H2O
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
Сера взаимодействует с щелочами только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Щелочи взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2KOH + Zn → K2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями.
С щелочами взаимодействуют соли тяжелых металлов.
Например, хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения, гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований. В воде практически нацело диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу. При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например, нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
2NaNO3 → 2NaNO2 + O2
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например, нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
Сильные окислители окисляют нитриты до нитратов.
Например, перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
Поделиться ссылкой:
chemege.ru
Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Тема: Основные металлы и неметаллы
Урок: Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы). У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
Рис. 1
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Свойства металлов
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см3.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl2→ 2NaCl
2Na + S Na2S
2Na + H2 2NaH
3Na + P Na3P
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
Li3N + 3H2O → 3LiOH + NH3↑
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2H2O → 2LiOH + H2↑
4. Взаимодействие с кислотами – сильными окислителями
8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
|
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ |
|
|
NaOH |
Едкий натр (каустическая сода) |
|
NaCl |
Поваренная соль |
|
NaNO3 |
Чилийская селитра |
|
Na2SO4∙10H2O |
Глауберова соль |
|
Na2CO3∙10H2O |
Сода кристаллическая |
|
KOH |
Едкое кали |
|
KCl |
Хлорид калия (сильвин) |
|
KNO3 |
Индийская селитра |
|
K2CO3 |
Поташ |
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов.
1. Взаимодействие с неметаллами
Сa + Cl2→ 2СaCl2
Сa + S СaS
Сa + H2 СaH2
3Сa + 2P Сa3 P2-
2. Взаимодействие с кислородом
2Сa + O2 → 2CaO
3. Взаимодействие с водой
Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl2 Сa + Cl2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al 3Ba + Al2O3
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3. Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
Рис. 2
СaO + H2O → Ca(OH)2
Ca(OH)2 + CO2↑ → CaCO3↓+ H2O
CaCO3↓+ H2O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2H2O, алебастр – CaSO4∙0,5H2O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.

Рис. 3
Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2H2O →Ca(OH)2 + C2H2↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.
Рис. 4
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Ca(HCO3)2 CaCO3↓ + СО2↑ + Н2О
Постоянная жесткость воды обусловлена наличием катионов Ca2+., Mg2+ и анионов H2PO4— ,Cl—, NO3— и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Алюминий и его соединения
Алюминий занимает 4-е место по распространенности в земной коре, уступая кремнию, кислороду и водороду. В природе он присутствует в виде алюмосиликатов, глин и бокситов. Рис. 5.
Рис. 5
По своим химическим свойствам он гораздо менее активен, чем щелочные и щелочноземельные металлы. Во многом это связано с образованием не его поверхности тончайшей пленки оксида, которая препятствует или замедляет многие химические реакции.
Химические свойства алюминия
1. Реакция с галогенами
2Al + 3I2 2AlI3
2. Сгор
interneturok.ru
Получение щелочных металлов | khimie.ru
Получение щелочных металлов почти всегда проводят электролитическим способом. Правда, щелочные металлы можно выделить из их соединений в свободном состоянии чисто химическим путем при помощи таких сильных восстановителей, как углерод, карбид кальция, карбид железа. Однако в случае более легких щелочных металлов эти способы связаны со значительно большими техническими трудностями, чем электролиз. В условиях крупного производства литий и натрий стали получать исключительно электролитическим путем. Ранее натрий изготовляли электролизом расплавленного гидроксида. Но так как в дальнейшем и гидроксид стали получать электролизом хлорида, этот метод получения потребовал в общем значительно большего расхода электроэнергии, чем непосредственный электролиз хлорида. Однако электролиз гидроксида технически проще осуществлялся, так как он обладает более низкой точкой плавления, чем хлорид. После того как научились достаточно понижать точку плавления хлорида введением подходящих добавок, электролиз хлорида стал все более вытеснять электролиз едкого натра.
Получение калия ведут также отчасти электролизом расплава (в последнее время путем электролитического разложения кислородных солей калия, растворенных в расплавленных галогенидах калия; при этом на графитовом аноде выделяется углекислый газ. Однако наряду с этим для получения калия существенное значение имеют также чисто химические способы, и прежде всего карбидные способы (взаимодействие КF с СаС2).
Металлический литий получают электролизом расплавленного чистого хлорида. В технике для этого применяют смеси LiCl и КС1. В лаборатории также используют хлорид лития, который растворяют в пиридине.
В случае рубидия и прежде всего в случае цезия электролитический метод менее пригоден. Здесь получение лучше вести химическим путем: нагреванием гидроксидов с металлическим магнием в токе водорода или с металлическим кальцием в вакууме. В качестве восстановителя, согласно де Буру (1930), подходит цирконий. Небольшие количества Rb или Сs, согласно де Буру (1927), удобно получать нагреванием их хлоридов, применяя их смесь с азидом бария в высоком вакууме. Далее щелочные металлы восстанавливает из их хлоридов, они испаряются и оседают на холодных стенках сосуда.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
Методы получения щелочных металлов::Chemfiles.narod.ru::
Щелочные металлы. Щелочные
металлы применяются в лаборатории весьма широко; так, некоторые из них
употребляются при образовании светочувствительной поверхности фотоэлемента и для
получения тонких плёнок — фильтров, применяемых в ультрафиолетовой части
спектра;, наконец, в парообразном состоянии щелочные металлы могут быть
использованы для демонстрации эффекта резонансного излучения. Вот почему мы
вкратце остановимся на некоторых способах обращения с этими, легко реагирующими
металлами.
Щелочной металл может быть получен в откачанной стеклянной трубке путём
вытеснения его кальцием из соответствующего хлорида:
2МС1 + Са = 2М +СаС12. (1)
Реакция будет развиваться в указанном направлении, если, повышая температуру, удалять свободный щелочной металл (М) путем испарения. Для получения щелочного металла можно воспользоваться также другой реакцией, беря вместо хлорида соль хромовой кислоты, а вместо кальция цирконий. Способ этот применим для получения всех щелочных металлов, за исключением лития, который вступает в реакцию со стеклом или с кварцем; литий лучше всего вытеснять цирконием из соли хромовой кислоты в железной аппаратуре.
Рассмотрим подробнее, как,
воспользовавшись реакцией (1), можно получить калий. Для этого измельчённый
хлористый калий смешивается в стехиометрической пропорции (3,7 г КС1 на 1 г Са)
со стружками металлического кальция внутри закрытой с одного конца железной
трубочки. Последнюю помещают в трубку из тугоплавкого стекла с утолщёнными
стенками, как показано на рис. 355. Стекло в этом месте сделано более толстым
для того, чтобы можно было максимально повысить температуру: при более низких
температурах реакция протекает очень медленно, тонкостенная же трубка будет
смята атмосферным давлением. После того как железная трубочка помещена внутрь
стеклянной, последняя запаивается с помощью ручной горелки. Затем, когда получен
хороший вакуум, химикалии постепенно подогревают, пока они полностью не
прореагируют. Нагревание производится сперва медленно, затем более интенсивно,
до температуры, при которой начинает размягчаться стекло. Слишком сильного
нагрева следует избегать, так как при этом можно перегнать кальций.
Освобождённый и перегнанный калий конденсируется на сгибе трубки (как это
показано на рис. 1), откуда он вновь перегоняется в ампулу, отпаиваемую под
вакуумом.
Так как щелочные металлы энергично реагируют с воздухом, то вскрывать ампулу
следует так, чтобы в неё не попал воздух. Операция эта производится следующим
образом. Ампулу, изготовленную из стекла пайрекс, с надетым на неё вольфрамовым
колечком, помещают в вакуум и затем с помощью высокочастотной индукционной
катушки нагревают вольфрамовое колечко до тех пор, пока стекло не треснет (рис.
2).
Можно вскрыть ампулу без помощи нагрева высокой частотой, воспользовавшись бойком, как показано на рис. 3. Как видно из рисунка, в стенке боковой стеклянной трубки имеется вмятина, задерживающая боёк и не позволяющая ему разбить ампулу до того, как вся конструкция напаяна на вакуумный пост. Во время напайки на пост вмятина выдувается, что освобождает бойку путь. Управляя бойком с помощью внешнего электромагнита, можно отбить кончик ампулы. Чтобы облегчить эту операцию, можно предварительно поцарапать кончик ампулы напильником.
Можно также охладить ампулу в наполненном углекислым газом стакане, на дне которого находится сухой лёд. Ампула вскрывается в атмосфере углекислого газа, быстро переносится к вакуумному посту, припаивается и откачивается. Заполняющий ампулу углекислый газ не позволяет воздуху соприкоснуться со щелочным металлом. Имеющиеся в продаже щелочные металлы в виде небольших кубиков или кусков неправильной формы хранятся погружёнными в керосин. Чтобы очистить их и сделать пригодными к употреблению, поступают следующим образом. Прежде всего, чтобы избавиться от керосина, металл промывают в пётролейном эфире или в бензоле, предварительно обезвоженных путём встряхивания с хлористым кальцием. Ни в коем случае не следует производить промывку щелочных металлов в четырёххлористом углероде или в хлороформе, так как при этом образуются сильно взрывчатые соединения. Затем металл расплавляется на дне 8-мм пробирки и засасывается в стеклянный капилляр диаметром 1 мм, снабжённый для этой цели резиновой трубочкой.
Капилляр отпаивается над самым металлом и закрывается с
другого конца мягким парафином. Если металл необходимо ввести в вакуумную
систему, то нужный кусок начинённого металлом капилляра отрезается с помощью
кусачек и помешается в припаянную к откачному посту колбочку, откуда металл
затем перегоняется в систему (рис. 4).
На рис. 5 показано, как производится перегонка натрия под вакуумом с целью
освободить его от водорода и углеводородов (водород, содержащийся в калии или в
натрии, будучи измерен при атмосферном давлении, может составить от ста до
двухсот объёмов металла). Чтобы очистить натрий от керосина, кубики металла
промывают способом, описанным выше, и затем помещают в камеру I. Здесь, после
того как система откачана, металл расплавляют, подогревая камеру коптящим
пламенем.
При этом металл стекает в
камеру II, а камера I с остатками затем отпаивается. В камере II металл в
течение нескольких часов подогревается маленькой электрической печью. Испарённый
металл конденсируется в изолированной асбестом трубке над камерой
II.
За это время успевают откачаться водород и углеводороды. После этого металл
перегоняют в камеру III, пропуская ток через проволоку, обмотанную вокруг
трубки, где конденсировался металл. Затем отпаивают камеру II. Камера III может
быть приёмником металла; можно также перегнать металл в следующую приемную
ампулу. При дистилляции щелочных металлов рекомендуется пользоваться
электрическими нагревателями, так как при нагреве пламенем горелки может
треснуть стекло.
При работе со щелочными металлами необходимо соблюдать следующие
предосторожности: не следует обрабатывать больших количеств металла, чем это
требуется: под рукой на случай пожара должен находиться ящик с песком; ни в коем
случае нельзя допускать соприкосновения щелочных металлов с водой;
использованный металл и негодные приборы, в которых находится металл, надо
зарывать в землю. Желательно при работе со щелочными металлами пользоваться
защитными очками. Натрий можно получить путём электролиза через стенки колбы
электрической лампы, изготовленной из натриевого стекла. Для этой цели лучше
всего воспользоваться 32-вольтовой лампой, обладающей более массивной
вольфрамовой нитью, чем 110-вольтовая лампа. Лампа, откачанная предварительно
через специально впаянную боковую трубку, погружается в ванну с расплавленным
азотнокислым и азотистокислым натрием и включается в электрическую цепь, как
показано на рис. 6.
От вольфрамовой нити к стеклянным стенкам колбы ток переносится электронами или разрядом в парах натрия, либо в некоторых специальных случаях разрядом в аргоне. Практические особенности этого процесса описал Р. Берт. Свободный металл образуется из рекомбинировавших ионов натрия, которые при протекании тока проходят сквозь стекло, являющееся твёрдым электролитом. Рекомбинация происходит благодаря присутствию электронов и отрицательных ионов натрия (или аргона). Описанный процесс электролиза подчиняется закону Фарадея. При фотографировании спектра разряда в парах натрия подтвердилась высокая степень чистоты металла, полученного путём электролиза. Загрязнения по оценке Берта не превышают 0,000002. Для металла, полученного электролизом, характерно полное отсутствие водорода и углеводородов. Сила тока при электролизе меняется от нескольких миллиампер, когда ток имеет исключительно электронный характер, до нескольких сот миллиампер, когда он становится ионным. Чтобы получить разряд в парах натрия, достаточно прекратить воздушное дутьё, охлаждающее колбу лампы для конденсации на ней металла. Берт утверждает, что спектр разряда в натрии не является самообращённым; лампа, содержащая натрий, будучи подогрета, флуоресцирует, если на неб фокусировать свет натриевого разряда, происходящего в другой лампе (см. рис. 7).
В кварцевый фотоэлемент натрий можно ввести путём электролиза, используя переходный спай стекло-кварц, как показано на рис. 8. Калий можно получать путём электролиза сквозь калиевое стекло, свободное от натрия и свинца; ванна наполняется в этом случае расплавленным азотнокислым и азотистокислым калием. Калий и натрий можно растворять в нашатырном спирте и затем осаждать их в нужных местах, выпаривая растворитель; для лития растворителем служит этиламин. Все щелочные металлы при повышенных температурах реагируют со стеклом, особенно со свинцовым, с которым они по этой причине вообще не должны соприкасаться. Покрывая трубки из стекла пайрекс бурой или борной кислотой, можно повысить их стойкость по отношению к натрию. Чтобы покрыть трубку, её наполняют горячим насыщенным раствором буры, осаждающимся при охлаждении раствора в виде кристаллов на внутренних стенках трубки. Когда стекло покроется тонким слоем кристаллов, раствор выливают и трубку осторожна просушивают, после чего откачивают её, нагревая пламенем горелки для устранения воды. Сначала нагревание ведут осторожно, доводя в конце 1 концов трубку до максимальной температуры, выдерживаемой стеклом. Образуется гладкая внутренняя поверхность, стойкая по отношению к натрию.
Сплавы натрия с калием, содержащие от 45 до 90% калия, остаются жидкими при комнатной температуре.
www.chemfiles.narod.ru
Получение щелочноземельных металлов | khimie.ru
Из металлов главной подгруппы ІІ группы технически наиболее важным является магний. Обычно его получают электролизом чистого обезвоженного и расплавленного карналлита МgСl2∙КС1 или смеси соответствувлцнх: солей при температуре, превышающей точку плавления магния, применяя анод из графита Ачесона и железпыи катод. Жидкий магний при электролизе поднимается на поверхность, откуда его извлекают черпаками.
Так как при электролизе расплава происходит разложение только хлорид магния МgС12, его необходимо непрерывно добавлять. МgCl2 получают из магнезита вля жженого доломита по реакции:
МgО + СО + С12 = МgС12 + СО2,
для которой используют хлор, выделяющийся на аноде.
В последнее время для производства магния технологическое значение приобрели так называемые термические методы. Важнейшие из них — восстановление Мg0 карбидом кальция или углем (карботермические методы) и восстановление МgO кремнием (силикотермические методы).
При производстве магния парботермичеакими методами ведут восстановление МgO углеродом в электродуговых пtчах. Реакция МgО + С = Мg + СО идет слева направо только при температуре выше 2000 °C. Чтобы в улетучивающейся смеси паров магния и СО вновь не образовалась МgО, их следует очень быстро охлаждать. Вначале это достигали добавлением водорода.
В США, где в основном применяют и арботермический метод, быстрое охлаждение реакционных газов осуществляется при введении природпых газов.
Более простым в технологическом отношении, чем восстановление МgО углеродом, является воcстановление карбидом кальция. Восстановление ведут в вакууме в реторте, нагреваемой снаружи почти до 1200 °C; реакция идет по уравнению
МgО + СаС2 = Мg + СаО + 2С.
Этот метод (применяемый в основном в Англии и во Франции) экономически выгоден только при наличии дешевого карбида кальция.
Силикотермический метод основан на том, что сильно экзотермическая реакция
SiO2 + 2Mg = 2MgO + Si
при повышении температуры может пойти в обратную сторону. При этом исходят обычно не из чистого оксида магния, а из жженого доломита. Последний в смеси с кремнием или ферросилицием нагревают до 1200-1300 °С в стальной реторте или в высоко-вакуумной печи, обогреваемой электричеством. При этом происходит следующая реакция:
2Мg0 + 2СаО + Si = Са2SiO4 + 2Mg.
Магний (с чистотой 98-99 %) Отгоняется и осаждается в приемниках, охлаждаемых воздухом.
Техническое получение кальция осуществляют электролизом расплавленного хлорида кальция в смеси с фторидом кальция и хлоридом калия. При этом оказалось целесообразным такое устройство катода, при котором последний едва касается поверхности расплавленной массы; по мере выделения кальция на катоде последний поднимают вверх. Нагревание расплава производит лишь в такой степени, чтобы он оставался жидким. Если вести электролиз при температуре более высокой, чем точка плавления кальция, то значительная часть расплавленного кальция переходит в результате диффузии в плав и теряется вследствие вторичного окисления. Если же электролиз вести ниже температуры плавления кальция, то металлическим кальций выделяется в виде губчатой, сильно загрязненной массы. При описанном устройстве катода на нем вследствие местного разогрева, вызываемого очень высокой плотностью тока, выделяется кальций, причем заметной диффузии его в более холодный плав уже по происходит. По мере подъема катода па нем застывает выделившийся кальций, так что образуется все более длинный стержень из чистого металла, поверхность которого защищена от окисления коркой из застывшей расплавленной массы.
Кальций высокой чистоты получают в технике по Хакшпиллю при нагревании хлорида кальция с металлическим алюминием. Образующийся при этом хлорид алюминия испаряется, а кальций можно подвергнуть дальнейшей очистке перегонкой в вакууме.
Стронций, так же как и кальций, можно получить электролитически, в то же время получение бария этим методом сопряжено с большими трудностями. Гораздо чучшее по методу Гувтца и Матиньона удается восстановление в вакууме оксида бария алюминием или кремнием при 1200 ºС, протекающее по реакциям:
3ВаО + 2А1 = А12О3 + 3Ва;
3ВаО + Si = ВаSiO3 + 2Ва.
Металлический бериллий, согласно Фихтеру , проще всего получать в лаборатории электролизом расплавленной смеси ВеF2 и NаF в молярном отпошенпг 2:1. Расплавленную массу при этом помещают в никелевый тигель, служащий одновременно катодом, в то время как анод — толстый угольный стержень — погружают в плав. Во избежание образования сплава бериллия с никелем: не следует допускать слишком сильного нагревания.
Технический способ получения бериллия, разработанный Штоком и Гольдшминдтом (1925), основан на электролизе смеси NаВеF3 и Ва(ВеF3),. или других подходящих смесей, состав которых подбирают так, чтобы они отличались возможно более высокой электропроводностью наряду с возможно меньшей летучестью при температурах выше точки плавления бериллия. При этом, так же как прс получении кальция, применяют охлаждаемые контактные катоды, однако температуре расплава значительно выше (около 1400 ºC). Бериллий высокой чистоты получают про перегонке в вакууме. Для этого металл загружают в тигель из ВеО и нагревают током высокой частоты.
Для получения щелочноземельных металлов в очень небольших количествах используют разложение азидов.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
Интегрированный урок химии и информатики по теме «Щелочные металлы»
Разделы: Химия, Конкурс «Презентация к уроку»
Презентация к уроку
Загрузить презентацию (7,8 МБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель урока: на примере щелочных металлов продемонстрировать общую закономерность изменения свойств элементов главных подгрупп Периодической системы Д.И.Менделеева. Дать характеристику простых и сложных веществ, образованных данными элементами, рассмотреть способы получения и области применения этих веществ.
Оборудование: образцы щелочных металлов (литий, натрий), эксикатор с водой, фенолфталеин, колбы с кислородом, закрытые пробками, ложечки для сжигания веществ, концентрированная соляная кислота.
Строение атомов элементов главной подгруппы I группы
Учащиеся записывают в тетрадь знаки химических элементов, указывают распределение электронов по энергетическим уровням, выявляют общие закономерности в строении атомов щелочных металлов: наличие 1 электрона на внешнем уровне и последовательное увеличение радиусов атомов от лития до цезия в связи с возрастанием числа уровней. Проанализировав данные факты, учащиеся делают вывод, что щелочные металлы являются сильными окислителями и проявляют в соединениях постоянную степень окисления +1. Следствием увеличения радиуса атомов от Li к Cs является усиление их восстановительных свойств.
Характеристика простых веществ
В ходе демонстрации учителем образцов щелочных металлов, учащиеся делают обобщение, что все щелочные металлы при обычных условиях мягкие, серебристо-белые вещества. Учитель сообщает, что их температуры плавления и кипения уменьшаются с ростом порядкового номера элемента. Плотность же, как правило, возрастает.
Химические свойства щелочных металлов
В химических реакциях эти металлы проявляют ярко выраженные восстановительные свойства, которые возрастают от Li к Cs. Из-за высокой химической активности по отношению к воде, кислороду, азоту их хранят под слоем керосина или минерального масла. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера отрезают скальпелем, очищают поверхность от продуктов его взаимодействия с окружающей средой и проводят химическую реакцию.
Взаимодействие с кислородом. В зависимости от металла продукты взаимодействия с кислородом имеют разный состав.
Только литий сгорает на воздухе с образованием оксида:
4Li + O2 = 2Li2O
При горении натрия на воздухе в основном образуется пероксид Na2O2:
2Na + O2 = Na2O2
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
K + O2 = KO2.
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
2NaOH + 2Na = 2Na2O + H2,
Na2O2 + 2Na = 2Na2O,
KO2 + 3K = 2K2O.
Оксиды щелочных металлов обладают всеми свойствами основных оксидов – они реагируют с водой, кислотными оксидами и кислотами:
Li2O + H2O = 2LiOН
K2O + SO3 = K2SO4,
Na2O + 2HNO3 = 2NaNO3 + H2O
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
2NaI + Na2O2 + 2H2SO4 = I2 + 2Na2SO4 + 2H2O,
4KO2 + 2CO2 = 2K2CO3 + 3O2
Последняя реакция используется на космических кораблях и подводных лодках для получения кислорода.
Взаимодействие с другими неметаллами. При нагревании они соединяются с водородом с образованием гидридов; галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием соответственно галогенидов, сульфидов, фосфидов, карбидов и силицидов:
2Na +Cl2= 2NaCl,
2K+S = K2S,
6Li +N2 =2Li3N,
2Na + H2 = 2NaH,
2Li + 2C = Li2C2
Качественные реакции щелочных металлов. При нагревании металла или его соединений в пламени элементы ионизируется , окрашивая пламя в разные цвета. Для лития и его соединений характерен карминно — красный цвет, для натрия — желтый, для калия — фиолетовый, для соединений рубидия — беловато-розовый, для цезия – фиолетово-красный.
Получение щелочных металлов
Из-за высокой восстановительной способности щелочных металлов получают их в основном электролизом расплавов галогенидов, чаще всего- хлоридов, образующих природные минералы:
2LiCl = 2Li + Cl2
(катод: 2Li+ + 2e → 2Li, анод: 2Cl— — 2e → Cl2).
Иногда для получения металлов используют электролиз расплавов гидроксидов:
4NaOH = 4Na + 2H2O + O2
(катод: 4Na+ + 4e → 4Na, анод: 4OH— — 4e → 2H2O + O2)
Применение щелочных металлов и их соединений
Натрий и калий — жизненно важные элементы. В тканях млекопитающих действует система транспорта ионов натрия и калия, называемая натриевый или калиевый нанос, которая обеспечивает необходимое соотношение концентраций ионов натрия или калия во внеклеточном и внутриклеточном пространстве.
Мировое производство гидроксида натрия превышает 30 млн. т в год, он используется для изготовления мыла, синтетических моющих средств, производства искусственного волокна, получения органических соединений, например фенола. Мировой объем производства соды (карбоната натрия) достигает десятков миллионов тонн в год. Основной потребитель соды — стекольная промышленность — потребляет около 10 млн. т кальцинированной соды.
Основными калийсодержащими соединениями, широко используемыми на практике, являются нитрат калия, необходимый для производства удобрений, и поташ K2CO3, используемый в производстве стекла и жидкого мыла.
Интегрирование урока химии и урока информатики
На этом уроке химии по щелочным металлам со стороны теоретического курса информатики наглядно отображена тема «Информационные модели и их построение ». Информационная модель объекта – это его описание. Способы описания могут быть разными: словесное, графическое, табличное, математическое и т.д.
Информационная табличная модель — это универсальное средство представления информации об изучаемых объектах. Таблицы разделены на несколько типов, такие как «объекты-свойства», «объекты-объекты», «сложные типы таблиц», вычислительные таблицы. В представленной презентации «Щелочные металлы» показаны основные формы информационных моделей. Электронное строение щелочных металлов сведено в табличную информационную модель типа «объекты-свойства». В качестве объектов взяты названия щелочных металлов, справа указаны свойства этих объектов — схематическое электронное строение и электронная формула.
Физические свойства щелочных металлов представлены как словесная информационная модель. Эти свойства продемонстрированы видеороликом, вставленным в презентацию.
Химические свойства щелочных металлов представлены в смешанной форме информационной модели – словесная и формульная, где использованы естественный и формальный язык химических формул. Также эти свойства отражены в видеоролике.
В разделе презентации «Применение щелочных металлов» использована информационная модель на графах. Такого типа модели позволяют определить связи между объектами, в частности здесь показана связь между щелочным металлом и изделиями, в которых он применяется.
И наконец, показана графическая информационная модель «Электролиз солей», выполненного в виде рисунка и формулы.
К уроку подготовлена презентация «Щелочные металлы» в PowerPoint (см. Приложение 1 – архив с включенными видеофайлами), которая демонстрирует возможности этой программы: дизайн, анимацию, звук, видео. Переход между слайдами осуществляется по щелчку мыши, воспроизведение видеороликов в слайдах происходит также по щелчку мыши.
Благодаря разноплановым видам информации, в которых изложена тема, урок становится интересным для учащихся и хорошо усваиваемым.
13.02.2011
urok.1sept.ru
Щелочные металлы получение — Справочник химика 21
Политетрафторэти-л е н (тефлон, флюон), производимый в сравнительно небольших количествах, представляет особый интерес из-за своей чрезвычайно высокой устойчивости. Все атомы водорода в молекуле полиэтилена заменены в этом полимере атомалш фтора, имеющими близкую величину радиуса атома. Энергия связи углерод — фтор составляет 124 ккал моль. Этим объясняется высо- сая термостойкость, устойчивость к действию растворителей и агрессивных химических реагентов. Политетрафторэтилен практически . ожет быть разрушен только при действии расплавленных щелочных металлов. Получение мономера и полимера протекает о следующей схеме [c.71]Щелочные металлы. Общая характеристика на основе положения в периодической системе элементов. Получение, физические и химические свойства. Оксиды и пероксиды щелочных металлов. Гидроксиды щелочных металлов, получение, химические свойства (гидроксиды натрия и калия). Важнейшие соли натрия и калия, их применение. Калийные удобрения. [c.8]
Темно-красный, низкоплавкий, при кипении разлагается. Имеет ионное строение 1 [1СЬ]. Реагирует с водой, концентрированными кислотами, щелочами, хлоридами щелочных металлов. Получение см. 519 , 533. [c.277]
Желто-оранжевый, кристаллический или аморфный, при умеренном нагревании разлагается. Проявляет амфотерные свойства реагирует с водой, кислотами, щелочами. Переводится в раствор действием карбонатов щелочных металлов. Получение см. 68>, 684, 685. [c.343]
Эффект действия железа в растворе хлорида щелочного металла (получение амина) не тождественен эффекту действия цинка р-рас-творе хлористого аммония (получение -арил гидроксиламина) . возникает вопрос чем вызывается эта разница [c.127]
Аналогичные данные были получены для большинства элементов, легко переводимых в жидкое состояние (координационные числа для жидкостей приведены на рис. 5.13, см. т. 1), для некоторых простых многоатомных жидкостей (напрпмер, ССЦ, НгО, ЗпЦ) и для некоторых солей (например, галогенидов щелочных металлов). Полученные результаты согласуются с изложенной выше моделью. [c.126]
Райс и Клемперер [731] исследовали термодинамические свойства газообразных галогенидов щелочных металлов. Полученные результаты показали, что содержание в газовой фазе димеров и более высоких полимеров незначительно. Като [732] наблюдал рост волокон ЫаСЮз на искусственных монокристаллах. Волокна состоят из кристаллитов 0,5 мм длиной. [c.423]
СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ Получение амальгамы натрия [c.161]
Металлические S , Y, La получают путем металлотермического восстановления ЭСЬ и Э2О3 магнием. Из образующегося сплава магния с металлом магний удаляют высокотемпературной отгонкой в вакууме. Для получения S , Y, La используют также взаимодействие фторидов и хлоридов с кальцием (лолучение S , Y), щелочными металлами (получение Y, La), а также электролиз расплавов фторидов или хлоридов с добавками Na l или K l, вводимыми для понижения температуры плавления. Так, возмож- ность течения процесса [c.497]
В табл. 8 приведены значения —1 Тт+ Для некоторых галогенидов щелочных металлов, полученные методом определения температуры замерзания водных растворов. [c.165]
Раствор, содержащий Ва2+, Sf2+, a + и Mg + нейтрализуют 10%-ным раствором щелочи и осаждают катионы П группы и Mg2+ насыщенным раствором карбоната щелочного металла. Полученный осадок хорошо промывают, растворяют при нагревании разбавленным раствором уксусной кислоты. Далее катионы II группы отделяют от Mg + и обнаруживают их обычным способом (см. 42). В фильтрате обнаруживают Mg +. [c.470]
Силикаты щелочных металлов, полученные в результате сплавления кремнезема со щелочами, представляют собой стеклообразную массу и вследствие растворимости в воде называются растворимым стеклом. В промышленности силикат натрия Na2SiOз получают сплавлением песка с содой [c.365]
Прибавляют 1—2 капли H l, выпаривают досуха и прокаливают на горелке для удаления аммониевых солей при температуре темно-красного каления (до начала плавления хлоридов щелочных металлов). При этой операции температуру повышают постепенно во избежание потери за счет растрескивания осадка хлоридов щелочных металлов. Полученные хлориды взвешивают. [c.184]
Рентгенограммы порошков бариевых солей и солей щелочных металлов, полученных таким методом, указывают на то, что гекса- [c.73]
Весовой метод. Литий может быть определен весовым методом в виде сульфата, фторида, фосфата, алюмината. Взвешивание в виде сульфата практикуется при экстракционном методе отделения лития от остальных щелочных металлов. Полученный в процессе экстракции хлорид лития переводится в сульфат и прокаливается при 650—700°. Процесс рекомендуется осуществлять в платиновой или кварцевой посуде. [c.81]
Образование водородных связей между гидратной оболочкой катионов и обмениваемой группой приводит к обращению ряда селективности катионов щелочных металлов, полученного> на катионитах с карбоксильными или фосфиновыми группами,, а для сульфированных катионитов последовательность катионов сохраняется. Отмеченные выше примеры наблюдались как аномалии в поведении ионитов обычных типов. В нескольких случаях эти наблюдения помогли получить сорбенты с заранее заданными свойствами. [c.241]
Содержание примесей в щелочных металлах, полученных электрохимическим методом [c.78]
Результаты анализа щелочных металлов, полученных методом вакуумной электрохимии, приведены в табл. 2. Анализ проб производился в платиновой посуде. При спектральном анализе применялись безборные электроды. [c.79]
Мелкопористые фильтры из полиэтилена низкого давления (ВТУ ВНИИСС № 30 — 63). Представляют собой изделия (диски, пластины, трубы, стаканы) из жесткого пористого полиэтилена, полученные методом спекания. Для изготовления фильтров полиэтилен просеивается на вибрационном стенде через сито для удаления крупных частиц и посторонних примесей. Высушенный минеральный наполнитель также просеивается и в шаровой мельнице смешивается с полиэтиленом. Размер ячеек сита определяется заданной величиной отфильтровываемых частиц. В качестве наполнителя используют растворимые в воде соли — обычно соли щелочных металлов. Полученную композицию прессуют без [c.193]
Металлические S , Y, La получяют лутем металлотермического восстановления ЭСЬ и 3j0j магнием. Из образующегося сплава магния с металлом магний удаляют высокотемпературной отгонкой л вакууме. Для производства S , Y, La используют также реакции фторидоя и хлоридов этих металлов с кальцием (получение S , Y) и щелочными металлами (получение Y, La), а также электролиз расплавов фторидов или хлоридов с добавками Na I или K I, вводимыми для понижения температуры плавления. Так, интенсивное течение процесса [c.483]
Обьгшо динитрил медленно (от 10 до 340 ч) добавляют к кипящему р-ру амида щелочного металла полученную смесь обрабатывают избытком р-ра НС1 и затем добавляют конц. НС1. Образовавшийся кетонитрил подвергают жесткому пщролизу и дека
www.chem21.info
