Получение щелочных металлов и едких щелочей. Задачи 973
Задача 973.
Чем отличается электролитический способ получения щелочных металлов от электролитического способа получения едких щелочей? Какие электрохимические процессы происходят в том и другом случае?
Решение:
а) Щелочные металлы получают электролизом расплавов их соединений, например, натрий можно получить электролизом расплава хлорида натрия. При этом на катоде выделяется металлический натрий, а на аноде – газообразный хлор.
Уравнения реакций электродных процессов при электролизе расплава NaCl:
На катоде: Na+ + = Na0;
На аноде: Cl¯- = Cl0;
Cl0 +Cl0 = Cl2↑
Побочным продуктом является газообразный хлор, который собирают и используют в промышленности.
б) Едкие щёлочи получают электролизом водных растворов солей щелочных металлов, например, едкое натрий получают электролизом водного раствора хлорида натрия.
Уравнения реакций процессов на катоде и аноде при электролизе раствора хлорида натрия:
На катоде: 2Н2О + 2 = Н2↑ + 2ОН¯;
На аноде: 2Сl¯ — 2 = Cl20↑
Молекулярная форма:
2NaCl + 2H 2O H2↑ + 2NaOH + Cl2↑
В процессе электролиза в анодное пространство непрерывно поступает раствор NaCl, а из катодного вытекает раствор, содержащий смесь NaCl и NaOH.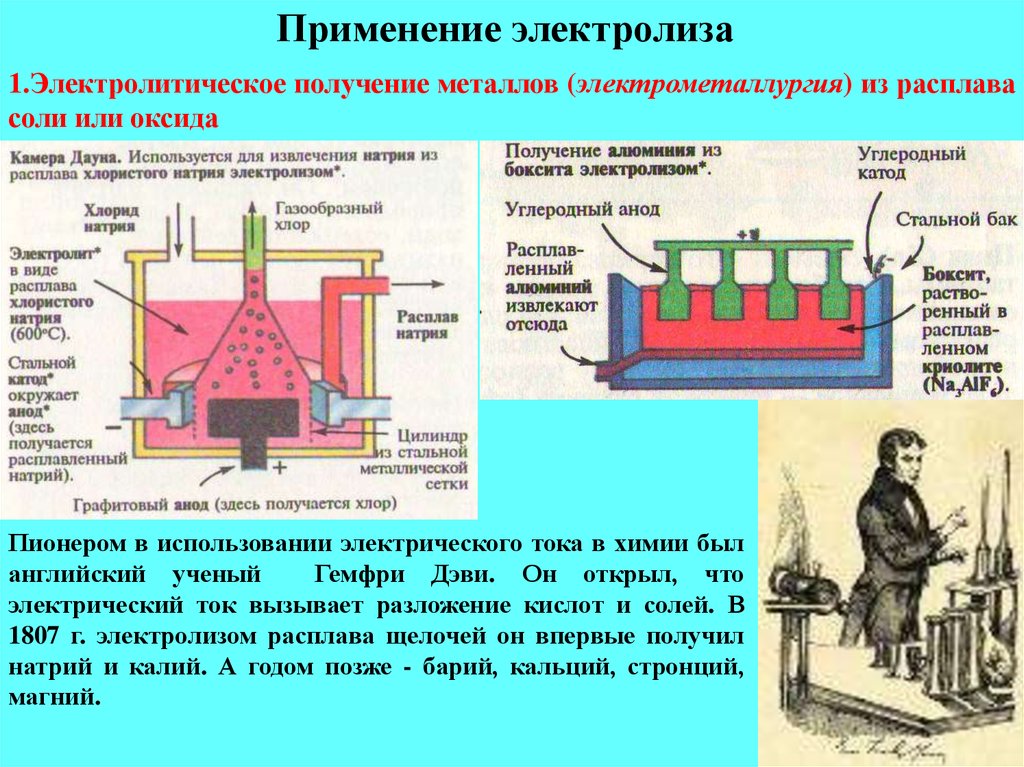 При выпаривании раствора NaCl выкристаллизовывается, а NaOH остаётся в растворе. NaOH отделяют от NaCl и выпаривают до полного удаления воды. Полученный гидроксид натрия сплавляют и отливают в формы. Побочными продуктами являются водород и хлор.
При выпаривании раствора NaCl выкристаллизовывается, а NaOH остаётся в растворе. NaOH отделяют от NaCl и выпаривают до полного удаления воды. Полученный гидроксид натрия сплавляют и отливают в формы. Побочными продуктами являются водород и хлор.
Если катодом служит ртуть, то у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя амальгаму натрия. Полученную при электролизе амальгаму разлагают горячей водой, при чём получается гидроксид натрия и выделяется водород и освобождается ртуть. Этим методом можно получить чистый гидроксид натрия, не содержащий в виде примеси хлорид натрия.
Задача 974.
Как путем электролиза раствора хлорида калия получить гидроксид, гипохлорит и хлорат калия? Написать уравнения происходящих реакций.
Решение:
а) Электролиз (Elektrolyse) раствора хлорида калия – соли образованной при взаимодействии активного металла и бескислородной кислоты протекает предсказуемо.
 В данном случае на электродах выделяется водород (катод) и хлор (анод). А в растворе постепенно накапливается соответственно щелочь (КОН).
В данном случае на электродах выделяется водород (катод) и хлор (анод). А в растворе постепенно накапливается соответственно щелочь (КОН). Стандартный электродный потенциал системы К+ + 1 = К0 (-2,950 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода:
Катод: 2Н2О +2 = H2↑ + 2ОН¯,
а ионы К+, приходящие к катоду будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление ионов хлора Cl¯, приводящее к выделению газообразного хлора:2Сl¯ + 2 + 2Cl0;
2Cl0 = Cl20↑
Поскольку отвечающей этой системе стандартный электродный потенциал (1,359 В), хотя и больше, чем стандартный электродный потенциал системы: 2Н2О = О2↑+ 4Н+ + 4 (1,228 В), то разряжаться будут ионы Cl¯. Эта аномалия связана со значительным перенапряжением электродного процесса 2Сl¯ + 2 + 2Cl0.
Эта аномалия связана со значительным перенапряжением электродного процесса 2Сl¯ + 2 + 2Cl0.
По окончании электролиза жидкость у катодного пространства выпаривают. При его выпаривании выкристаллизовываются хлорид калия и остаётся почти чистый гидроксид калия, который выпаривают до полного удаления воды. Затем, гидроксид калия сплавляют в формы. Побочными продуктами электролиза являются газообразные водород и хлор.
б) Получение гипохлорита калия. Для получения гипохлорита калия нужно, выделяющийся при электролизе хлорида калия газообразный хлор, пропустить через раствор гидроксида калия у катодного пространства. При пропускании хлора через исходный раствор едкого калия образуется гипохлорит калия:
2KOH + Cl2 = KCl + KOCl + H2O
гипохлорит
калия
в) Для получения хлората калия нужно пропустить хлор в горячий раствор гидроксида калия, получим:
6KOH + 3Cl2 = 5KCl + KClО3 + 3H2O
хлорат
калия
Поскольку хлорат калия малорастворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
|
ПРОИЗВОДСТВО ЩЕЛОЧНЫХ МЕТАЛЛОВ — IMPERIAL CHEMICAL INDUSTRIES LTD.
Настоящее изобретение относится к производству щелочных металлов. В частности, оно относится к усовершенствованному электролитическому способу получения щелочных металлов, особенно металлического натрия, и к новому устройству для осуществления усовершенствованного способа.
Наиболее широко используемые процессы производства металлического натрия включают электролиз расплавленного электролита, содержащего хлорид натрия в смеси с хлоридами щелочноземельных металлов, особенно хлоридом кальция. Эти процессы имеют несколько недостатков. Из-за необходимости включения хлорида щелочноземельного металла в электролит для снижения его температуры плавления до приемлемого уровня всегда существует равновесие между свободным щелочноземельным металлом на катоде и ионами щелочноземельного металла в электролите рядом с катодом. так что, хотя натрий является основным продуктом катода, он загрязнен щелочноземельным металлом, например кальцием. Это приводит к проблемам с закупоркой выпускных труб твердым кальцием, осаждающимся из жидкого натрия при его охлаждении, к необходимости фильтрации натрия для удаления дополнительных количеств примесей кальция и к необходимости повторной обработки смеси натрия и кальция вместе с солевые и оксидные примеси удаляются фильтрами с целью повышения эффективности процесса. Потребление энергии в этих известных способах является высоким из-за большого зазора, который поддерживается между электродами для поддержания высокой рабочей температуры и/или для сведения к минимуму рекомбинации анодных и катодных продуктов в ячейке. Такая рекомбинация имеет тенденцию к повреждению стальной сетчатой диафрагмы, расположенной между анодами и катодом, и это повреждение дополнительно усугубляется образованием твердых отложений кальция, перекрывающих зазор катод-диафрагма.
так что, хотя натрий является основным продуктом катода, он загрязнен щелочноземельным металлом, например кальцием. Это приводит к проблемам с закупоркой выпускных труб твердым кальцием, осаждающимся из жидкого натрия при его охлаждении, к необходимости фильтрации натрия для удаления дополнительных количеств примесей кальция и к необходимости повторной обработки смеси натрия и кальция вместе с солевые и оксидные примеси удаляются фильтрами с целью повышения эффективности процесса. Потребление энергии в этих известных способах является высоким из-за большого зазора, который поддерживается между электродами для поддержания высокой рабочей температуры и/или для сведения к минимуму рекомбинации анодных и катодных продуктов в ячейке. Такая рекомбинация имеет тенденцию к повреждению стальной сетчатой диафрагмы, расположенной между анодами и катодом, и это повреждение дополнительно усугубляется образованием твердых отложений кальция, перекрывающих зазор катод-диафрагма.
Настоящее изобретение предлагает способ, который позволяет избежать всех этих трудностей и позволяет электролитически получать щелочной металл, наиболее предпочтительно натрий, калий или литий, в очень чистом состоянии без дополнительной обработки и с относительно низким потреблением энергии.
В соответствии с настоящим изобретением мы предлагаем способ производства щелочного металла, который включает пропускание тока электролиза от анода, находящегося в контакте с расплавленной галогенидной солью металла, содержащей ионы щелочного металла, а не другие одновалентные катионы, последовательно через расплавленной соли и через диафрагму, представляющую собой поликристаллический керамический материал, проницаемый только для одновалентных катионов, к катоду в виде жидкого щелочного металла и удаляющему щелочной металл, выделяющийся на катодной стороне диафрагмы.
Подходящие поликристаллические керамические материалы для использования в качестве диафрагмы представляют собой неорганические материалы, имеющие структуру кристаллической решетки, которая содержит большое количество дефектов и содержит ионы щелочного металла, который желательно получить электролизом, или другие одновалентные катионы, способные замещаться ионами желаемого металла. Однако количество дефектов не должно быть настолько большим, чтобы материал стал электронным проводником. Одним из очень подходящих материалов является бета-оксид алюминия. Он имеет приблизительный состав Na 2 0,11A1 2 0 3 и ионы натрия в кристаллической решетке могут обмениваться с введенными извне ионами щелочных металлов, например ионами натрия, калия или лития. Другими подходящими материалами являются определенные алюминаты, алюмосиликаты и титанаты.
Одним из очень подходящих материалов является бета-оксид алюминия. Он имеет приблизительный состав Na 2 0,11A1 2 0 3 и ионы натрия в кристаллической решетке могут обмениваться с введенными извне ионами щелочных металлов, например ионами натрия, калия или лития. Другими подходящими материалами являются определенные алюминаты, алюмосиликаты и титанаты.
Изобретение также включает электролизер для производства щелочного металла, который содержит анодную камеру и катодную камеру, разделенные разделительной стенкой, по крайней мере, часть площади разделительной стенки состоит из поликристаллического керамического материала проницаема только для одновалентных катионов, и любая часть оставшейся стенки является электрическим изолятором, при этом анодная камера приспособлена для размещения тела из расплавленного металлогалогенидного электролита, находящегося в контакте со стенкой из поликристаллического керамического материала, и содержит анод для контакта с расплавленным электролитом, катод из жидкого щелочного металла, контактирующий со стенкой из поликристаллического керамического материала внутри катодной камеры, впускное средство для подачи электролита в анодную камеру, выпускное средство для удаления анодного продукта из анодной камеры и выпускное средство для удаления жидкого щелочного металла из катодной камеры .
Электролитическая ячейка согласно изобретению может быть снабжена керамической диафрагмой в виде плоского листа или, альтернативно, в виде замкнутой поверхности, такой как цилиндрическая стенка с одним или несколькими анодами внутри или снаружи цилиндра и жидкостью. катод из щелочного металла на противоположной стороне цилиндрической стенки. Когда используются плоские листовые диафрагмы, механическая прочность может быть увеличена за счет включения нескольких небольших листов в опорный каркас для формирования структуры оконной рамы, чтобы создать большую площадь диафрагмы.
В элементах предшествующего уровня техники для производства щелочных металлов из их галоидных солей используемые составы электролитов были строго ограничены из-за необходимости избежать, насколько это возможно, совместного осаждения на катоде металлов из солей-разбавителей и необходимости ограничить максимальное температуры в электролите, чтобы избежать разрушения получаемого щелочного металла. В устройстве по настоящему изобретению таких ограничений нет. Поскольку диафрагма проницаема только для одновалентных катионов, щелочной металл выделяется в высокой степени чистоты, например выше 9.9,9%, так что можно использовать более широкий диапазон солей-разбавителей, содержащих катионы, недопустимые в элементах предшествующего уровня техники, и исключить опасность рекомбинации с галогеном, высвобождающимся на стороне анода. Кроме того, при желании можно использовать компоненты электролита более низкой чистоты, чем раньше, поскольку примеси задерживаются диафрагмой. Поддержание состава смешанного электролита также проще, поскольку любые используемые разбавляющие соли не теряются во время электролиза.
Поскольку диафрагма проницаема только для одновалентных катионов, щелочной металл выделяется в высокой степени чистоты, например выше 9.9,9%, так что можно использовать более широкий диапазон солей-разбавителей, содержащих катионы, недопустимые в элементах предшествующего уровня техники, и исключить опасность рекомбинации с галогеном, высвобождающимся на стороне анода. Кроме того, при желании можно использовать компоненты электролита более низкой чистоты, чем раньше, поскольку примеси задерживаются диафрагмой. Поддержание состава смешанного электролита также проще, поскольку любые используемые разбавляющие соли не теряются во время электролиза.
При желании элемент можно эксплуатировать при высокой температуре, используя только галогенид нужного щелочного металла, например хлорид натрия, в качестве расплавленного электролита. Однако в целом предпочтительнее работать при более низких температурах, используя легкоплавкие смеси галоидных солей. Для производства натрия, например, очень легкоплавкие смеси хлорида натрия и хлорида алюминия (содержащие до 60 моль 3 ).
С легкоплавкими электролитами требуемую рабочую температуру можно поддерживать, окружая элемент термовоздушной рубашкой, если резистивно-нагревающее действие тока электролиза недостаточно. Для запуска элемента или для поддержания температуры с помощью электролитов с более высокой температурой плавления могут использоваться электрические нагреватели, погруженные в соль, или даже погружные нагреватели дымовых газов.
В действующих электролизерах согласно изобретению галоген, например хлор, обычно удаляют из электролизера в виде анодного продукта. Однако, поскольку эти электролизеры могут работать при относительно низких температурах без какой-либо опасности контакта щелочного металла с анодным продуктом, их можно легко настроить для проведения электроорганических реакций, например реакции галогенирования углеводородов или дальнейшего галогенирования углеводородов. частично галогенированный углеводород в анодных отсеках, если это желательно. Так, например, этилен можно подавать в анодное отделение электролизера, производящего хлор, так что хлорированные этилены образуются в результате реакции между этиленом и выделяющимся хлором и удаляются как анодный продукт.
РИС. 1 и фиг. 2 чертежей схематично и без масштаба показаны виды в разрезе двух вариантов осуществления устройства согласно изобретению. ИНЖИР. 3 показан вид сверху керамической диафрагмы, подходящей для использования в ячейке по фиг. 1. Чертежи будут обсуждаться со ссылкой на производство натрия и хлора, хотя, как указано выше, аппарат может быть адаптирован для производства других щелочных металлов и других галогенов или галогенированных органических соединений.
На фиг. 1 прямоугольное анодное отделение 1 ограничено боковыми стенками 2 и крышкой 3 электролизера, например, из никеля или футерованной стали, вместе с нижней стенкой 4 образующих диафрагму между анодным отделением и катодным отделением 5. Диафрагма предпочтительно выполнена в виде расположение оконной рамы, как показано на фиг. 3, в котором листы из бета-оксида алюминия 6 удерживаются в стальных рамах, обозначенных позицией 7. Верхняя и нижняя рама (показана только в плане на фиг. 3) разделены листами из бета-оксида алюминия, чтобы сохранить электрическую изоляцию между ними. противоположные стороны диафрагмы. Боковые стенки 2 и соответствующие стенки катодного отсека скреплены между собой изолированными болтами через изолирующие фланцы 8 для обеспечения электрической изоляции между анодным и катодным отсеками, крайние стальные рамы 7 диафрагмы зажаты между фланцами, а стыки при необходимости герметизированы. с шамотом. Графитовые аноды 9подвешенные на токоподводах 10, окружены хлороулавливающими куполами из никеля 11, снабженными отводящими трубами 12 для отвода хлора. 13 – вход для подачи электролита в анодное отделение. 14 и 15 — стальные кожухи, окружающие боковые стенки и основание камеры, пространство между которыми заполнено теплоизоляционной кирпичной кладкой 16. 17 — пустая рубашка, снабженная входными и выходными патрубками 18 и 19, например, для циркуляции теплоносителя. горячий воздух через куртку. Катодное отделение 5 заполнено жидким натрием, который выводится из электролизера при электролизе по трубе 20, проходящей через электроизоляционные средства 21 в стенках 14 и 15, и по трубе 22, которая обычно соединяется с ресивером для жидкости.
противоположные стороны диафрагмы. Боковые стенки 2 и соответствующие стенки катодного отсека скреплены между собой изолированными болтами через изолирующие фланцы 8 для обеспечения электрической изоляции между анодным и катодным отсеками, крайние стальные рамы 7 диафрагмы зажаты между фланцами, а стыки при необходимости герметизированы. с шамотом. Графитовые аноды 9подвешенные на токоподводах 10, окружены хлороулавливающими куполами из никеля 11, снабженными отводящими трубами 12 для отвода хлора. 13 – вход для подачи электролита в анодное отделение. 14 и 15 — стальные кожухи, окружающие боковые стенки и основание камеры, пространство между которыми заполнено теплоизоляционной кирпичной кладкой 16. 17 — пустая рубашка, снабженная входными и выходными патрубками 18 и 19, например, для циркуляции теплоносителя. горячий воздух через куртку. Катодное отделение 5 заполнено жидким натрием, который выводится из электролизера при электролизе по трубе 20, проходящей через электроизоляционные средства 21 в стенках 14 и 15, и по трубе 22, которая обычно соединяется с ресивером для жидкости. натрия (не показано). Стояк 23 и заглушки 24, 25, 26 предусмотрены для удобства заполнения катодного отсека натрием перед пуском. Отрицательный токопровод показан позицией 27, проходящий через электроизоляционное средство 28 во внешнем корпусе и контактирующий с корпусом из металлического натрия в катодном отделении. Однако, поскольку натрий является хорошим электрическим проводником, отрицательное соединение при желании может быть выполнено в качестве альтернативы заполненным натрием трубам 20 или 23. Такая конструкция элемента имеет дополнительное преимущество по сравнению с натриевыми элементами предшествующего уровня техники, заключающееся в том, что аноды могут быть сделаны регулируемыми в вертикальном направлении, чтобы их можно было перемещать к диафрагме для компенсации износа анода, тем самым поддерживая низкое электрическое сопротивление на пути тока через расплавленный электролит.
натрия (не показано). Стояк 23 и заглушки 24, 25, 26 предусмотрены для удобства заполнения катодного отсека натрием перед пуском. Отрицательный токопровод показан позицией 27, проходящий через электроизоляционное средство 28 во внешнем корпусе и контактирующий с корпусом из металлического натрия в катодном отделении. Однако, поскольку натрий является хорошим электрическим проводником, отрицательное соединение при желании может быть выполнено в качестве альтернативы заполненным натрием трубам 20 или 23. Такая конструкция элемента имеет дополнительное преимущество по сравнению с натриевыми элементами предшествующего уровня техники, заключающееся в том, что аноды могут быть сделаны регулируемыми в вертикальном направлении, чтобы их можно было перемещать к диафрагме для компенсации износа анода, тем самым поддерживая низкое электрическое сопротивление на пути тока через расплавленный электролит.
Ячейка, показанная на фиг. 2 выполнен цилиндрическим в плане, чтобы использовать повышенную прочность керамической диафрагмы цилиндрической формы. В этом случае цилиндрическая диафрагма из бета-оксида алюминия 29 соединена со стояком 30 из чугуна или никеля, который действует как соединитель отрицательного тока, и натрий заполняет этот стояк, образуя хороший электрический проводник, ведущий к жидкий натриевый катод в собственно катодном отсеке. Основание анодного отсека 1 электрически изолировано от катодного отсека изолирующим полом 31. Аноды 32 (показаны только два) представляют собой графитовые стержни, расположенные по кольцу вокруг керамической диафрагмы 29.. 33 – выход для хлора, образующегося на анодах. Анодный и катодный выводы электрически изолированы друг от друга на крышке ячейки либо путем ее изготовления из бетона или асбестовой плиты, либо путем пропускания одного или нескольких соединений через изолирующие средства в крышке. Оболочки вокруг ячейки такие же, как на фиг. 1, кроме цилиндрической формы.
В этом случае цилиндрическая диафрагма из бета-оксида алюминия 29 соединена со стояком 30 из чугуна или никеля, который действует как соединитель отрицательного тока, и натрий заполняет этот стояк, образуя хороший электрический проводник, ведущий к жидкий натриевый катод в собственно катодном отсеке. Основание анодного отсека 1 электрически изолировано от катодного отсека изолирующим полом 31. Аноды 32 (показаны только два) представляют собой графитовые стержни, расположенные по кольцу вокруг керамической диафрагмы 29.. 33 – выход для хлора, образующегося на анодах. Анодный и катодный выводы электрически изолированы друг от друга на крышке ячейки либо путем ее изготовления из бетона или асбестовой плиты, либо путем пропускания одного или нескольких соединений через изолирующие средства в крышке. Оболочки вокруг ячейки такие же, как на фиг. 1, кроме цилиндрической формы.
Способ изобретения дополнительно иллюстрируется следующим примером.
ПРИМЕР
Электролитическая ячейка лабораторного масштаба была сконструирована в соответствии со схематическим изображением, показанным на прилагаемом чертеже, фиг. 24. Внешний стеклянный контейнер 34 использовали для формирования внутри него анодной камеры 35. Керамическая трубка 36 была приклеена к краю тигля 37 из бета-глинозема, чтобы образовать катодную камеру 38 внутри анодной камеры. Сверху анодная камера закрывалась стеклянной крышкой 39.имеющую вертикальную центральную колонну 40, расположенную вокруг керамической трубки 36 и закрытую на верхнем конце газонепроницаемым уплотнением 41. Взвешенное количество натрия помещали в тигель 37, как показано позицией 42, для формирования катода ячейки, а стальную трубку 43 помещали в тигель 37. проходит через уплотнение 41 так, что его нижний конец погружается в натрий и действует как токоподвод от натриевого катода. Некоторое количество электролита, состоящего из эквимолярных пропорций хлорида натрия и хлорида алюминия, помещали в анодную камеру, как указано позицией 44, и анод 45 пропускали через уплотнительное средство 46 в стеклянной крышке так, чтобы его нижний конец был погружен в электролит. 47 — термопара для измерения температуры электролита.
24. Внешний стеклянный контейнер 34 использовали для формирования внутри него анодной камеры 35. Керамическая трубка 36 была приклеена к краю тигля 37 из бета-глинозема, чтобы образовать катодную камеру 38 внутри анодной камеры. Сверху анодная камера закрывалась стеклянной крышкой 39.имеющую вертикальную центральную колонну 40, расположенную вокруг керамической трубки 36 и закрытую на верхнем конце газонепроницаемым уплотнением 41. Взвешенное количество натрия помещали в тигель 37, как показано позицией 42, для формирования катода ячейки, а стальную трубку 43 помещали в тигель 37. проходит через уплотнение 41 так, что его нижний конец погружается в натрий и действует как токоподвод от натриевого катода. Некоторое количество электролита, состоящего из эквимолярных пропорций хлорида натрия и хлорида алюминия, помещали в анодную камеру, как указано позицией 44, и анод 45 пропускали через уплотнительное средство 46 в стеклянной крышке так, чтобы его нижний конец был погружен в электролит. 47 — термопара для измерения температуры электролита. Кювету помещали в печь с температурой 295°С ±5°С, и поток сухого азота непрерывно пропускали по токоподводу трубчатого катода, как показано позицией 48, чтобы вытекать из трубки через отверстия 49, предусмотренные вблизи поверхности натриевого катода 42, в анодное отделение, как показано стрелками, и, наконец, выход из ячейки через выпускную трубу 50. Когда температура ячейки достигла равновесия, как показано термопарой, начался электролиз путем подключения анода и катода к источнику постоянного тока. Хлор, выделяющийся на аноде, выводился из ячейки вместе с потоком азота через выпускную трубу 50. Ток непрерывно контролировался на протяжении всего цикла, затем повторно взвешивали натриевый катод для расчета выхода по току и анализировали образец. Средний КПД по току составил 92%, а в натрии оказалось не больше алюминия, чем в начале электролиза.
Кювету помещали в печь с температурой 295°С ±5°С, и поток сухого азота непрерывно пропускали по токоподводу трубчатого катода, как показано позицией 48, чтобы вытекать из трубки через отверстия 49, предусмотренные вблизи поверхности натриевого катода 42, в анодное отделение, как показано стрелками, и, наконец, выход из ячейки через выпускную трубу 50. Когда температура ячейки достигла равновесия, как показано термопарой, начался электролиз путем подключения анода и катода к источнику постоянного тока. Хлор, выделяющийся на аноде, выводился из ячейки вместе с потоком азота через выпускную трубу 50. Ток непрерывно контролировался на протяжении всего цикла, затем повторно взвешивали натриевый катод для расчета выхода по току и анализировали образец. Средний КПД по току составил 92%, а в натрии оказалось не больше алюминия, чем в начале электролиза.
Президентский конкурс «Зеленая химия»: Премия малого бизнеса 2008 г.
Новые стабилизированные щелочные металлы для более безопасных и устойчивых синтезов
Инновации и преимущества: Щелочные металлы, такие как натрий и литий, являются мощными инструментами в синтетической химии, поскольку они обладают высокой реакционной способностью. Однако их реакционная способность также делает их как легковоспламеняющимися, так и взрывоопасными, если с ними не обращаться очень осторожно. SiGNa Chemistry разработала способ стабилизации этих металлов путем инкапсуляции их в пористые, похожие на песок порошки, сохраняя при этом их полезность в синтетических реакциях. Стабилизированные металлы гораздо безопаснее хранить, транспортировать и обрабатывать. Они также могут быть полезны для удаления серы из топлива, производства водорода и переработки различных опасных отходов.
Однако их реакционная способность также делает их как легковоспламеняющимися, так и взрывоопасными, если с ними не обращаться очень осторожно. SiGNa Chemistry разработала способ стабилизации этих металлов путем инкапсуляции их в пористые, похожие на песок порошки, сохраняя при этом их полезность в синтетических реакциях. Стабилизированные металлы гораздо безопаснее хранить, транспортировать и обрабатывать. Они также могут быть полезны для удаления серы из топлива, производства водорода и переработки различных опасных отходов.
Краткий обзор технологии : Щелочные металлы имеют сильную склонность отдавать электроны, что делает эти металлы особенно реактивными. Эта реактивность имеет огромный потенциал для ускорения химических реакций в науке и промышленности, возможно, включая новые пути к чистой энергии и восстановлению окружающей среды. К сожалению, та же реактивность также делает их крайне нестабильными и опасными при хранении и обращении. Кроме того, повышенный риск прерывания цепочки поставок и затраты на обработку этих металлов сделали их непривлекательными для химической промышленности. Отрасли промышленности, от фармацевтической до нефтяной, разработали альтернативные пути синтеза, чтобы избежать использования щелочных металлов, но эти альтернативы требуют дополнительных реагентов и стадий реакции, что приводит к неэффективным и расточительным производственным процессам.
Отрасли промышленности, от фармацевтической до нефтяной, разработали альтернативные пути синтеза, чтобы избежать использования щелочных металлов, но эти альтернативы требуют дополнительных реагентов и стадий реакции, что приводит к неэффективным и расточительным производственным процессам.
SiGNa Chemistry решает эти проблемы с помощью своей технологии наномасштабной абсорбции реакционноспособных щелочных металлов в пористых оксидах металлов. Эти новые материалы представляют собой порошки, похожие на песок. Материалы SiGNa устраняют опасность и связанные с этим затраты, связанные с прямым использованием реактивных металлов, но сохраняют полезность щелочных металлов. В отличие от своих опасных предшественников, материалы SiGNa реагируют управляемо с предсказуемой активацией, которую можно адаптировать к различным отраслевым потребностям. Обеспечивая практические химические сокращения и непрерывные технологические процессы, инкапсулированные щелочные металлы повышают эффективность хранения, цепочки поставок, рабочей силы и утилизации отходов.
Для фармацевтической, нефтехимической и общей синтетической промышленности прорыв SiGNa устраняет дополнительные шаги, которые обычно предпринимаются в этих отраслях, чтобы избежать использования щелочных металлов, и обеспечивает желаемую реакцию на 80–90 процентов меньше времени. В частности, для фармацевтической промышленности эти материалы могут ускорить разработку и производство лекарств, одновременно повышая безопасность работников.
Помимо экологизации традиционных химических синтезов, материалы SiGNa позволяют развивать совершенно новые области химии. В области чистой энергии стабилизированные щелочные металлы компании безопасно производят рекордные уровни чистого газообразного водорода для зарождающегося сектора топливных элементов. С уровнями выхода, которые уже превышают цели Министерства энергетики на 2015 год, материалы SiGNa представляют собой наиболее эффективное средство для переработки воды в водород. Материалы SiGNa также позволяют безопасно применять щелочные металлы для очистки окружающей среды от нефтяного загрязнения и разрушения ПХБ и ХФУ.

 Для получения щелочного металла можно
воспользоваться также другой реакцией, беря вместо хлорида соль хромовой
кислоты, а вместо кальция цирконий. Способ этот применим для получения всех
щелочных металлов, за исключением лития, который вступает в реакцию со стеклом
или с кварцем; литий лучше всего вытеснять цирконием из соли хромовой кислоты в
железной аппаратуре.
Для получения щелочного металла можно
воспользоваться также другой реакцией, беря вместо хлорида соль хромовой
кислоты, а вместо кальция цирконий. Способ этот применим для получения всех
щелочных металлов, за исключением лития, который вступает в реакцию со стеклом
или с кварцем; литий лучше всего вытеснять цирконием из соли хромовой кислоты в
железной аппаратуре.
 3. Как видно из рисунка, в стенке боковой стеклянной трубки имеется вмятина,
задерживающая боёк и не позволяющая ему разбить ампулу до того, как вся
конструкция напаяна на вакуумный пост. Во время напайки на пост вмятина
выдувается, что освобождает бойку путь. Управляя бойком с помощью внешнего
электромагнита, можно отбить кончик ампулы. Чтобы облегчить эту операцию, можно
предварительно поцарапать кончик ампулы напильником.
3. Как видно из рисунка, в стенке боковой стеклянной трубки имеется вмятина,
задерживающая боёк и не позволяющая ему разбить ампулу до того, как вся
конструкция напаяна на вакуумный пост. Во время напайки на пост вмятина
выдувается, что освобождает бойку путь. Управляя бойком с помощью внешнего
электромагнита, можно отбить кончик ампулы. Чтобы облегчить эту операцию, можно
предварительно поцарапать кончик ампулы напильником. Ни в коем случае не следует производить промывку щелочных
металлов в четырёххлористом углероде или в хлороформе, так как при этом
образуются сильно взрывчатые соединения. Затем металл расплавляется на дне 8-мм
пробирки и засасывается в стеклянный капилляр диаметром 1 мм, снабжённый для
этой цели резиновой трубочкой.
Ни в коем случае не следует производить промывку щелочных
металлов в четырёххлористом углероде или в хлороформе, так как при этом
образуются сильно взрывчатые соединения. Затем металл расплавляется на дне 8-мм
пробирки и засасывается в стеклянный капилляр диаметром 1 мм, снабжённый для
этой цели резиновой трубочкой. Здесь, после
того как система откачана, металл расплавляют, подогревая камеру коптящим
пламенем.
Здесь, после
того как система откачана, металл расплавляют, подогревая камеру коптящим
пламенем. Желательно при работе со щелочными металлами пользоваться
защитными очками. Натрий можно получить путём электролиза через стенки колбы
электрической лампы, изготовленной из натриевого стекла. Для этой цели лучше
всего воспользоваться 32-вольтовой лампой, обладающей более массивной
вольфрамовой нитью, чем 110-вольтовая лампа. Лампа, откачанная предварительно
через специально впаянную боковую трубку, погружается в ванну с расплавленным
азотнокислым и азотистокислым натрием и включается в электрическую цепь, как
показано на рис. 6.
Желательно при работе со щелочными металлами пользоваться
защитными очками. Натрий можно получить путём электролиза через стенки колбы
электрической лампы, изготовленной из натриевого стекла. Для этой цели лучше
всего воспользоваться 32-вольтовой лампой, обладающей более массивной
вольфрамовой нитью, чем 110-вольтовая лампа. Лампа, откачанная предварительно
через специально впаянную боковую трубку, погружается в ванну с расплавленным
азотнокислым и азотистокислым натрием и включается в электрическую цепь, как
показано на рис. 6. Описанный процесс электролиза
подчиняется закону Фарадея. При фотографировании спектра разряда в парах натрия
подтвердилась высокая степень чистоты металла, полученного путём электролиза.
Загрязнения по оценке Берта не превышают 0,000002. Для металла, полученного
электролизом, характерно полное отсутствие водорода и углеводородов. Сила тока
при электролизе меняется от нескольких миллиампер, когда ток имеет исключительно
электронный характер, до нескольких сот миллиампер, когда он становится ионным.
Чтобы получить разряд в парах натрия, достаточно прекратить воздушное дутьё,
охлаждающее колбу лампы для конденсации на ней металла. Берт утверждает, что
спектр разряда в натрии не является самообращённым; лампа, содержащая натрий,
будучи подогрета, флуоресцирует, если на неб фокусировать свет натриевого
разряда, происходящего в другой лампе (см. рис. 7).
Описанный процесс электролиза
подчиняется закону Фарадея. При фотографировании спектра разряда в парах натрия
подтвердилась высокая степень чистоты металла, полученного путём электролиза.
Загрязнения по оценке Берта не превышают 0,000002. Для металла, полученного
электролизом, характерно полное отсутствие водорода и углеводородов. Сила тока
при электролизе меняется от нескольких миллиампер, когда ток имеет исключительно
электронный характер, до нескольких сот миллиампер, когда он становится ионным.
Чтобы получить разряд в парах натрия, достаточно прекратить воздушное дутьё,
охлаждающее колбу лампы для конденсации на ней металла. Берт утверждает, что
спектр разряда в натрии не является самообращённым; лампа, содержащая натрий,
будучи подогрета, флуоресцирует, если на неб фокусировать свет натриевого
разряда, происходящего в другой лампе (см. рис. 7). 8. Калий можно получать путём электролиза сквозь калиевое
стекло, свободное от натрия и свинца; ванна наполняется в этом случае
расплавленным азотнокислым и азотистокислым калием. Калий и натрий можно
растворять в нашатырном спирте и затем осаждать их в нужных местах, выпаривая
растворитель; для лития растворителем служит этиламин. Все щелочные металлы при
повышенных температурах реагируют со стеклом, особенно со свинцовым, с которым
они по этой причине вообще не должны соприкасаться. Покрывая трубки из стекла
пайрекс бурой или борной кислотой, можно повысить их стойкость по отношению к
натрию. Чтобы покрыть трубку, её наполняют горячим насыщенным раствором буры,
осаждающимся при охлаждении раствора в виде кристаллов на внутренних стенках
трубки. Когда стекло покроется тонким слоем кристаллов, раствор выливают и
трубку осторожна просушивают, после чего откачивают её, нагревая пламенем
горелки для устранения воды. Сначала нагревание ведут осторожно, доводя в конце
1 концов трубку до максимальной температуры, выдерживаемой стеклом.
8. Калий можно получать путём электролиза сквозь калиевое
стекло, свободное от натрия и свинца; ванна наполняется в этом случае
расплавленным азотнокислым и азотистокислым калием. Калий и натрий можно
растворять в нашатырном спирте и затем осаждать их в нужных местах, выпаривая
растворитель; для лития растворителем служит этиламин. Все щелочные металлы при
повышенных температурах реагируют со стеклом, особенно со свинцовым, с которым
они по этой причине вообще не должны соприкасаться. Покрывая трубки из стекла
пайрекс бурой или борной кислотой, можно повысить их стойкость по отношению к
натрию. Чтобы покрыть трубку, её наполняют горячим насыщенным раствором буры,
осаждающимся при охлаждении раствора в виде кристаллов на внутренних стенках
трубки. Когда стекло покроется тонким слоем кристаллов, раствор выливают и
трубку осторожна просушивают, после чего откачивают её, нагревая пламенем
горелки для устранения воды. Сначала нагревание ведут осторожно, доводя в конце
1 концов трубку до максимальной температуры, выдерживаемой стеклом. Образуется
гладкая внутренняя поверхность, стойкая по отношению к натрию.
Образуется
гладкая внутренняя поверхность, стойкая по отношению к натрию.