Общие способы получения металлов | Подготовка к ЦТ и ЕГЭ по химии
3 Фев
Posted on Author admin 0
Чтобы поделиться, нажимайте
Общие способы получения металлов.
Природные соединения металлов:
| хлориды | сильвинит КСl ∙ NaCl, каменная соль NaCl; |
| сульфиды | серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS; |
| карбонаты | мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 ∙ MgCO3; |
| сульфаты | глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О; |
| оксиды | магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н |
| нитраты | чилийская селитра NaNO3; |
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
Способы получения металлов из руд.
- 1. Электрометаллургический способ — это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
NaCl (расплав) ↔ Na+ + Cl
—катод Na+ + e → Na0 ¦ 2
анод 2Cl— — 2e → Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.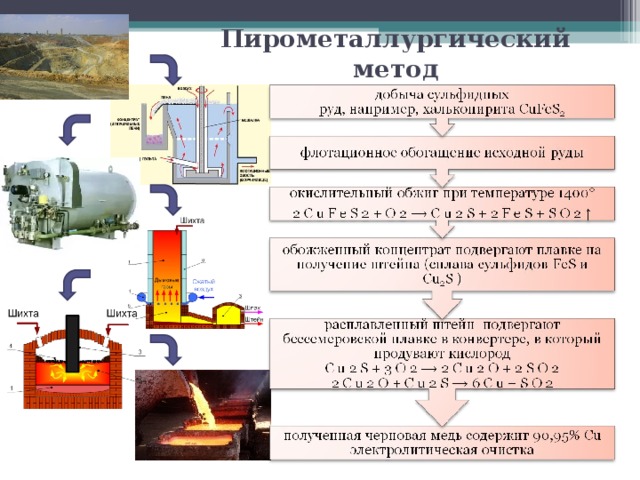 ) – (э.ток)→ 2Na + Cl2
) – (э.ток)→ 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
Al2O3 (расплав) → Al3+ + AlO33–
катод Al3+ +3e → Al 0
анод 4AlO33– –12 e → 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э.ток)→ 4Al + 3O2 .
- Пирометаллургический способ — это восстановление металлов из их руд при высоких температурах с помощью восстановителей: неметаллических: кокс, оксид углерода (II), водород; металлических: алюминий, магний, кальций.

| Алюмотермия: Fe+32O3 +2Al = 2Fe0 + Al2O3 | Получают железо, хром. |
| Восстановление оксидов металлов водородом (водородотермия): Cu +2O + H2–(t)→ Cu0 + H2O | Получают малоактивные металлы – медь, вольфрам. |
| Получение чугуна: В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды: | 3Fe2O3 + CO –(t)→ 2Fe3O4 + CO2 , Fe3O4 + 4CO –(t)→ 3FeО + 4CO2 FeO + CO –(t)→ Fe+ CO2
|
| Восстановление углём (коксом): ZnO + C –(t)→ Zn + CO | Получают цинк, никель. |
- Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
б) из карбоната – разложением: СаСО3–(t)→ СаО + СО2
общие способы получения металлов / Справочник :: Бингоскул
Металлические элементы встречаются в земной коре, в почве и воде в виде простых и сложных веществ. Получение металлов в промышленности основано на химическом составе сырья и свойствах компонентов.
Получение металлов в промышленности основано на химическом составе сырья и свойствах компонентов.
Понятие о металлургии
Металлургия — получение металлов из руд — один из древнейших видов человеческой деятельности. Еще во втором тысячелетии до н. э. в Египте умели выплавлять железо из железной руды. Так называемый железный век пришел на смену бронзовому, тот, в свою очередь, наступил после каменного.
Получают металлы из рудных полезных ископаемых. Например, халькопирит или медный колчедан — сырье для производства железа, меди и серы (Рис. 1). Химическая формула минерала CuFeS2. Металлы в составе других руд находятся в виде оксидов или солей неорганических кислот, химически связанных катионов.
Рис. 1. ХалькопиритСуть металлургического процесса заключается в восстановлении положительных ионов до свободных атомов металла. Используют в качестве источников электронов углерод и его соединения, водород, металлы. В процессе восстановления катионы получают недостающие электроны. Происходит восстановление электронных оболочек металла. Схема процесса:
В процессе восстановления катионы получают недостающие электроны. Происходит восстановление электронных оболочек металла. Схема процесса:
Ме+n + ne— → Me, где
- Ме+n — металл в окисленной форме;
- +n — степень окисления;
- ne— — количество присоединяемых электронов;
- Ме — металл в восстановленной форме.
Способы получения металлов
В зависимости от того, кокой восстановитель используют в металлургическом процессе различают: пиро — , гидро, электро — и биометаллургию.
Наиболее распространенные способы получения металлов: пирометаллургический и электрометаллургический. Большинство реакций восстановления протекают при высоких температурах (Рис. 2). Так как металлическая связь обладает повышенной прочностью, то выделение металлов в чистом виде из природных соединений проводят при высоких температурах.
Рис. 2. Металлургическое производствоПирометаллургический способ
Пирометаллургия — получение металлов из руд при высоких температурах при участии восстановителей. В переводе с греческого «пирос» означает «огненный». Используют в качестве восстановителей кокс, диоксид углерода, водород. Применяют активные металлы для получения менее активных.
В переводе с греческого «пирос» означает «огненный». Используют в качестве восстановителей кокс, диоксид углерода, водород. Применяют активные металлы для получения менее активных.
Пирометаллургия подразделяется на
- карботермия,
- водородотермия,
- металлотермию.
Карботермия: перевод сульфида металла путем обжига в оксид и дальнейшим восстановлением углем до чистого состояния.
2ZnS + 3O2 = 2ZnO + 2 SO2
ZnO + C = CO + Zn
Руды, состоящие из оксидов и сульфидов железа, подвергают карботермии. Проводят восстановление коксом или диоксидом углерода (угарным газом). Получают сплавы железа — чугун и сталь. Первый содержит больше углерода, а также оксидов серы, фосфора и кремния. Углерод снижает твердость и другие характерные для металлов качества.
Химические реакции, лежащие в основе выплавки чугуна:
- C + O2 = CO2↑,
- CO2 + C ↔ 2CO↑,
- 3Fe2O3 + CO = 2Fe3O4+ CO2↑,
- Fe3O4 + CO = 3FeO + CO2↑,
- FeO + CO = Fe + CO2↑.

Сталь выплавляют в специальных печах — электрических, конвертерных, мартеновских (Рис. 3). При продувании обогащенного кислородом воздуха выгорает избыточный углерод, его содержание уменьшается до 2% и ниже. Этот способ является более экономически применим, т.к. при помощи него получают сталь и чугун, которые широко используются в современной промышленности.
Рис. 3. ПирометаллургияВосстановлением углем можно получить железо, медь, цинк, кадмий, германий, олово, свинец и другие металлы. В качестве сырья используют медную (Cu2O), оловянную (SnO2), марганцевую (MnO2) руды.
| Схема получение железа и хрома | (Cr2Fe)O4 + 4C(кокс) = Fe + 2Cr + 4CO↑ |
| Реакция, лежащая в основе выплавки меди | Cu2O + C (кокс) = 2Cu + CO↑ |
| Схема производство олова | SnO2 + 2C (кокс) = Sn + 2CO↑ |
| Процесс выплавки марганца | MnO2 + C(кокс) = Mn + CO2↑ |
| Схема получения свинца | 2PbO + C → Pb + CO↑ |
Металлы можно извлечь из сульфидных руд. Сначала проводят обжиг, затем — восстановление полученного оксида углем. Схемы обжига цинковой обманки и получение цинка:
Сначала проводят обжиг, затем — восстановление полученного оксида углем. Схемы обжига цинковой обманки и получение цинка:
- 2ZnS +3O2 = 2ZnO + 2SO2↑;
- ZnO + C = Zn + CO↑.
Карбонаты тоже прокаливают с углем для получения оксидов и последующего восстановления углем. Схемы обжига сидерита и восстановления оксида железа:
- FeCO3 = FeO + CO2↑;
- FeO + C = Fe + CO↑.
Водородотермия — производство металлов восстановлением водородом
Достоинством этого металлургического метода является получение очень чистых металлов. Восстановление меди из оксида CuO — пример восстановительных свойств водорода из школьного курса неорганической химии. Схема протекания реакции (Рис 4):
Рис. 4. Восстановление меди водородомВодородом восстанавливают из оксидов тугоплавкие металлы молибден и вольфрам.
Металлотермия
Проводят восстановление одного металла другим, более химически активным. Этот способ применяют для получения металлов из оксидов и галогенидов.
Этот способ применяют для получения металлов из оксидов и галогенидов.
В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием.
| Схема получение марганца | 3MnO2 + 4Al = 3Mn + 2Al2O3 |
| Процесс выплавки хрома | Cr2O3 + 2Al → 2Cr + Al2O3 |
| Схема получение кальция | 4CaO+ 2Al= 2Ca+ (CaAl2)O4 |
Силикотермия — восстановление металлов кремнием. Процесс протекает согласно схеме: 2MgO + Si → 2Mg + SiO2.
Гидрометаллургический способ
Гидрометаллургия — способ получения благородных, цветных, редких металлов. Например, оксид меди сначала переводят в сульфат с помощью серной кислоты. Медь вытесняют из раствора железом. Протекает следующая реакция замещения: CuSO4 + Fe = Cu + FeSO4. Либо медь извлекают из раствора электролизом. Пропускают электрический ток, ионы Cu2+ осаждаются на катоде.
Протекает следующая реакция замещения: CuSO4 + Fe = Cu + FeSO4. Либо медь извлекают из раствора электролизом. Пропускают электрический ток, ионы Cu2+ осаждаются на катоде.
Преимущество гидрометаллургического способа — возможность получать металлы из бедных руд. Еще один плюс метода — снижение газообразных выбросов в атмосферу. Большое количество вредных газов и сажи поступает в воздух при обжиге руды и пирометаллургии.
Электролиз
Электролиз расплавов оксидов, солей и гидроксидов проводят для получения металлов, расположенных в ряду активности от лития до марганца. Электролиз водных растворов служит для производства менее активных металлов (Рис. 5).
Рис. 5. В цехе электролизаЭлектролиз расплавов
Катодные (восстановительные) процессы. На катоде происходит восстановление катионов металлов и водорода или молекул воды.
- Для растворов кислот: К(-) Н+ + 2 е— ⟶H20↑.

- Для растворов солей или щелочей: К(-) Mn+, H2O.
Характер восстановительного процесса зависит от значения стандартного потенциала металла:
Li, Cs, K, Ba, Ca, Na, Mg, Al | Катионы этих металлов не восстанавливаются, восстановлению подвергаются молекулы воды 2 H2O +2 е— ⟶H2 + ОН— |
Mn, Zn, Cr, Fe, Co, Ni, Pb | Катионы этих металлов восстанавливаются одновременно с молекулами воды, поэтому на катоде одновременно выделяются и H2 и металл |
Bi, Cu, Ag, Hg, Pt, Au | Катионы этих металлов легко и полностью восстанавливаются на катоде |
Схема электролиза расплава хлорида натрия: 2NaCl (эл. ток) → 2Na + Cl2↑.
ток) → 2Na + Cl2↑.
Схема электролиза сульфата марганца в растворе: 2MnSO4 + 2H2O (эл. ток) → 2Mn + O2↑+2H2SO4.
Способ термического разложения
Железо с диоксидом углерода при повышенных давлении и температуре образует пентакарбонил Fe(CO)5. Эту жидкую субстанцию перегоняют для очистки от примесей, затем нагревают. Карбонил разлагается с образованием порошка железа. Дальнейшее нагревание в вакууме или атмосфере водорода приводит к получению очень чистого железа. Схема процесса: Fe(CO)5 → Fe + 5CO↑.
Биометаллургия
Способ, основанный на биохимических процессах с участием микроорганизмов. Метод получил распространение на Западе, так как позволяет меньше загрязнять окружающую среду. Биометаллургия служит для получения меди, серебра, никеля, свинца, урана, рения и ряда других металлов.
Кроме собственно добычи металла из природных соединений (руд), металлургия включает в себя вторичную переработку сплавов и металлических изделий. Минеральные ресурсы Земли огромны, но конечны, а переплавка бывших в употреблении изделий бывает выгоднее и проще. Иногда обработку металлов тоже относят к металлургии, поэтому можно сказать, что это действительно одна из самых крупных областей промышленности.
Минеральные ресурсы Земли огромны, но конечны, а переплавка бывших в употреблении изделий бывает выгоднее и проще. Иногда обработку металлов тоже относят к металлургии, поэтому можно сказать, что это действительно одна из самых крупных областей промышленности.
Смотри также:
- Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
- Природные источники углеводородов, их переработка
- Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
- Применение изученных неорганических и органических веществ
металлургия | Определение и история
металлургия
Смотреть все СМИ
- Ключевые люди:
- Михаил Ломоносов
Георгиус Агрикола
Дэниел Коуэн Джеклинг
Сэр Алан Коттрелл
Арден Л.
 Бемент-младший
Бемент-младший
- Похожие темы:
- металлоконструкции переработка полезных ископаемых металлография технологическая металлургия физическая металлургия
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
металлургия Искусство и наука по извлечению металлов из руд и модификации металлов для использования. Металлургия обычно относится к коммерческим, а не к лабораторным методам. Это также касается химических, физических и атомных свойств и структуры металлов, а также принципов, по которым металлы объединяются в сплавы.
История металлургии
Современное использование металлов является кульминацией долгого пути развития, растянувшегося примерно на 6500 лет. Принято считать, что первыми известными металлами были золото, серебро и медь, находившиеся в самородном или металлическом состоянии, из которых самыми ранними, по всей вероятности, были самородки золота, найденные в песках и гравии в руслах рек. Такие самородные металлы стали известны и ценились за их декоративную и утилитарную ценность во второй половине каменного века.
Такие самородные металлы стали известны и ценились за их декоративную и утилитарную ценность во второй половине каменного века.
Самая ранняя разработка
Золото можно агломерировать в более крупные куски путем холодной ковки, но самородная медь не может, и важным шагом на пути к Веку металлов стало открытие того, что такие металлы, как медь, могут быть преобразованы в формы путем плавления и отливки в формы; среди самых ранних известных изделий этого типа — медные топоры, отлитые на Балканах в 4-м тысячелетии до н. э. Еще одним шагом стало открытие того, что металлы можно извлекать из металлосодержащих минералов. Они были собраны, и их можно было отличить по цвету, текстуре, весу, цвету пламени и запаху при нагревании. Заметно больший выход, полученный при нагревании самородной меди с сопутствующими оксидными минералами, мог привести к процессу плавки, поскольку эти оксиды легко восстанавливаются до металла в слое древесного угля при температурах выше 700 ° C (1300 ° F) в качестве восстановителя.
Во многих регионах в последующий период производились медно-мышьяковые сплавы, обладающие превосходными свойствами по сравнению с медью как в литом, так и в деформируемом виде. Сначала это могло быть случайным из-за сходства по цвету и цвету пламени между ярко-зеленым медно-карбонатным минералом малахитом и продуктами выветривания таких медно-мышьяковых сульфидных минералов, как энаргит, а позднее за этим мог последовать целенаправленный отбор соединений мышьяка на основе их чесночного запаха при нагревании.
Содержание мышьяка варьировалось от 1 до 7 процентов, олова до 3 процентов. Практически не содержащие мышьяка медные сплавы с более высоким содержанием олова — другими словами, настоящая бронза — по-видимому, появились между 3000 и 2500 годами до нашей эры, начиная с дельты Тигра и Евфрата. Открытие значения олова могло произойти благодаря использованию станнита, смешанного сульфида меди, железа и олова, хотя этот минерал не так широко доступен, как основной минерал олова, касситерит, который, должно быть, был конечным источником. металла. Касситерит поразительно плотный и встречается в виде гальки в аллювиальных отложениях вместе с арсенопиритом и золотом; это также происходит в определенной степени в госсанах оксида железа, упомянутых выше.
Открытие значения олова могло произойти благодаря использованию станнита, смешанного сульфида меди, железа и олова, хотя этот минерал не так широко доступен, как основной минерал олова, касситерит, который, должно быть, был конечным источником. металла. Касситерит поразительно плотный и встречается в виде гальки в аллювиальных отложениях вместе с арсенопиритом и золотом; это также происходит в определенной степени в госсанах оксида железа, упомянутых выше.
Хотя бронза могла развиваться независимо в разных местах, наиболее вероятно, что бронзовая культура распространилась через торговлю и миграцию народов с Ближнего Востока в Египет, Европу и, возможно, Китай. Во многих цивилизациях производство меди, мышьяковой меди и оловянной бронзы какое-то время продолжалось одновременно. Возможное исчезновение медно-мышьяковых сплавов трудно объяснить. Производство могло быть основано на полезных ископаемых, которые не были широко доступны и стали дефицитными, но относительная нехватка минералов олова не мешала значительной торговле этим металлом на значительных расстояниях.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
По мере разработки выветрелых медных руд в определенных местах, более твердые сульфидные руды под ними добывались и плавились. Используемые минералы, такие как халькопирит, сульфид меди и железа, нуждались в окислительном обжиге для удаления серы в виде диоксида серы и получения оксида меди. Это не только требовало больших металлургических навыков, но также окисляло тесно связанное железо, что в сочетании с использованием флюсов из оксида железа и более сильными восстановительными условиями, создаваемыми усовершенствованными плавильными печами, приводило к более высокому содержанию железа в бронзе.
Невозможно провести четкую границу между бронзовым веком и железным веком. Небольшие куски железа должны были производиться в медеплавильных печах, поскольку использовались флюсы оксида железа и железосодержащие сульфидные руды меди. Кроме того, более высокие температуры печи создали бы условия для более сильного восстановления (то есть более высокое содержание монооксида углерода в газах печи). Ранний кусок железа с дороги в провинции Дренте, Нидерланды, был датирован 1350 годом до нашей эры, датой, которую обычно принимают за средний бронзовый век для этой области. С другой стороны, в Анатолии железо использовалось уже в 2000 г. до н. э. Есть также случайные ссылки на железо и в более ранние периоды, но этот материал имел метеоритное происхождение.
Кроме того, более высокие температуры печи создали бы условия для более сильного восстановления (то есть более высокое содержание монооксида углерода в газах печи). Ранний кусок железа с дороги в провинции Дренте, Нидерланды, был датирован 1350 годом до нашей эры, датой, которую обычно принимают за средний бронзовый век для этой области. С другой стороны, в Анатолии железо использовалось уже в 2000 г. до н. э. Есть также случайные ссылки на железо и в более ранние периоды, но этот материал имел метеоритное происхождение.
Как только была установлена взаимосвязь между новым металлом, найденным в медных плавках, и рудой, добавленной в качестве флюса, естественным образом последовала работа печей для производства только железа. Несомненно, к 1400 г. до н. э. в Анатолии большое значение приобрело железо, а к 1200–1000 гг. до н. э. из него в больших масштабах изготавливали оружие, первоначально лезвия кинжалов. По этой причине 1200 г. до н.э. был принят за начало железного века. Данные раскопок указывают на то, что искусство изготовления железа зародилось в гористой местности к югу от Черного моря, где доминировали хетты. Позже это искусство, по-видимому, распространилось среди филистимлян, поскольку в Гераре были обнаружены грубые печи, датируемые 1200 г. до н. э., вместе с рядом железных предметов.
Позже это искусство, по-видимому, распространилось среди филистимлян, поскольку в Гераре были обнаружены грубые печи, датируемые 1200 г. до н. э., вместе с рядом железных предметов.
Плавка оксида железа с древесным углем требовала высокой температуры, и, поскольку температура плавления железа 1540 °C (2800 °F) тогда была недостижима, продукт представлял собой просто губчатую массу пастообразных глобул металла, смешанных с полужидкий шлак. Этот продукт, позже известный как блюм, вряд ли можно было использовать в том виде, в каком он был, но повторный нагрев и горячая ковка устранили большую часть шлака, создав кованое железо, продукт гораздо лучшего качества.
На свойства железа сильно влияет присутствие небольшого количества углерода, при этом значительное увеличение прочности связано с содержанием менее 0,5 процента. При достижимых тогда температурах — около 1200 ° C (2200 ° F) — восстановление древесным углем давало почти чистое железо, которое было мягким и имело ограниченное применение для оружия и инструментов. с изобретением лучших мехов железо поглощало больше углерода. Это привело к цветению и железным изделиям с различным содержанием углерода, что затрудняло определение периода, в течение которого железо могло быть преднамеренно упрочнено путем науглероживания или повторного нагревания металла в контакте с избытком древесного угля.
с изобретением лучших мехов железо поглощало больше углерода. Это привело к цветению и железным изделиям с различным содержанием углерода, что затрудняло определение периода, в течение которого железо могло быть преднамеренно упрочнено путем науглероживания или повторного нагревания металла в контакте с избытком древесного угля.
Углеродосодержащее железо имело еще одно большое преимущество, заключавшееся в том, что, в отличие от бронзы и безуглеродистого железа, его можно было сделать еще более твердым путем закалки, т. е. быстрого охлаждения путем погружения в воду. Нет никаких свидетельств использования этого процесса закалки в раннем железном веке, так что он должен был быть либо неизвестен тогда, либо не считался выгодным, поскольку закалка делает железо очень хрупким и должна сопровождаться отпуском или повторным нагревом при более низкая температура, чтобы восстановить ударную вязкость. То, что, по-видимому, было установлено на раннем этапе, было практикой многократной холодной ковки и отжига при 600–700 ° C (1100–1300 ° F), температура, естественно достигаемая при простом огне. Эта практика распространена в некоторых частях Африки даже сегодня.
Эта практика распространена в некоторых частях Африки даже сегодня.
К 1000 г. до н. э. железо стало известно в Центральной Европе. Его использование медленно распространялось на запад. Производство железа было широко распространено в Великобритании во время римского вторжения в 55 г. до н. э. В Азии железо также было известно в древности, в Китае около 700 г. до н.э.
Руда | Национальное географическое общество
Руда — это месторождение в земной коре одного или нескольких ценных минералов. Наиболее ценные рудные месторождения содержат металлы, имеющие решающее значение для промышленности и торговли, такие как медь, золото и железо.
Медная руда добывается для различных промышленных целей. Медь, отличный проводник электричества, используется в качестве электрического провода. Медь также используется в строительстве. Это обычный материал для труб и сантехники.
Как и медь, золото также добывается для промышленности. Например, космические шлемы покрыты тонким слоем золота, чтобы защитить глаза космонавта от вредного солнечного излучения. Однако большая часть золота используется для создания ювелирных изделий. На протяжении тысячелетий золотую руду добывали как основу валюты или денег. Большинство стран перестали оценивать свои деньги по золотому стандарту в двадцатом веке.
Однако большая часть золота используется для создания ювелирных изделий. На протяжении тысячелетий золотую руду добывали как основу валюты или денег. Большинство стран перестали оценивать свои деньги по золотому стандарту в двадцатом веке.
Железную руду добывали тысячи лет. Железо, второй по распространенности металл на Земле, является основным компонентом стали. Сталь — это прочный и ценный строительный материал. Железо используется во всем: от стекла до удобрений и твердотопливных ускорителей, когда-то использовавшихся для космических челноков, покидающих атмосферу Земли.
Металлы часто связаны с определенными рудами. Например, алюминий обычно содержится в руде, называемой бокситом. Алюминий, содержащийся в бокситах, используется в таре, косметике и лекарствах.
Плавка и электролиз
Когда горняки находят породу, содержащую минеральную руду, они сначала извлекают ее из земли. Это может быть огромный процесс, иногда вытесняющий миллионы тонн грязи.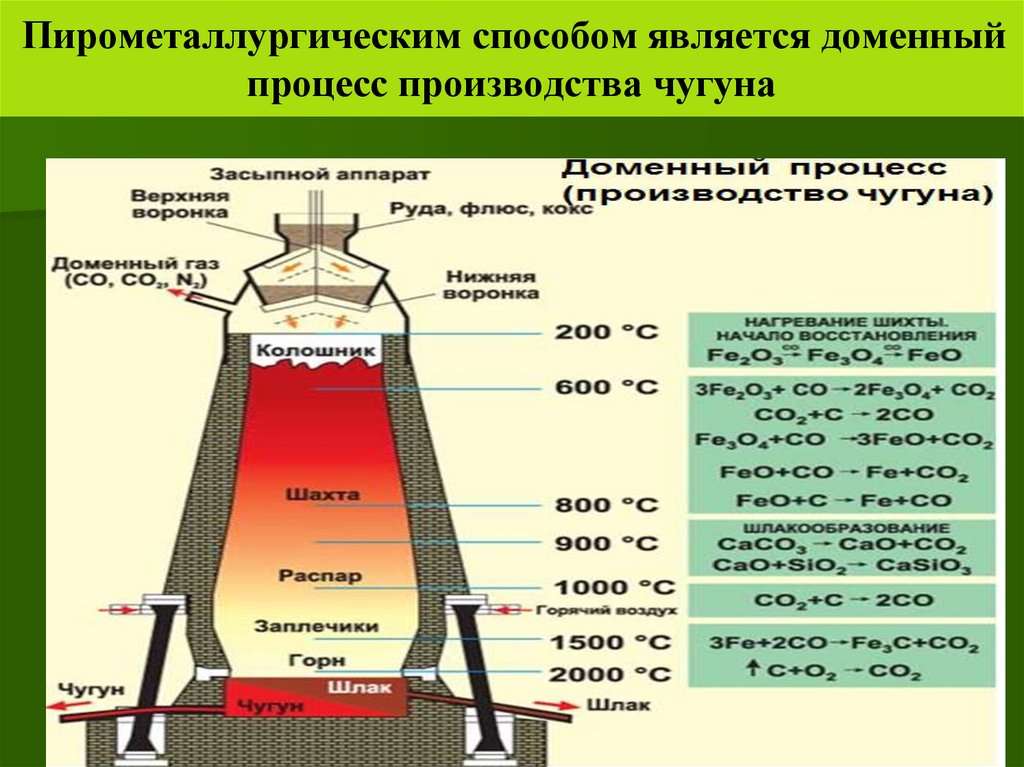 Затем скала дробится мощной техникой.
Затем скала дробится мощной техникой.
Металл извлекают из дробленой руды одним из двух основных способов: плавлением или электролизом.
При плавке используется тепло для отделения ценного металла от остальной руды. Для плавки обычно требуется восстановитель или другое химическое вещество, чтобы отделить металл от руды. В первых плавильнях восстановителем был углерод в форме древесного угля. Древесный уголь, сжигаемый с гематитовой рудой, например, плавит железо.
Электролиз отделяет металл от руды с помощью кислоты и электричества. Алюминий, который горит при очень высокой температуре, извлекается из бокситов электролизом. Боксит помещают в бассейн с кислотой, и через бассейн пропускают электрический ток. Электроны в токе присоединяются к кислороду и водороду, другим элементам в боксите, оставляя алюминий.
Генезис руды
Земля содержит ограниченное количество руды. По оценкам, генезис руды, процесс создания месторождения руды, занимает миллионы лет. Различают три основных типа рудогенеза: внутренние процессы, гидротермальные процессы и поверхностные процессы.
Различают три основных типа рудогенеза: внутренние процессы, гидротермальные процессы и поверхностные процессы.
Руда может накапливаться в результате геологической активности, например, когда вулканы выносят руду из глубин планеты на поверхность. Это называется внутренним процессом. Руда также может накапливаться, когда морская вода циркулирует через трещины в земной коре и откладывает минералы в районах вокруг гидротермальных источников. Это называется гидротермальным процессом. Наконец, руда может накапливаться в результате процессов, происходящих на поверхности Земли, таких как эрозия. Этот тип рудогенеза называется поверхностным процессом.
Руда также может падать на Землю в виде каменистых обломков из других частей Солнечной системы. Эти обломки, попадающие в атмосферу в виде падающих звезд, называются метеоритами. Многие метеориты содержат большое количество железной руды.
Руда — невозобновляемый ресурс. Поскольку современное общество так сильно зависит от металлической руды для промышленности и инфраструктуры, горняки должны постоянно искать новые месторождения руды. Горнодобывающие компании исследовали все континенты, а также дно океана в поисках ценной руды. Этот дефицит вносит свой вклад в стоимость руды.
Горнодобывающие компании исследовали все континенты, а также дно океана в поисках ценной руды. Этот дефицит вносит свой вклад в стоимость руды.
Краткий факт
Алюминий
Алюминий очень редко встречается в чистом металлическом виде и не может быть переплавлен. До двадцатого века алюминий часто был более ценным, чем золото.
Краткий факт
Эврика!
Крупнейшим источником золота является месторождение руды, расположенное в бассейне Витватерсранд в Южной Африке. Примерно 40 процентов золотой руды, добываемой на Земле, добыто там. Неисчислимое количество золота все еще остается скрытым в бассейне.
Краткий факт
Все, что блестит
Большая часть золотой руды, добытой на Земле, более 80 процентов становится ювелирными изделиями. Небольшой процент этого идет на электронное оборудование, монеты и зубные пломбы.
Краткий факт
Производство стали
Производство железной руды часто используется как показатель экономического здоровья страны.




 Бемент-младший
Бемент-младший