Понятие о металлургии: общие способы получения металлов
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
| Нахождение металлов в природе | ||
| Активные металлы — в виде солей | Металлов средней активности — в виде оксидов и сульфидов | Малоактивные металлы -в виде простых веществ |
| Хлорид натрия NaCl
| ||
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
CaCl2 → Ca + Cl2
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
2Al2O3 → 4Al + 3O2
youtube.com/embed/xSC4Sx5v_2o» frameborder=»0″ allowfullscreen=»allowfullscreen»>
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например, железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.
 3. Восстановление металлов угарным газом
3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например, железо можно получить восстановлением из оксида с помощью угарного газа:
2Fe2O3 + 6CО → 4Fe + 6CO2
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например, при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
youtube.com/embed/a-7TTaROUVw» frameborder=»0″ allowfullscreen=»allowfullscreen»>
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.
1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
C + O2 = CO2
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Fe2O3 → Fe3O4 (FeO·Fe2O3) → FeO → Fe
Последовательность восстановления оксида железа (III):
3Fe2O3 + CO → 2Fe3O4 + CO2
Fe3O4 + CO → 3FeO + CO2
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
Fe2O3 + 3CO → 2Fe + 3CO2
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др. ). Эти вещества растворяются в жидком железе.
). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
CaCO3 → CaO + CO2
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
CaO + SiO2 → CaSiO3
Понравилось это:
Нравится Загрузка…
Получение металлов. (9 класс) — презентация онлайн
Похожие презентации:
Нахождение металлов в природе. Общие способы получения металлов. 9 класс
Металлы в природе, общие способы получения металлов
Общие способы получения металлов
Способы получения металлов
Способы получения металлов
Способы получения металлов
Способы получения металлов. (11 класс)
(11 класс)
Общие способы получения металлов
Металлы в природе. Способы получения металлов
Получение металлов. Металлы в природе
Муниципальное бюджетное
общеобразовательное учреждение средняя
общеобразовательная школа №150.
Получение
металлов
Презентация подготовлена
Учителем химии
Назаровой Н. А. для
параллели 9-х классов.
2. Объясните, используя знания о химических свойствах металлов, почему нельзя:
а)хранить литий на воздухе?б)использовать для прекращения горения
натрия воду.
в)хранить кислые щи в алюминиевой
кастрюле.
г)готовить раствор сульфата меди в ведре,
сделанном из оцинкованного железа.
3. «Жизнь учит тех, кто её изучает»
Д. И. МенделеевНе сразу в дом пришел металл,
Не сразу ложкой, вилкой стал.
Не сразу стал он кружкой
И заводной игрушкой.
Был путь металла долог:
Сперва пришел геолог.
Нашел он гору- в ней руда.
И горняки пришли туда.

И машинист дает гудокК печам руду доставит в срок.
И металлический ручей
Течет из огненных печей.
Еще работе не конец:
Придут и токарь, и кузнец,
Слесарь и штамповщик,
Сварщик, фрезеровщик.
И каждый вложит труд в металл,
Чтобы металл трудится стал.
Он в проводах несет нам свет,
Метал – коньки, велосипед,
Метро, трамвай, будильник,
Утюг и холодильник.
Бурый железняк
Красный железняк
Магнитный железняк
Цинковая обманка
Свинцовый блеск
Киноварь
7. Нахождение металлов в природе.
В различныхВ свободном виде
химических
(самородные металлы)природных
металлы, которые трудно
соединениях.
окисляются кислородом
Входят в состав
воздуха
(платина, золото, серебро). горных пород и руд.
Содержатся в виде зерен или РУДА — это природные
образования,
вкраплений в горных
содержащие
породах.
минералы.
8. Ученые, занимающиеся получением металлов.
Николай НиколаевичБекетов
(1827-1911)
Русский химик, физик.

Способствовал развитию
физической химии как
самостоятельной области
науки.Открыл химический
процесс
вытеснения
металлов из растворов их
солей под действием
других
металлов
и
водорода.
9. Ученые, занимающиеся получением металлов.
Гемфри Дэви(1778-1829)
Английский химик и физик.
Один
из
основателей
электрохимии.
Путем
электролиза
солей
и
щелочей получил калий,
натрий, барий, кальций,
амальгаму
(раствор
металла в ртути) стронция
и магния.
10. Металлургия
Металлургия – это наука о методахи
процессах
производства
металлов
из
руд
и
других
металлосодержащих
продуктов,
наука о получении сплавов и
обработке металлов.
Пирометаллургия
— методы переработки руд,
основанные на химических реакциях, происходящих
при высоких температурах.
Пирометаллургия включает :
1) обжиг — при этом содержащиеся в рудах соединения
металлов, в частности сульфиды переводятся в
оксиды, а сера удаляется в виде so2.

2CuS +3O2
2CuO +2SO2
2) плавка — происходит восстановление металлов из их
оксидов с помощью угля, водорода,
активного металла.
CuO +C
Cu +CO
co
,
более
Гидрометаллургия
— методы получения
металлов, основанных на химических
реакциях, происходящих в растворах.
Стадии:
1) перевод нерастворимых соединений металлов
из руд в растворы.
CuS + 4H 2SO4
CuSO4 +4SO2 +4H 2O
2) восстановительное выделение металлов из
полученных растворов с помощью других
металлов или электрического тока.
CuSO4 + Fe
FeSO4 +Cu
Электрометаллургия
метод
получения металлов, основанный на
выделении металлов из растворов или
расплавов их соединений под действием
электрического тока. Применяется при
получении
металлов
–
щелочных,
щелочноземельных и алюминия, а также
для производства легированной стали.
2NaCl
2Na +Cl2
Микробиологические методы получения
металлов:
Здесь используется жизнедеятельность
некоторых видов бактерий.
 Например,
Например,тионовые бактерии способны переводить
нерастворимые сульфиды в растворимые
сульфаты.
«Крестики – нолики»
Кислород
Хлор
Серебро
Магний
Углерод
Алюмини Водород
й
Оксид
Вода
Кальций
Фтор
Оксид
алюминия
Медь
Сера
Железо
Оксид
углерода(II)
углерода(IV)
16. Составьте уравнения реакций восстановления железа из его оксидов
Fe2O3 + AlFe2O3 + h3
Fe2O3 +CO
17. Проверяем
Fe2O3 + 2AlFe2O3 + 3h3
Fe2O3 +3CO
Al2O3 + 2Fe
3 h3O + 2Fe
3CO2 + 2Fe
18. Задание на дом
В начале века из Нью-Йоркского порта вышлав открытый океан красавица яхта. Ее
владелец, американский миллионер, не
пожалел денег. Корпус яхты был сделан из
очень дорогого металла алюминия, листы
которого скреплялись медными заклепками.
Было очень красиво. Однако через несколько
дней обшивка корпуса начала расходиться и
яхта пошла ко дну. Почему?
19.
 Бдагодарю за урок Бдагодарю за урок
Бдагодарю за урок Бдагодарю за урок Желаю удачи. Надеюсь, что знания
полученные на уроке расширят ваш
кругозор.
English Русский Правила
Добыча металлов | CPD
Используйте эти идеи и упражнения, чтобы помочь своим учащимся понять процессы восстановления и окисления
Вполне вероятно, что ножки столов и стульев в вашем классе сделаны из железа. Если бы ваши ученики спросили вас, откуда взялось это железо, как химика, у вас был бы гораздо более интересный ответ, чем «из магазина».
История о том, откуда берется железо и как мы использовали его в нашей мебели, показывает ежедневное влияние химии металлов. Железная руда была добыта, измельчена и обработана для производства ножек стульев и столов. Медь в наших телефонах и свинец в автомобильных аккумуляторах подверглись аналогичным процессам.
Источник: © William Barron de Burgh
На прогулке в загородном парке вы ближе к металлам, чем вы думаете.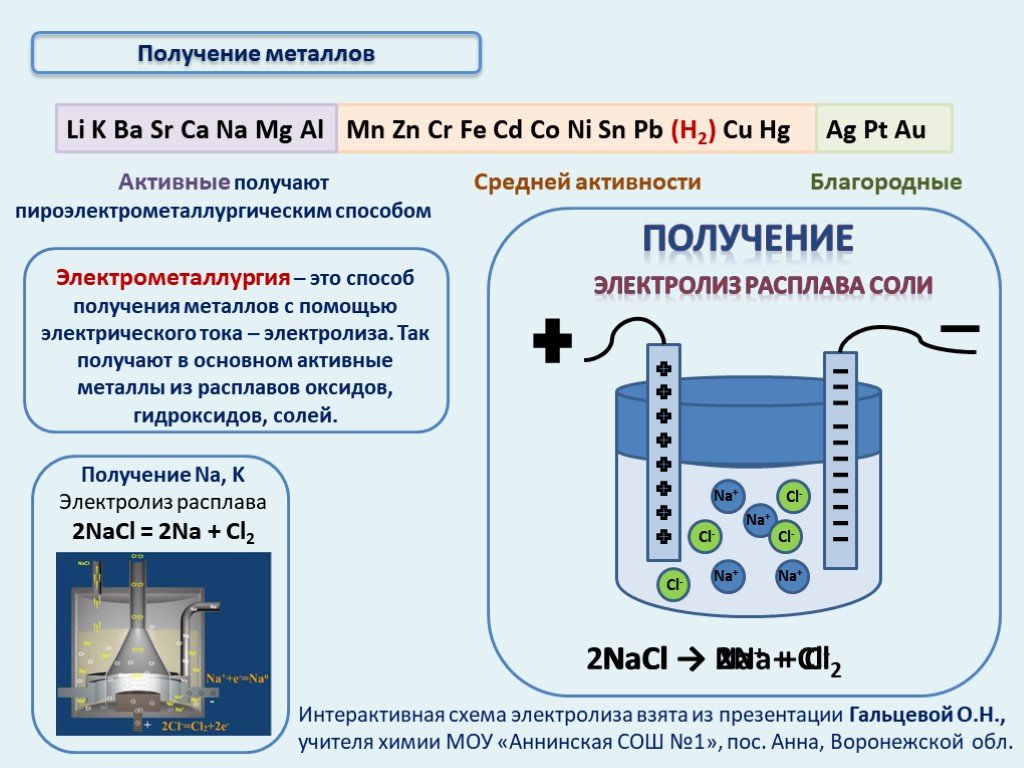 резкий контраст холмов, деревьев и полей рядом с горизонтом из бетона, стекла и металла Бирмингема позади. Хотя это не очевидно для всех, металлы находятся поблизости в изобилии, хотя и в их окисленной форме в виде положительных ионов металлов. Магний в хлорофилле листьев, кальций и многие другие ионы металлов в земле под моими ногами, и это лишь некоторые из мест. Сокращая ионы металлов в соединениях, мы можем извлекать металлы для собственного использования и буквально строить мир вокруг себя.
резкий контраст холмов, деревьев и полей рядом с горизонтом из бетона, стекла и металла Бирмингема позади. Хотя это не очевидно для всех, металлы находятся поблизости в изобилии, хотя и в их окисленной форме в виде положительных ионов металлов. Магний в хлорофилле листьев, кальций и многие другие ионы металлов в земле под моими ногами, и это лишь некоторые из мест. Сокращая ионы металлов в соединениях, мы можем извлекать металлы для собственного использования и буквально строить мир вокруг себя.
Что нужно знать учащимся
• Руда – это минерал, содержащий достаточное количество металла, чтобы его можно было извлечь. Углерод можно использовать для извлечения металлов из оксидов некоторых металлов.
• Металл может либо восстанавливаться, либо окисляться в результате реакции.
• Восстановление происходит, когда металл в соединении теряет кислород с образованием элементарного металла.
• Окисление происходит, когда металл (или углерод) получает кислород с образованием оксидного соединения.
Идеи для занятий
Многие металлы можно восстановить и извлечь в школьной лаборатории. Самыми простыми являются железо, медь и свинец. В течение нескольких уроков студентов можно научить тому, как металл извлекается и восстанавливается из руды. По мере введения каждого нового примера усложняйте химию. Этот процесс будет продолжаться во время обучения на GCSE и A-level. Ваше учение о восстановлении и окислении, или окислительно-восстановительном потенциале, в 11-14 годах создает концептуальную основу, на которой строится все остальное.
Начните с определения учащимися металлов, которые окисляются (в соединениях с кислородом) или восстанавливаются (как элементы). Покажите примеры, включая металлические руды и соединения, и сравните их с самими металлами. Попросите учащихся определить окисленные и восстановленные формы. Обсудите различные свойства, связанные с металлами и неметаллами, соединениями и элементами, ионами и атомами.
Начните с определения учащимися металлов, которые окисляются (в соединениях с кислородом) или восстанавливаются (как элементы). Покажите примеры, включая металлические руды и соединения, и сравните их с самими металлами. Попросите учащихся определить окисленные и восстановленные формы. Обсудите различные свойства, связанные с металлами и неметаллами, соединениями и элементами (rsc.li/354CsQJ), а также ионами и атомами (rsc.li/2Pt75sM).
Покажите примеры, включая металлические руды и соединения, и сравните их с самими металлами. Попросите учащихся определить окисленные и восстановленные формы. Обсудите различные свойства, связанные с металлами и неметаллами, соединениями и элементами (rsc.li/354CsQJ), а также ионами и атомами (rsc.li/2Pt75sM).
Источник: © Shutterstock
Развивайте понимание учащихся, постепенно увеличивая детализацию понятий. Используйте следующие определения в последовательности, чередуя предшествующие знания:
| Восстановление металла | Окисление металла | |
|---|---|---|
1 ст | Удаление кислорода | Добавление кислорода |
2 й | Формование элемента | Образование соединения |
3 рд | Формирование атома | Образование иона |
Предложите учащимся описать реакции, используя как можно больше ключевых слов, чтобы развить беглость речи.
Эту последовательность можно представить с помощью серии вопросов; см. некоторые в рабочих листах ниже.
Загрузите рабочие листы
по извлечению металлов в формате MS Word и pdf, а также заметки и ответы для учителя в формате MS Word и pdf.
Рабочие листы по извлечению металлов, заметки учителей и ответы с веб-сайта Education in Chemistry: rsc.li
Практическая химия
Учащиеся могут сами проводить эксперименты по восстановлению, например, восстанавливать оксид железа до железа. Любимое практическое занятие класса – извлечение железа на спичечной головке. Начните с показа образца гематита из железной руды. Обсудите источники железной руды и рудники, такие как бывший железный рудник Флоренс в Эгремонте, Камбрия, который закрылся в 2008 году. Я рассказываю своим ученикам, как «я часами молотком дробил гематит, пока он не превратился в мелкий порошок для их использования» . Тогда покажите им порошкообразный оксид железа.
Любимое практическое занятие класса – извлечение железа на спичечной головке. Начните с показа образца гематита из железной руды. Обсудите источники железной руды и рудники, такие как бывший железный рудник Флоренс в Эгремонте, Камбрия, который закрылся в 2008 году. Я рассказываю своим ученикам, как «я часами молотком дробил гематит, пока он не превратился в мелкий порошок для их использования» . Тогда покажите им порошкообразный оксид железа.
Учащиеся могут сами проводить эксперименты по восстановлению, например, восстанавливать оксид железа до железа. Любимое практическое занятие класса – извлечение железа из спичечной головки (rsc.li/2P4VEIT). Начните с показа образца гематита из железной руды. Обсудите источники железной руды и рудники, такие как бывший железный рудник Флоренс в Эгремонте, Камбрия, который закрылся в 2008 году. Я рассказываю своим ученикам, как «я часами молотком дробил гематит, пока он не превратился в мелкий порошок для их использования» . Покажите им порошкообразный оксид железа.
Покажите им порошкообразный оксид железа.
Перед сжиганием смеси окуните головку спички последовательно в воду, затем в карбонат натрия и, наконец, в оксид железа. Раздавите сгоревшую смесь лопаткой в лодочке для взвешивания и используйте магнит внизу, чтобы показать, что железо было произведено. Древесина спички действует как источник углерода, восстанавливая оксид железа до железа. Студенты должны быть в состоянии написать уравнение слова и определить восстановление и окисление, как описано выше.
Свинец можно восстановить из руды галенита (сульфида свинца), которую раньше добывали в Шропшире. Медь можно восстановить из малахита (гидроксид карбоната меди), который добывали в древних медных рудниках в мысе Грейт-Орм, Лландундо. Обе руды требуют обжига — нагревания на воздухе — прежде чем они будут готовы к восстановлению. Этот этап можно смоделировать в классе термическим разложением карбоната меди на оксид меди перед восстановлением углеродом.
Свинец может быть восстановлен из руды галенита (сульфида свинца), которую раньше добывали в Шропшире. Медь можно восстановить из малахита (гидроксид карбоната меди), который добывали в древних медных рудниках в мысе Грейт-Орм, Лландундо. Обе руды требуют обжига — нагревания на воздухе — прежде чем они будут готовы к восстановлению. Этот этап можно смоделировать в классе путем термического разложения карбоната меди на оксид меди (rsc.li/2rsYsX5) перед восстановлением углеродом (rsc.li/2sY6bNb).
Медь можно восстановить из малахита (гидроксид карбоната меди), который добывали в древних медных рудниках в мысе Грейт-Орм, Лландундо. Обе руды требуют обжига — нагревания на воздухе — прежде чем они будут готовы к восстановлению. Этот этап можно смоделировать в классе путем термического разложения карбоната меди на оксид меди (rsc.li/2rsYsX5) перед восстановлением углеродом (rsc.li/2sY6bNb).
Формирующее оценивание
Теперь учащиеся должны уметь перенести свои знания о восстановлении оксида железа на примеры оксида меди и оксида свинца. Попросите их объяснить, как элементарная медь и свинец образуются из руд. Используйте индивидуальные доски, чтобы дать учащимся метод с низкими ставками для разработки их мышления и получить быструю индивидуальную устную обратную связь. Рабочие листы могут быть использованы для оценки знаний учащихся. Смоделируйте свое мышление, отвечая на один набор ответов, а затем попросите учащихся самостоятельно или коллегами оценить другие ответы.
Источник: © Shutterstock.com
Придайте урокам контекст. Например, обратитесь к местной статуе, которая занимается окислением
Progression 14-16
Концепция восстановления и окисления может быть расширена за пределы восстановления металлов. Следующие шаги будут включать описание реакций с точки зрения переноса электрона.
Например, покажите ржавую железную цепь или медную статую королевы Виктории в Бирмингеме. Спросите студентов: что случилось с железом в цепи и с медью в статуе?
Обсудите, что происходит с неметаллом в соединении, когда металл восстанавливается. Остается ли он частью соединения и поэтому не восстанавливается и не окисляется? Или он удаляется из соединения и поэтому окисляется?
Распространенные заблуждения
Распространенное заблуждение состоит в том, что окисление ограничивается реакцией с кислородом, а восстановление ограничивается удалением кислорода. Постарайтесь не предлагать ограничительных определений восстановления или окисления — подчеркните, что многие ключевые термины в науке могут иметь несколько, часто перекрывающихся значений.
Уточните, что подразумевается под «с кислородом». Подчеркните разницу между соединением оксида металла, например, оксидом железа, и смесью элементов, например, железа и кислорода.
Неметаллы могут реагировать противоположным образом по отношению к металлам при окислительно-восстановительной экстракции, что может привести к путанице – например, хлор окисляется при экстракции из раствора хлорида натрия.
Пункты самовывоза
- Металлы можно извлекать из руд путем восстановления – удалением кислорода или образованием металлического элемента из соединения.
- Окисление и восстановление имеют несколько значений, а не только связаны с добавлением и удалением кислорода.
- Поощряйте учащихся использовать ключевые термины как можно чаще. Постоянное моделирование ключевых слов поможет повысить уверенность учащихся и беглость речи.
- Понимание учащимися окислительно-восстановительного потенциала перерастет в их понимание переноса электронов и реакций, включая замещение и электролиз.

Извлечение металлов: ключевые моменты | Средняя наука 4 Все
Опубликовано Автор: secondscience4all
Металлическая руда
Металлы обычно находятся в земной коре либо в виде элемента (если металл неактивен), либо в виде соединения металла (если металл химически активен).
Руды содержат достаточное количество металла, чтобы его добыча была экономичной.
Однако со временем экономика добычи может измениться.
Руды добываются и могут быть обогащены до извлечения и очистки металла.
Знание ряда реакционной способности металлов важно для принятия решения о методе извлечения металла из металлической руды.
Важно отметить, что более реакционноспособный металл может восстанавливать соль (оксид) металла с более низкой реакционной способностью.
Нереакционноспособные металлы (например, золото, серебро, платина) находятся на Земле в виде самого чистого металла. Золото можно отделить от горных пород физическими методами.
Металлы, которые менее реакционноспособны, чем углерод (например, цинк, железо, олово, свинец, медь), могут быть извлечены из их оксидов путем восстановления углеродом, например, оксид железа восстанавливается монооксидом углерода (образуется из угольного кокса) гладить в доменной печи
Металлы, более реакционноспособные, чем углерод (например, алюминий и титан) не могут быть извлечены из их оксидов путем восстановления углеродом, а вместо этого извлекаются электролизом расплавленных соединений или восстановлением руды с использованием более реакционноспособного металла . Электролиз использует большое количество энергии для извлечения этих металлов. Это, в дополнение к многочисленным стадиям, связанным с процессами экстракции, делает извлечение этих металлов очень дорогим.
Для получения сертификата GCSE требуются специальные знания о следующих металлах (методы добычи, свойства и использование).
| Металл | Метод экстракции | Свойства | Использование |
|---|---|---|---|
| Железо | Восстановление оксида железа (III) монооксидом углерода (образуется при сжигании кокса — формы углерода). | Железо из доменной печи содержит около 96 % железа. Чугун хрупкий, поэтому его применение ограничено. Большая часть добываемого железа перерабатывается в стальные сплавы. | Сталь (железо/углеродистые сплавы), строительство Магнитные материалы. |
| Алюминий | Электролиз расплавленного оксида алюминия. Требует высоких температур, значительного электричества и многих процессов. Следовательно, алюминий стоит дорого. | Низкая плотность Прочный и пластичный Стойкий к коррозии Хороший электрический и тепловой проводник | Строительная промышленность, самолеты, банки для еды и напитков, кухонная фольга, кастрюли, воздушные линии электропередач |
| Титан | Много стадий процесса экстракции. Требуется большое количество энергии. Поэтому титан стоит дорого. | Низкая плотность Прочный и пластичный Стойкий к коррозии | Военные самолеты, ракеты, реактивные снаряды Замена суставов и других костей |
| Медь | *Руды, богатые медью: плавка с последующим электролизом. Бедные медные руды: фитодобыча, биовыщелачивание. *Руды, богатые медью, становятся пугающими | Ковкий Хороший проводник тепла и электричества Не реагирует с водой | Водопроводные трубы в системах отопления Электропроводка Медные сплавы, включая бронзу и латунь |
Несмотря на то, что алюминий и титан являются высокореактивными металлами, почему они устойчивы к коррозии под действием кислот и щелочей?
Алюминий быстро вступает в реакцию с кислородом, образуя поверхностный слой оксида алюминия, который покрывает алюминий и предотвращает его дальнейшую реакцию.


