Карбонат бария, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Способ получения карбоната бария
Изобретение используется для выделения, очистки и получения карбоната бария, в том числе изотопно-обогащенного, полученного методом электромагнитной сепарации. Изобретение заключается в том, что приготовление водной суспензии барийсодержащего концентрата ведут путем промывки водой плава сульфата бария со смесью соды, щавелевой кислоты и нитрата натрия, очистку раствора нитрата бария проводят упариванием его до влажной соли, промывкой ее концентрированной азотной кислотой и растворением в воде. Очищенный раствор обрабатывают раствором аммиака с концентрацией не менее 5%, насыщенным карбонатом аммония. Осадок карбоната бария отделяют, промывают и сушат. Изобретение позволяет выделить 98,0% изотопно-обогащенного бария в виде карбоната требуемой степени очистки.
Изобретение относится к области выделения, очистки и получения карбоната бария, в том числе изотопно-обогащенного, получаемого методом электромагнитной сепарации.
Задачей выделения и очистки изотопно-обогащенного бария является максимально полное извлечение его на всех стадиях химической переработки сульфата бария и получение карбоната бария, содержащего минимальное количество примесей.
Известен способ получения карбоната бария автоклавной гидротермальной обработкой барита, суспендированного раствором карбоната натрия с последующим отделением целевого продукта от содосульфатного раствора (патент РФ 1691305 МПК5 С 01 F 11/18). Недостатком этого способа является то, что он не обеспечивает отделения примесей элементов, не растворимых в щелочной среде, к тому же карбонат бария содержит непрореагировавший сульфат. Кроме этого, применение способа требует использования дополнительного специального оборудования.
Известен также способ получения карбоната бария, включающий обработку водной суспензии плава сернистого бария соляной кислотой, подщелачивание суспензии, отделение раствора хлорида бария, очистку его от примесей упариванием до концентрации ВаСl2 в маточном растворе 210-300 г/л, отделение кристаллов хлорида бария, их растворение в воде и осаждение карбоната бария обработкой раствора карбонатом натрия (патент РФ 1373686 МПК4 С 01 F 11/18). Недостатком этого способа является загрязнение барийсодержащего раствора примесями тяжелых и цветных металлов при обработке водной суспензии плава соляной кислотой. Кроме этого, существенны потери бария, образующиеся как на стадии обработки плава из-за частичного окисления сернистого бария и образования нерастворимого сульфата, так и на стадии очистки раствора хлорида бария из-за высокой концентрации бария в отделяемом маточном растворе. К тому же довольно существенная растворимость хлорида бария не позволяет использовать этот способ для выделения малых количеств бария, что часто является необходимостью при получении изотопно-обогащенного продукта.
Недостатком этого способа является загрязнение барийсодержащего раствора примесями тяжелых и цветных металлов при обработке водной суспензии плава соляной кислотой. Кроме этого, существенны потери бария, образующиеся как на стадии обработки плава из-за частичного окисления сернистого бария и образования нерастворимого сульфата, так и на стадии очистки раствора хлорида бария из-за высокой концентрации бария в отделяемом маточном растворе. К тому же довольно существенная растворимость хлорида бария не позволяет использовать этот способ для выделения малых количеств бария, что часто является необходимостью при получении изотопно-обогащенного продукта.
Известен способ получении барийсодержащего раствора, включающий сплавление барита со смесью соды, щавелевой кислоты и нитрата натрия, обработку плава водой, отделение барийсодержащего концентрата и растворение его в горячей уксусной кислоте (ж. «Заводская лаборатория», 4, с. 397, 1954). Использование этого способа позволяет извлечь барий из BaSO4 достаточно полно, однако полученный раствор будет содержать все примеси, содержащиеся в исходном сульфате бария, что требует проведения дополнительной очистки с учетом специфики состава раствора.
Наиболее близким к заявляемому техническому решению является способ получения карбоната бария, включающий получение барийсодержащего раствора обработкой водной суспензии плава сульфида бария 20-23%-ной азотной кислотой при 60-70oC с последующей обработкой полученной суспензии паром до 85-95oC, очистку его от примесей нейтрализацией раствором гидрооксида натрия и отфильтровыванием осадка примесей, обработку очищенного раствора карбонатом натрия, отделение осадка карбоната бария, его промывку и сушку (патент РФ 2096329 МПК6 С 01 F 11/18, 11/38).
Основным недостатком этого способа является недостаточно полное выделение бария в барийсодержащий раствор из-за частичного окисления сульфида бария и образования нерастворимого сульфата. Кроме этого, предлагаемый способ не позволит достичь требуемой степени очистки карбоната бария, так как обработка барийсодержащего раствора гидроксидом натрия не обеспечивает достоточно полного отделения примесей щелочноземельных элементов из-за высокой растворимости их гидроксидов. К тому же использование натрийсодержащих реагентов, в том числе карбоната натрия, при осаждении карбоната бария приведет к загрязнению конечного продукта примесью натрия.
К тому же использование натрийсодержащих реагентов, в том числе карбоната натрия, при осаждении карбоната бария приведет к загрязнению конечного продукта примесью натрия.
Технической задачей изобретения является получение чистого карбоната бария, в том числе изотопно-обогащенного, при минимальных потерях бария на всех стадиях химической переработки.
Поставленная задача достигается тем, что плав сульфата бария со смесью соды, щавелевой кислоты и нитрата натрия растворяют в воде и отделяют барийсодержащий концентрат. Водную суспензию барийсодержащего концентрата обрабатывают 20-23%-ной азотной кислотой при 60-70oС. Полученный барийсодержащий раствор очищают от примесей упариванием до получения влажной соли, промыванием ее концентрированной азотной кислотой и растворением в воде. Очищенный раствор обрабатывают раствором аммиака с концентрацией не менее 5%, насыщенным карбонатом аммония. Осадок карбоната бария отделяют, промывают и сушат.
В заявляемом техническом решении способ получения барийсодержащего концентрата позволяет максимально полно извлекать в раствор барий, содержащийся в исходном сульфате. Очистка барийсодержащего раствора упариванием до влажной соли и промыванием ее концентрированной азотной кислотой обеспечивает достаточно эффективное отделение примесей при минимальных потерях бария с маточным раствором. Использованный способ осаждения карбоната бария раствором карбоната аммония в аммиаке не только исключает загрязнение целевого продукта примесью натрия, но и позволяет выделить его из очищенного раствора практически без потерь.
Проведенный анализ общедоступных источников информации об уровне техники не позволил выявить техническое решение, тождественное заявленному, на основании чего делается вывод о неизвестности последнего, т.е. соответствии представленного в настоящей заявке изобретения критерию «новизна».
Сопоставительный анализ заявленного решения с известными техническими решениями позволил выявить, что представленная совокупность отличительных признаков не известна для специалиста в данной области и не следует явным образом из известного уровня техники, на основании чего делается вывод о соответствии представленного в настоящей заявке изобретения критерию «изобретательский уровень».
Предложенный способ получения карбоната бария реализовали следующим образом.
Пример 1. 5 г сульфата бария, содержащего около 1% кальция и примеси меди, железа, хрома сплавили со смесью соды, щавелевой кислоты и нитрата натрия (на 1 г BaSO4 1,5 г Na2CO3, 1 г H2C2O42H2O, 3 г NaNO3) при 450oС в течение 1 часа. Плав растворили в воде при нагревании и охладили. Твердый остаток отфильтровали и промыли водой. Фильтрат проанализировали на содержание бария. Оно составило 0,2 мг/л. К полученному барийсодержащему концентрату добавили воды для образования суспензии и обработали 20-23%-ной азотной кислотой при 60…70oС до рН 2-3.
Осадок, содержащий несплавившийся сульфат бария и оксиды примесей, отфильтровали, промыли водой и прокалили. В шламе определили содержание бария. Потери бария при получении азотнокислого раствора составили 0,71%.
Раствор нитрата бария упарили до влажной соли, добавили концентрированной азотной кислоты из расчета 5 мл на 1 г бария и тщательно перемешали. Осадок ВаNО3 отфильтровали и промыли концентрированной азотной кислотой. Азотнокислый фильтрат проанализировали на содержание бария. Потери бария при очистке азотнокислого раствора составили 0,24%.
Осадок нитрата бария растворили в воде и добавили насыщенный раствор карбоната аммония в 5%-ном аммиаке (при этом избыточная концентрация (NH4)2 CO3 составила 10 г/л). Раствор с осадком тщательно перемешали и выстояли в течение 10…16 часов.
Осадок ВаСО3 отфильтровали, промыли и просушили при 600…700oС до постоянного веса.
Карбонатный фильтрат проанализировали на содержание бария. Оно составило 0,3 мг/л. Карбонат бария проанализировали на содержание примесей. Их общая сумма составила 0,013%, в том числе 0,005% Cа и 0,0011% Sr.
Их общая сумма составила 0,013%, в том числе 0,005% Cа и 0,0011% Sr.
Пример 2. Получение карбоната бария проводили, как в примере 1, но осаждение карбоната бария из очищенного раствора проводили насыщенным раствором карбоната аммония в 4%-ном аммиаке.
Потери бария при очистке азотнокислого раствора составили 0,21%. Концентрация бария в карбонатном фильтрате составила 18,4 мг/л.
Общая сумма примесей в ВаСО3 составила 0,011%, в том числе 0,002% Са и 0,001% Sr.
Пример 3. Получение карбоната бария проводили, как в примере 1, но осаждение BaCO3 проводили насыщенным раствором карбоната аммония в 6%-ном аммиаке. Потери бария при очистке азотнокислого раствора составили 0,19%. Концентрация бария в карбонатном фильтрате составила 0,3 мг/л, то есть увеличение концентрации аммиака в карбонатсодержащем реагенте не влияет на полноту осаждения ВаСО3. Общая сумма примесей в ВаСО3 составила 0,012%, в том числе 0,001% Са и 0,001% Sr.
Общая сумма примесей в ВаСО3 составила 0,012%, в том числе 0,001% Са и 0,001% Sr.
Пример 4. Азотнокислый раствор бария получали, как в примере 1. Потери бария с нерастворившимся шламом составили 0,54%.
Раствор нитрата бария упарили до 40 мл, что соответствовало концентрации Ba(NO3)2 13,5% и добавили 40%-ный раствор NаОН до избыточной концентрации щелочи 10 г/л. Раствор прогрели и профильтровали (очистка от кальция по патенту РФ 2096329 МПК6 С 01 F 11/18, 11/38, выбранному в качестве прототипа).
Осаждение карбоната бария из очищенного раствора, отделение осадка, его промывку и сушку проводили, как в примере 1. Содержание бария в фильтрате составило 0,5 мг/л. Общая сумма примесей в полученном ВаСО3 составила 0,764%, в том числе 0,003% Na, 0,647% Са и 0,037% Sr.
Пример 5. Получение и очистку азотнокислого раствора бария проводили, как в примере 1, но осаждение карбоната бария проводили раствором карбоната натрия при 80oС (по прототипу).
Потери бария при получении азотнокислого раствора составили 0,73%, при очистке — 0,21%.
Отделение осадка ВаСО3, его промывку и сушку проводили, как в примере 1. Содержание бария в карбонатном фильтрате составило 0,6 мг/л. Общая сумма примесей в полученном ВаСО3 составила 0,057%, в том числе 0,029% Nа, 0,007% Са и 0,001% Sr.
Пример 6. Получение карбоната бария проводили по прототипу. 5 г сульфата бария, содержащего около 1% кальция, а также примеси меди, железа, хрома восстанавливали в токе водорода при 900oС. Плав сульфида бария растворили в воде. Водную суспензию обработали 20-23%-ной азотной кислотой при 60-70oС до pH 2-3. Азотнокислый раствор бария отфильтровали. Нерастворившийся осадок (смесь сульфата бария и серы) прокалили и взвесили. Потери бария при получении азотнокислого раствора бария составили 17,24%. Раствор нитрата бария нейтрализовали раствором NаОН до pH 8,5 и отделили осадок гидроксидов примесей фильтрованием. Очистку от кальция проводили, как в примере 2, а осаждение карбоната бария, как в примере 3. Содержание бария в карбонатном фильтрате составило 0,4 мг/л. Общая сумма примесей в полученном карбонате бария составила 0,987%, в том числе 0,051% Na, 0,798% Са, 0,043% Sr.
Очистку от кальция проводили, как в примере 2, а осаждение карбоната бария, как в примере 3. Содержание бария в карбонатном фильтрате составило 0,4 мг/л. Общая сумма примесей в полученном карбонате бария составила 0,987%, в том числе 0,051% Na, 0,798% Са, 0,043% Sr.
Предложенный способ получения карбоната бария опробован на производстве стабильных изотопов. Он позволил выделить 98,0% изотопно-обогащенного бария в виде карбоната с общей суммой примесей 0,012%.
Предложенный способ позволяет использовать стандартное оборудование, дешевые и доступные реактивы, не требует большого расхода электроэнергии. Способ пригоден и с экологической точки зрения, т.к. исключает образование летучих токсичных веществ (сероводорода), а образующиеся фильтраты взаимно нейтрализуются.
Формула изобретения
Способ получения карбоната бария, включающий приготовление водной суспензии барийсодержащего концентрата, обработку его 20-23%-ной азотной кислотой при 60-70oС, очистку полученного раствора нитрата бария от примесей, обработку очищенного раствора карбонатсодержащим реагентом, отделение осадка карбоната бария, его промывку и сушку, отличающийся тем, что приготовление водной суспензии барийсодержащего концентрата ведут путем промывки водой плава сульфата бария со смесью соды, щавелевой кислоты и нитрата натрия, очистку раствора нитрата бария проводят упариванием его до влажной соли, промывкой ее концентрированной азотной кислотой и растворением в воде, а в качестве карбонатсодержащего реагента используют насыщенный карбонатом аммония раствор аммиака с концентрацией не менее 5%.
ICSC 0777 — КАРБОНАТ БАРИЯ
ICSC 0777 — КАРБОНАТ БАРИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| КАРБОНАТ БАРИЯ | ICSC: 0777 (Октябрь 2006) |
| CAS #: 513-77-9 |
| UN #: 1564 |
| EINECS #: 208-167-3 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. При пожаре выделяет раздражающие или токсичные пары (или газы). При пожаре выделяет раздражающие или токсичные пары (или газы). |
В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. |
| Кожа | Покраснение. | Защитные перчатки. | Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. | Использовать средства защиты глаз. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). |
| Проглатывание | Тошнота. Рвота. Брюшные судороги. Диарея. Слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Смести просыпанное вещество в закрытые контейнеры. Тщательно собрать оставшееся. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от трифторида брома, сильных кислот и пищевых продуктов и кормов. | |
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. |
| КАРБОНАТ БАРИЯ | ICSC: 0777 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: BaCO3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: Xn; R: 22; S: (2)-24/25 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Карбонат бария
Вызов:
Википедия
Декабрь 16, 2021
Карбона́т ба́рия — химическое соединение, бариевая соль угольной кислоты. Химическая формула BaCO3. В природе встречается в виде минерала витерита.
| Карбонат бария | |
|---|---|
| Общие | |
| Систематическое наименование | Карбонат бария |
| Традиционные названия | Карбонат бария; углекислый барий, витерит |
| Хим. формула | BaCO3 |
| Рац. формула | BaCO3 |
| Физические свойства | |
| Молярная масса | 197,34 г/моль |
| Плотность | 4,286 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | >1400 °C |
| Энтальпия | |
| • образования | −1211 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | (при 20 °C) 0,0024 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,60 |
| Классификация | |
Рег. номер CAS номер CAS | |
| PubChem | |
| Рег. номер EINECS | 208-167-3 |
| SMILES | |
| InChI | |
| RTECS | CQ8600000 |
| Номер ООН | 1564 |
| ChemSpider | |
| Безопасность | |
| ЛД50 | 418 мг/кг (крысы, перорально) |
| Токсичность | ирритант, среднетоксичен |
| NFPA 704 | 0 2 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Обладает умеренно-токсическим действием. Может использоваться в качестве компонента отравленных приманок.
Содержание
- 1Физические свойства
- 2Получение
- 3Химические свойства
- 4Применение
- 5Биологическая роль
- 6Примечания
- 7Литература
- 8См.
 также
также
Углекислый барий (BaCO3) представляет собой бесцветные кристаллы. До 810 °C устойчива α-модификация с ромбической решёткой; в интервале 810—960 °C — β-модификация с гексагональной решёткой; свыше 960 °C — γ-модификация с кубической решёткой.
Tпл 1555 °C (в атмосфере CO2 под давлением 45 МПа). Плохо растворим в воде (ПР = 8⋅10−9 при 20 °C). Растворимость повышается в присутствии ионов аммония или угольной кислоты. Образует твердые растворы с CaCO3 и SrCO3, BaO. C BaCl2 и BaTiO3 дает эвтектические смеси.
В промышленности, обычно, карбонат бария получают из минерального сырья; кроме того возможны следующие химические способы его получения:
- Взаимодействие BaS с CO2 или Na2CO3:
- BaS+Na2CO3⟶BaCO3↓+Na2S{\displaystyle {\mathsf {BaS+Na_{2}CO_{3}\longrightarrow \ BaCO_{3}\downarrow \ +Na_{2}S}}}
- Обменная реакция растворимых солей бария или гидроксида бария с растворами карбонатов:
- Ba2++CO32−⟶BaCO3↓{\displaystyle {\mathsf {Ba^{2+}+CO_{3}^{2-}\longrightarrow \ BaCO_{3}\downarrow \ }}}
- Реагирует с разбавленной соляной, азотной и уксусной кислотами:
- BaCO3+2HCl⟶BaCl2+h3O+CO2↑{\displaystyle {\mathsf {BaCO_{3}+2HCl\longrightarrow \ BaCl_{2}+H_{2}O+CO_{2}\uparrow }}}
- BaCO3+2HNO3⟶Ba(NO3)2+h3O+CO2↑{\displaystyle {\mathsf {BaCO_{3}+2HNO_{3}\longrightarrow \ Ba(NO_{3})_{2}+H_{2}O+CO_{2}\uparrow }}}
- BaCO3+2Ch4COOH⟶(Ch4COO)2Ba+h3O+CO2↑{\displaystyle {\mathsf {BaCO_{3}+2CH_{3}COOH\longrightarrow \ (CH_{3}COO)_{2}Ba+H_{2}O+CO_{2}\uparrow }}}
- При нагревании свыше 1400 °C разлагается:
- BaCO3⟶BaO+CO2↑{\displaystyle {\mathsf {BaCO_{3}\longrightarrow \ BaO+CO_{2}\uparrow }}}
- В отличие от карбоната кальция не образует гидрокарбонат под действием CO2 в водной среде.

Применяется в компонентах смесей для производства катодов различных электровакуумных приборов. Например, смесь «Radio Mix No. 3» от фирмы «J. T. Baker Chemical Co.» состоит на 57,3 % из карбоната бария, который при нагревании в вакууме разлагается до оксида бария.
Компонент шихты в производстве оптического стекла, эмалей, глазури и керамических изделий.
Карбонат бария используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Используется в качестве отравы для мышей
В России «барий углекислый технический» выпускается в соответствии с ГОСТ 2149-75.
Карбонат бария BaCO3 является умеренно-ядовитым веществом для крыс — ЛД50 составляет 418 мг/кг (при пероральном введении). Однако передозировка ионов бария Ba2+ в живых организмах явно небезопасна.[источник не указан 503 дня]
- Варламов В.А., Шехмейстер Е.И. Сборочные операции в электровакуумном производстве // М.
 : Высшая школа, 1974. — 360 с. С.316-317
: Высшая школа, 1974. — 360 с. С.316-317
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- Барий
- Нитрат бария
- Среднетоксичные вещества
- Зооциды
Карбонат, бария, Язык, Следить, Править, Текущая, версия, страницы, пока, не, проверялась, опытными, участниками, может, значительно, отличаться, от, версии, проверенной, июня, 2018, проверки, требуют, правок, Карбона, ба, рия, химическое, соединение, бариевая. Karbonat bariya Yazyk Sledit Pravit Tekushaya versiya stranicy poka ne proveryalas opytnymi uchastnikami i mozhet znachitelno otlichatsya ot versii proverennoj 23 iyunya 2018 proverki trebuyut 27 pravok Karbona t ba riya himicheskoe soedinenie barievaya sol ugolnoj kisloty Himicheskaya formula BaCO3 V prirode vstrechaetsya v vide minerala viterita Karbonat bariyaObshieSistematicheskoe naimenovanie Karbonat bariyaTradicionnye nazvaniya Karbonat bariya uglekislyj barij viteritHim formula BaCO3Rac formula BaCO3Fizicheskie svojstvaMolyarnaya massa 197 34 g molPlotnost 4 286 g sm Termicheskie svojstvaTemperatura razlozheniya gt 1400 CEntalpiya obrazovaniya 1211 kDzh molHimicheskie svojstvaRastvorimost v vode pri 20 C 0 0024 g 100 mlOpticheskie svojstvaPokazatel prelomleniya 1 60KlassifikaciyaReg nomer CAS 513 77 9PubChem 10563Reg nomer EINECS 208 167 3SMILES Ba 2 O C O OInChI InChI 1S Ch3O3 Ba c2 1 3 4 h h3 2 3 4 q 2 p 2AYJRCSIUFZENHW UHFFFAOYSA LRTECS CQ8600000Nomer OON 1564ChemSpider 10121BezopasnostLD50 418 mg kg krysy peroralno Toksichnost irritant srednetoksichenNFPA 704 021Privedeny dannye dlya standartnyh uslovij 25 C 100 kPa esli ne ukazano inoe Mediafajly na Vikisklade Obladaet umerenno toksicheskim dejstviem Mozhet ispolzovatsya v kachestve komponenta otravlennyh primanok Soderzhanie 1 Fizicheskie svojstva 2 Poluchenie 3 Himicheskie svojstva 4 Primenenie 5 Biologicheskaya rol 6 Primechaniya 7 Literatura 8 Sm takzheFizicheskie svojstva PravitUglekislyj barij BaCO3 predstavlyaet soboj bescvetnye kristally Do 810 C ustojchiva a modifikaciya s rombicheskoj reshyotkoj v intervale 810 960 C b modifikaciya s geksagonalnoj reshyotkoj svyshe 960 C g modifikaciya s kubicheskoj reshyotkoj Tpl 1555 C v atmosfere CO2 pod davleniem 45 MPa Ploho rastvorim v vode PR 8 10 9 pri 20 C Rastvorimost povyshaetsya v prisutstvii ionov ammoniya ili ugolnoj kisloty Obrazuet tverdye rastvory s CaCO3 i SrCO3 BaO C BaCl2 i BaTiO3 daet evtekticheskie smesi Poluchenie PravitV promyshlennosti obychno karbonat bariya poluchayut iz mineralnogo syrya krome togo vozmozhny sleduyushie himicheskie sposoby ego polucheniya Vzaimodejstvie BaS s CO2 ili Na2CO3 B a S N a 2 C O 3 B a C O 3 N a 2 S displaystyle mathsf BaS Na 2 CO 3 longrightarrow BaCO 3 downarrow Na 2 S Obmennaya reakciya rastvorimyh solej bariya ili gidroksida bariya s rastvorami karbonatov B a 2 C O 3 2 B a C O 3 displaystyle mathsf Ba 2 CO 3 2 longrightarrow BaCO 3 downarrow Himicheskie svojstva PravitReagiruet s razbavlennoj solyanoj azotnoj i uksusnoj kislotami B a C O 3 2 H C l B a C l 2 H 2 O C O 2 displaystyle mathsf BaCO 3 2HCl longrightarrow BaCl 2 H 2 O CO 2 uparrow B a C O 3 2 H N O 3 B a N O 3 2 H 2 O C O 2 displaystyle mathsf BaCO 3 2HNO 3 longrightarrow Ba NO 3 2 H 2 O CO 2 uparrow B a C O 3 2 C H 3 C O O H C H 3 C O O 2 B a H 2 O C O 2 displaystyle mathsf BaCO 3 2CH 3 COOH longrightarrow CH 3 COO 2 Ba H 2 O CO 2 uparrow Pri nagrevanii svyshe 1400 C razlagaetsya B a C O 3 B a O C O 2 displaystyle mathsf BaCO 3 longrightarrow BaO CO 2 uparrow V otlichie ot karbonata kalciya ne obrazuet gidrokarbonat pod dejstviem CO2 v vodnoj srede Primenenie PravitPrimenyaetsya v komponentah smesej dlya proizvodstva katodov razlichnyh elektrovakuumnyh priborov Naprimer smes Radio Mix No 3 ot firmy J T Baker Chemical Co sostoit na 57 3 iz karbonata bariya kotoryj pri nagrevanii v vakuume razlagaetsya do oksida bariya 1 2 Komponent shihty v proizvodstve opticheskogo stekla emalej glazuri i keramicheskih izdelij Karbonat bariya ispolzuetsya kak himicheskij standart dlya kalibrovki kalorimetrov po temperature i teploemkosti Ispolzuetsya v kachestve otravy dlya myshej V Rossii barij uglekislyj tehnicheskij vypuskaetsya v sootvetstvii s GOST 2149 75 Biologicheskaya rol PravitKarbonat bariya BaCO3 yavlyaetsya umerenno yadovitym veshestvom dlya krys LD50 sostavlyaet 418 mg kg pri peroralnom vvedenii Odnako peredozirovka ionov bariya Ba2 v zhivyh organizmah yavno nebezopasna istochnik ne ukazan 503 dnya Primechaniya Pravit US5422542A Low power pulsed anode magnetron for improving spectrum quality Google Patents Varlamov V A Shehmejster E I Sborochnye operacii v elektrovakuumnom proizvodstve M Vysshaya shkola 1974 360 s S 316 317Literatura PravitHimicheskaya enciklopediya Redkol Knunyanc I L i dr M Sovetskaya enciklopediya 1988 T 1 Abl Dar 623 s Sm takzhe PravitBarij Nitrat bariya Srednetoksichnye veshestva Zoocidy Istochnik https ru wikipedia org w index php title Karbonat bariya amp oldid 110089939, Википедия, чтение, книга, библиотека, поиск, нажмите,
истории
, книги, статьи, wikipedia, учить, информация, история, секс, порно, скачать, скачать, sex, seks, porn, porno, скачать, бесплатно, скачать бесплатно, mp3, видео, mp4, 3gp, jpg, jpeg, gif, png, картинка, музыка, песня, фильм, игра, игрыПолучение — карбонат — Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
Предложения по переработке сернистощелочных сточных вод в слабовосстановительных газовых средах с получением карбоната натрия [370, 377, 378] неприемлемы по экономическим и экологическим причинам. При получении соды вся сера, содержащаяся в сточных водах, переходит в дымовые газы. Переработка этих газов на элементную серу или серную кислоту экономически невыгодна ввиду низких концентраций SO2 в дымовых газах и малых масштабов выхода этих газов. Таким образом, вся сера сточных вод теряется.
[31]
При получении соды вся сера, содержащаяся в сточных водах, переходит в дымовые газы. Переработка этих газов на элементную серу или серную кислоту экономически невыгодна ввиду низких концентраций SO2 в дымовых газах и малых масштабов выхода этих газов. Таким образом, вся сера сточных вод теряется.
[31]
Карбонат калия ( поташ), К2С03, получают по методу Леблана ( см. выше о получении карбоната натрия), а также кальцинированием формиата калия или ионообменным способом. [32]
Какие условия ( температура, концентрация исходных растворов, порядок их сливания) должны быть выбраны при получении карбонатов цинка, никеля. Какой раствор, карбоната или гидрокарбоната натрия, следует взять при этом. [33]
Завод перерабатывает в сутки 10 т сульфида бария с соответствующим количеством соды и 35 т воды с целью получения карбоната бария и раствора сульфида натрия. Переработка ведется в пятиступенчатой противоточной батарее. Осадок карбоната бария во время процесса удерживает двойное ( по массе) количество воды. В результате переработки получается 10 % раствор сульфида натрия. Желательно добиться 98 % извлечения сульфида натрия. Определить: а) потерю сулр фида натрия в остатке, б) количество воды, которое необходимо добавить в качестве растворителя, в) концентрации в каждом сгустителе.
[34]
Осадок карбоната бария во время процесса удерживает двойное ( по массе) количество воды. В результате переработки получается 10 % раствор сульфида натрия. Желательно добиться 98 % извлечения сульфида натрия. Определить: а) потерю сулр фида натрия в остатке, б) количество воды, которое необходимо добавить в качестве растворителя, в) концентрации в каждом сгустителе.
[34]
Завод перерабатывает в сутки 10 т сульфида бария с соответствующим количеством соды и 35 т воды с целью получения карбоната бария и раствора сульфида натрия. Переработка ведется в пятиступенчатой противоточной батарее. Осадок карбоната бария во время процесса удерживает двойное ( по массе) количество воды. В результате переработки получается 10 % раствор сульфида натрия. Желательно добиться 98 % — го извлечения сульфи-ла натрия. Определить: а) потерю сульфида натрия в остатке; б) 1 количество воды, которое необходимо добавить в качестве растворителя; в) концентрации в каждом сгустителе. [35]
[35]
Другой способ заключается в применении гидроокиси магния с углекислотой, бикарбонатом кальция или бикарбонатом магния, которые могут присутствовать в воде или их можно добавлять для получения карбоната магния, который поглощает кремнекислоту. Удаление растворенной кремнекислоты более затруднительно и способы ее удаления в настоящее время находятся в стадии изучения. [36]
Образовавшийся в результате этой реакции бикарбонат натрия, как менее растворимая соль, выпадает из раствора в виде кристаллического осадка, после чего отфильтровывается и подвергается прокаливанию ( кальцинации) согласно реакции ( 2) для получения карбоната натрия — кальцинированной соды. [37]
Еще в древние времена было известно моющее действие золы растений, которое-связано с присутствием в ней карбоната калия. Получение карбоната калия из древесной золы было известно уже древним грекам и римлянам, однако они не отличали полученную таким образом соль от встречающейся в природе соды. [38]
[38]
Еще в древние времена было известно моющее действие золы растений, которое связано с присутствием в ней карбоната калия. Получение карбоната калия из древесной золы было известно уже древним грекам и римлянам, однако они не отличали полученную таким образом соль от встречающейся в природе соды. Алхимики готовили чистый карбонат калия прокаливанием виннокаменной соли КК ЩОд, а позднее путем сжигания ее с селитрой. [39]
Еще в нревние времена было известно моющее действие золы растений, которое связано с присутствием в ней карбоната калия. Получение карбоната калия из древесной золы было известно уже древним грекам и римлянам, однако они не отличали полученную таким образом соль от встречающейся в природе соды. Алхимики готовили чистый карбонат калия прокаливанием виннокаменной соли КНС4Н4Ов, а позднее путем сжигания ее с селитрой. [40]
Написать уравнения реакций получения карбоната и бикарбоната кальция, учитывая, что во второй реакции кроме двуокиси углерода принимает участие вода. [41]
[41]
Ответить на поставленный по ходу работы вопрос. Написать уравнения реакций получения карбоната и бикарбоната кальция, учитывая, что во второй реакции, кроме углекислого газа, принимает участие вода. [42]
Известно, что по аммиачно-хлоридному способу производства соды раствор хлористого натрия, насыщенный аммиаком, подвергается карбонизации с помощью двуокиси углерода, что приводит к образованию бикарбоната натрия, который выпадает в осадок и отделяется фильтрацией. Бикарбонат далее прокаливается для получения карбоната натрия, в то время как маточный раствор после кристаллизации бикарбоната подвергается переработке с целью регенерации аммиака. Водный маточный раствор содержит в основном хлорид аммония, но если конверсия хлористого натрия неполная, то он также присутствует в растворе в достаточно большом количестве. В маточном растворе присутствует в незначительном количестве свободный аммиак и его летучие соединения, например бикарбонат и карбонат аммония, а также некоторые примеси из исходного раствора. [43]
[43]
В основе метода лежит получение карбонатов щелочных металлов с последующим переводом в сульфаты, которые являются весовой формой. Метод может быть применен для определения содержания щелочных металлов в силикатах. [44]
Например, такая кривая показывает, что кристаллогидрат оксалата кальция СаС2О4 — Н2О устойчив лишь при температуре не выше 100 С. Последняя при 420 С разлагается с получением карбоната кальция СаСОз. Далее при 660 С начинается распад карбоната на окись кальция и двуокись угле — рода. Этот процесс заканчивается при температуре 840 С. [45]
Страницы: 1 2 3 4
ФС.2.2.0001.15 Бария сульфат | Фармакопея.рф
Содержимое (Table of Contents)
- 1 ФС.2.2.0001.15 Бария сульфат
- 1.1 Описание
- 1.2 Растворимость
- 1.3 Подлинность
- 1.4 Кислотность или щелочность
- 1.5 Кислоторастворимые вещества
- 1.
 6 Растворимые соли бария
6 Растворимые соли бария - 1.7 Сульфиды
- 1.8 Хлориды
- 1.9 Сульфаты
- 1.10 Железо
- 1.11 Фосфаты
- 1.12 Сульфиты и другие восстанавливающие вещества
- 1.13 Тяжелые металлы
- 1.14 Мышьяк
- 1.15 Микробиологическая чистота
- 1.16 Количественное определение
- 1.17 Хранение
- 1.17.1 Поделиться ссылкой:
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Бария сульфат ФС.2.2.0001.15
Бария сульфат Взамен ГФ XII, ч.1, ФС 42-0222-07;
Barii sulfas взамен ФС 1222-97
Сульфат бария
BaSO4 М. м. 233,39
м. 233,39
Cодержит не менее 97,5 % бария сульфата BaSO4.
ОписаниеБелый или почти белый порошок.
РастворимостьПрактически не растворим в воде, разведенных кислотах и щелочах и органических растворителях.
Подлинность- Качественная реакция. 1 г субстанции кипятят в течение 5 мин с 10 мл раствора натрия карбоната. Осадок отфильтровывают и промывают 10 мл воды. Охлажденный фильтрат, нейтрализованный хлористоводородной кислотой разведенной 8,3 %, дает характерную реакцию на сульфаты. Определение проводят в соответствии с ОФС «Общие реакции на подлинность».
- Качественная реакция. Осадок на фильтре обрабатывают 5 мл хлористоводородной кислоты разведенной 8,3 % и фильтруют. К фильтрату прибавляют 1 мл серной кислоты разведенной 16 %; должен образоваться белый осадок.
5 г субстанции нагревают на водяной бане в течение 5 мин с 20 мл воды. После охлаждения раствор фильтруют. К 10 мл фильтрата прибавляют 0,05 мл 0,05 % раствора бромтимолового синего; окраска раствора должна изменяться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или 0,01 М раствора хлористоводородной кислоты.
После охлаждения раствор фильтруют. К 10 мл фильтрата прибавляют 0,05 мл 0,05 % раствора бромтимолового синего; окраска раствора должна изменяться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или 0,01 М раствора хлористоводородной кислоты.
20 г субстанции кипятят в течение
5 мин со смесью 90 мл воды и 10 мл уксусной кислоты ледяной. Охлаждают, доводят объем раствора до первоначального и фильтруют. 25 мл фильтрата упаривают сначала на водяной бане, а затем высушивают при температуре от 100 до 105 ºС до постоянной массы. Масса полученного осадка не должна превышать 0,015 г (не более 0,3 %).
К 10 мл фильтрата, полученного в испытании на «Кислоторастворимые вещества», прибавляют 1 мл серной кислоты разведенной 16 %.
Через 1 ч опалесценция раствора должна быть не более опалесценции смеси 10 мл того же фильтрата и 1 мл воды.
Сульфиды10 г субстанции кипятят со смесью 30 мл воды и 10 мл хлористоводородной кислоты 25 %, закрыв колбу бумагой, смоченной раствором свинца(II) ацетата; бумага в течение 5 мин не должна темнеть.
Не более 0,02 % (ОФС «Хлориды»). 1 г субстанции кипятят в течение 5 мин с 20 мл свежепрокипяченной воды и фильтруют. К фильтрату прибавляют 80 мл воды. Для определения отбирают 10 мл полученного раствора.
СульфатыНе более 0,1% (ОФС «Сульфаты»). Для определения отбирают 10 мл раствора, полученного в испытании «Хлориды».
ЖелезоНе более 0,003 % (ОФС «Железо»). 2 г субстанции нагревают до кипения со смесью 5 мл хлористоводородной кислоты 25 % и 15 мл воды и фильтруют. Для анализа отбирают 10 мл фильтрата.
Фосфаты2 г субстанции нагревают до кипения с 10 мл азотной кислоты и после охлаждения фильтруют. К фильтрату прибавляют 5 мл 10 % раствора аммония молибдата; в течение 1 ч не должен образовываться желтый осадок.
Сульфиты и другие восстанавливающие вещества1 г субстанции смешивают с 10 мл воды, прибавляют 1 мл серной кислоты разведенной
16 % и 0,1 мл 0,1 % раствора калия перманганата; в течение 10 мин не должно наблюдаться обесцвечивание раствора.
Не более 0,001% (ОФС «Тяжёлые металлы»). Для анализа отбирают 10 мл фильтрата, полученного в испытании «Кислоторастворимые вещества».
МышьякНе более 0,00005 % с использованием 1 г субстанции (ОФС «Мышьяк»).
Микробиологическая чистотаВ соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определениеОколо 2 г (точная навеска) субстанции кипятят при перемешивании со 100 мл хлористоводородной кислоты 25 % в течение 15 мин. Осадок количественно переносят на двойной фильтр «синяя лента» и промывают горячей водой до отрицательной реакции на хлориды. Фильтр с осадком переносят во взвешенный тигель, осторожно озоляют, прокаливают при температуре 800 – 850 ºС до постоянной массы и взвешивают. Масса должна составить не менее 97,5 % от исходной.
ХранениеВ хорошо укупоренной упаковке.
Скачать в PDF ФС. 2.2.0001.15 Бария сульфат
2.2.0001.15 Бария сульфат
Карбонат бария – свойства, применение и метод производства
Что такое карбонат бария?
Карбонат бария белого цвета представляет собой твердый элемент, который выпадает в осадок из раствора гидроксида бария и мочевины. Его химическая формула указана как BaCO3. Карбонат бария, как правило, токсичен по своей природе и существует в других формах, таких как минеральная форма, называемая витеритом, и его также можно получить из баритов с помощью осаждения. Его также можно увидеть в глазури бирюзы. При работе с этим химическим соединением рекомендуется принимать надлежащие защитные меры, поскольку его высокая токсичность — это то, с чем вам не следует связываться. Его следует строго хранить при низком качестве, желательно ниже 20%. Он также известен как монокарбонат бария 9.0005
Формула карбоната бария — BACO3
Baco3 | 9000 | ||||||||||||
Молис. | 4.29 г/см3 | ||||||||||||
Печата плавления | 811 ℃ | ||||||||||||
. Точка для кипения | |||||||||||||
.0005 | 1,360 ℃ | ||||||||||||
Chemical Formula | BaCO3 | ||||||||||||
Solubility | 0.02 g/l | ||||||||||||
Form | Solid Powder | ||||||||||||
Color | White | ||||||||||||
Запах | .0003
В приведенной выше таблице приведены физические свойства карбоната бария. Структура BaCO3/карбоната бария(Изображение будет добавлено в ближайшее время) Химические свойства карбоната бария — BaCO3BaCO3 + CaSO4 → CaCO3 + BaSO4 BaCO3 + 2HCl → BaCl2 + h30 + CO2 85 Различные области применения Карбонат бария — BaCO 3
Метод производства BaCO3
Процесс производства BaCO3 с помощью процесса карбонизации включает следующее:
Химическая реакция BaS + CO2 + h3O → BaCO3↓+ h3S↑
В методе метатезиса сульфид бария и карбонат аммония вступают в реакцию метатезиса, в результате которой образуется карбонат бария. Затем конечный продукт промывают, фильтруют и сушат для получения продуктов висмута. Химическая реакция BaS + (Nh5) 2CO3 → BaCO3 ↓ + (Nh5) 2S
В этом процессе растворимая соль бария получается путем взаимодействия витерита с солью аммония. Полученный карбонат аммония рециркулируют для повторного использования. Этот карбонат аммония затем добавляют в растворимый раствор бария, полученный ранее, для осаждения карбоната бария в очищенной форме. Полученный BaCO3 затем фильтруют и сушат для получения продуктов на основе карбоната бария. Химическая реакция BaCl2 + Nh5HCO3 + Nh5OH → BaCO3 ↓ + 2Nh5Cl + h3O
Процесс происходит следующим образом: Карбонат бария, полученный из сильных осадков, просеивают и помещают на склад сырья. Затем его хорошо перемешивают, перемешивают и затем дегазируют. Полуфабрикаты подвергаются ножевому импульсному пневматическому транспортированию, которое подается в вибрационный питатель на сито. Гранулятор выпускает карбонат бария в виде частиц размером более 20 меш.
В этом методе используется система осаждения для фильтрации осадка, содержащего воду, богатую барием, в процессе производства. Осадок на фильтре должен иметь возможность контролировать содержание воды на уровне около 20%. Затем материал проходит через вращающиеся лопасти и быстро перемешивается. Затем его замешивают и перемешивают с образованием полуплотных частиц/влажных гранул. Интересный факт: Карбонат бария или BaCO3 также называют вайтритом по имени Уильяма Уизеринга, который открыл этот белый минерал в 1784 году из баритов. Обычно он встречается в жилах свинцовых руд и встречается в природе в нескольких местах. Получение, свойства и применение карбоната барияКарбонат бария с формулой BaCO3 представляет собой щелочь и неорганическое соединение, которое находится в порошкообразной форме, нерастворимо в воде и токсично по своей природе. Также называемая монокарбонатом бария , эта белая кристаллическая соль, без сомнения, является одним из наиболее важных существующих соединений бария и встречается в природе в ограниченных количествах. Карбонат бария можно получить различными способами, включая осаждение баритов и осаждение раствора мочевины и гидроксида бария. Между тем, этот белый кристалл существует в природе в виде витерита, названного в честь Уильяма Уизеринга — человека, который нашел белый минерал из баритов в экспериментах, которые он проводил на Terra Ponderosa — гигантской металлической руде в 1784 году. Получение карбоната бария 1. Карбонат бария можно получить с помощью процесса кальцинированной соды, который включает обработку водного раствора сульфида бария карбонатом натрия. BaS + h3O + CO2 = BaCO3 + h3S 2. Карбонат бария можно получить, используя процесс метатезиса, который включает реакцию метатезиса карбоната аммония и сульфида бария с получением карбоната бария. Продукты висмута далее получают, когда результат этой реакции должным образом промыт и высушен. BaS + (Nh5) 2CO3 = BaCO3 + (Nh5) 2S 3. Карбонат бария также можно получить методом карбонизации. В этом процессе диоксид углерода (CO2) пропускают через раствор сульфида бария для усиления его карбонизации, а затем получают суспензию карбоната бария, которую затем промывают для удаления содержащейся в ней серы, затем подвергают вакуумной фильтрации и затем сушат при температуре 300°C для удаления влаги. Затем его измельчают для получения твердой порошкообразной формы карбоната бария. BaS + CO2 + h3O = BaCO3 + h3S 4. Карбонат бария может быть получен методом влажной грануляции, который включает осаждение фильтрационной лепешки, полученной при производстве кека. Этот материал должен иметь 20% водорегулирующую способность. Материал быстро перемешивают, разделяют на отдельные части, а затем прессуют с образованием влажных окатышей, которые нагревают до 800-1200°С с добавлением в печь железной руды и флюсов. 5. Карбонат бария также можно получить в процессе преобразования ядовитого нефелина. В этом методе витерит реагирует с солью аммония с образованием растворимой соли бария и в процессе образует карбонат аммония, который затем добавляется к первоначально полученной растворимой соли бария для получения очищенного порошкообразного карбоната бария, который затем сушат и фильтруют для получения других Продукты на основе BaCO3. BaCl2 + Nh5HCO3 + Nh5OH = BaCO3 + 2Nh5Cl + h3O 6. Карбонат бария также может быть получен путем сухой грануляции, восстановления барита с использованием метана, сжигания геля и путем осаждения раствора мочевины и гидроксида бария. Химические свойства карбоната бария Карбонат бария реагирует с соляной кислотой с образованием хлорида бария, двуокиси углерода и воды. BaCO3 + 2 HCl = BaCl2 + CO2 + h3O Карбонат бария подвергается пиролизу с образованием оксида бария и пероксида бария. Карбонат бария реагирует с растворимыми солями кальция с образованием сульфата бария и карбоната кальция. BaCO3 + CaSO4 = BaSO4 + CaCO3 Физические свойства карбоната бария Карбонат бария представляет собой белый кристаллический порошок без запаха и вкуса. Он нерастворим в метаноле, серной кислоте и воде и растворим в большинстве кислот. Имеет плотность 4,29 г/см3 и молярную массу 197,34 г/моль. Он плавится при 811°C (1492°F), кипит при 1450°C (2640°F). Использование карбоната бария • Используется для удаления сульфатных примесей в хлорно-щелочном процессе. • Используется в качестве флюса. • Используется в производстве термисторов PTC. • Используется в качестве компонента при получении соединений, таких как ферриты. • Используется как матирующее средство. • В керамической промышленности используется в качестве компонента при производстве глазури. • Используется в качестве агента кристаллизации. • Добавляется к другим соединениям, таким как сульфат магния и сульфат кальция, для образования высолов в кирпичной промышленности. • Используется в коммерческих целях в эмалевой и фотоиндустрии. • Используется в производстве оптоволокна и специального стекла. • Используется как родентицид. • Используется для бурения нефтяных скважин. • Используется в производстве конденсаторов. • Используется в производстве магнитных компонентов. • Используется в качестве ингредиента в лакокрасочной промышленности. • Он смешивается с другими цветными оксидами для получения редких цветов, которые невозможно получить другими способами. Проблемы со здоровьем Карбонат бария — очень токсичное вещество, с которым не следует шутить. Вы должны стараться использовать защитную одежду и очки при работе с этой солью, чтобы избежать несчастных случаев, и после прикосновения к ней убедитесь, что ваши руки должным образом вымыты, прежде чем есть или пить. Его сходство с мукой привело к большому количеству отравлений барием, а также были подняты вопросы по поводу его использования в производстве керамики, поэтому он имеет тенденцию выщелачиваться из глазури в пищу. Теги: Карбонат бария, химикаты, химия, элементы, органические соединения, фармацевтика, Получение карбоната бария, Применение карбоната бария ГЕОГРАФИЧЕСКИЕ НАЗВАНИЯ |
| Медицинское предупреждение! Эта статья взята из Британской энциклопедии 1911 года. Медицинская наука сделала много скачков вперед с тех пор, как она была написана. Это не сайт для медицинских консультаций, когда вам нужна информация о состоянии здоровья, вместо этого обратитесь к профессионалу. |
БАРИЙ (символ Ba, атомный вес 137,37 [0=,6]), один из металлических химических элементов, входящих в группу щелочноземельных металлов. Он получил свое название от греческого f3apvs (тяжелый) из-за его присутствия в барите или тяжелом шпате, который впервые был исследован в 1602 г.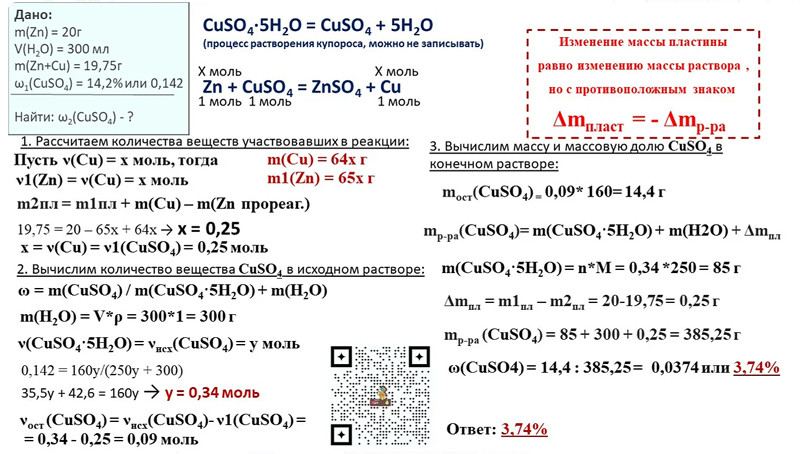 В. Касциоролом, сапожником из Болоньи, который обнаружил, что после воспламенения горючими веществами он фосфоресцирует, и по этой причине его часто называли болонским фосфором. В 1774 г. К. В. Шееле при исследовании образца пиролюзита обнаружил в минерале новое вещество, так как при обработке серной кислотой оно давало нерастворимую соль, которая впоследствии оказалась идентичной соли, содержащейся в тяжелом шпате. Барий встречается главным образом в виде барита или тяжелого шпата BaS 0 4 и визерита BaCO 3 и в меньшей степени в баритокальците, баритоцелестине и различных сложных силикатах. Металл трудно выделить, и до недавнего времени можно было сомневаться, был ли получен чистый металл. Сэр Х. Дэви пытался провести электролиз барита, но безуспешно; позже им были предприняты попытки использовать хлорид бария в присутствии ртути. Таким образом он получил амальгаму, из которой при отгонке ртути был получен барий в виде серебристо-белого остатка. Р. Бунзен в 1854 г. провел электролиз густой пасты из хлористого бария и разбавленной соляной кислоты в присутствии ртути при 10° С, получив амальгаму бария, из которой методом перегонки была выделена ртуть.
В. Касциоролом, сапожником из Болоньи, который обнаружил, что после воспламенения горючими веществами он фосфоресцирует, и по этой причине его часто называли болонским фосфором. В 1774 г. К. В. Шееле при исследовании образца пиролюзита обнаружил в минерале новое вещество, так как при обработке серной кислотой оно давало нерастворимую соль, которая впоследствии оказалась идентичной соли, содержащейся в тяжелом шпате. Барий встречается главным образом в виде барита или тяжелого шпата BaS 0 4 и визерита BaCO 3 и в меньшей степени в баритокальците, баритоцелестине и различных сложных силикатах. Металл трудно выделить, и до недавнего времени можно было сомневаться, был ли получен чистый металл. Сэр Х. Дэви пытался провести электролиз барита, но безуспешно; позже им были предприняты попытки использовать хлорид бария в присутствии ртути. Таким образом он получил амальгаму, из которой при отгонке ртути был получен барий в виде серебристо-белого остатка. Р. Бунзен в 1854 г. провел электролиз густой пасты из хлористого бария и разбавленной соляной кислоты в присутствии ртути при 10° С, получив амальгаму бария, из которой методом перегонки была выделена ртуть. А. Н. Гунц ( Comptes rendus, 1901, 133, с. 872) проводит электролиз насыщенного раствора хлорида бария с ртутным катодом и получает 3%-ную амальгаму бария; эту амальгаму переносят в железную лодку в широкой фарфоровой трубке и трубку медленно нагревают электрическим током, при этом хороший выход чистого бария получается при температуре около 100°С. Свежевырезанный металл обладает серебристо-белым блеском, немного тверже свинца. , и чрезвычайно легко окисляется при воздействии; он растворим в жидком аммиаке и легко воздействует как на воду, так и на спирт.
А. Н. Гунц ( Comptes rendus, 1901, 133, с. 872) проводит электролиз насыщенного раствора хлорида бария с ртутным катодом и получает 3%-ную амальгаму бария; эту амальгаму переносят в железную лодку в широкой фарфоровой трубке и трубку медленно нагревают электрическим током, при этом хороший выход чистого бария получается при температуре около 100°С. Свежевырезанный металл обладает серебристо-белым блеском, немного тверже свинца. , и чрезвычайно легко окисляется при воздействии; он растворим в жидком аммиаке и легко воздействует как на воду, так и на спирт.
Известны три оксида бария, а именно моноксид ВаО, диоксид ВаО2 и субоксид, получаемые нагреванием ВаО с магнием в вакууме до 110° (Guntz, , loc. cit., 1906, p. 359). Монооксид образуется при горении металла на воздухе, но обычно его получают при воспламенении выделяющихся нитратов, кислорода и оксидов азота. Он также может быть получен прокаливанием однородной смеси карбоната и углерода, а также в небольших количествах прокаливанием йодата. Это твердое вещество сероватого цвета, которое очень энергично соединяется с водой с образованием гидроксида, причем во время соединения выделяется много тепла; при нагревании докрасна в токе кислорода он соединяется с кислородом с образованием двуокиси, которая при более высоких температурах снова распадается на моноокись и кислород.
Это твердое вещество сероватого цвета, которое очень энергично соединяется с водой с образованием гидроксида, причем во время соединения выделяется много тепла; при нагревании докрасна в токе кислорода он соединяется с кислородом с образованием двуокиси, которая при более высоких температурах снова распадается на моноокись и кислород.
Гидроксид бария, Ba(OH) 2 , представляет собой белый порошок, который можно получить гашением монооксида необходимым количеством воды, но обычно его получают в больших масштабах путем нагревания тяжелого шпата с мелким углем, при этом сырой барий получается сульфид. Затем этот сульфид нагревают в токе влажного углекислого газа, при этом образуется карбонат бария, BaS+H 2 O+CO 2 =BaCO 3 +H 2 S, и, наконец, карбонат разлагается в токе перегретого пара, BaCO3+h3O. = Ba(OH) 2 + CO 2 , оставляя остаток гидроксида. Это белый порошок, умеренно растворимый в холодной воде, хорошо растворимый в горячей воде, раствор имеет щелочную реакцию и легко поглощает углекислый газ. Решение, известное как барит-вода, находит широкое применение в практической химии, применяясь в газоанализе для определения количества углекислого газа в атмосфере; а также используется в органической химии в качестве гидролизующего агента при разложении сложных уреидов и замещенных ацетоуксусных эфиров, а Э. Фишер использовал его в качестве конденсирующего агента при получении а и О-акрозы из акролеиндибромида. Насыщенный раствор гидроксида осаждается при охлаждении в виде гидратированного Ва(ОН) 2,8Н 2 О в виде бесцветных квадратных призм, которые на воздухе теряют семь молекул кристаллизационной воды.
Решение, известное как барит-вода, находит широкое применение в практической химии, применяясь в газоанализе для определения количества углекислого газа в атмосфере; а также используется в органической химии в качестве гидролизующего агента при разложении сложных уреидов и замещенных ацетоуксусных эфиров, а Э. Фишер использовал его в качестве конденсирующего агента при получении а и О-акрозы из акролеиндибромида. Насыщенный раствор гидроксида осаждается при охлаждении в виде гидратированного Ва(ОН) 2,8Н 2 О в виде бесцветных квадратных призм, которые на воздухе теряют семь молекул кристаллизационной воды.
Двуокись бария BaO2 можно получить, как показано выше, или в гидратированном состоянии добавлением избытка баритовой воды к раствору пероксида водорода, когда он осаждается в кристаллическом состоянии в виде BaO 2,8H 2 O. Эти кристаллы при нагревании до 130°С теряют кристаллизационную воду и оставляют остаток безводного пероксида. В процессе Брина для производства кислорода диоксид бария получают в качестве промежуточного продукта путем нагревания монооксида бария с воздухом под давлением. Это порошок серого цвета, который легко разлагается разбавленными кислотами с образованием перекиси водорода.
Это порошок серого цвета, который легко разлагается разбавленными кислотами с образованием перекиси водорода.
Хлорид бария, BaCl 2.2H 2 O, может быть получен растворением визерита в разбавленной соляной кислоте, а также из тяжелого шпата прокаливанием в отражательной печи со смесью угля, известняка и хлорида кальция, при этом хлорид бария извлекают из расплавленную массу водой, оставляя осадок нерастворимого сульфида кальция. Хлорид кристаллизуется в виде бесцветных ромбических табличек с удельным весом 3,9, хорошо растворим в воде, но почти нерастворим в концентрированной соляной кислоте и абсолютном спирте. Его можно получить в безводном состоянии при осторожном нагревании примерно до 120°С. Он имеет горький вкус и является сильным ядом. Бромид бария получают насыщением барита водой или разложением карбоната бария бромистоводородной кислотой. Он кристаллизуется в виде BaBr 2.2H 2 O, изоморфного хлориду бария. Бромат бария Ва(ВгО3)2 можно получить действием избытка брома на баритовую воду или разложением кипящего водного раствора 10 частей бромата калия таким же раствором 74 частей кристаллизованного хлорида бария. Он кристаллизуется в моноклинной системе и выделяется из водного раствора в виде Ba(BrO3)2.h3O. При нагревании начинает разлагаться при 260—265° С. Хлорат бария Ва(С103)2 получают добавлением хлорида бария к раствору хлората натрия; при концентрировании раствора сначала выделяется хлорид натрия, а затем при дальнейшем выпаривании выкристаллизовывается хлорат бария, который можно очистить перекристаллизацией. Его также можно получить, взвесив карбонат бария в кипящей воде и пропуская хлор. Он кристаллизуется в моноклинных призмах состава Ва(С10 3) 2 Н 2 О и начинает разлагаться при нагревании до 250°С. Иодат бария Ва(103)2 получают действием избытка иодной кислоты на горячие раствором едкого барита или добавлением йодата натрия к раствору хлорида бария. Он кристаллизуется в моноклинных призмах состава Ba(103) 2 H 2 O и очень мало растворим в холодной воде.
Он кристаллизуется в моноклинной системе и выделяется из водного раствора в виде Ba(BrO3)2.h3O. При нагревании начинает разлагаться при 260—265° С. Хлорат бария Ва(С103)2 получают добавлением хлорида бария к раствору хлората натрия; при концентрировании раствора сначала выделяется хлорид натрия, а затем при дальнейшем выпаривании выкристаллизовывается хлорат бария, который можно очистить перекристаллизацией. Его также можно получить, взвесив карбонат бария в кипящей воде и пропуская хлор. Он кристаллизуется в моноклинных призмах состава Ва(С10 3) 2 Н 2 О и начинает разлагаться при нагревании до 250°С. Иодат бария Ва(103)2 получают действием избытка иодной кислоты на горячие раствором едкого барита или добавлением йодата натрия к раствору хлорида бария. Он кристаллизуется в моноклинных призмах состава Ba(103) 2 H 2 O и очень мало растворим в холодной воде.
Карбид бария, BaC2, получают методом, подобным тому, который используется для получения карбида кальция (см. Ацетилен). Л. Макенн также получил его путем перегонки смеси амальгамы бария и угля в токе водорода. Сульфид бария, BaS, получают пропусканием сероводорода над нагретым монооксидом бария или, лучше, сплавлением сульфата с мелким углем. Это белый порошок, который легко разлагается водой с образованием гидроксида и гидросульфида. Фосфоресценция сульфида, полученного при нагревании тиосульфата, значительно увеличивается при добавлении урана, висмута или тория перед воспламенением пр. Chem., 1905, ii. п. 196).
Сульфид бария, BaS, получают пропусканием сероводорода над нагретым монооксидом бария или, лучше, сплавлением сульфата с мелким углем. Это белый порошок, который легко разлагается водой с образованием гидроксида и гидросульфида. Фосфоресценция сульфида, полученного при нагревании тиосульфата, значительно увеличивается при добавлении урана, висмута или тория перед воспламенением пр. Chem., 1905, ii. п. 196).
Сульфат бария, BaSO 4 , является наиболее распространенным из встречающихся в природе соединений бария (см. Бариты) и может быть получен искусственно добавлением серной кислоты или любого растворимого сульфата к раствору растворимой соли бария при его осаждении в виде аморфного белого порошка с удельным весом 4,5. Он практически нерастворим в воде и очень мало растворим в разбавленных кислотах; он до некоторой степени растворим в свежеприготовленном виде в горячей концентрированной серной кислоте, и при охлаждении раствора выпадают кристаллы состава BaSO 4 H 2 SO 4 . Используется в качестве пигмента под названием «перманентный белый» или белый фикс. Нитрид бария Ba 3 N 2 получают в виде коричневатой массы пропусканием азота над нагретой амальгамой бария. Разлагается водой с выделением водорода, а при нагревании в токе угарного газа образует цианистый барий (Л. Макенн). Амид бария Ba(NH 2 ) 2 получают из калия и бромида бария.
Используется в качестве пигмента под названием «перманентный белый» или белый фикс. Нитрид бария Ba 3 N 2 получают в виде коричневатой массы пропусканием азота над нагретой амальгамой бария. Разлагается водой с выделением водорода, а при нагревании в токе угарного газа образует цианистый барий (Л. Макенн). Амид бария Ba(NH 2 ) 2 получают из калия и бромида бария.
Нитрат бария, Ba(N03)2, получают растворением карбоната или сульфида в разбавленной азотной кислоте или смешиванием горячих насыщенных растворов хлорида бария и нитрата натрия. Он кристаллизуется в октаэдрах с удельным весом 3,2 и плавится при 597°С (Т. Карнелли). Он разлагается под действием тепла и широко используется в пиротехнике для приготовления зеленого огня. Карбонат бария BaCO 31 встречается довольно широко в виде витерита и может быть получен добавлением хлорида бария к горячему раствору карбоната аммония, при этом он осаждается в виде плотного белого порошка с удельным весом 4,3; почти нерастворим в воде.
Барий и его соли легко обнаруживаются по желтовато-зеленой окраске, которую они дают при увлажнении соляной кислотой и нагревании в пламени Бунзена, или по наблюдению их спектров, когда видны две характерные зеленые линии. В растворе соли бария можно обнаружить по немедленному осадку, который они дают при прибавлении сульфата кальция (это позволяет отличить соли бария от солей кальция), и по желтому осадку хромата бария, образующемуся при прибавлении хромата калия. Количественно барий определяют в пересчете на сульфат. Атомный вес элемента был определен К. Мариньяком путем превращения хлорида бария в сульфат бария, а также путем определения количества серебра, необходимого для осаждения точно известного веса хлорида; полученное среднее значение равно 136,84; Т. В. Ричардс ( Цайт. анорг. хим., 1893, 6, с. 89), определив эквивалент хлорида и бромида бария серебру, получил значение 137,44. Об отношении бария к радию см. Радиоактивность.
Купить Карбонат бария
Карбонат бария, паспорт безопасности
Применение
Карбонат бария представляет собой химическое соединение, которое широко используется в керамической промышленности в керамических глазурях. Он ведет себя как флюс, который является кристаллизующим и матирующим агентом и соединяется с определенными красящими оксидами для получения уникальных цветов, которые нелегко получить другими средствами. Однако некоторые утверждают, что карбонат бария может попасть из глазури в любую еду или напиток в керамическом контейнере.
Он ведет себя как флюс, который является кристаллизующим и матирующим агентом и соединяется с определенными красящими оксидами для получения уникальных цветов, которые нелегко получить другими средствами. Однако некоторые утверждают, что карбонат бария может попасть из глазури в любую еду или напиток в керамическом контейнере.
В целях безопасности карбонат бария часто используется в форме фритты. В производстве плитки, фаянса, кирпича и гончарных изделий карбонат бария используется в качестве добавки к глинам для осаждения растворимых солей, таких как сульфаты кальция и магния, которые вызывают высолы. Карбонат бария также используется в производстве цемента, производстве фарфора и стекла, а в прошлом он использовался для рафинирования сахара. Он также используется в крысиный яд.
Подробнее
Другие названия: Витерит, монокарбонат бария, угольная кислота, соль бария.
CAS: 513-77-9
Внешний вид: Тонкий белый порошок без запаха
Растворимость: Нерастворим в воде
Натуральный или синтетический: Природный встречается в жилах свинцовой руды.
Рекомендуемый срок годности при повторных испытаниях: Неопределенный срок в герметичном контейнере
Хранение: Прохладный, темный, сухой, плотно закрытый.
Меры предосторожности
Не для приема внутрь. Для борьбы с вредителями
Кто мыловары?
Мы с гордостью представляем разнообразный и
широкий выбор расходных материалов для изготовления мыла, включая формы для мыла
, а также https://www.soapgoods.com/soap-base-c-23.html
target=» _blank»>растопить и залить мыльную основу.
Вы ищете что-то уникальное, что трудно найти? Интересно
Где купить СТПП? Мы
фантастический источник!
У нас есть все это и много других фантастических
но трудно найти товары по отличным оптовым ценам, мы
универсальный магазин, вы можете найти здесь все, что вам нужно, даже сорбиновую кислоту оптом. Прямо здесь, по телефону
Мыловары
Мы знаем, что у вас есть выбор, поэтому мы
работаем усерднее, обеспечивая лучшее качество, более быструю доставку и широкий
выбор изделий практичных размеров для любого применения. Когда вам
Когда вам
нужно совершить покупку и вам нужна быстрая доставка, обратитесь к нам, чтобы
предоставить вам необходимую услугу. У нас даже есть оптовый сорбитанстеарат,
в малых и больших размерах, в любом случае, вы можете получить наши лучшие
напрямую по потребительским ценам. Кроме того, мы отправляем его в следующий рабочий день
дней. и отправим на следующий рабочий день.
Где еще
можно делать все покупки в одном месте? Когда вам нужно сделать
покупку и получить ее быстро. Купить порошок спирулины? Правильно
здесь
Если вы ищете качественные средства личной гигиены
, косметику и мыло»>https://www.soapgoods.com/»>мыловарение
расходных материалов, обязательно посетите наш интернет-магазин стеариновой кислоты. Наслаждайтесь
нашими высококачественными ингредиентами и сверхбыстрой доставкой.
Прочитайте наши Реальные обзоры от Google и Bizrate
100% Реальные обзоры
(мы не можем редактировать, создавать или удалять обзоры) От Google, нажмите
здесь -> Real SoapGoods Reviews
Посмотреть больше реальных отзывов (мы не можем редактировать, создавать или
удалить отзывы) из отзывов стороннего наблюдателя Bizrate Real SoapGoods Reviews (нажмите здесь и
Прокрутите вниз)
Прочтите сотни реальных отзывов
за более чем десятилетний опыт работы. SoapGoods»>https://www.soapgoods.com/index.php?dispatch=discu…
SoapGoods»>https://www.soapgoods.com/index.php?dispatch=discu…
Отзывы.
Как быстро я могу получить Это?
Мы гарантируем отправку вашего заказа
в тот же или на следующий рабочий день! Это означает, что на Юго-Востоке вы будете
Получите ваш заказ в течение 1-3 рабочих дней, на Северо-Востоке обычно 3
до 4 дней, а на Западе обычно от 4 до 5 дней. Для получения полной информации о
время доставки и обработки, пожалуйста, ознакомьтесь с ожидаемой доставкой
раз.
Время основано на в рабочие дни, не включая выходные и праздничные дни.
Доставка FedEx Карта
Время обработки Нажмите Здесь
Доставка USPS Карта
Типичная Сроки доставки в крупные города США
| Крупные города | Всего рабочих дней +1 / -1 |
|---|---|
| Алабама (AL) — Монтгомери, Бирмингем | 1 |
| Аляска (AK) — Джуно, Анкоридж | 7 |
| Аризона (Аризона) — Феникс, Тусон | 4 |
| Арканзас (АР) — Литл-Рок, Фейетвилл | 2 |
| Калифорния (Калифорния) — Сакраменто, Лос-Анджелес, Сан-Франциско, Сан-Диего, Сакраменто, Сан Хосе | 4 |
| Колорадо (Колорадо) — Денвер, Колорадо-Спрингс | 3 |
| Коннектикут (Коннектикут) — Хартфорд, Нью-Хейвен | 2 |
| Делавэр (DE) — Довер, Уилмингтон, Ньюарк | 2 |
| Флорида (Флорида) — Таллахасси, Орландо, Майами, Джексонвилл, Тампа, Дестин | 2 |
| Джорджия (Джорджия) — Атланта, Саванна, Огаста, Афины | 1 |
| Гавайи (Гавайи) — Гонолулу, Кайлуа | 7 |
| Айдахо (Айдахо) — Бойсе, Кёр д’Ален | 4 |
| Иллинойс (Иллинойс) — Спрингфилд, Чикаго, Пеория, Рокфорд | 2 |
| Индиана (Индиана) — Индианаполис, Форт-Уэйн | 2 |
| Айова (Айова) — Де-Мойн, Сидар-Рапидс | 2 |
| Канзас (Канзас) — Топика, Вичита, Канзас-Сити | 2 |
| Кентукки (Кентукки) — Франкфурт, Луисвилл, Лексингтон | 2 |
| Луизиана (Луизиана) — Батон-Руж, Новый Орлеан, Лафайет | 2 |
| Мэн (ME) – Огаста, Портленд, Бангор | 3 |
| Мэриленд (Мэриленд) — Аннаполис, Балтимор | 2 |
| Массачусетс (Массачусетс) — Бостон, Кембридж, Вустер | 2 |
| Мичиган (Мичиган) — Лансинг, Детройт, Гранд-Рапидс | 2 |
| Миннесота (Миннесота) — Сент-Пол, Миннеаполис, Дулут | 3 |
| Миссисипи (Миссисипи) — Джексон, Билокси, Хаттисберг | 1 |
| Миссури (Миссури) — Джефферсон-Сити, Сент-Луис, Канзас-Сити | 2 |
| Монтана (Монтана) — Хелена, Биллингс | 4 |
| Небраска (NE) — Линкольн, Омаха | 2 |
| Невада (Невада) — Карсон-Сити, Лас-Вегас, Рено | 4 |
| Нью-Гэмпшир (Нью-Гэмпшир) — Конкорд, Манчестер, Портсмут | 2 |
| Нью-Джерси (Нью-Джерси) – Трентон, Ньюарк, Джерси-Сити | 2 |
| Нью-Мексико (Нью-Мексико) – Санта-Фе, Альбуркерке | 3 |
| Нью-Йорк (Нью-Йорк) — Олбани, Нью-Йорк, Рочестер, Буффало, Олбани, Сиракузы, Ниагара Фолс, Итака | 3 |
| Северная Каролина (Северная Каролина) — Роли, Шарлотта | 2 |
| Северная Дакота (Северная Дакота) — Бисмарк, Фарго | 3 |
| Огайо (Огайо) — Колумбус, Кливленд, Цинциннати | 2 |
| Оклахома (ОК) — Оклахома-Сити, Фэрвью, | 2 |
| Орегон (Орегон) — Салем, Портленд, Юджин | 5 |
| Пенсильвания (Пенсильвания) — Гаррисберг, Филадельфия, Питтсбург | 2 |
| Род-Айленд (Род-Айленд) — Провиденс, Ньюпорт | 2 |
| Южная Каролина (Южная Каролина) – Колумбия, Чарльстон | 1 |
| Юг Дакота (Южная Дакота) — Пьер, Су-Фолс, Рапид Сити | 3 |
| Теннесси (Теннесси) — Нэшвилл, Мемфис | 2 |
| Техас (Техас) — Остин, Хьюстон, Даллас | 3 |
| Юта (Юта) — соль Лейк-Сити, Сент-Джордж | 3 |
| Вермонт (VT) — Монпелье, Берлингтон | 3 |
| Вирджиния (Вирджиния) — Ричмонд, Вирджиния-Бич | 2 |
| Вашингтон (Вашингтон) — Олимпия, Сиэтл, Ванкувер, Спокан | 5 |
| Западная Вирджиния (Западная Вирджиния) — Чарлстон, Моргантаун | 2 |
| Висконсин (Висконсин) — Мэдисон, Милуоки | 2 |
| Вайоминг (Вайоминг) — Шайенн, Джексон | 4 |
Как Это Корабль?
Наши ингредиенты
обычно отправляются в прочных повторно закрывающихся пластиковых пакетах, чем больше
размеры (размер 50 фунтов и кратные 50 фунтам) поставляются в прочном
бумажные / пластиковые мешки промышленной прочности, обычно используемые для 50 фунтов
химические вещества. В некоторых случаях, в зависимости от уровня запасов, мы можем использовать
несколько сумок для выполнения заказа, например, 16 фунтов могут быть 4 x 4
фунтов, а не один мешок на 16 фунтов. Если размер упаковки
пожалуйста, свяжитесь с нами, и мы будем рады работать с вами.
В некоторых случаях, в зависимости от уровня запасов, мы можем использовать
несколько сумок для выполнения заказа, например, 16 фунтов могут быть 4 x 4
фунтов, а не один мешок на 16 фунтов. Если размер упаковки
пожалуйста, свяжитесь с нами, и мы будем рады работать с вами.
Паспорт безопасности (Barium-Carbonate.pdf, 113 КБ) [Скачать]
БАРИЯ КАРБОНАТ | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|
|
|
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| никто |
| ||
NFPA 704
данные недоступны
Общее описание
Карбонат бария представляет собой белый порошок. Он нерастворим в воде и растворим в большинстве кислот, за исключением серной кислоты. Он имеет удельный вес 4,275. Он токсичен при приеме внутрь.
Он нерастворим в воде и растворим в большинстве кислот, за исключением серной кислоты. Он имеет удельный вес 4,275. Он токсичен при приеме внутрь.
Опасности
Что это за информация?
Опасные поля включают специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп а также потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
нет
Реакции с воздухом и водой
Нерастворим в воде и растворим в большинстве кислот, за исключением серной кислоты.
Пожароопасность
Выдержка из Руководства ERG 154 [Вещества – токсичные и/или коррозионные (негорючие)]:
Негорючее, само вещество не горит, но может разлагаться при нагревании с образованием коррозионных и/или токсичных паров. Некоторые из них являются окислителями и могут воспламенять горючие материалы (дерево, бумагу, масло, одежду и т. д.). При контакте с металлами может выделяться легковоспламеняющийся газообразный водород. Контейнеры могут взорваться при нагревании. Для электромобилей или оборудования также следует обращаться к ERG Guide 147 (литий-ионные батареи) или ERG Guide 138 (натриевые батареи). (ЭРГ, 2020)
Некоторые из них являются окислителями и могут воспламенять горючие материалы (дерево, бумагу, масло, одежду и т. д.). При контакте с металлами может выделяться легковоспламеняющийся газообразный водород. Контейнеры могут взорваться при нагревании. Для электромобилей или оборудования также следует обращаться к ERG Guide 147 (литий-ионные батареи) или ERG Guide 138 (натриевые батареи). (ЭРГ, 2020)
Опасность для здоровья
(ТОЛЬКО ПРИ ПРОГЛАТЫВАНИИ): чрезмерное слюноотделение, рвота, сильная боль в животе и сильное понос с водянистым и кровянистым стулом; медленный и часто нерегулярный пульс и преходящее повышение артериального давления; шум в ушах, головокружение и головокружение; подергивания мышц, переходящие в судороги и/или параличи; расширенные зрачки с нарушением аккомодации; спутанность сознания и нарастающая сонливость без комы; коллапс и смерть от дыхательной недостаточности и остановки сердца. (USCG, 1999)
Профиль реакционной способности
Основные соли, такие как КАРБОНАТ БАРИЯ, обычно растворимы в воде. Полученные растворы содержат умеренные концентрации гидроксид-ионов и имеют рН более 7,0. Они реагируют как основания, чтобы нейтрализовать кислоты. Эти нейтрализации выделяют тепло, но меньше или намного меньше, чем выделяется при нейтрализации оснований в группе реакционной способности 10 (Основания) и при нейтрализации аминов. Обычно они не реагируют ни как окислители, ни как восстановители, но такое поведение не невозможно.
Полученные растворы содержат умеренные концентрации гидроксид-ионов и имеют рН более 7,0. Они реагируют как основания, чтобы нейтрализовать кислоты. Эти нейтрализации выделяют тепло, но меньше или намного меньше, чем выделяется при нейтрализации оснований в группе реакционной способности 10 (Основания) и при нейтрализации аминов. Обычно они не реагируют ни как окислители, ни как восстановители, но такое поведение не невозможно.
Принадлежит к следующей реакционной группе (группам):
- Карбонатные соли
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по ответу
Что это за информация?
Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 154 [Вещества — токсичные и/или коррозионные (негорючие)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте место разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров. (75 футов) для твердых веществ.
(75 футов) для твердых веществ.
РАЗЛИВ: При необходимости увеличьте расстояние для немедленных мер предосторожности в подветренном направлении.
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
Пожаротушение
Выдержка из Руководства ERG 154 [Вещества — токсичные и/или коррозионные (негорючие)]:
НЕБОЛЬШОЙ ПОЖАР: Сухой химикат, CO2 или распыленная вода.
БОЛЬШОЙ ПОЖАР: Сухой химикат, CO2, спиртоустойчивая пена или распыленная вода. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня. Сток дамбы от пожарной охраны для последующей утилизации.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ ИЛИ АВТОМОБИЛЬНЫЕ/ТРЕЙЛЕРНЫЕ НАГРУЗКИ: Тушить огонь с максимального расстояния или использовать беспилотные устройства основного потока или контрольные насадки. Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 154 [Вещества – токсичные и/или коррозионные (негорючие)]:
УСТРАНИТЕ все источники воспламенения (не курить, факелы, искры или пламя) в непосредственной близости. Не прикасайтесь к поврежденным контейнерам или пролитому материалу, если вы не надели соответствующую защитную одежду. Остановите утечку, если вы можете сделать это без риска. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Впитать или засыпать сухой землей, песком или другим негорючим материалом и переложить в контейнеры. НЕ ПОЛУЧАЙТЕ ВОДУ ВНУТРИ КОНТЕЙНЕРОВ. (ЭРГ, 2020)
Защитная одежда
Респиратор от пыли (USCG, 1999)
DuPont Tychem® Suit Fabrics
Информация отсутствует.
Первая помощь
Быстрое пероральное введение растворимого в воде сульфата, такого как сульфат магния или натрия (2 унции), квасцы (4 г) или очень разбавленная серная кислота (30 мл 10% раствора, разбавленного до 1 кварты). ). Эти агенты осаждают барий в виде нерастворимого сульфата. Промывание желудка или индуцированная рвота. Обратитесь за медицинской помощью. (USCG, 1999)
Физические свойства
Что это за информация?
Поля физических свойств включают в себя такие свойства, как давление пара и температура кипения, а также пределы взрываемости и пороги токсического воздействия Информация в CAMEO Chemicals поступает из различных источников. источники данных.
| Химическая формула: |
|
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные недоступны
Температура самовоспламенения: Не воспламеняется (USCG, 1999)
Температура плавления: данные отсутствуют
Давление пара: данные отсутствуют
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес:
4. 3
при 68°F
(USCG, 1999)
3
при 68°F
(USCG, 1999)
Температура кипения: данные недоступны
Молекулярный вес: 197,35 (USCG, 1999)
Растворимость в воде: данные отсутствуют
Энергия/потенциал ионизации: данные отсутствуют
IDLH: данные недоступны
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитного действия)
| Химические вещества | ПАК-1 | ПАК-2 | ПАК-3 |
|---|---|---|---|
| Карбонат бария (513-77-9) | 2,2 мг/м3 | 270 мг/м3 | 1600 мг/м3 |
(DOE, 2018)
Нормативная информация
Что это за информация?
Поля нормативной информации
включить информацию из
Сводный список III Агентства по охране окружающей среды США
списки,
Химический завод Агентства кибербезопасности и безопасности инфраструктуры США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
Сводный перечень списков EPA
| Нормативное наименование | Номер CAS/ 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | ЭПКРА 313 ТРИ | RCRA Код | CAA 112(r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Соединения бария | Н040 | 313 |
(Список списков Агентства по охране окружающей среды, 2022 г. )
)
Антитеррористические стандарты CISA Chemical Facility (CFATS)
Отсутствует нормативная информация.
Список стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.
Альтернативные химические названия
Что это за информация?
В этом разделе приводится список альтернативных названий этого химического вещества, включая торговые названия и синонимы.
- БАРИЯ КАРБОНАТ
- БАРИЯ КАРБОНАТ (1:1)
- БАРИЯ КАРБОНАТ (BACO3)
- БАРИЯ МОНОКАРБОНАТ
- БФ 1
- БФ 1 (СОЛЬ)
- BW-C3
- БВ-П
- К.И. 77099
- К.И. ПИГМЕНТ БЕЛЫЙ 10
- БЕЛЫЙ ПИГМЕНТ 10
Тенденции цен на рынке карбоната бария и прогноз до 2027 года
Обзор рынка:В 2021 году мировой рынок карбоната бария достиг 577,9 млн долларов США.
Заглядывая вперед, IMARC Group ожидает, что рынок достигнет 872,2 млн долларов США к 2027 году, демонстрируя среднегодовой темп роста 6,9% в течение 2022-2027 годов. Помня о неопределенности, связанной с COVID-19, мы постоянно отслеживаем и оцениваем прямое и косвенное влияние пандемии на различные отрасли конечного использования. Эти идеи включены в отчет в качестве основного вклада в рынок.
Карбонат бария (BaCO 3 ) представляет собой белое твердое вещество, полученное в результате осаждения гидроксида бария и мочевины. Его также получают из минерального барита или хлорида бария. Карбонат бария нерастворим в воде, не имеет вкуса и запаха, плотный и чрезвычайно токсичен по своей природе. Он используется в производстве различных коммерческих продуктов, включая каучук, краски, эмали, керамику, бурение нефтяных скважин, стекло и кирпичи. Специальное стекло, изготовленное из карбоната бария, обеспечивает защиту от излучения в ЭЛТ-телевизорах. Он также используется в производстве кирпичей, глины, покрытий для фотобумаги, твердых ферритовых магнитов, постоянных керамических магнитов для громкоговорителей и для удаления сульфатов из соляных растворов перед их подачей в электролизеры. Кроме того, высокая токсичность карбоната бария делает его идеальным раствором для приготовления родентицидов.
Кроме того, высокая токсичность карбоната бария делает его идеальным раствором для приготовления родентицидов.
www.imarcgroup.com
Примечание: Значения и тренды на приведенной выше диаграмме представляют собой фиктивные данные и показаны здесь только в целях представления. Пожалуйста, свяжитесь с нами для получения информации о фактическом размере рынка и тенденциях.
Чтобы получить дополнительную информацию об этом рынке, Образец запроса
Тенденции рынка карбоната бария:
Стремительное развитие в сфере строительства и недвижимости в первую очередь способствует росту мирового рынка карбоната бария. Кроме того, правительства разных стран уделяют внимание развитию инфраструктуры, что увеличивает спрос на кирпич и керамическую плитку. Росту рынка также способствует значительный рост урбанизации и располагаемых доходов, особенно в развивающихся странах, что привело к резкому увеличению продаж декоративных предметов премиум-класса, таких как вазы, картины из стекла и керамические фигурки. Кроме того, в электрокерамической промышленности наблюдается значительный рост, где карбонат бария используется в производстве нескольких компонентов, таких как пьезоэлектрические преобразователи, электромеханические устройства, датчики и оптические модуляторы. Кроме того, внедрение строгих правил по контролю за ухудшением состояния окружающей среды, вызванным промышленным сектором, побудило ключевых игроков принять экологически чистые процессы производства карбоната бария, такие как использование метана в качестве восстановителя, что создает позитивные перспективы для рынка.
Кроме того, в электрокерамической промышленности наблюдается значительный рост, где карбонат бария используется в производстве нескольких компонентов, таких как пьезоэлектрические преобразователи, электромеханические устройства, датчики и оптические модуляторы. Кроме того, внедрение строгих правил по контролю за ухудшением состояния окружающей среды, вызванным промышленным сектором, побудило ключевых игроков принять экологически чистые процессы производства карбоната бария, такие как использование метана в качестве восстановителя, что создает позитивные перспективы для рынка.
IMARC Group предоставляет анализ ключевых тенденций в каждом подсегменте мирового рынка карбоната бария, а также прогнозы на глобальном и региональном уровнях на 2022–2027 годы. В нашем отчете рынок классифицирован на основе конечного использования.
Разбивка по конечному использованию:
www.imarcgroup. com
com
Примечание: Значения и тренды на приведенной выше диаграмме представляют собой условные данные и показаны здесь только в целях представления. Пожалуйста, свяжитесь с нами для получения информации о фактическом размере рынка и тенденциях.
Чтобы получить дополнительную информацию об этом рынке, Образец запроса
- Стекло
- Кирпич и глина
- Бариевые ферриты
- Покрытия для фотобумаги
- Другие
В настоящее время карбонат бария наиболее широко используется в производстве стекла во всем мире.
Региональные данные:
- Китай
- Япония
- Латинская Америка
- Ближний Восток и Африка
- Европа
- Другие
На региональном уровне Китай демонстрирует явное доминирование на рынке, на долю которого приходится большая часть всего мирового рынка.
Конкурентная среда: Также была изучена конкурентная среда отрасли, а также профили ключевых игроков. Некоторые из этих игроков включают Solvay S.A., Chemical Products Corporation, Hubei Jingshan Chutian Barium Salt Corporation Ltd., Guizhou Red Star Development Import and Export Co. Ltd., Sakai Chemical Industry Co. Ltd., Hebei Xinji Chemical Group Co. Ltd., Shhanxi Ankang Jianghua Group Co. Ltd., Zaozhuang City Yongli Chemical Co., Ltd. и т. д.
Некоторые из этих игроков включают Solvay S.A., Chemical Products Corporation, Hubei Jingshan Chutian Barium Salt Corporation Ltd., Guizhou Red Star Development Import and Export Co. Ltd., Sakai Chemical Industry Co. Ltd., Hebei Xinji Chemical Group Co. Ltd., Shhanxi Ankang Jianghua Group Co. Ltd., Zaozhuang City Yongli Chemical Co., Ltd. и т. д.

 1; Группа упаковки по ООН: III
1; Группа упаковки по ООН: III
 Приводит к появлению опасности пожара.
Приводит к появлению опасности пожара.

 также
также
 6 Растворимые соли бария
6 Растворимые соли бария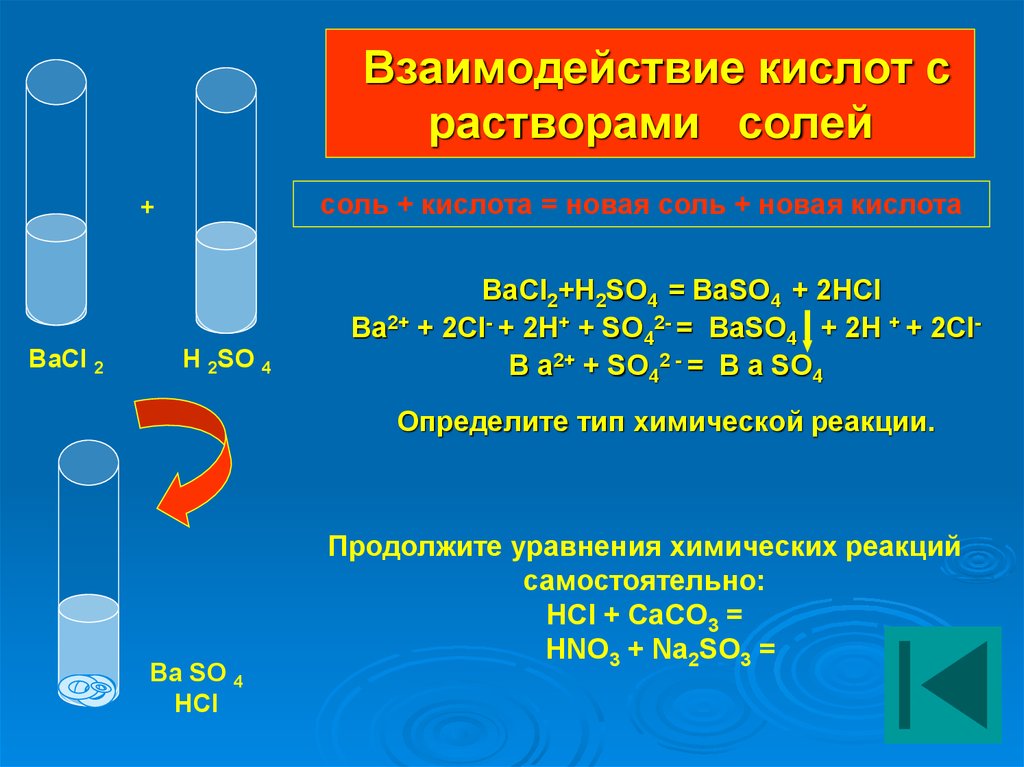 Плотность
Плотность 14483
14483


 Затем материал проходит через роторный питатель. Конечный продукт прессуется валками в таблетки толщиной от 3,7 до 4 мм. Затем полученные таблетки раскатывают в лист во входном грануляторе, и его скорость регулируется соответствующим образом. Это дает полуфабрикаты бария.
Затем материал проходит через роторный питатель. Конечный продукт прессуется валками в таблетки толщиной от 3,7 до 4 мм. Затем полученные таблетки раскатывают в лист во входном грануляторе, и его скорость регулируется соответствующим образом. Это дает полуфабрикаты бария. Затем влажные гранулы помещают во вращающуюся печь прямого нагрева, а затем спекают при температуре 800-1200 ℃. Затем его дополнительно просеивают, обезжелезивают, взвешивают, а затем упаковывают в частицы карбоната бария.
Затем влажные гранулы помещают во вращающуюся печь прямого нагрева, а затем спекают при температуре 800-1200 ℃. Затем его дополнительно просеивают, обезжелезивают, взвешивают, а затем упаковывают в частицы карбоната бария.



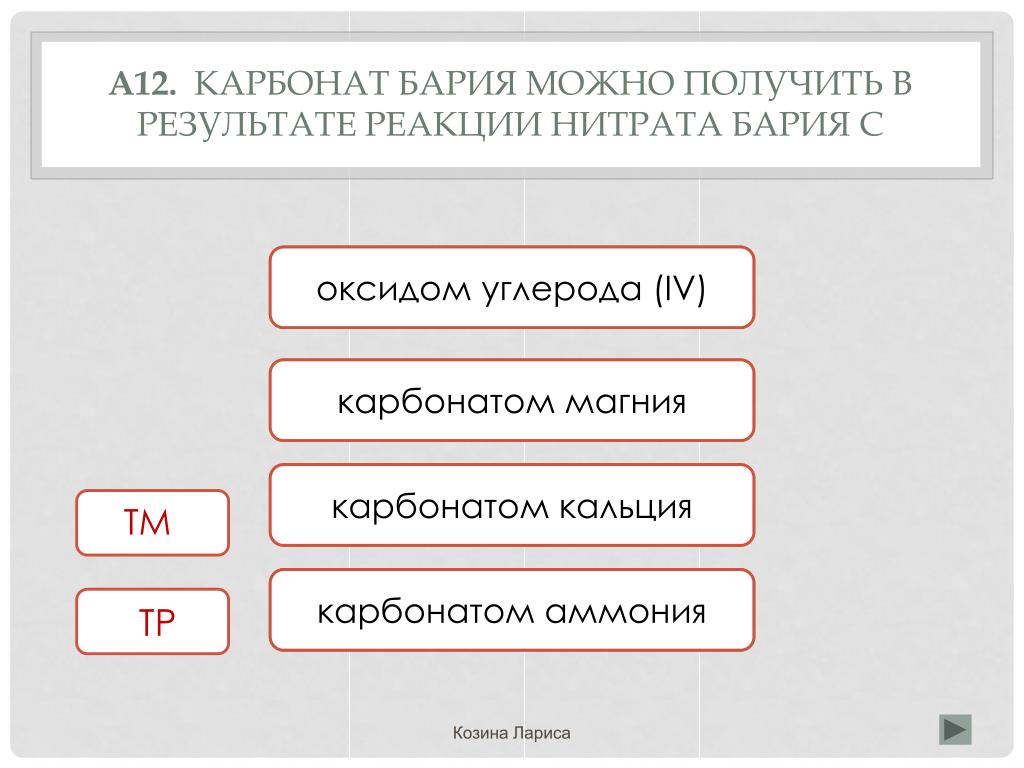

 Заглядывая вперед, IMARC Group ожидает, что рынок достигнет 872,2 млн долларов США к 2027 году, демонстрируя среднегодовой темп роста 6,9% в течение 2022-2027 годов. Помня о неопределенности, связанной с COVID-19, мы постоянно отслеживаем и оцениваем прямое и косвенное влияние пандемии на различные отрасли конечного использования. Эти идеи включены в отчет в качестве основного вклада в рынок.
Заглядывая вперед, IMARC Group ожидает, что рынок достигнет 872,2 млн долларов США к 2027 году, демонстрируя среднегодовой темп роста 6,9% в течение 2022-2027 годов. Помня о неопределенности, связанной с COVID-19, мы постоянно отслеживаем и оцениваем прямое и косвенное влияние пандемии на различные отрасли конечного использования. Эти идеи включены в отчет в качестве основного вклада в рынок.