Производство гипохлорита натрия на предприятиях водоочистки
Хлорирование продолжает оставаться самым распространенным способом обеззараживания воды в мире. Этот происходит с применением жидкого хлора.
Гипохлорит натрия получают, пропуская электрический ток выпрямителя через раствор обычной поваренной соли, методом электролиза раствора хлористого натрия. Основной задачей при получении гипохлорита натрия является создание таких условий, при которых равновесная концентрация гипохлорит-ионов наступала бы как можно позднее. Регулируя анодную плотность тока на выпрямителе, добиваются запуска процесса облегчения разряд ионов хлора, и концентрация гипохлорит-ионов достигается позднее.
Существуют два пути получения конечного продукта: с применением мембранного разделения катодного и анодного (электродного) пространства электролизера, и без такого разделения.
В мембранной электролизной установке анодное и катодное пространство отделяются друг от друга катион-проницаемой мембраной.
Величина выхода по току является основным показателем любого процесса электролиза. Чем выше его значение, тем эффективнее протекает процесс электролиза, тем ниже энергетические затраты на получение единицы готового продукта. При высоких значениях величины выхода по току можно уменьшить требуемую площадь рабочей поверхности электродов, для достижения заданной производительности, применить более компактные установки и снизить расходы на их изготовление. И, хотя целевым продуктом процесса электролиза в нашем случае является гипохлорит натрия, основным показателем процесса надо считать выход по току хлора.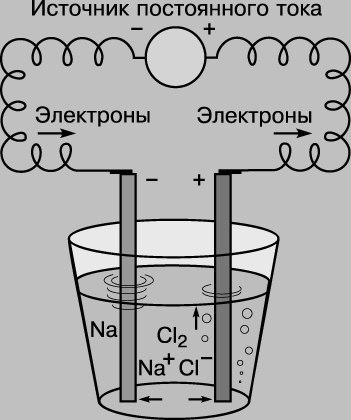
При этом, один из способов получения раствора гипохлорита реализуется через наличие в агрегате такой опции, как «реверс». В этом случае процесс электролиза до реверсирования тока ведут при плотности тока 1-2 кА/м2 в течение 6-7 сут., а к моменту реверсирования плотность тока устанавливают в диапазоне 70-100 А/м2 и разбавляют электролит в 300-400 раз, после чего проводят реверсирование тока и электролиз ведут в течение 0,5-4 ч. Оптимальным выбором источников тока для нормального протекания процесса производства гипохлорита натрия являются промышленные выпрямители тока с реверсом серии Пульсар ПРО или Пульсар СМАРТ.
 При очень малых плотностях тока, отвечающих интервалу потенциалов +0,8 – 1,33 В, на аноде будет выделяться кислород, затем при достижении равновесного потенциала выделения хлора начнется совместное выделение кислорода и хлора, причем с ростом плотности тока, выход по току хлора будет быстро возрастать. При плотностях тока около 1000 А/м2 на выделение кислорода будет расходоваться всего несколько процентов тока.
При очень малых плотностях тока, отвечающих интервалу потенциалов +0,8 – 1,33 В, на аноде будет выделяться кислород, затем при достижении равновесного потенциала выделения хлора начнется совместное выделение кислорода и хлора, причем с ростом плотности тока, выход по току хлора будет быстро возрастать. При плотностях тока около 1000 А/м2 на выделение кислорода будет расходоваться всего несколько процентов тока.
Повышая напряжение на электролизере в настройках выпрямителя Пульсар ПРО или Пульсар СМАРТ на токоподводящих электродах, увеличивается плотность тока. Таким образом, при сохранении максимально возможного значения выхода по току хлора, можно увеличить (в определенных пределах) производительность установки без существенного отклонения энергетических затрат от минимальных.
Поставки выпрямителей производства ООО «Навиком» на предприятия водоочистки на территории России показали эффективную и стабильную работу в процессе производства гипохлорита натрия.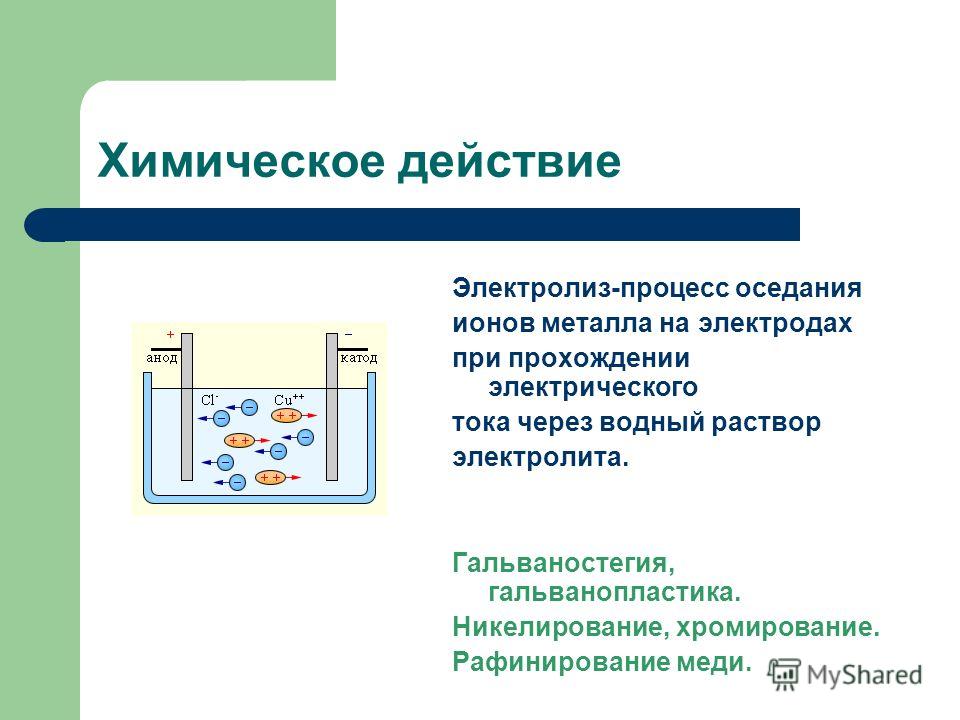
Инженерный вестник Дона | Исследование коррозионных и электрохимических свойств оксидных покрытий анодов для производства низкоконцентрированного гипохлорита натрия
Аннотация
И.В. Пчельников, С.И. Игнатенко, А.А. Бабаев, Л.Н. Фесенко
Дата поступления статьи: 22.01.2014
Рассмотрен выбор покрытий анодов для получения низкоконцентрованного гипохлорита натрия электролизом 3%-ного раствора поваренной пищевой соли и черноморской воды. Определена коррозионная стойкость анодов с разной закладкой оксидов рутения и иридия, а также их характеристики: выход хлора по току, напряжение на ячейке, динамика роста концентрации активного хлора в растворе.
Ключевые слова: оксидные покрытия, иридий, рутений, низкоконцентрированный гипохлорит натрия, коррозионная стойкость анодов, выход хлора по току, электролиз 3%-ного раствора поваренной пищевой соли и морской воды.
05.23.04 — Водоснабжение, канализация, строительные системы охраны водных ресурсов
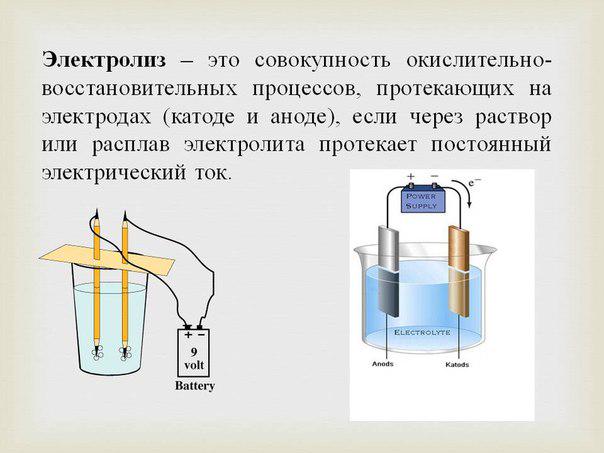
Низкоконцентрированный гипохлорит натрия (ГХН) получают электролизом хлоридных растворов в бездиафрагменных электролизерах [1]. При этом количество образующегося активного хлора зависит от материала анода, концентрации хлоридов в растворе, анодной плотности тока, времени протекания электролиза и др. [1-3]. Среди них наиболее значимым, определяющим электрические и электрохимические параметры электролиза, его экономичность и эксплуатационный регламент, конструкцию аппаратов и их долговечность является материал анода [3]. Поскольку аноды работают в химически агрессивной среде, то основное требование к материалу анодно-поляризуемого электрода – его химическая стойкость.
При этом количество образующегося активного хлора зависит от материала анода, концентрации хлоридов в растворе, анодной плотности тока, времени протекания электролиза и др. [1-3]. Среди них наиболее значимым, определяющим электрические и электрохимические параметры электролиза, его экономичность и эксплуатационный регламент, конструкцию аппаратов и их долговечность является материал анода [3]. Поскольку аноды работают в химически агрессивной среде, то основное требование к материалу анодно-поляризуемого электрода – его химическая стойкость.
 Неоспоримыми достоинствами в части коррозионной стойкости, низкого перенапряжения по хлору и технологичности обладают электроды из платины. Однако, высокая стоимость материала ограничили применение платины в серийном производстве электролизных установок [2, 3].
Неоспоримыми достоинствами в части коррозионной стойкости, низкого перенапряжения по хлору и технологичности обладают электроды из платины. Однако, высокая стоимость материала ограничили применение платины в серийном производстве электролизных установок [2, 3].Однако, наряду с преимуществами (высокие селективные и электрокаталитические свойства, механическая и коррозионная стойкость) ОРТА, как и другие аноды не лишены недостатков, основной из которых — ограниченный срок службы, связанный с непрерывным уменьшением толщины активного покрытия при электролизе и, как следствие, необратимая потеря оксида рутения [1, 3, 11-13].
 Одним из компонентов в составе покрытия электродов, способным продлить срок службы анода, может служить металл платиновой группы – иридий [14].
Одним из компонентов в составе покрытия электродов, способным продлить срок службы анода, может служить металл платиновой группы – иридий [14].Трехкомпонентные покрытия анодов, содержащие иридий, известны под названием ОИРТА (окисно-иридиевые рутений-титановые аноды), применяют в промышленном производстве хлора [14]. При этом электролиз проводят в диафрагменных электролизерах c насыщенным раствором NaCl, и анод находится в кислой среде, что отличается от условий производства низкоконцентрированного гипохлорита натрия в бездиафрагменных аппаратах, где анод работает уже в щелочном растворе [1]. На практике гипохлорит может быть получен на ОРТА и ОИРТА не только из искусственно приготовленных растворов поваренной соли, но и из природных минерализованных хлоридных вод, в том числе — морской воды.
Недостаточность исследований поведения покрытий ОИРТА и ОРТА при бездиафрагменном электролизе искусственного сырья – 3%-ного раствора NaCl и природного – морской воды при производстве низкоконцентрированного ГХН определило необходимость сравнительной оценки работы таких электродных покрытий, что и послужило целью настоящих экспериментов.
Цель исследований – изучение и сравнительная оценка коррозионных и электрохимических свойств оксидных покрытий анодов, а также энергетических показателей при производстве низкоконцентрированного гипохлорита натрия электролизом 3%-ного раствора поваренной соли и морской воды.
Коррозионную стойкость определяли на анодах с разным массовым соотношением металлов (рутений, иридий) в покрытии. Добавление в оксиды рутения некоторого количества иридия способно повлиять на увеличение коррозионной стойкости анода [14]. В качестве анодного покрытия использовали смесь солей металлов платиновой группы — RuCl3, IrCl3, в комбинации с TiCl4. Суммарная масса драгоценных металлов в покрытии была постоянной – 7,5 г/м2. В опытах варьировали соотношение рутения и иридия в интервале от 0 до 100 % с шагом 10 %, масса ТiO 2 во всех покрытиях составляла 2 г/м2. В качестве катода и основы анода использовали титан марки ВТ1-0 толщиной 1 мм.

Испытания коррозионной стойкости анодного покрытия проводили в 1М растворе H2SO4 при плотности тока 10000 А/м2 по методике, изложенной в [15], и согласно которой начало разрушения покрытия отмечается резким скачком напряжения относительно начального 3,5-5,5В. Испытательный стенд включал электрохимическую ячейку объемом 300 мл, блок питания и контроля напряжения, систему вентиляции. Вольтамперные характеристики анодного материала фиксировали автоматически и систематизировали при помощи специального программного обеспечения.
Результаты испытаний коррозионной стойкости анодов представлены в таблице и рис.1, из которых следует, что соотношение иридия и рутения в покрытии существенно влияет на среднюю коррозионную стойкость анода. Так, наибольшее время работы (25 часов) отмечено при процентно-массовом соотношении Ir к Ru как 80 к 20 (анод № 9), наименьшее (3 часа) – при минимальном содержании иридия 10 % или его полном отсутствии (аноды № 1 и 2).
 1). показали, что рост напряжения на электрохимической ячейке при электролизе характерен для всех образцов. При этом по мере увеличения процентного содержания иридия в покрытии рост напряжения замедляется и продолжительность работы анода возрастает, что свидетельствует о большей коррозионной стойкости анодов, содержащих иридий.
1). показали, что рост напряжения на электрохимической ячейке при электролизе характерен для всех образцов. При этом по мере увеличения процентного содержания иридия в покрытии рост напряжения замедляется и продолжительность работы анода возрастает, что свидетельствует о большей коррозионной стойкости анодов, содержащих иридий.Таблица. Коррозионная стойкость анодов в зависимости от процентного содержания Ir и Ru в покрытии
Номер анода Показатели |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
|
Содержание в покрытии Ir |
г/м2 |
0,00 |
0,75 |
1,50 |
2,25 |
3,00 |
3,75 |
4,50 |
5,25 |
6,00 |
6,75 |
7,50 |
|
% |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
|
Средняя коррозионная стойкость, ч |
3,00 |
2,38 |
3,28 |
4,49 |
6,29 |
9,00 |
11,48 |
13,00 |
25,00 |
22,00 |
19,00 |
|
Рис. 1. Изменение напряжения во времени при испытании на коррозионную стойкость покрытий анодов с процентным соотношением Ir/Ru: 1 – 0/100; 2 – 10/90; 3 – 20/80; 4 — 30/70; 5 – 40/60; 6 – 50/50; 7 – 60/40; 8 – 70/30; 9 – 80/20; 10 – 90/10; 11 – 100/0
1. Изменение напряжения во времени при испытании на коррозионную стойкость покрытий анодов с процентным соотношением Ir/Ru: 1 – 0/100; 2 – 10/90; 3 – 20/80; 4 — 30/70; 5 – 40/60; 6 – 50/50; 7 – 60/40; 8 – 70/30; 9 – 80/20; 10 – 90/10; 11 – 100/0
Электрохимические характеристики электрокаталитических покрытий анодов (напряжение, выход хлора по току, концентрация активного хлора и др.) получали в бездиафрагменном электролизере циркуляционного типа с объемом раствора 300 мл и при анодной плотности постоянного тока 1000 А/м2. Температуру электролита поддерживали термостатированием на уровне 20 °С±1°. Во времени электролиза измеряли напряжение на электролитической ячейке и концентрацию активного хлора в растворе по стандартным методикам [16]. Размер электродов ‒ 60х10 мм. Источником напряжения служил инверторный блок питания марки GW INSTEK 3610 с системой автоматического поддержания заданного тока. После каждого опыта электроды последовательно промывали 3%-ным раствором соляной кислоты и дистиллированной водой для удаления карбонатных отложений.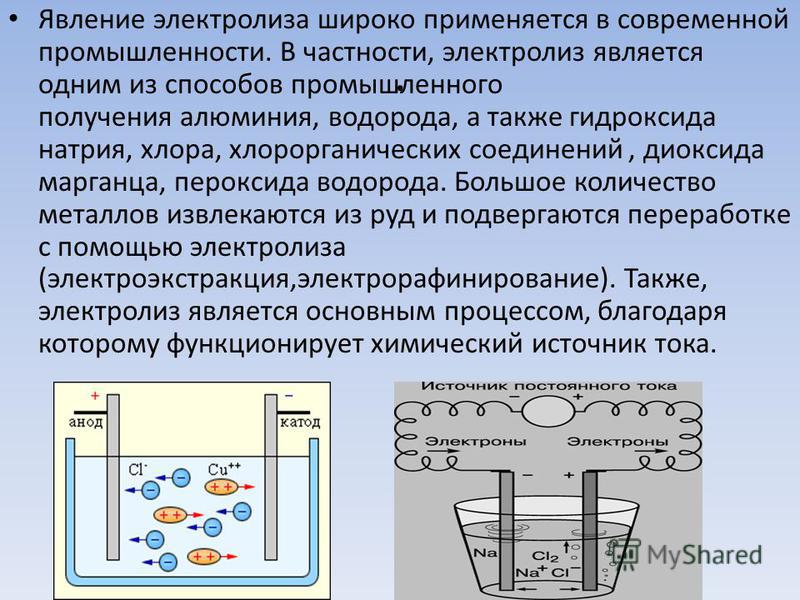
В экспериментах использовали 3%-ный солевой раствор, приготовленный растворением в донской водопроводной воде г. Новочеркасска пищевой поваренной соли первого сорта, производства ГПО «Артемсоль» и воду Черного моря, отобранную на глубине 5 м на расстоянии 300 м от уреза берега в Адлерском районе г. Сочи. Эксперименты проводили с трехкратной повторяемостью, достоверность полученных результатов проверяли методами математической статистики с доверительной вероятностью 0,95 [17].
Результаты исследований влияния состава покрытия анода на количество образующегося ГХН представлены на рис. 2, из которых следует, что в 3 %-ном солевом растворе максимум концентрации по хлору (13,5 г/л, в морской воде – 11,0 г/л) в обоих случаях отмечен на анодах № 1 и 2 с минимальным содержанием иридия. Общий характер кривых (рис. 2 а, б) идентичен и отличие состоит только в том, что в морской воде образуются более низкие концентрации активного хлора.
Общий характер кривых (рис. 2 а, б) идентичен и отличие состоит только в том, что в морской воде образуются более низкие концентрации активного хлора.
На количество получаемого целевого продукта – активного хлора в ГХН заметно влияет состав анодного покрытия. Так, кривая выхода активного хлора на аноде с закладкой иридия 100 % (№ 11) расположена ниже всех остальных зависимостей, а наибольший прирост концентрации наблюдается при 100%-ном содержании рутения на аноде № 1 (ОРТА), рис. 3. При необходимости получения концентраций по активному хлору более 12 г/л и 10 г/л, соответственно на 3%-ном солевом растворе и морской воде, следует применять покрытия с минимальным содержанием иридия или без него (0–20 %).
При электролизе хлоридных растворов эффективность работы оксидных покрытий с вариантностью процентной закладки иридия и рутения возможно характеризовать не только сравнением выхода хлора по току (рис. 3), но и удельных затрат электроэнергии на килограмм вырабатываемого активного хлора (рис. 4).
3), но и удельных затрат электроэнергии на килограмм вырабатываемого активного хлора (рис. 4).
Характер кривых (рис. 4 а, б) подтверждает сходство электролиза искусственного 3%-ного солевого раствора и морской воды. Выход хлора по току в морской воде на всех образцах анодов в среднем на 10 % ниже, чем в солевом растворе. Минимальные показатели выхода хлора по току в солевом растворе наблюдали на анодах № 2 – 6, на морской воде — № 2 – 4. В течение первых 60 мин электролиза (рис. 3) в обоих растворах выход хлора по току максимальный, далее происходит его постепенное снижение, что объясняется протеканием побочных ред-окс реакций на аноде и катоде, снижающих выход по току активного хлора [1 – 3, 18, 19]:
— окисление гипохлорита до хлората ClO3— на аноде:
6ClO- + 6OH- — 6e → 3H2O + 2ClO3— + 1,5O2 + 4Cl-;
— восстановление гипохлорита и хлората на катоде:
ClO- + 2Н2О + 2e → Cl- + 2OH-;
ClO3— + 3H2O + 6e → Cl- + 6OH-.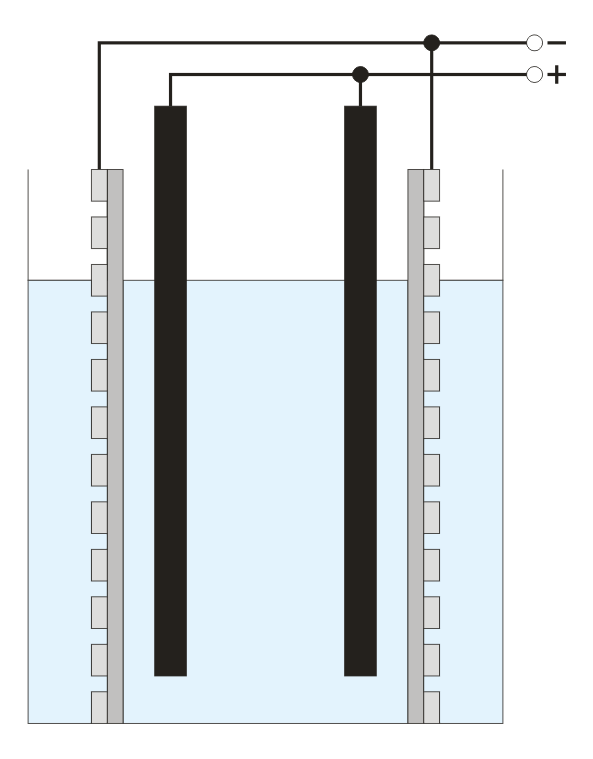
Для оценки расхода электроэнергии отнесенного к производству 1 кг активного хлора была построена зависимость в координатах: «концентрация активного хлора – затраты электроэнергии» для всех исследуемых образцов анодов (рис. 4). Из рисунка следует, что общий характер зависимостей энергопотребления для обоих исследуемых растворов похож, однако отличается затратами энергии. Так, расходуя одинаковое количество электроэнергии (5 — 6 кВт∙ч на кг активного хлора) в 3%-ном растворе возможно получить концентрацию ГХН 8 — 10 г/л, в морской воде – не более 4 – 6 г/л. Получение же более высоких концентраций активного хлора начинает приводить к непропорциональному росту электропотребления [20, 21]. В искусственном солевом растворе на всех типах анодов значительный рост затрат начинается с концентрации активного хлора 10 — 12 г/л, в морской воде – 6 — 10 г/л. Из рис. 4 видно, что оксидные покрытия, содержащие иридий, менее энергозатратны вследствие более низкого напряжения на электролизере (рис. 4).
Из рис. 4 видно, что оксидные покрытия, содержащие иридий, менее энергозатратны вследствие более низкого напряжения на электролизере (рис. 4).
В заключение возможно констатировать, что включение иридия в оксидное покрытие титановых анодов заметно влияет на их коррозионные, электрохимические и энергетические характеристики.
Выводы:
- Включения иридия в анодное рутениево-титановое оксидное покрытие при процентно-массовом соотношении иридия к рутению 80:20 увеличивает коррозионную стойкость анодов в 8 раз.
- Состав покрытий анодов (ОРТА или ОИРТА) при электролизе 3%-ного раствора поваренной соли до концентраций 10-12 г/л и морской воды до 5-7 г/л существенно не влияет на динамику прироста активного хлора в растворе. При необходимости получения концентраций по активному хлору более 12 г/л и 10 г/л, соответственно на 3%-ном солевом растворе и морской воде, следует применять покрытия с минимальным содержанием иридия или без него (0 – 20 %).

- Анодные покрытия, содержащие в основной массе иридий, эксплуатируются с меньшими затратами электроэнергии, вследствие более низкого напряжения на электролизере. Количество электроэнергии, потребляемой при производстве килограмма активного хлора в оптимальном режиме для 3%-ного раствора составляет 7,5 кВт∙ч/кг, морской воды — 10 кВт∙ч/кг.
- Фесенко Л.Н., Денисов В.В., Скрябин А.Ю. Дезинфектант воды – гипохлорит натрия: производство, применение, экономика и экология / Под ред. проф. В.В. Денисова. Ростов-на-Дону: Изд-во СКНЦ ВШ ЮФУ, 2012. – 246 с.
- Медриш Г.Л., Тейшева А.А., Басин Д.Л. Обеззараживание природных и сточных вод с использованием электролиза. — Москва Стройиздат 1982. – 81с.
- Якименко Л.М. Электрохимические процессы в химической промышленности: производство водорода, кислорода, хлора и щелочей. — М.: Химия, 1981. 280 с.
- Слипченко А.В., Максимов В.
 В., Кульский Л. А. Современные малоизнашиваемые аноды и перспективы развития электрохимических технологий водообработки // Химия и технология воды. – 1993. Т. 15.–№ 3. – С. 180 – 231.
В., Кульский Л. А. Современные малоизнашиваемые аноды и перспективы развития электрохимических технологий водообработки // Химия и технология воды. – 1993. Т. 15.–№ 3. – С. 180 – 231. - Кульский Л. А., Слипченко А.В., Мацкевич Е. С. Получение гипохлорита натрия на магнетитовом аноде при электролизе разбавленных растворов // Химия и технология воды. – 1988. – Т. 10. – № 3. – С. 219 – 221.
- Любушкин В.И., Любушкина Е.Т. Кинетика процессов, протекающих при электролизе хлористого натрия в бездиафрагменном электролизере // Изв. СКНЦВШ. Сер. естеств. наук. – 1980. – № 2. – С. 49 – 51.
- Любушкин В.И., Смирнов В.А., Любушкина Е.Т. Электросинтез гипохлорита натрия на электродах со шпинельным покрытием // Электрохимия. – 1981. – Т. XVII. – № 6. – С. 828 – 832.
- Любушкин В. И. Исследование анодных процессов, протекающих на различных электродах при синтезе гипохлорита / В. И. Любушкин М. Г. Смирнова Е. Т. Любушкина // Тез. докл. 6-й Всесоюзн. конф.
 по электрохимии. 1982. — Т. 2. — С. 316.
по электрохимии. 1982. — Т. 2. — С. 316. - Жук А.П. и др. Малоизнашивающиеся аноды и применение их в электрохимических процессах // Тез. докл. V Всесоюзного совещания. – М.: ЦПНХО им. Д. И. Менделеева, 1984. – С. 26, 61 – 76.
- Калиновский Е.А. и др. Выбор анода для электрохимической обработки воды // Химия и технология воды. – 1988. – Т. 10. – № 2. – С. 138 – 140.
- Горбачев А.К., Бровин А.Ю., Тульский Г.Г., Ваулина Е.Н. Влияние анодного материала на процессы электрохимического синтеза растворов гипохлорита натрия // Вопросы химии и химической технологии, 2003, №1, С. 112 – 116.
- Коварский Н.Я., Гребень В.П., Драчев Г.Ю. Получение концентрированных растворов гипохлорита из морской воды электролизом с применением металлоксидных анодов // Химия и технология воды, 1989, Т.11, №1. – С. 63 – 66.
- Кульский Л. А., Слипченко А.В., Мацкевич Е. С. Особенности работы гипохлоритных электролизеров при низких концентрациях хлоридов в воде // Химия и технология воды.
 – 1988. – Т. 10. – № 5. – С. 438 – 441.
– 1988. – Т. 10. – № 5. – С. 438 – 441. - Небурчилов В.А. Коррозионно-электрохимическое поведение металлоксидных анодов на основе диоксида иридия в условиях хлорного электролиза: Дис. канд. тех. наук. 05.17.03. – Москва, 2003. – 168 с.
- Пат. 2379380 Россия, С25В11/10. Высокоэффективное анодное покрытие для получения гипохлорита / Карлсон Р.К; Моутс М.С., Харди К.Л. –: №2007132164/15; Заявл.:27.01.2005; Опубл.: 20.01.2010
- ГОСТ 18190-72. Вода питьевая. Методы определения содержания активного хлора:. – М.: Изд-во стандартов, 1976. – 7 с.
- Адлер Ю.П., Маркова Ю.В., Грановский Ю.В. Планирование эксперимента при поиске оптимальных условий. Издание второе. М.: Наука, 1976 – 279 с.
- Burney Н.S. Report of the electrolytic industries for the year 1990 / H.S. Burney J.B. Talbot // J. Electrochem. Soc. 1991. — V. 138. — № 10. -P. 3140-3172.
- Kinman R. N. Disinfection / R.N. Kinman H.A. Faber // J. Water Pollut. Control.
 Fed. 1972. — V. 44. — № 6. — P. 972 — 977.
Fed. 1972. — V. 44. — № 6. — P. 972 — 977. - Серпокрылов Н.С., Кожин С.В., Тайвер Е.А. Очистка сточных вод бассейнов для содержания ластоногих до норм оборотного водоснабжения [Электронный ресурс] // «Инженерный вестник Дона», 2011, №1. – Режим доступа: http://www.ivdon.ru/magazine/archive/n1y2011/380 (доступ свободный) – Загл. с экрана. – Яз. рус.
- Серпокрылов Н.С., Петренко С.Е., Борисова В.Ю. Повышение эффективности и надежности очистки сточных вод на разных стадиях эксплуатации очистных сооружений [Электронный ресурс] // «Инженерный вестник Дона», 2013, №3. — Режим доступа: http://www.ivdon.ru/magazine/archive/n2y2013/1602 (доступ свободный) – Загл. с экрана. – Яз. рус.
Гипохлорит натрия для обеззараживания питьевой воды
Главная » Услуги » Электролизный гипохлорит СЧИТАТЬ ПРАВИЛЬНЫМ ВСЯКОЕ
УТВЕРЖДЕНИЕ, ПОЛУЧЕННОЕ
ИЗ ОПЫТА С ПОМОЩЬЮ ИНДУКЦИИ,
ПОКА НЕ БУДУТ ОБНАРУЖЕНЫ
ДРУГИЕ ЯВЛЕНИЯ,
КОТОРЫЕ ОГРАНИЧИВАЮТ
ЭТО УТВЕРЖДЕНИЕ
ИЛИ ПРОТИВОРЕЧАТ ЕМУ.
Исаак Ньютон
Сегодня многие люди понимают необходимость ведения здорового образа жизни, стараются следить за своим здоровьем, весом и физическим тонусом. Однако, если не будет качественной и экологически безопасной воды, то все усилия могут оказаться слабо эффективными. Здесь не будет банальным воспользоваться популярным афоризмом «вода – это жизнь», однако как для ее очистки используется гипохлорит натрия, многим остается загадкой. Ассоциации со всем известной «хлоркой» напрашиваются, но их применение не совсем обоснованно.
Смысл процесса обеззараживания воды в дезинфекции этой важнейшей для существования человека жидкости, то есть, результатом должна стать бактериологически чистая вода, которую можно применять не только для промышленных, но и для домашних нужд. Наличие бактерий в любой среде – это не для кого ни секрет, то, что не все бактерии погибают при кипячении воды, тоже известно большинству людей, а вот как обезвредить наиболее опасных в данном случае бактерий из группы кишечной палочки и др. ? Вот в этом и призван помочь гипохлорит натрия, который защитит от дизентерии и многих других болезней использованием в достаточно несложном и не затратном процессе. Процесс обеззараживания воды гипохлоритом натрия является наиболее эффективным по сравнению с озонированием, ультрафиолетовым облучением, серебрением или обработкой ультразвуком. Однако большие концентрации хлора являются токсичными и вредными не только человеку, но и всей окружающей среде.
? Вот в этом и призван помочь гипохлорит натрия, который защитит от дизентерии и многих других болезней использованием в достаточно несложном и не затратном процессе. Процесс обеззараживания воды гипохлоритом натрия является наиболее эффективным по сравнению с озонированием, ультрафиолетовым облучением, серебрением или обработкой ультразвуком. Однако большие концентрации хлора являются токсичными и вредными не только человеку, но и всей окружающей среде.
Для того, чтобы применение хлорных составов не вызывало осложнений из-за передозировок, не требовалось сложных конструкций химических дозаторов и не было необходимости в постоянных пробах и расчетах, стали применять натрия гипохлорит. Он получается при помощи электролизных установок, которые исключают возможности для неправильной дозировки и дают уверенность в правильности работы системы очистки. Обеззараженная таким образом вода абсолютно не токсична, хотя и натрия гипохлорит требует знаний по его правильному применению, риск здесь минимален. Эффект действия описываемого вещества основан на сильном окислении, которое дает максимальное бактерицидное, туберкулоцидное и вирулицидное влияние на воду. При этом электролизный гипохлорит натрия имеет главное отличие от жидкого хлора – он не токсичен, именно поэтому сейчас многие регионы обращаются именно к этой методике обеззараживания.
Эффект действия описываемого вещества основан на сильном окислении, которое дает максимальное бактерицидное, туберкулоцидное и вирулицидное влияние на воду. При этом электролизный гипохлорит натрия имеет главное отличие от жидкого хлора – он не токсичен, именно поэтому сейчас многие регионы обращаются именно к этой методике обеззараживания.
Технология получения гипохлорита натрия электролизом солевых растворов для обеззараживания питьевых и сточных вод.
При традиционном способе электролиза раствора поваренной соли быстро достигается насыщение по концентрации активного хлора в гипохлорите практически независимо от концентрации соли в начальном растворе (рис. 1) :
рис.1
В практике электролиза, это обстоятельство определяет рабочую концентрацию солевого раствора на уровне 25-30г/л поваренной соли.
По закону М. Фарадея процесс электролиза должен идти иначе (рис.2):
рис.2
Если полученный гипохлорит разбавить водой и провести электролиз
разбавленного продукта, масса превращения соли в гипохлорит увеличивается пропорционально разбавлению (рис. 3), приближаясь к закону электролиза М. Фарадея.
рис.3
Наблюдаемый эффект позволяет начать процесс электролиза с высокой концентрации соли, что позволяет экономить энергию и наиболее эффективно вырабатывает соль. Научное значение полученного результата – уточнение второго закона термодинамики. В соответствии с этим законом устанавливается соотношение между химической работой и тепловой энергией ее сопровождающей. Экспоненциальная зависимость (рис.1) между массой превращенного вещества (химическая работа) и затратами тепловой энергии, когда химическая работа прекращалась, объясняется в соответствии со вторым законом термодинамики энтропийными процессами. Это объяснение вызывает сомнение в применимости второго закона термодинамики к полученным нами результатам: без дополнительных затрат энергии, а лишь за счет подачи воды на разбавление, нам удалось добиться перераспределения затрат энергии в пользу химической работы за счет уменьшения доли тепловой энергии. Это наблюдение открывает доступ к новым инновационным технологиям, получения альтернативной энергии, очистке вод различного назначения от дисперсных частиц.
Цена найденного технологического решения становится понятной, если учесть многочисленные попытки западных фирм, которые несмотря на репутационные потери ( отсутствие патентов и статей по данной технологии) претендовали на интеллектуальную собственность, заключенную в российском патенте №2125120 «Способ электролиза водного раствора соли» и его евразийском аналоге патенте №001666 (см.раздел «Репутация»).
Промышленная реализация новой технологии электролиза
Получение хлора и щелочи методом электролиза
При получении хлора и каустика методом электролиза раствора хлорида натрия производятся гидроксид натрия, хлор и водород. Электролиз проходит на современных мембранных ячейках.
Сырье и продукция
Сырьем для получения хлора и каустика методом электролиза служит соль (NaCl). Её получают из морской воды (рассол), месторождений минерального сырья (каменная соль) или методом выпаривания (вакуумная соль).
Первичные продукты электролиза по мембранной технологии – это гидроксид натрия (каустик 32%), газообразные водород и хлор. Первичные продукты могут быть превращены в пригодные для хранения товарные продукты:
- соляная кислота (HCl 32 % — 36 %)
- натровый щелок 50 %
- жидкий хлор.
Поскольку большие объемы этих продуктов используются в качестве базовых химикатов для самых различных химических конечных продуктов, установки по производству хлора и щелочи эксплуатируются в непосредственном комплексе в следующих отраслях промышленности:
- химическая промышленность
- целлюлозно-бумажная промышленность, для снабжения её отбеливателями
- промышленность с большим потреблением хлора, например, нефтехимия и производство пластмасс (ВХМ, ПВХ, трихлорметан, эпихлоргидрин и т.д.)
- промышленность с большим потреблением натрового щелока (например, металлургическая, фармацевтическая)
Технология и электролизеры
Могут быть предложены электролизеры ведущих мировых производителей, что дает возможность учитывать специфические требования наших заказчиков.
Технология
Комплектная установка для получения хлора и каустика состоит из следующих
технологических узлов:
- Растворение соли (каменная или выварочная соль)
- Первичная очистка рассола
- Тонкая очистка рассола
- Мембранный электролиз с трансформаторно-выпрямительным блоком
- Обработка католита и водорода
- Обработка анолита и хлора
- Сушка, компримирование, сжижение и хранение хлора
- Упаривание щелочи, с чешуированием, расфасовкой и отгрузкой
- Система абсорбции хлора, аварийная абсорбция или получение гипохлорита
- Синтез соляной кислоты (HCl)
Преимущества
- Малое энергопотребление
- Окружающая среда не загрязняется амальгамой или асбестом
- Высокая чистота продукта
- Простота в работе и управлении
- Низкие капитальные и эксплуатационные затраты
Здесь вы сможете ознакомиться с нашими актуальными референтными установками.
Производство гипохлорита натрия на предприятиях водоочистки
Хлорирование продолжает оставаться самым распространенным способом обеззараживания воды в мире. Этот происходит с применением жидкого хлора.
Гипохлорит натрия получают, пропуская электрический ток выпрямителя через раствор обычной поваренной соли, методом электролиза раствора хлористого натрия. Основной задачей при получении гипохлорита натрия является создание таких условий, при которых равновесная концентрация гипохлорит-ионов наступала бы как можно позднее. Регулируя анодную плотность тока на выпрямителе, добиваются запуска процесса облегчения разряд ионов хлора, и концентрация гипохлорит-ионов достигается позднее.
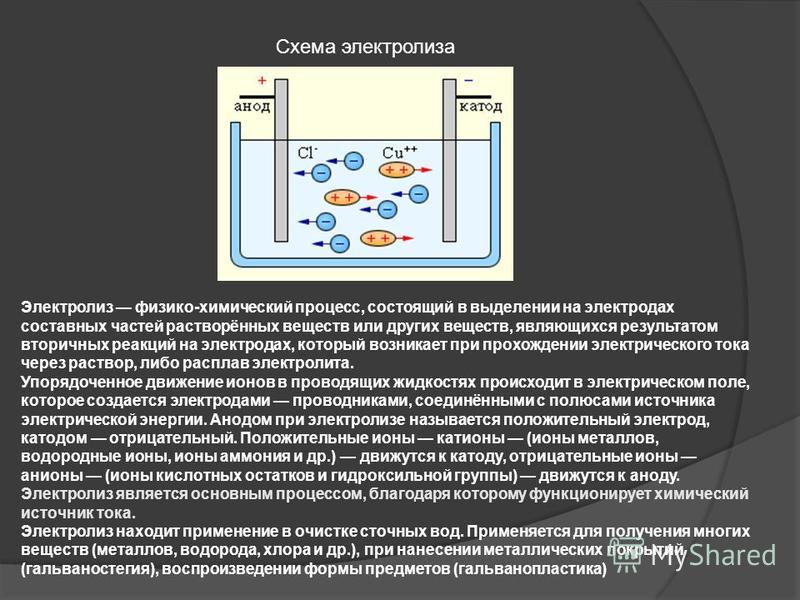
Существуют два пути получения конечного продукта: с применением мембранного разделения катодного и анодного (электродного) пространства электролизера, и без такого разделения.
В мембранной электролизной установке анодное и катодное пространство отделяются друг от друга катион-проницаемой мембраной. При этом, в анодную камеру подается раствор поваренной соли, а в катодную камеру — вода. На катоде вода, под воздействием электрического тока, разлагается на ионы гидроксила и водород. На аноде — хлориды окисляются до молекулярного хлора. Под воздействием электрического тока катионы натрия диффундируют через мембрану, переходят в катодное пространство (католит) и взаимодействуют с анионами, образуя при этом едкий натрий.
Величина выхода по току является основным показателем любого процесса электролиза. Чем выше его значение, тем эффективнее протекает процесс электролиза, тем ниже энергетические затраты на получение единицы готового продукта. При высоких значениях величины выхода по току можно уменьшить требуемую площадь рабочей поверхности электродов, для достижения заданной производительности, применить более компактные установки и снизить расходы на их изготовление. И, хотя целевым продуктом процесса электролиза в нашем случае является гипохлорит натрия, основным показателем процесса надо считать выход по току хлора. Данный процесс не может протекать без использования промышленного выпрямителя тока. Источник постоянного электрического тока должен быть снабжен регулировочным устройством (панелью управления), позволяющим изменять величину тока и напряжение в электрической цепи.
При этом, один из способов получения раствора гипохлорита реализуется через наличие в агрегате такой опции, как «реверс». В этом случае процесс электролиза до реверсирования тока ведут при плотности тока 1-2 кА/м2 в течение 6-7 сут., а к моменту реверсирования плотность тока устанавливают в диапазоне 70-100 А/м2 и разбавляют электролит в 300-400 раз, после чего проводят реверсирование тока и электролиз ведут в течение 0,5-4 ч. Оптимальным выбором источников тока для нормального протекания процесса производства гипохлорита натрия являются промышленные выпрямители тока с реверсом серии Пульсар ПРО или Пульсар СМАРТ.
Выход по току гипохлорита увеличивается с возрастанием анодной плотности тока, так как в этих условиях затрудняется доступ ионов к аноду. При очень малых плотностях тока, отвечающих интервалу потенциалов +0,8 — 1,33 В, на аноде будет выделяться кислород, затем при достижении равновесного потенциала выделения хлора начнется совместное выделение кислорода и хлора, причем с ростом плотности тока, выход по току хлора будет быстро возрастать. При плотностях тока около 1000 А/м2 на выделение кислорода будет расходоваться всего несколько процентов тока.
Повышая напряжение на электролизере в настройках выпрямителя Пульсар ПРО или Пульсар СМАРТ на токоподводящих электродах, увеличивается плотность тока. Таким образом, при сохранении максимально возможного значения выхода по току хлора, можно увеличить (в определенных пределах) производительность установки без существенного отклонения энергетических затрат от минимальных.
Поставки выпрямителей производства ООО «Навиком» на предприятия водоочистки на территории России показали эффективную и стабильную работу в процессе производства гипохлорита натрия.
Гипохлорит натрия, производство раствора гипохлорита натрия, электролиз, хранение, дозирование гипохлорита в электролизных установках, цены.
Основным действующим веществом в гипохлорите натрия (хлорной воде, анолите) является хлорноватистая кислота (НСLO), ион гипохлорита мало активен. Количество хлорноватистой кислоты в растворе дезинфектанта зависит как от указанного % — содержания активного хлора, так и от pH самого раствора:
в кислой и нейтральной среде доля хлорноватистой кислоты, HСlO, составляет 78%, а гипохлорита — 22%,
в щелочной среде, даже при рН=8, доля хлорноватистой кислоты, HСlO, всего- 24%, гипохлорита — 76%.
Технический гипохлорит натрия марки А и В по ГОСТ 11086-76*, получаемый хлорированием водного раствора едкого натра, имеет сильно щелочную среду (массовая концентрация щелочи от 10 до 60 г\л в зависимости от марки). Электролизный гипохлорит натрия выпускается по ТУ производителя. Содержание щелочи в нем не нормируется, зависит от технологии получения. Если производить гипохлорит натрия в электролизерах с анодами из оксидов рутения (ОРТА) или иридия (ОИРТА), которые выпускают почти все российские производители, то он будет иметь щелочную среду (РH 8-12). Как следствие такие гипохлориты имеют невысокие обеззараживающие свойства по сравнению с хлором (хлорной водой, анолитом), расход их на обеззараживание и окисление больше.
Специалисты НПФ РУТТЕХ задались целью получить электролизный гипохлорит с низким содержанием щелочи. Для чего были изготовлены аноды с покрытием из разных металлов платиновой группы и их смесей. Проведенные опыты показали, что на анодах ОРТА и ОИРТА из солевого раствора с содержанием NaCl 25-30 г\л можно получить гипохлорит, содержащий только 8 г\л хлора, а с анодами из смешанных оксидов платиновой группы можно получить те же 8 г\л хлора из солевого раствора, содержащего лишь 15 г\л NaCl. Так как расходуется меньше NaCl, то соответственно вырабатывается и меньше щелочи. В бездиафрагменном электролизере смешиваются кислый раствор, образованный у анода и щелочной раствор, образованный у катода. В результате образовался практически нейтральный раствор гипохлорита натрия.
Так с 2013 года НПФ РУТТЕХ стала выпускать принципиально новые электролизеры серии УЭ ГПХН Сэ с покрытием из смешанных оксидов платиновой группы, которые преобразуют практически всю соль в исходном растворе в хлор, при этом полученный гипохлорит натрия имеет практически нейтральную среду, которая обеспечивает ему высокие окислительные и обеззараживающие свойства.
Производство гипохлорита натрия на установках серии УЭ ГПХН СЭ более экономично.
Если сравнивать с электролизерами с разделительными мембранами (диафрагмами), то гипохлоритные электролизеры УЭ ГПХН СЭ более дешевы, просты в аппаратном оформлении и эксплуатации, не требуют утилизации щелочи, ежегодной замены мембраны, требуют меньше затрат соли и электроэнергии на 1 кг эквивалента активного хлора. Размещение установок на объекте не требует проектной привязки.
Если сравнивать с гипохлоритными электролизерами на базе анодов ОРТА и ОИРТА, то при одной и той же цене на установки себестоимость производства гипохлорита ниже по соли и электроэнергии практически в 1,5 раза.
Физико-химические свойства гипохлорита натрия марки Э,
полученного на установках серии УЭ ГПХН Сэ
| Наименование показателя | Норма | |
| 1 | Химическая формула | NaOCl |
| 2 | Метод получения | Электролиз раствора поваренной соли в бездиафрагменном электролизере |
| 3 | Состав | Хлорноватистая кислота, гипохлорит натрия, перекись водорода, хлор, диоксид хлора |
| 4 | Внешний вид | Бесцветная прозрачная или слегка зеленоватая жидкость |
| 5 | Запах | Хлора |
| 6 | Массовая концентрация активного хлора* | 8 г\л или 0,8% с возможностью доведения до 12 г\л |
| 7 | Массовая концентрация щелочи в пересчете на NaOH** |
Практически отсутствует |
| 8 | рH | Около 7 |
| 9 | Массовая концентрация соли NaCl | Практически отсутствует |
| 10 | Компоненты для производства |
Соль: 1,8-2 кг\кг акх |
| 11 | Себестоимость производства NaOCL | От 20 руб за кг эквивалента активного хлора |
| 12 | Срок хранения | 15 суток в темной стеклянной или полиэтиленовой посуде при температуре не выше 10 градС |
Примечание: Свойства по показателям по п.п. 7-12 отличаются
от свойств гипохлорита натрия, полученного с применением анодов ОРТА и ОИРТА.
*Массовая концентрация активного хлора в гипохлорите определяется:
- Поместите приблизительно 50 см3 дистиллированной воды в коническую колбу.
- Добавьте приблизительно 1 г кристаллов иодида калия.
- Добавьте 20 см3 уксусной кислоты (или приблизительно 10 г кристаллов лимонной кислоты)
- При помощи пипетки отберите 5 см3 конечного продукта УЭ ГПХН (как указано выше) и добавьте в колбу. [Раствор окрашивается в насыщенный красно-коричневый цвет в связи с высвобождением йода].
- Титрируйте раствором тиосульфата натрия 0,1 мол. дм– 3, постепенно добавляя его, пока цвет не исчезнет. По мере исчезновения цвета тиосульфат натрия следует добавлять осторожно, по каплям, чтобы точно определить конечную точку.
- Концентрация раствора, выраженная в эквиваленте хлора Cl2, определяется по следующей формуле: мг/л Cl2 = (Т × 3,456 × 1000)/ (Объем пробы), Где Т – титрирование в см3
**Массовая концентрация щелочи в гипохлорите определяется:
- 1000 см3 раствора гипохлорита, переносят пипеткой в коническую колбу и осторожно небольшими порциями прибавляют 20-25 см3 раствора перекиси водорода, осторожно перемешивая во избежание сильного газовыделения. Через 2-3 мин после прекращения интенсивного газовыделения в колбу прибавляют 2-3 капли фенолфталеина и титруют ее содержимое раствором соляной кислоты до обесцвечивания раствора.
- Обработка результатов: Массовую концентрацию щелочи в пересчете на NaOH (X1), г/дм3, вычисляют по формуле:
где V — объем раствора соляной кислоты концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3;
0,004 — масса гидроокиси натрия, соответствующая 1 см3 раствора соляной кислоты концентрации точно 0,1 моль/дм3, г.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 0,5 г/дм3 при доверительной вероятности Р = 0,95.
- Допускаемая абсолютная суммарная погрешность результатов определения ±0,4 г/дм3 при доверительной вероятности Р = 0,95.
Требования безопасности
- Гипохлорит натрия является окислителем, вызывающим раздражение кожных покровов и слизистой оболочки. Гипохлорит натрия при попадании на кожу может вызвать ожоги, а при попадании в глаза — слепоту. При нагревании выше 35°С гипохлорит натрия разлагается с образованием хлоратов и выделением кислорода.
- Гипохлорит натрия негорюч и невзрывоопасен. Однако при контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызвать их загорание.
- Производственные помещения должны быть оборудованы приточно-вытяжной вентиляцией. Оборудование должно быть герметичным. Негерметичные узлы оборудования должны быть снабжены местными вентиляционными отсосами.
- Производственный персонал должен быть обеспечен специальной одеждой и иметь индивидуальные средства защиты: защитные очки, резиновые сапоги, резиновые перчатки, фартук из прорезиненной ткани и противогаз марки В или ВКФ (ГОСТ 12.4.121-83).
- Гипохлорит натрия не допускается хранить вместе с органическими продуктами, горючими материалами и кислотами.
- При попадании гипохлорита натрия на кожные покровы необходимо обмывать их обильной струей воды в течение 10-12 мин. При попадании брызг продукта в глаза следует немедленно промыть их обильным количеством воды и направить пострадавшего к врачу.
- В случае загорания — тушить водой, песком, углекислотными огнетушителями.
- Разлившийся гипохлорит натрия смыть водой.
Принцип обеззараживания электролизным гипохлоритом натрия
Раствор электролизного гипохлорита натрия смешивают с дезинфицируемой водой в требуемых пропорциях в зависимости от вида обрабатываемых вод и их хлорпоглощаемости. Продолжительность контакта хлора или гипохлорита с водой от момента смешения до поступления воды к ближайшему потребителю следует принимать в соответствии с ГОСТ 2874-82. Контакт хлорсодержащих реагентов с водой надлежит осуществлять в резервуарах чистой воды или специальных контактных резервуарах. При отсутствии попутного водоразбора допускается учитывать продолжительность контакта в водоводах.
Если Вы ранее использовали хлор для обеззараживания воды\стоков, то Вам потребуется то же количество эквивалента хлора в электролизном гипохлорите натрия, произведенного установками УЭ ГПХН СЭ,
Если же Вы ранее использовали технический гипохлорит натрия, то Вам потребуется в 1, 5 раза меньше эквивалента хлора в электролизном гипохлотире натрия, произведенного установками УЭ ГПХН СЭ (уточняется после запуска оборудования на объекте).
Свойства электролизного гипохлорита натрия
- Обладает высокой антимикробной активностью в отношении практически всех патогенных микроорганизмов.
- Обладает последействием.
- Разрушает фенолы – источник неприятного вкуса и запаха.
- Окисляет железо, марганец, сероводород, разрушает сульфид водорода, цианиды, аммиак и другие соединения азота.
- Способствует удалению мутности из воды.
- Удаляет биопленки.
- При содержаниях хлора в гипохлорите до 450 мг\л не образует побочных эффектов хлорирования.
- Уменьшает скорость коррозии водоводов.
- Имеет низкую себестоимость производства.
- Разрешен к применению для обеззараживания воды, стоков, оборотных вод, бассейнов, дельфинариев и пр.
Натрий металлический — ПАО «СЭЗ им. Серго Орджоникидзе»
Digital Mobile Radio – стандарт цифровой радиосвязи.
Разработан для пользователей профессиональной мобильной радиосвязи Европейским институтом телекоммуникационных стандартов (ETSI).
Обеспечивает отказоустойчивый децентрализованный принцип построения сети.
Обеспечивает радиопокрытие меньшим количеством базовых станций.
Обеспечивает централизованную регистрацию переговоров и расширенный функционал диспетчеризации.
Обеспечивает индивидуальные, групповые и аварийные вызовы с приоритетами.
Обеспечивает плавный перевод аналоговых сетей в цифровые.
Обеспечивает помехозащищенную передачу данных.
Стандарты DMR
DMR Tier I
Простейший вариант технологии без сетевой инфраструктуры. Используются маломощные коммерческие рации с мощностью не более 0,5 Вт для безлицензионного использования в 446 MГц диапазоне на ограниченном количестве каналов. Оборудование «DMR Tier I» ориентировано на частных пользователей и малые предприятия, которым не требуются большая зона покрытия и расширенные возможности радиосвязи.
DMR Tier II
Стандарт конвенциональной связи, охватывающий лицензируемые частоты от 66 до 960 МГц. Оборудование профессиональной системы радиосвязи: репитеры, мобильные радиостанции и портативные радиостанции, работающие в лицензируемых полосах частот PMR. «DMR Tier II» ориентирован на пользователей, нуждающихся в максимальной эффективности использования радиочастот, расширенных возможностях голосовой связи и интегрированных услугах передачи данных. Стандарт «DMR Tier II» использует два слота TDMA в одном радиоканале 12,5 кГц.
DMR Tier III
Профессиональные системы цифровой транкинговой радиосвязи, работающие в лицензируемых полосах частот PMR (Professional Mobile Radio). Стандарт «DMR Tier III» использует два слота TDMA в одном радиоканале 12,5 кГц. Поддерживаются голосовые вызовы и короткие текстовые сообщения. Также поддерживаются услуги пакетной передачи данных в различных форматах, включая поддержку протоколов IPv4 и Ipv6.
Сети профессиональной мобильной радиосвязи с технологией SIMULCAST
Одна из существенных проблем при построении сетей профессиональной мобильной радиосвязи (ПМР) в России – обеспечение радиосвязи на большой территории при ограниченном частотном ресурсе. SIMULCASТ (SIMULtaneous broadCAST – технология использования одних и тех же частот для радиосвязи) – эффективное и надежное решение, которое снимает ограничения по созданию единой масштабной зоны радиопокрытия.
Ретрансляторы SIMULCASТ предназначены для абонентов, имеющих в своем распоряжении всего несколько пар радиочастот, но нуждающихся в покрыти
и протяженных и сложных, с географической точки зрения, территорий надежной и качественной связью для передачи голоса и данных.Соединенные между собой ретрансляторы могут быть сконфигурированы как для увеличения обслуживаемой территории, так и для увеличения существующего в зоне обслуживания количества радиоканалов. Данные решения предоставляют пользователям голосовую связь и базовые услуги по передаче данных.
Зона действия сети SIMULCASТ может быть легко расширена простым добавлением базовых станций. Новые базовые станции подключаются к сети, используя только административные и технические мероприятия на объектах инфраструктуры, что исключает проведение трудоемких и длительных работ по изменению конфигурации терминалов.
(PDF) Оптимизация параметров электролитического процесса получения гипохлорита натрия для обеззараживания воды
1
Содержимое этой работы может использоваться в соответствии с условиями лицензии Creative Commons Attribution 3.0. Любое дальнейшее распространение
этой работы должно содержать указание на автора (авторов) и название работы, цитирование журнала и DOI.
Опубликовано по лицензии IOP Publishing Ltd
1234567890
9RNC-IPNT IOP Publishing
IOP Conf.Серия: Физический журнал: конф. Серия 918 (2017) 012028 doi: 10.1088 / 1742-6596 / 918/1/012028
Оптимизация параметров электролитического процесса получения гипохлорита натрия
для обеззараживания воды
Богословский С.Ю., Кузнецов Н.Н., Болдырев В.С.
Отделение химии, МГТУ им. Н. Э. Баумана, Москва,
Россия
E-mail: [email protected]
Аннотация.
Оптимизированы параметры электрохлорирования в проточном и непроточном режимах для
кюветы объемом 1 л.При плотности тока 0,1 А / см2 в диапазоне расходов
от 0,8 до 6,0 л / ч при температуре исходного раствора ниже 20ºС на выходе
поддерживается температура, близкая к оптимальной 40ºС. PH раствора при электролизе
увеличивается до 8,8 ÷ 9,4. Изучали процесс, в котором использовали раствор
с температурой 7-8 ºC и концентрацией хлорида натрия 25 и 35 г / л в непроточной ячейке
. Зависимость концентрации активного хлора от
от времени электролиза меняется с концентрацией исходного раствора хлорида натрия
.При концентрации хлоридов 25 г / л практически линейная зависимость
дает возможность легко выбрать время электролиза с целью получения необходимой концентрации продукта
.
Гипохлорит натрия относится к новому поколению реагентов, используемых для обеззараживания воды
как альтернатива газообразному хлору, и может применяться в виде товарного (технического) гипохлорита
(представляет собой высококонцентрированный сильнощелочной раствор
, произведенный на химических предприятиях с содержанием активного хлора 14%) или произведенный на месте
использования в необходимом количестве путем электролиза хлорида натрия.Этот метод получения гипохлорита
непосредственно в растворе хлорида натрия с помощью электрического тока называется электрохлорированием. Из-за высокой концентрации товарный гипохлорит (CH)
разлагается быстрее, чем полученный непосредственно на месте в ячейке (EH).
Это разложение гипохлорита на хлорат приводит как к потере продукта, так и к появлению в воде нежелательного побочного продукта
. EH производится на месте потребления
по мере необходимости, что сокращает срок хранения перед использованием.CG имеет высокое значение pH
(pH = 12) для обеспечения стабильности продукта. Следовательно, при введении его в воду с высоким содержанием
катионов кальция и магния могут образовываться нерастворимые карбонаты и
гидроксидов. Это приводит к необходимости дополнительной фильтрации воды перед использованием. Наконец, CH
содержит потенциально канцерогенный бромат, концентрация которого не должна превышать 10
мкг / л в ЕС. ЭГ с низким содержанием бромата можно получить за счет использования хлорида натрия
с низким содержанием бромида.Поэтому системы электрохлорирования
все чаще используются вместо технических операций по дозированию гипохлорита.
В качестве технической воды можно использовать морскую воду вместо раствора хлорида натрия [1].
Хлор образуется на аноде в ячейке электролизера; вода разлагается на катоде
с образованием ионов водорода и гидроксила. В открытом реакторе свободно реагенты
Неорганическая химия — Максимально возможная концентрация гипохлорита от электролиза?
Небольшое исследование Википедии показывает, что
Гипохлорит натрия также может быть получен в виде кристаллического пентагидрата $ \ ce {NaOCl · 5 h3O} $, который не взрывоопасен и намного более устойчив, чем безводное соединение.5 Формулу иногда называют $ \ ce {2NaOCl · 10h3O} $. Прозрачные светло-зеленовато-желтые орторомбические [10] [11] кристаллы содержат 44% NaOCl по массе и плавятся при 25−27 ° C. Соединение быстро разлагается при комнатной температуре, поэтому его нужно хранить в холодильнике. Однако при более низких температурах он довольно стабилен: по имеющимся данным, разлагается только 1% через 360 дней при 7 ° C.6 [12]
Таким образом, похоже, что 44% мас. / Об. Будет верхней границей для любого раствора NaOCl в воде, независимо от того, был ли он получен путем электрохлорирования или нет.Это соответствует примерно 43,1% активного хлора.
Также обратите внимание, что термин «активный хлор» измеряет общую окислительную способность, не обязательно концентрацию гипохлорита — гипохлориты могут легко разлагаться на хлораты без изменения общей окислительной способности большего раствора. $$ \ ce {3OCl- (водн.) -> ClO3- (водн.) + 2Cl- (водн.)} $$ как продемонстрировано их молярно-эквивалентными йодометриями $$ \ ce {3OCl- (водн.) + 6I- (водн.) + 6H + (водн.) -> 3I2 (s) + 3Cl- (водн.) + 3h3O (\ ell) \\ ClO3- (водн.) + 6I- ( водн.) + 6H + (водн.) -> 3I2 (s) + Cl- (водн.) + 3h3O (\ ell)} $$ поэтому для более точных измерений концентрации гипохлорита, вероятно, также могут потребоваться дополнительные методы (например, спектроскопия).
Наконец, из-за нестабильного характера растворов с высоким содержанием [NaOCl (aq)] и их естественной склонности к $$ \ ce {2OCl- (водн.) -> 2Cl- (водн.) + O2 (g)} $$ максимизация [NaOCl (водн.)] исключительно посредством электролиза / электрохлорирования, вероятно, потребует специальной установки, которая одновременно:
- Ограничивает воздействие атмосферы вокруг анода, чтобы предотвратить потерю газообразного хлора, позволяя газообразному водороду выходить через катод (или, альтернативно, превращают атмосферный кислород в воду)
- Сохраняет раствор при низких температурах (для ограничения различных других реакций разложения)
- Поддерживает некоторое внешнее «поддерживающее» напряжение (для сохранения равновесия Нернста)
Для практических приложений это может быть очень громоздкой формой хранения!
Как рассол используется в процессе производства хлора
Хлор — это химический элемент с высокой реакционной способностью, который легко соединяется с другими атомами с образованием соединений, имеющих множество практических применений.Обычно в сочетании с натрием в виде соли (NaCl) используются дополнительные процессы для производства гипохлорита натрия (NaOCl), который используется в питьевой воде и санитарной обработке плавательных бассейнов. Хотя эти области применения могут быть наиболее известными, в основном хлор используется в производстве поливинилхлорида (ПВХ) и растворителей, используемых в химической чистке. Чтобы обеспечить такой высокий спрос на хлор, Соединенные Штаты используют промышленный метод производства хлора для производства 14 миллионов тонн в год.Производство хлора из рассола, тщательно обработанного раствора соленой воды, является одним из основных методов, используемых в процессе производства хлора.
Как производится хлор
Процесс производства хлора путем электролиза рассола называется хлорщелочным процессом. В этом промышленном методе производства хлора используются два электрода в солевом растворе с приложением напряжения между ними. Этот процесс пропускает электрический ток через рассол и притягивает ионы в растворе к положительной и отрицательной клеммам.Электролиз рассола отделяет раствор соленой воды через пористую мембрану, в результате чего отрицательный анод притягивает к себе положительно заряженные ионы хлора, в то время как положительный катод собирает отрицательно заряженные ионы водорода, обнаруженные в воде. Оставшийся жидкий раствор затем превращается в щелочь, гидроксид натрия (NaOH), который также имеет много промышленных применений в качестве каустической соды. Использование диафрагмы или ионообменной мембраны поддерживает разделение катода и анода, так что их ионы не рекомбинируют в гипохлорит натрия.Эти отдельные компоненты затем собираются и затем сохраняются для использования по мере необходимости.
Поскольку хлор, производимый в хлорно-щелочном процессе, составляет менее половины производимого гидроксида натрия, промышленность по производству хлора требует больших количеств или рассола для удовлетворения потребностей потребителей. Кроме того, рассол, необходимый для процесса, должен быть подвергнут специальной обработке и требует точных уровней насыщения и чистоты. С этой целью хлорщелочная промышленность в значительной степени полагается на промышленность по производству рассола.
Texas Brine Company — Крупнейший независимый производитель рассола
Крупнейшим независимым производителем рассола в США является Texas Brine Company LLC, обеспечивающая тридцать процентов потребностей в рассоле для хлорно-щелочной промышленности. Наш рассол производится с помощью процесса, называемого добычей раствора. Компания Texas Brine Company LLC разрабатывает богатые солью подземные пещеры, прежде чем использовать контролируемые методы для их наполнения пресной водой. Вода смешивается с солью в пещерах, образуя солевой раствор.Насосы выводят рассол на поверхность, где его можно обработать и использовать в хлорно-щелочном процессе. После завершения обширная сеть подземных каверн, созданная в процессе, используется для безопасного хранения жидкостей, газов и сырой нефти. Компания Texas Brine Company проводит обширные тренинги по технике безопасности и стремится обеспечить безопасные условия труда для своих сотрудников. Являясь членом Американского химического совета, наша компания уделяет особое внимание вовлечению и осведомленности общества в рамках программы Responsible Care®, которая уже более тридцати лет устанавливает стандарты химической промышленности в отношении проблем окружающей среды, безопасности и здоровья.
Гипохлоритные соли — питьевая вода хлорированная; Побочные продукты хлорирования; Некоторые другие галогенированные соединения; Кобальт и соединения кобальта
Абдель-Рахман, М.С. (1985) Фармакокинетика хлора, полученного из диоксида хлора, хлора, хлорамина и хлорида. В: Jolley, R.L., Bull, R.J., Davis, W.P., Katz, S., Roberts, M.H., Jr & Jacobs, V.A., ред., Хлорирование воды: химия, воздействие на окружающую среду и влияние на здоровье , Vol. 5, Анн-Арбор, Мичиган, Lewis Publishers, стр.281–293.
Абернети Д.Дж., Фразелл Дж.Х., Борейко С.Дж. Относительный цитотоксический и трансформирующий потенциал респираторных раздражителей в системе трансформации клеток C3H / 10T1 / 2 (Реферат № Cd-20). Environ. Мутагенез. 1983; 5: 419.
Aieta, E.M. & Roberts, P.V. (1985) Химия оксохлорсодержащих соединений, относящаяся к образованию диоксида хлора. В: Jolley, R.L., Bull, R.J., Davis, W.P., Katz, S., Roberts, M.H., Jr & Jacobs, V.A., ред., Хлорирование воды: химия, воздействие на окружающую среду и влияние на здоровье , Vol.5, Анн-Арбор, Мичиган, Lewis Publishers, стр. 783–794.
Аноним. (1985) Тенденции химической промышленности в 1984 году. В: Japan Chemical Week, ed., Japan Chemical Annual 1985 , Tokyo, The Chemical Daily Co., стр. 14–18.
Аноним. (1989) OPD Chemical Buyers Directory , 76-е ежегодное издание, Нью-Йорк, Schnell Publishing Company, стр 125, 150, 505, 576.
Баум, Б.М., Финли, Дж. Х., Блумбергс, Дж. Х., Эллиотт, Э. Дж. , Шолер, Э и Вутен, Х.Л. (1978) Отбеливающие средства. В: Mark, H.F., Othmer, D.F., Overberger, C.G., Seaborg, G.T. & Grayson, M., eds, Kirk-Othmer Encyclopedia of Chemical Technology , 3-е изд., Vol. 3, Нью-Йорк, John Wiley & Sons, стр. 938–958.
Blabaum C.Дж., Николс М.С. Влияние сильно хлорированной питьевой воды на белых мышей. Варенье. Водопроводные работы доц. 1956; 48: 1503–1506.
Budavari, S., ed. (1989) The Merck Index , 11-е изд., Rahway, NJ, Merck & Co., pp. 254, 1363.
Chemical Information Services Ltd (1988) Справочник мировых производителей химической продукции 1989/90 , Оушенсайд, штат Нью-Йорк, стр. 522.
Eller, RM. (1984a) Руководство по аналитическим методам NIOSH , 3-е изд., Vol. 2, Nuisance Dust, Total, Method 500 , Цинциннати, Огайо, Национальный институт профессиональной безопасности и здоровья, стр. 500–1–500–3.
Эллер, П.М. (1984b) Руководство по аналитическим методам NIOSH , 3-е изд., Vol. 1, Кальций и соединения в виде Ca, метод 7020 , Цинциннати, Огайо, Национальный институт профессиональной безопасности и здоровья, стр. 7020–1–7020–3.
Холдсворт, Г., Макколи, П. и Ревис, штат Нью-Йорк. (1990) Долгосрочное влияние хлорсодержащих дезинфицирующих средств на уровни холестерина и тироксина в плазме крови кроликов и голубей.В: Jolley, R.L., Condie, L.W., Johnson, J.D., Katz, S., Minear, R.A. & Mattice, J.S., eds, Хлорирование воды: химия, воздействие на окружающую среду и влияние на здоровье , Vol. 6, Челси, Мичиган, Lewis Publishers, стр. 319–328.
Ishidate, M., Jr (1987) Книга данных по хромосомной аберрации In Vitro, ред. изд., Токио, Информационный центр наук о жизни, стр. 383.
Jones Chemical (1989) Паспорт безопасности материала, гипохлорит натрия , Нью-Йорк.
Кавачи, Т., Комацу, Т., Када, Т., Ишидатэ, М., Сасаки, М., Сугияма, Т. и Тазима, Ю. (1980) Результаты недавних исследований актуальность различных краткосрочных скрининговых тестов в Японии.В: Williams, G.M., Kroes, R., Waaijers, H.W. & van de Poll, K.W., eds, Прогностическая ценность краткосрочных скрининговых тестов при оценке канцерогенности , Амстердам, Elsevier / North-Holland Biomedical Press, стр. 253–260.
Mannsville Chemical Products Corp.(1987) Химические продукты Сводка: гипохлорит кальция , Эсбери Парк, Нью-Джерси.
Министерство международной торговли и промышленности (1989) Ежегодник статистики химической промышленности , 1988 , Токио, Международная торговая и промышленная ассоциация.
Филип Р., Шеперд К., Фоутроп Ф. и Поулсом Б. (1985) Отравление хлором в домашних условиях (письмо в редакцию). Lancet, ii , 495.
PPG Industries (1990) Отчет о гипохлорите кальция от PPG Chemicals Group , Питтсбург, Пенсильвания.
Сасаки М., Сугимура К., Йошида М.А., Абэ С. Цитогенетические эффекты 60 химических веществ на культивируемые клетки человека и китайского хомячка. Kromosomo II. 1980. 20: 574–584.
Sigma-Aldrich Company (1989) Паспорт безопасности материала, гипохлорит натрия , Гиллингем, Дорсет.
Weast, R.C., ed. (1989) Справочник CRC по химии и физике , 70-е изд., Бока-Ратон, Флорида, CRC Press, стр. B-79, B-117, B-130.
Белый, G.C. (1986) Справочник по хлорированию , 2-е изд., Нью-Йорк, Ван Ностранд Рейнхольд.
Войтович, Я.А. (1979) Хлоркислородные кислоты и соли (оксид хлора, хлорноватистая кислота и гипохлориты).В: Mark, H.F., Othmer, D.F., Overberger, C.G., Seaborg, G.T. & Grayson, M., eds, Kirk-Othmer Encyclopedia of Chemical Technology , 3-е изд., Vol. 5, Нью-Йорк, John Wiley & Sons, стр. 586–611.
Wones, R.G, Mieczkowski, L. & Frohman, L.A. (1990) Влияние хлора питьевой воды на метаболизм липидов и щитовидной железы человека. В: Jolley, R.L., Condie, L.W., Johnson, J.D., Katz, S., Minear, R.A. & Mattice, J.S., eds, Хлорирование воды: химия, воздействие на окружающую среду и влияние на здоровье , Vol.6, Челси, Мичиган, Lewis Publishers, стр. 301–308.
Получение гипохлорита натрия (NaOCl) из раствора хлорида натрия с использованием электродов C / PbO 2 и Pb / PbO 2
G.F. Connell, Справочник по хлорированию / хлораминации: серия по обеззараживанию воды , Американская ассоциация водоснабжения, Денвер, 1996.
Google Scholar
Агентство по охране окружающей среды США, Руководство по альтернативным дезинфицирующим средствам и окислителям , EPA 815-R-99-014, США, 1999.
C.H. Ян, К. Ли и Т. Вен, Образование гипохлорита на бинарном оксиде Ru-Pt для очистки сточных вод от красителей, J. Appl. Электрохим. , 30 (2000) с. 1043.
Артикул CAS Google Scholar
D. Rajkumar and J.G. Ким, Окисление различных реактивных красителей активным хлором, генерируемым на месте, для очистки сточных вод текстильной красильной промышленности, J. Hazard. Матер. , 136 (2006) стр.203.
Статья CAS Google Scholar
К. Скотт, Электрохимические процессы для чистой технологии , Королевское химическое общество, Кембридж, 1995, стр.189.
Google Scholar
Д. Плетчер и Ф.С. Walsh, Industrial Electrochemistry , 2nd. Ed., Chapman and Hall Ltd., Лондон, 1990.
Google Scholar
D.Раджкумар, Дж. Ким и К. Паланивелу, Непрямое электрохимическое окисление фенола в присутствии хлорида для очистки сточных вод, Chem. Англ. Technol. , 28 (2005), стр.98.
Артикул CAS Google Scholar
К. Асокан и К. Субраманиан, Дизайн резервуарного электролизера для in-situ поколения NaClO, [in] Proceedings of the World Congress on Engineering and Computer Science , San Francisco, 2009 , п.139.
D.E. Герхардт и Х.Н.Вильямс, Факторы, влияющие на стабильность растворов гипохлорита натрия, используемых для дезинфекции зубных слепков, Quintessence Int. , 22 (1991), стр.587.
CAS Google Scholar
J.A. Коттоне и Дж. Молинари, Выбор для стоматологической практики химических дезинфицирующих и стерилизующих средств от гепатита и СПИДа, Aust. Вмятина. J. , 32 (1987), стр. 368.
Артикул CAS Google Scholar
Б. Пишкин и М. Тюркюн, Стабильность различных растворов гипохлорита натрия, J. Endodont. , 21 (1995), с.253.
Артикул Google Scholar
G. Gordon, L.C. Адам, Б. Бубнис, К. Куо, Р.С. Кушинг и Р.Х. Сакаджи, Прогнозирование разложения жидкого отбеливателя, J. Am. Водопроводные работы доц. , 89 (1997), стр.142.
CAS Google Scholar
T.M. Фабиан и С. Уокер, Стабильность растворов гипохлорита натрия, Am. J. Hosp. Pharm. , 39 (1982), стр.1016.
CAS Google Scholar
G. Pappalardo, F. Tanner, D. Roussianos и A. Pannatier, Эффективность и стабильность двух хлорсодержащих антисептиков, Drugs Exp. Clin. Res. , 12 (1986) стр.905.
CAS Google Scholar
B.R. Джонсон и Н.А.Ремейкис, Эффективный срок хранения приготовленного гипохлорита натрия, J. Endodont. , 19 (1993), с.40.
Артикул CAS Google Scholar
Г. Гамбарини, Химическая стабильность нагретых эндодонтических ирригантов из гипохлорита натрия, J. Endodont. , 24 (1998), стр. 432.
Артикул CAS Google Scholar
Н.Крстаич, В. Накич и М. Спасоевич, Производство гипохлорита: I. Модель катодных реакций, J. Appl. Электрохим. , 17 (1987) с.77.
Артикул Google Scholar
C.Y. Ченг и Г. Келсалл, Модель производства гипохлорита в электрохимических реакторах с пластиной и пористым анодом, J. Appl. Электрохим. , 37 (2007) с.1203.
Артикул CAS Google Scholar
S.Ю. Баштан, В.В. Гончарук, Р.Д.Чеботарева, В. Беляков, В. Линьков, Производство гипохлорита натрия в электролизере с керамической мембраной, Desalination , 126 (1999) с.77.
Артикул CAS Google Scholar
S.Y. Баштан, В. Гончарук, Р.Д.Чеботарева, В. Линьков, Производство гипохлорита натрия в электролизере с керамической мембраной, Русс. J. Electrochem., 37 (2001), стр.782.
Артикул CAS Google Scholar
Л. Петков, Т. Тодоров, Л. Дарданова, К. Бошнаков, Математическое моделирование процесса электрохимического производства NaClO из разбавленных хлоридных растворов, J. Univ. Chem. Technol. Металл. , 41 (2006), стр.133.
CAS Google Scholar
К. П. Де Паули и С.Trasatti, Композиционные материалы для электрокатализа O 2 выделение: IrO 2+ SnO 2 в растворе кислоты, J. Electroanal. Chem. , 538–539 (2002) с.145.
Google Scholar
A. de Oliveira-Sousa, M.A.S. да Силва, С.А.С. MacHado, L.A. Avaca, P. de Lima-Neto, Влияние метода приготовления на морфологические и электрохимические свойства Ti / IrO 2 электродов с покрытием , Electrochim.Acta , 45 (2000), стр.4467.
Артикул Google Scholar
C.C. Ху, Ч. Ли и Т. Вен, Выделение кислорода и образование гипохлорита на бинарных оксидах Ru-Pt, J. Appl. Электрохим. , 26 (1996) стр.72.
Артикул CAS Google Scholar
C.H. Ян, Производство гипохлорита на электроде из бинарного оксида Ru-Sn и его применение при очистке сточных вод от красителей, Кан.J. Chem. Англ. , 77 (1999) с.1161.
Артикул CAS Google Scholar
A.M. Polacro, S. Palmas, F. Renoldi и M. Mascia, О характеристиках анодов Ti / SnO 2 и Ti / PbO 2 при электрохимическом разложении 2-хлорфенола для очистки сточных вод, J. Appl. Электрохим. , 29 (1999), стр.147.
Артикул Google Scholar
К.К. Нарасимхам и Х.В.К. Удупа, Приготовление и применение анода из диоксида свинца с графитовой подложкой (GSLD), J. Electrochem. Soc. , 123 (1976), стр. 1294.
Артикул CAS Google Scholar
В.Т. Лиу и Г. Kalbus, Анализ гипохлорита в коммерческих жидких отбеливателях кулонометрическим титрованием, J. Chem. Educ. , 52 (1975) p.335
Статья CAS Google Scholar
O.Ž. Павлович, Н.В. Крстаич, М.Д. Спасоевич, Образование броматов на титановом аноде RuO 2 / TiO 2 , Surf. Пальто. Technol. , 34 (1988), стр.177.
Артикул Google Scholar
Дж. Сен-Пьер и А.А. Рэгг, Поведение электрогенерированных пузырьков водорода и кислорода в узкозонных ячейках: Часть II. Применение в производстве хлора, Электрохим. Acta , 38 (1993), p.1705.
Артикул CAS Google Scholar
A.Kraft, M. Stadelmann, M. Blaschke, D. Kreysig, B. Sandt, F. Schröder и J. Rennau, Электрохимическая дезинфекция воды: Часть 1. Производство гипохлорита из очень разбавленных хлоридных растворов, J. Appl. Электрохим ,, 29 (1999), с.861.
CAS Google Scholar
К. Ронко и Г.Дж. Мишкин, Дезинфекция гипохлоритом натрия: применение диализа, Contrib Nephrol. , 154 (2007), стр.7.
Google Scholar
М.Морита, К. Ивакура и Х. Тамура, Анодные характеристики электродов из диоксида марганца, полученных термическим разложением нитрата марганца, Electrochim. Acta , 22 (1977), стр. 325.
Артикул CAS Google Scholar
G.H. Келсалл, Электрогенерация гипохлорита: I. Параметрическое исследование электродной ячейки с параллельными пластинами, J. Appl. Электрохим. , 14 (1984) с.177.
Артикул CAS Google Scholar
П.Ф. Чао, Дж. Борхардт, М. Прист и З. Лю, Технико-экономическое обоснование производства хлора на месте, [in] Proceedings of the Water Environment Federation , 2007, p.943.
Производство хлора — Институт хлора
- Home
- Stewardship
- Хлор
- Производство хлора
Большая часть хлора производится электролитическим способом с помощью процесса диафрагмы, мембраны или ртутного элемента. В каждом процессе раствор соли (хлорид натрия или калия) подвергается электролизу под действием постоянного электрического тока, который преобразует ионы хлора в элементарный хлор.Хлор также получают рядом других способов, например, электролизом расплавленного хлорида натрия или магния с получением элементарного натрия или металлического магния; электролизом соляной кислоты; и неэлектролитическими процессами.
Производство хлора за 2006 г. в коротких тоннах / год оценивается следующим образом:
| Производство хлора | |
|---|---|
| Площадь | Миллион коротких тонн |
| В мире | 65 |
| США | 13.8 |
| Канада | 1,1 |
| Мексика | 0,5 |
Технология мембранных ячеек
В настоящее время в Северной Америке большая часть хлора производится с помощью мембранных элементов. Продуктами этого типа электролизера являются газообразный хлор, газообразный водород и электролит, состоящий из гидроксида натрия и раствора хлорида натрия.
Почти насыщенный раствор хлорида натрия (рассол) поступает в анолитный отсек диафрагменной ячейки и проходит через диафрагму в катодную секцию. Хлорид-ионы окисляются на аноде с образованием газообразного хлора. На катоде образуются газообразный водород и ионы гидроксида. Ионы натрия мигрируют через диафрагму от анодного отсека к катодной стороне с образованием жидкости ячейки, содержащей от 10% до 12% гидроксида натрия. Некоторые ионы хлора также мигрируют через диафрагму, в результате чего клеточный раствор содержит около 16% хлорида натрия.Клеточный раствор обычно концентрируют до 50% гидроксида натрия путем выпаривания. Соль, извлеченная в процессе выпаривания, возвращается в систему рассола для повторного использования.
Технология мембранных ячеек
Технология мембранных элементов использует листы перфторированных полимерных ионообменных мембран для разделения анодов и катодов внутри электролизера. Сверхчистый рассол подается в анодные отсеки, где ионы хлора окисляются с образованием газообразного хлора.Мембраны являются катион-селективными, что приводит к миграции преимущественно ионов натрия и воды через мембраны в катодные отсеки. Вода восстанавливается с образованием газообразного водорода и ионов гидроксида на катодах. В катодном отсеке ионы гидроксида и ионы натрия объединяются с образованием гидроксида натрия.
Мембранные электролизеры обычно производят от 30% до 35% гидроксида натрия, содержащего менее 100 частей на миллион хлорида натрия. Гидроксид натрия можно дополнительно сконцентрировать, обычно до 50%, с помощью испарителей.
Технология ртутных элементов
В технологииMercury Cell в качестве катода используется поток ртути, протекающий по дну электролизера. Аноды подвешены параллельно основанию электролизера, на несколько миллиметров выше текущей ртути. Рассол подается в один конец ящика ячейки и течет под действием силы тяжести между анодами и катодом. Газообразный хлор выделяется и выделяется на аноде.
Ионы натрия осаждаются вдоль поверхности проточного катода ртути.Щелочной металл растворяется в ртути, образуя жидкую амальгаму. Амальгама самотеком перетекает из электролизера в разложитель, заполненный углеродом, куда добавляется деионизированная вода. Вода химически отделяет щелочной металл от ртути с образованием водорода и 50% гидроксида натрия. Затем ртуть перекачивается обратно на вход электролизера, где процесс электролиза повторяется.
Взято из Chlorine Basics (Брошюра 1) , Раздел 2.2. Его можно скачать в нашем книжном магазине.
Как сделать хлорит натрия
Хлорит натрия используется в коммерческих целях для отбеливания тканей и бумаги, а также для очистки и дезинфекции муниципальной воды. Домовладельцы используют хлорит натрия в качестве противообрастающего агента для воды и прекурсора для других легковоспламеняющихся или взрывоопасных химикатов. Есть много разных способов сделать хлорит натрия. В промышленных масштабах диоксид хлора добавляют к гидроксиду натрия и перекиси водорода. Для домашнего химика поваренная соль добавляется в воду для получения насыщенного раствора, затем применяется электричество, чтобы связать O2 из воды с солью.Некоторые люди любят добавлять аккумуляторную кислоту или другой едкий агент, чтобы ускорить процесс, однако это может привести к нестабильному взрывоопасному раствору.
Приготовление хлорита натрия
Налейте 3 литра воды в жаропрочную стеклянную банку с широким горлышком или стеклянный стакан и нагрейте до температуры чуть ниже кипения.
Добавьте 1/2 стакана соли в воду; продолжайте нагревать смесь до полного растворения соли. Когда соль растворится, снимите с огня.
Заточите оба конца карандашей, пока на обоих концах не останется не менее 1 дюйма оголенного грифеля.
Прикрепите провода к одному концу каждого карандаша зажимом типа «крокодил». Убедитесь, что зажим захватывает только провод.
Приклейте картон к горлышку стеклянной банки или химического стакана.
Проделайте в картоне отверстия на дюйм от стенок банки. Вставьте концы карандашей без зажимов типа «крокодил» в отверстия и вставьте в банку, пока оголенный грифель не погрузится в смесь соли и воды.
Присоедините один зажим «крокодил» к отрицательной клемме, а другой зажим «крокодил» — к положительной клемме аккумулятора или солнечной панели. Это обеспечивает электролиз, который превращает NaCl в NaclO2. Подождите не менее 16 часов перед отключением электролиза.
Отсоедините зажимы типа «крокодил» от батареи или солнечной панели и карандашей. Достаньте карандаши и картон из стеклянных банок.
Выровняйте воронку с кофейным фильтром и поместите в пластиковый контейнер.Вылейте смесь соли и воды через воронку с фильтром. Хлорит натрия будет улавливаться кофейным фильтром.
Снимите кофейный фильтр с воронки и осторожно поместите на решетку для сушки стороной, на которую налилась смесь соли и воды.


 В., Кульский Л. А. Современные малоизнашиваемые аноды и перспективы развития электрохимических технологий водообработки // Химия и технология воды. – 1993. Т. 15.–№ 3. – С. 180 – 231.
В., Кульский Л. А. Современные малоизнашиваемые аноды и перспективы развития электрохимических технологий водообработки // Химия и технология воды. – 1993. Т. 15.–№ 3. – С. 180 – 231. по электрохимии. 1982. — Т. 2. — С. 316.
по электрохимии. 1982. — Т. 2. — С. 316.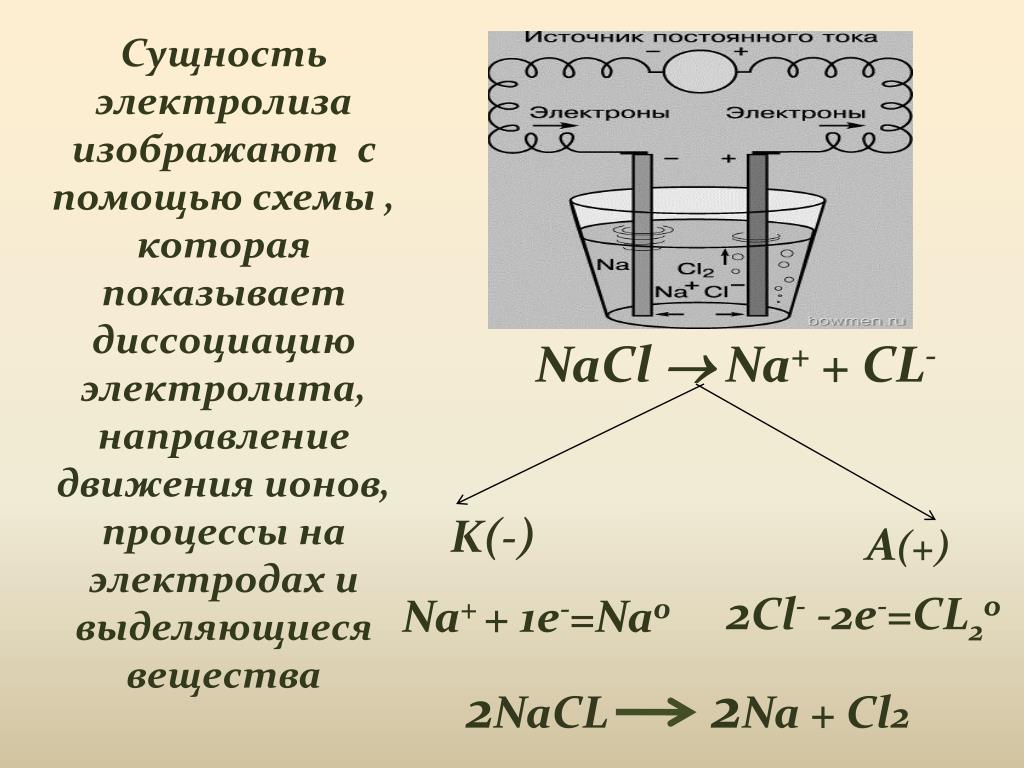 – 1988. – Т. 10. – № 5. – С. 438 – 441.
– 1988. – Т. 10. – № 5. – С. 438 – 441.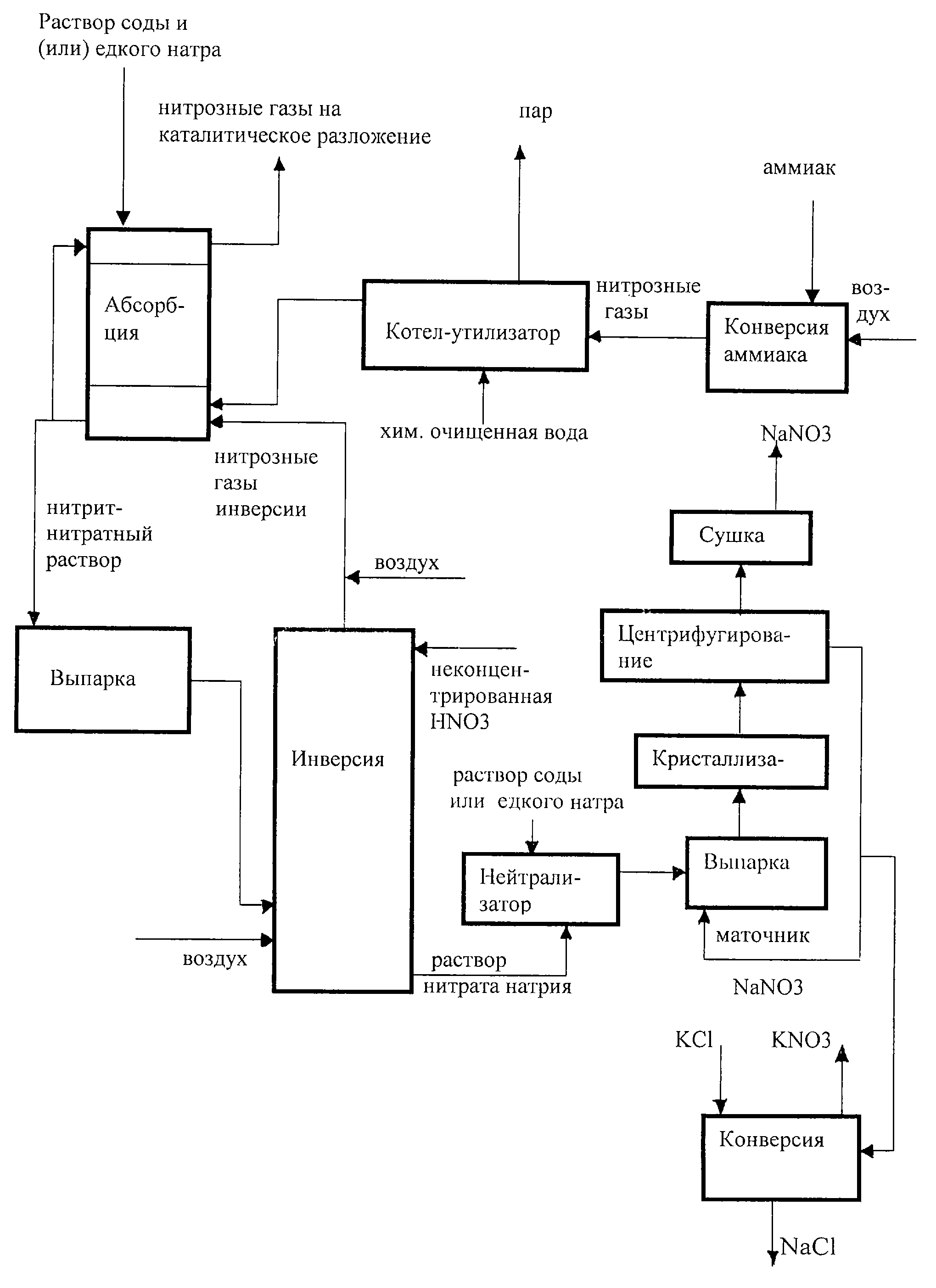 Fed. 1972. — V. 44. — № 6. — P. 972 — 977.
Fed. 1972. — V. 44. — № 6. — P. 972 — 977.