Количественное осаждение соли бария. Задачи 103
Задача 103.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество Ba(NO3)2, навеска массой 0,85г; осадитель К2SO4, концентрация 1М.
Решение:
Уравнение реакции осаждения:
Ba(NO3)2 + К2SO4 = BaSO4↓ + 2КNO3
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
где MЭ[Ba(NO3)2] = M[Ba(NO3)2]/2 = 261,327/2 = 130,66 г/моль;
MЭK2SO4 = 71,23г/моль..
Согласно закону равенства эквивалентов:
Теперь рассчитаем объём раствора К2SO4, теоретически необходимый для осаждения 0,85г Ba(NO3)2 из пропорции:
100 : 30 = х : 0,327;
х = (0,327  100)/30 = 1,09см3.
100)/30 = 1,09см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём К2SO4, необходимый для осаждения:
V(К2SO4) = (1,5 . 1,06 )= 1,6см3.
Условия осаждения: Определение осложняется тем, что BaSO4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- при осаждении BaSO4 к раствору добавляют небольшое количество НСl, что повышает растворимость осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(К2SO4) = 1,6см3
Количественное осаждение хлорида бария
Задача 104.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество BaCl2, навеска массой 0,60г; осадитель AgNO3, концентрация 1М.
Решение:
Уравнение реакции осаждения:
2AgNO3 + BaCl2 = 2AgCl↓ + Ba(NO3)2
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
где
СN(AgNO
MЭ(BaCl2) = M(BaCl2)/2 = 208,233/2 = 164,116 г/моль.
Согласно закону равенства эквивалентов:
Теперь рассчитаем объём раствора AgNO3, теоретически необходимый для осаждения 0,60г BaCl2 из пропорции:
1000 : 1 = х : 0,0058;
х = (0. 0058 . 1000)/1 = 5,8см3.
0058 . 1000)/1 = 5,8см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём AgNO3, необходимый для осаждения:
V(AgNO3) = 1,5 . 5,8 = 8,7см3.
Условия осаждения: Определение осложняется тем, что AgNO3 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(AgNO3) = 8,7см3.
Хлопин В. Г. Избранные труды. Т. 1. — 1957 — Электронная библиотека «История Росатома»
Хлопин В. Г. Избранные труды. Т. 1. — 1957 — Электронная библиотека «История Росатома»Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
ОбложкаФронтиспис12345678910111213141516 пустая1718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142143144145146147148149150151152153154155156157158159160161162163164165166167168169170171172173174175176177178179180181182183184185186187188189190191192193194195196197198199200201202203204205206207208209210211212213214215216217218219220221222223224225226227228229230231232233234235236237238 пустая239240 пустая241242243244245246247248249250251252253254255256257258259260261262263264265266267268269270271272273274275276 пустая277278279280281282283284285286287288289290291292293294295296297298299300301302303304305306307308309310311312313314 пустая315316 пустая317318319320321322323324325326327328329330331332333334335336337338339340341342343344345346347348349350351352353354355356357358359360361362363364365366367368369370371372372 вкл. 1
1
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
ФронтисписФронтиспис
1Титульные листы
3От редакции
5Ратнер А. П.
Академик Виталий Григорьевич Хлопин. (Биографический очерк)15Работы по распределению электролитов между твердой и жидкой фазами
17Хлопин В.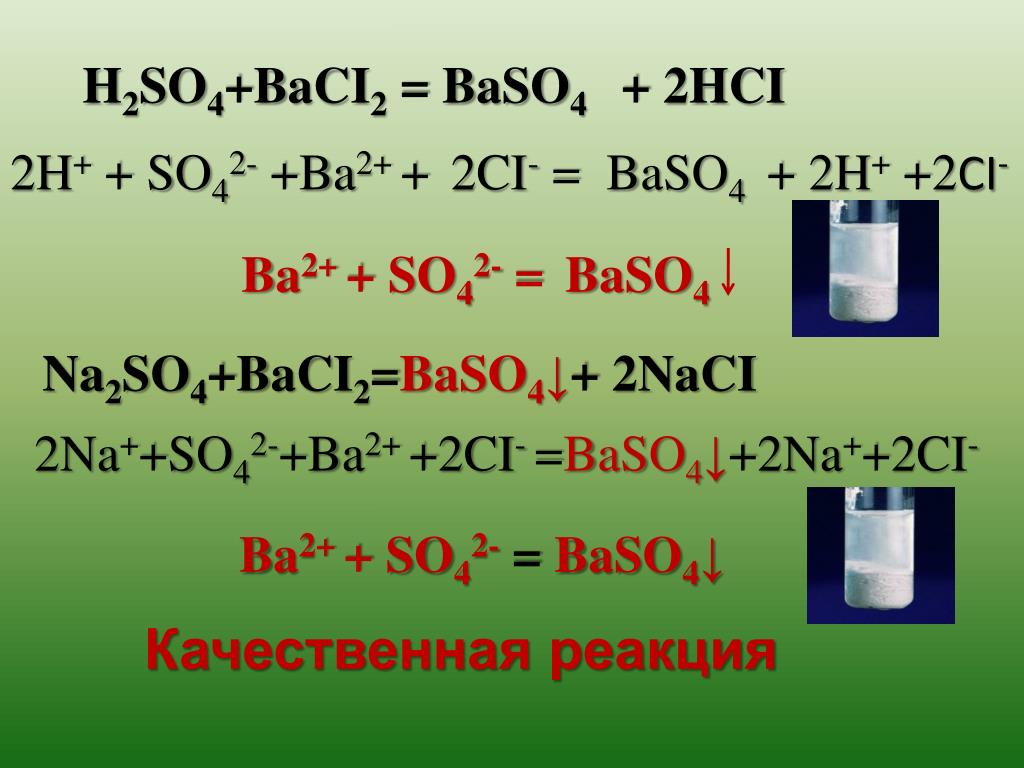
Хлопин В. Г.
К вопросу об отделении радия от бария 83Хлопин В. Г.
Опыт теории дробной кристаллизации радиоактивных веществ 87Хлопин В. Г., Пасвик М. А.
Дробное осаждение бромистых соединений бария и радия постоянно кипящим гидратом бромистоводородной кислоты 90Хлопин В. Г.
К изучению дробной кристаллизации радиоактивных веществ. Сообщение I. Опыт теории этого процесса 104Хлопин В. Г., Никитин Б. А.
К изучению дробной кристаллизации радиоактивных веществ. Сообщение II. Равновесие в системе бромистый барий—бромистый радий—бромистоводородная кислота и вода при t = 0° и t = 25° 123Хлопин В. Г., Полесицкий А. Е.
К изучению дробной кристаллизации радиоактивных веществ. Сообщение III. Распределение радия между твердым кристаллическим BaCl2·2H2O и его насыщенным водным раствором при t = 0° и t = 35° 130Хлопин В. Г., Полесицкий А. Е., Толмачев П. И.
К изучению дробной кристаллизации радиоактивных веществ. Сообщение IV. Распределение радия между твердым кристаллическим нитратом бария и его насыщенным водным раствором при t = 0° и t = 25° 137
Сообщение IV. Распределение радия между твердым кристаллическим нитратом бария и его насыщенным водным раствором при t = 0° и t = 25° 137Хлопин В. Г., Полесицкий А. Е.
К изучению дробной кристаллизации радиоактивных веществ. Сообщение V. Распределение радия между смешанными кристаллами нитратов бария и свинца различного состава и их насыщенным водным раствором при t = 25° 145Хлопин В. Г., Ратнер А. П.
К изучению дробной кристаллизации радиоактивных веществ. Сообщение VI. Распределение радия между кристаллами азотнокислого свинца и их насыщенными растворами при t = 0° и t = 25° 151Хлопин В. Г., Толмачев П. И.
К изучению дробной кристаллизации радиоактивных веществ. Сообщение VII. Распределение радия между кристаллами азотнокислого бария и его насыщенным раствором, содержащим азотную кислоту, при t = 0° и t = 25° 156Хлопин В. Г.
Может ли существовать истинное равновесие между смешанными кристаллами и раствором, из которого они выделились? 159Хлопин В. Г., Полесицкий А. Е., Ратнер А. П., Толмачев П. И.
Г., Полесицкий А. Е., Ратнер А. П., Толмачев П. И.
Хлопин В. Г.
Распределение электролита между твердой кристаллической и жидкой фазами 212Хлопин В. Г., Клокман В. Р.
Распределение радия между расплавом и кристаллами неизоморфных солей 217Хлопин В. Г., Клокман В. Р.
Распределение радия между расплавом и кристаллами изоморфных солей 227Хлопин В. Г., Клокман В. Р., Мурин А. Н., Нефедов В. Д.
О механизме достижения равновесия при распределении микрокомпонента между твердой кристаллической изоморфной фазой и расплавом 239Работы по применению радиоэлементов для изучения строения аномальных смешанных кристаллов 241Хлопин В. Г., Никитин Б. А.
К вопросу о существовании смешанных кристаллов нового рода типа BaSO4 — KMnO4 253Хлопин В. Г., Толстая М. А.
А.
Хлопин В. Г., Меркулова М. С.
Распределение изотопов тория между кристаллами фтористого лантана и их насыщенным раствором в 3 и 12% HNO3 при температуре 100° 269Хлопин В. Г., Меркулова М. С.
Распределение радия между кристаллами фтористого лантана и их насыщенным раствором в 3% азотной кислоте при температуре 100° 272Хлопин В. Г.
Общий метод определения состава и молекулярной структуры химического соединения элементов, находящихся в радиохимических, т. е. невесомых количествахХлопин В. Г., Кузнецова В. И.
Адсорбция радия на сернокислом свинце 286Хлопин В. Г., Меркулова М. С.
Радиоактивные методы определения абсолютной поверхности кристаллических суспензий 302Хлопин В. Г., Меркулова М. С.
Адсорбция радия на сернокислом свинце в присутствии поверхностно-активных веществ315Разные работы по радиохимии
317Хлопин В. Г., Баранов В. И., Соколов В. А.
Г., Баранов В. И., Соколов В. А.
Хлопин В. Г., Самарцева А. Г.
Исследования по химии полония 325Хлопин В. Г.
Химия радиоэлементов 339Хлопин В. Г.
Технология радиоактивных веществ 348Хлопин В. Г.
Превращение элементов и периодический закон371Содержание
372Концевая страница
372 вкл. 1Опечатки
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации).
 Права Администрации
Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
Права Администрации
Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей или в соответствии с условиями, установленными такими правообладателями. Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также
индивидуальные предприниматели (далее — «Пользователи»).

- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.
- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям
(третьим лицам).

- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.
- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома»
(www.
 biblioatom.ru)
biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт — электронная библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован материал.
- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома»
(www.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-,
видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.

- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.
- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование
прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.

- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес [email protected] направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем.
 В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте. Администрация Сайта обязуется уведомить заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес, указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация Сайта вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все возможные меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес [email protected] направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем.
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование
прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
Ba(NO3)2, Mg(NO3)2 и AgNO3 | Wyzant Спросите эксперта
Химия Органическая химия
Монзеррат М.
спросил 15/10/22 Допустим, вы начинаете с водного раствора различных соединений и хотите их разделить.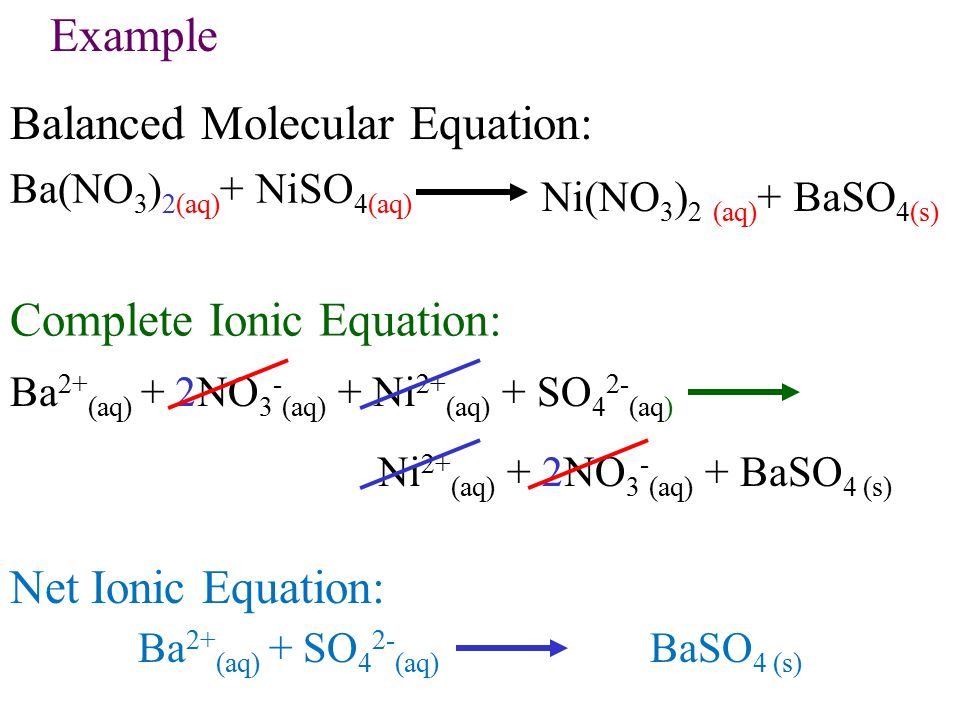 Стратегия состоит в выборе химиката, который будет селективно осаждать один компонент смеси за раз. Вы отделяете осадок физическими методами (например, фильтрованием, центрифугированием), а затем продолжаете реакцию остальной смеси с другим химическим веществом, которое будет селективно осаждать другой компонент, и так далее.
Стратегия состоит в выборе химиката, который будет селективно осаждать один компонент смеси за раз. Вы отделяете осадок физическими методами (например, фильтрованием, центрифугированием), а затем продолжаете реакцию остальной смеси с другим химическим веществом, которое будет селективно осаждать другой компонент, и так далее.
Для этого упражнения предположим, что вы начинаете с водной смеси, содержащей следующие соединения: Ba(NO 3 ) 2 , Mg(NO 3 ) 2 и AgNO 3 11 также есть отдельные растворы, по одному: K 2 SO 4 ( водный раствор ), KCl ( водный раствор ) и KOH ( водный раствор ). Назовем их реагентами для контрольного теста .
Ваша задача — предложить пошаговую процедуру последовательного разделения катионов в вашей смеси. Необходимо указать
- Какой реагент для контрольного заражения добавить,
- Какой катион выпадет в осадок,
- Уравнение этой реакции и
- Как отделить осадок от остальной смеси, чтобы можно было перейти к следующему контрольному реагенту.

Подписаться І 1
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Маргарет С. ответил 15.10.22
Репетитор
5,0 (484)
Кандидат химических наук со стажем преподавания более 15 лет
Об этом репетиторе ›
Об этом репетиторе ›
Раствор содержит Ba(NO 3 ) 2 , Mg(NO 3 ) 2 и AgNO 3
Сначала добавьте KCl. Он осаждает AgCl. BaCl 2 и MgCl 2 растворимы.
AgNO 3 (водн.) + KCl (водн.) → AgCl(тв) + KNO 3 (водн. )
)
чистое ионное Ag + (водн.) + Cl — (водн.) → AgCl(тв.) )
Центрифуга, твердый AgCl будет на дне, Раствор BaCl 2 и MgCl 2 можно декантировать.
К декантированному раствору, содержащему BaCl 2 и MgCl 2 , добавить K 2 SO 4 . BaSO 4 выпадет в осадок, а MgSO 4 растворим.
BaCl 2 (водн.) + K 2 SO 4 (водн.) → BaSO 4 (тв.) + 2KCl (водн.) 4 2- (водн.) → BaSO 4 (т)
Центрифуга твердая BaSO 4 будет внизу. Раствор MgCl 2 можно декантировать.
ИЛИ
вы можете использовать KOH для второго шага. Ba(OH) 2 растворим, и Mg(OH) 2 выпадет в осадок.
MgCl 2 (водн.) + 2KOH (водн.) → 2KCl (водн.) + Mg(OH) 2 (тв.)
нетто ионный: Mg 2+ (водн. ) + 2OH
) + 2OH
0 (водн. 90 ) → Mg(OH) 2 (s)
Центрифуга, твердый Mg(OH) 2 будет на дне, Раствор Ba(OH) 2 можно декантировать.
В обоих случаях вместо центрифугирования можно использовать фильтрацию. Твердое вещество останется на фильтровальной бумаге.
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Принцип Ле-Шателье в равновесии
- Химия
- Общая химия
- 595064
Не то, что вы ищете? Найдите наши решения ИЛИ задайте свой собственный вопрос.
Этот контент был скопирован с сайта BrainMass.com. Просмотрите оригинал и получите готовое решение здесь!
Наблюдения:
1 1 мл Ba(NO3)2 + 0,5 мл K2CrO4 + капли HCl? + капли NaOH? «Ba(NO3)2=прозрачный и бесцветный
Ba(NO3)2 + K2CrO4= желтый мутный раствор (осадок)
HCl= прозрачный желтый раствор (осадок растворен)
NaOH = желтоватый мутный раствор (осадок возвращается при нейтрализации кислотой) »
2 1 мл Ba(NO3)2 + 0,5 мл K2Cr2O7 + 10 капель HCl «Ba(NO3)2 = прозрачный и бесцветный
Ba(NO3)2 + K2Cr2O7 = оранжевый -желтый слегка мутный раствор (мутная реакция d/t с дистиллированной водой))
HCl= прозрачный желтоватый раствор (без осадка) »
3 1 мл Ba(NO3)2 + 5 капель HCl + 5 капель K2CrO4 «Ba(NO3)2= прозрачный и бесцветный
Ba(NO3)2 + HCl= прозрачный и бесцветный (подкисленный нитрат бария)
+K2CrO4= желтый прозрачный раствор (без осадка d/t быстро превращается в дихромат) »
4 1 мл Ba(NO3)2 + 5 капель Ch4CO2H + 5 капель K2CrO4 «Ba(NO3)2=прозрачный и бесцветный
Ba(NO3)2 + Ch4CO2H (уксусная кислота)= прозрачный и бесцветный
+K2CrO4= желтый мутный раствор ( образовавшийся осадок b/c уксусная кислота является слабой кислотой) »
1) Объясните, что произошло в каждом тесте относительно принципа Ле Шателье
2) При добавлении нескольких капель раствора фторида натрия к раствору, содержащему ионы железа (III), получается бесцветный раствор. Однако при добавлении нескольких капель хлорида натрия к раствору
Однако при добавлении нескольких капель хлорида натрия к раствору
Fe³⁺(водн.) + 6F‾(водн.) ⇋ FeF₆³‾(водн.)
(бледно-желтый) (бесцветный)
, содержащий ионы железа (III), получается бледно-желтый раствор, при этом желтый цвет становится темнее, чем больше хлорида натрия добавлен.
Fe³⁺(водн.) + 4Cl‾(водн.) ⇋ FeCl₄‾(водн.)
(бледно-желтый) (интенсивно-желтый)
Предскажите, что произойдет, если раствор фторида натрия добавить к раствору, приготовленному из железа (III ) и растворы хлорида натрия. Обоснуйте свой прогноз с точки зрения принципа Ле Шателье.
https://brainmass.com/chemistry/general-chemistry/lechateliers-principle-equilibria-595064
Приложения
- Chem 218 Lab D3.pages.zip
Предварительный просмотр решения
Ba 2+ + 2 NO3- + CrO42- + 2K+ —-> BaCrO4 + K+ + NO3-
бесцветный желтовато-желтый ppt
002
Добавление HCl похоже на добавление ионов H+.

 Права Администрации
Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
Права Администрации
Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.


 biblioatom.ru)
biblioatom.ru)


 В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;

