Бактерицидная установка — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
| Характеристика бактерицидных установок. [1] |
Бактерицидные установки различаются по производительности, типам источников ультрафиолетового излучения, расчетного давления и конструктивного оформления. [2]
Бактерицидные установки применяются для обеззараживания воды на централизованных хозяйственно-питьевых водопроводах с подземными и поверхностными источниками водоснабжения. [3]
Бактерицидная установка ОВ-АКХ-1 позволяет объединить в одном помещении до шести пятикамерных секций, располагаемых параллельно друг другу. [4]
Бактерицидная установка ОВ-АКХ-1 позволяет объединить в одном помещении до шести пятикамерных секций, располагаемых параллельно друг другу. Так как одна секция обычно является резервной, то максимальная суточная рабочая производительность всей установки может достигать QcyT 180 — 5 — 2421 600 м3 / сутки.
| Общий вид бактерицидной установки ОВ-ЗП-РКС 1 — камера облучения. 2 — шкаф электропитания и управления. 3 — смотровые окна. 4 — кран-воздушник. [6] |
Конструктивно бактерицидная установка выполнена в виде герметичной камеры облучения ( рис. 49), в которой расположена бактерицидная лампа в кварцевом чехле. Последний защищает лампу от контакта с водой, но свободно пропускает лучи ультрафиолетового спектра. [7]
Бактерицидная установка марки ОВ-1П ( рис. IV.17) состоит из камеры, в которой устроен кварцевый чехол, внутри которого размещена бактерицидная лампа, и пусковой аппаратуры. [8]
Бактерицидную установку включают в следующем порядке. Камеру заполняют водой и выпускают находящийся в ней воздух; только после этого включают лампу УФ-излучения. Включение лампы без наполнения камеры водой запрещается. Через 10 — 15 мин после зажигания лампы следует открывать задвижку на трубопроводе обеззараженной воды.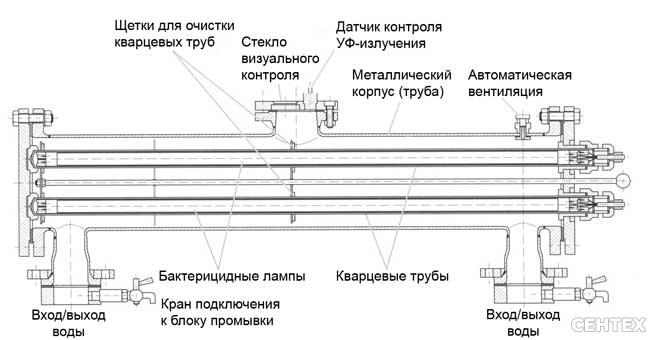
Если бактерицидные установки предназначены для обеззараживания воды из поверхностных источников, прошедшей обработку на водоочистных сооружениях, то расход электроэнергии составляет до 30 вт-ч на 1 мъ. [10]
Расчет бактерицидных установок следует производить на основании экспериментального определения коэффициента поглощения бактерицидного излучения обрабатываемой водой. [11]
Пуск бактерицидной установки в эксплуатацию производится с разрешения местных органов санитарно-эпидемиологической службы. Общая техническая эксплуатация установок осуществляется в соответствии с инструкцией завода-изготовителя. Обслуживающий персонал должен пройти специальную подготовку, в том числе по общим и дополнительным правилам техники безопасности. [12]
Трехкамерная: бактерицидная установка производительно -; стью 400ft м3 / суткй находится в эксплуатации с 19 мая 1958 г. на водопроводе-т. Вода на установку подается из сква: ; жииы. [13]
[13]
При монтаже бактерицидных установок необходимо принимать меры защиты кварцевых чехлов. [14]
При проектировании бактерицидных установок нужно стремиться к тому, чтобы арматура направляла бактерицидный поток в верхнюю зону. [15]
Страницы: 1 2 3 4
Установка для обеззараживания воды
Авторы патента:
Абдулов Н.М. (RU)
7 C02F1/00 —
Установка для обеззараживания воды предназначена для применения в системе водоснабжения. Полезная модель способная обеззараживать воду одновременно и ультрафиолетовым излучением, и озоном. Для этого в ламподержателе аргонно-дуговой лампы, предусмотрены отверстия, а корпус установки снабжен штуцерами для подачи и выхода воздуха. В качестве источника ультрафиолетового излучения и генератора озона применена дуговая ртутная люминесцентная лампа (например, типа ДРЛ), у которой удален внешний стеклянный баллон, заполненный углекислым газом.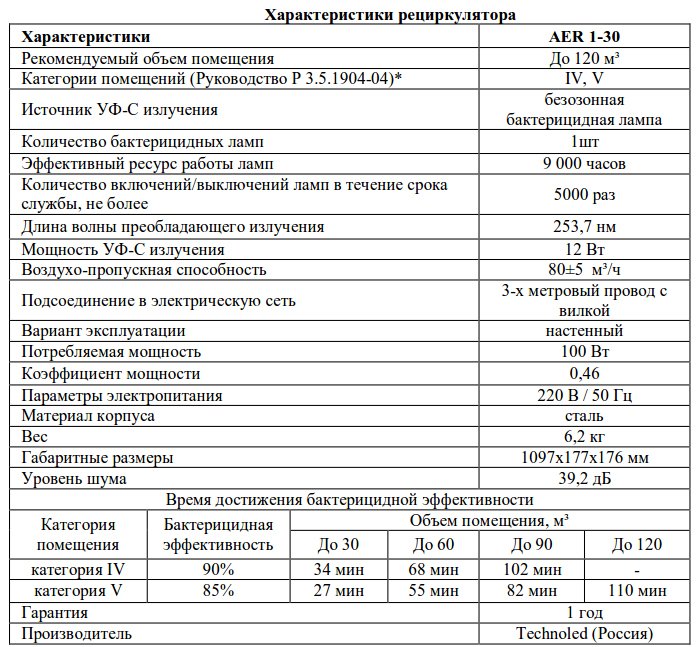
Установка для обеззараживания воды предназначена для применения в системе водоснабжения.
Известен способ обеззараживания воды путем хлорирования. Однако применение этого способа, вследствие токсичности хлора, требует особых мер предосторожности при транспортировке, хранении и дозировании. Кроме того, хлор действует только на вегетативные виды бактерий. Спорообразующие бактерии при обычно применяемых дозах хлора не погибают.
Более действенным способом обеззараживания воды является обработка воды бактерицидными лучами. Действие бактерицидного облучения является почти мгновенным. Обеззараживание воды происходит вследствие фотохимического воздействия на бактерии, находящиеся в воде, ультрафиолетовой бактерицидной энергией, излучаемой специальными лампами. Например, аргонно-ртутными лампами низкого давления типа БУВ-30 и БУВ-60П, а также ртутно-кварцевыми лампами высокого давления типа ПРК-7 и РКС-2,5 (В.Ф.Кожинов, «Очистка питьевой и технической воды». Издательство литературы по строительству, Москва, 1971). На этом принципе основана работа установки с источниками бактерицидного излучения типа ОВ-1П-РКС. Установка включает в себя корпус, внутри которого размещена ртутно-кварцевая лампа в кварцевом чехле. Очищаемая вода через входной патрубок подается в полость установки, и после облучения выпускается через выходной патрубок. Для интенсификации смешивания воды предусмотрена спираль. А для очистки кварцевого чехла лампы от налета, предусмотрены вращающиеся щетки. Для электропитания установки и ртутно-кварцевой лампы предназначен шкаф и высоковольтные кабели.
Например, аргонно-ртутными лампами низкого давления типа БУВ-30 и БУВ-60П, а также ртутно-кварцевыми лампами высокого давления типа ПРК-7 и РКС-2,5 (В.Ф.Кожинов, «Очистка питьевой и технической воды». Издательство литературы по строительству, Москва, 1971). На этом принципе основана работа установки с источниками бактерицидного излучения типа ОВ-1П-РКС. Установка включает в себя корпус, внутри которого размещена ртутно-кварцевая лампа в кварцевом чехле. Очищаемая вода через входной патрубок подается в полость установки, и после облучения выпускается через выходной патрубок. Для интенсификации смешивания воды предусмотрена спираль. А для очистки кварцевого чехла лампы от налета, предусмотрены вращающиеся щетки. Для электропитания установки и ртутно-кварцевой лампы предназначен шкаф и высоковольтные кабели.
Известно также, что для обеззараживания воды применяется озон. Озон обладает свойством быстро разлагаться в воздухе и, особенно в воде. Растворимость озона в воде находится под заметным влиянием рН и количества веществ, растворенных в воде; небольшое содержание кислот и нейтральных солей усиливает растворимость озона, а наличие щелочей снижает ее.
электродов водой. Так как озон является отравляющим веществом, то для предотвращения превышения концентрации озона сверх допустимой нормы, озонатор снабжен автоматической системой управления.
Недостаток обоих конструкций в том, что они применяются в отдельности.
Целью предлагаемой полезной модели является создание универсальной установки для обеззараживания воды, способной обрабатывать воду одновременно и ультрафиолетовым излучением и озоном.
Достигается данная цель путем подачи воздуха в полость кварцевого чехла, в которой размещены ртутные лампы. Для этого в ламподержателе предусмотрены отверстия, и корпус установки снабжен штуцерами для подачи и выхода воздуха. При этом в качестве источника ультрафиолетового излучения и генератора озона применена дуговая ртутная люминесцентная лампа (например, типа ДРЛ), у которой удален внешний стеклянный баллон, заполненный углекислым газом. Внутри лампы остается только кварцевая газоразрядная трубка, наполненная аргоном и ртутью, а также подводящие высоковольтные электроды. При подаче на электроды кварцевой трубки высокого напряжения возникает газовый разряд в смеси паров ртути с аргоном с выделением ультрафиолетового излучения.
Конструкция установки для обеззараживания воды приведена на фигуре. Установка состоит из корпуса 1 с водным 2 и выходным 3 патрубками для подачи воды. Внутри корпуса с двух сторон размещены ламподержатели 4 с патронами 5 и кварцевыми газоразрядными трубками 6, с высоковольтными подводящими электродами (на чертеже не указаны). Кварцевые трубки размещены в кварцевом цилиндрическом чехле 7, с уплотнительными кольцами 8. В ламподержатели по окружности выполнены отверстия 9. С торцов корпус установки снабжен гайками 10 с входным 11 и выходным 12 штуцерами. 13- водяная рубашка.
Установка работает следующим образом:
Через входной патрубок 2 в водяную рубашку 13 подается предварительно очищенная от примесей вода. Вода, заполнив водяную рубашку, размещенную между корпусом установки и кварцевым цилиндрическим чехлом, и подвергнувшись облучению ультрафиолетовыми лучами, вырабатываемыми кварцевыми газоразрядными трубками 6, через выходной патрубок 3 поступает в накопитель. Дополнительно вода охлаждает кварцевый чехол.
Дополнительно вода охлаждает кварцевый чехол.
Одновременно через входной штуцер 11 в корпус установки компрессором подается предварительно очищенный фильтрами воздух. Воздух, пройдя отверстия 9 ламподержателя и полость кварцевого чехла 7, через выходной штуцер 12 подается для озонирования воды в накопителе, прошедшей обработку ультрафиолетовым излучением.
Таким образом, вода подвергается двойному обеззараживанию: ультрафиолетовыми лучами и озоном.
Установка для обеззараживания воды, включающая фильтры очистки воды и воздуха, воздушный компрессор, высоковольтный источник напряжения, систему управления и контроля электрооборудованием, корпус с входным и выходным водяными патрубками, внутри которого размещены аргонно-ртутные лампы с ламподержателями, кварцевый кожух с уплотнительными кольцами, щетки для очистки поверхности кварцевого кожуха, спираль для перемешивания воды, отличающийся тем, что ламподержатель выполнен с отверстиями, а корпус установки снабжен входным и выходным штуцерами для подачи воздуха, причем в качестве источника ультрафиолетового излучения и генератора озона применена аргонно-ртутная люминесцентная лампа без стеклянного защитного баллона.
Похожие патенты:
Установка очистки и обеззараживания воды бассейнов для содержания морских млекопитающих // 114951
Полезная модель относится к водоочистным установкам, а конкретнее, к установкам очистки и обеззараживания морской или подсоленной пресной воды, и может быть полезна в использовании в системах очистки и обеззараживания воды бассейнов для содержания и демонстрационных представлений морских млекопитающих в условиях замкнутого бассейна в дельфинариях и океанариумах
Система подачи инертного газа к сварочной горелке // 54845
Натекатель газа для установки вакуумного напыления // 141916
Полезная модель относится к области ионно-плазменной металлизации в вакууме
Бактерицидный облучатель // 135917
Полезная модель относится к средствам обеззараживания воздуха с использованием ультрафиолетового излучения, а именно к бактерицидным облучателям, преимущественно, открытого типа с газоразрядными ртутными лампами низкого давления, и направлена на повышение безопасности надежности и эффективности работы бактерицидного облучателя
Бактерицидный облучатель // 135916
Полезная модель относится к средствам обеззараживания воздуха с использованием ультрафиолетового излучения, а именно к бактерицидным облучателям, преимущественно, открытого типа с газоразрядными ртутными лампами низкого давления, и направлена на повышение безопасности надежности и эффективности работы бактерицидного облучателя
Насадка-удлинитель к электродуговой горелке // 83722
Емкость для хранения нанопорошков // 57722
Газовый сенсор и устройство для контроля газовой среды // 79182
Колонка-концентратор для газовой хроматографии // 56641
Устройство для определения содержания органических веществ в жидких и твердых образцах // 81336
Устройство для нанесения ионно-плазменного покрытия // 111855
Технологическая линия производства стали // 73335
Бактериостатические антибиотики — StatPearls — NCBI Bookshelf
Программа непрерывного образования
Термин «бактериостатические антибиотики» используется для описания лекарств, механизм действия которых тормозит клеточную активность бактерий, не вызывая непосредственно их гибели. Механизмы действия этих противомикробных препаратов широки, и для их оптимального функционирования обычно требуется, чтобы у пациентов была функциональная иммунная система. В этом упражнении описываются показания, механизмы и противопоказания к применению бактериостатических противомикробных препаратов при лечении бактериальных инфекций, а также другие ключевые факторы, относящиеся к медицинскому персоналу, лечащему пациентов с бактериальными инфекциями.
Механизмы действия этих противомикробных препаратов широки, и для их оптимального функционирования обычно требуется, чтобы у пациентов была функциональная иммунная система. В этом упражнении описываются показания, механизмы и противопоказания к применению бактериостатических противомикробных препаратов при лечении бактериальных инфекций, а также другие ключевые факторы, относящиеся к медицинскому персоналу, лечащему пациентов с бактериальными инфекциями.
Цели:
Определите механизм действия различных бактериостатических противомикробных препаратов.
Опишите показания к применению различных бактериостатических противомикробных препаратов.
Проверить токсичность бактериостатических противомикробных препаратов.
Опишите стратегии межпрофессиональной команды для улучшения координации помощи и коммуникации для продвижения использования бактериостатических противомикробных препаратов.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания к применению
Бактериостатические противомикробные препараты — термин, обычно используемый для описания противомикробных препаратов, действие которых основано на ингибировании синтеза бактериального белка, — имеют множество показаний в медицине в зависимости от механизма их действия. Из-за простого ингибирования дальнейшего роста бактерий бактериостатические противомикробные препараты требуют функционирующей иммунной системы хозяина для полного устранения чрезмерного роста. Однако из-за этого эффекта обсервационные исследования показали, что существует более низкая частота токсического шока и более переносимые профили побочных эффектов. Следующие классы и специфические противомикробные препараты обычно обладают бактериостатическим действием: тетрациклины, макролиды, клиндамицин, триметоприм/сульфаметоксазол, линезолид и хлорамфеникол. Однако в последние годы рутинное клиническое использование хлорамфеникола перестало быть популярным из-за побочных эффектов.
Показания для тетрациклиновых противомикробных препаратов чрезвычайно широки. Как один из старейших классов противомикробных препаратов, тетрациклины продемонстрировали хорошую активность против грамположительных, грамотрицательных, атипичных и спирохетных бактерий.[5][6] В то время как более старые тетрациклины (тетрациклин, доксициклин) имеют значительную резистентность к более распространенным патогенам, они сохраняют хорошую активность против атипичных патогенов. Однако более новые препараты этого класса (тигециклин) все чаще используются для лечения полирезистентных патогенов из-за низкого уровня резистентности.[3] Кроме того, из-за их широкого спектра действия и предсказуемого и сравнительно переносимого профиля токсичности эти агенты популярны в амбулаторных условиях [3].
Показания к макролидным противомикробным препаратам зависят от конкретного рассматриваемого макролидного противомикробного препарата. В этом классе есть три основных противомикробных препарата: эритромицин, кларитромицин и азитромицин. [7][8] Эритромицин обладает слабой активностью в отношении грамотрицательных и анаэробных микроорганизмов. Однако он чрезвычайно эффективен против атипичных патогенов и имеет некоторую активность против Neisseria spp . Кларитромицин имеет спектр активности, аналогичный эритромицину, с дополнительной активностью против некоторых видов стафилококков и стрептококков.] Азитромицин обычно менее активен в отношении большинства распространенных грамположительных и негативных патогенов, но демонстрирует более высокую эффективность в отношении атипичных агентов.[9][8]
[7][8] Эритромицин обладает слабой активностью в отношении грамотрицательных и анаэробных микроорганизмов. Однако он чрезвычайно эффективен против атипичных патогенов и имеет некоторую активность против Neisseria spp . Кларитромицин имеет спектр активности, аналогичный эритромицину, с дополнительной активностью против некоторых видов стафилококков и стрептококков.] Азитромицин обычно менее активен в отношении большинства распространенных грамположительных и негативных патогенов, но демонстрирует более высокую эффективность в отношении атипичных агентов.[9][8]
Клиндамицин является противомикробным препаратом, который имеет множество показаний. В обзоре литературы 1996 года, посвященном этому препарату, показания к его применению включают следующие применения: инфекции кожи и мягких тканей (включая диабетическую стопу), остеомиелит и септический артрит, рецидивирующий стрептококковый фарингит, анаэробные инфекции легких, а также в качестве альтернативы для внутривенного введения. абдоминальные и тазовые инфекции.[9]] Однако он имеет низкую активность в кровотоке и не рекомендуется для лечения пациентов с сепсисом или пациентов с большинством грамотрицательных инфекций.[9][10][11]
абдоминальные и тазовые инфекции.[9]] Однако он имеет низкую активность в кровотоке и не рекомендуется для лечения пациентов с сепсисом или пациентов с большинством грамотрицательных инфекций.[9][10][11]
Триметоприм/сульфаметоксазол ранее применялся в качестве основного амбулаторного противомикробного препарата при широком спектре инфекций. Однако из-за появления широко распространенной резистентности он утратил свою полезность для эмпирического охвата инфекций в амбулаторных условиях.[12] В настоящее время показания к применению триметоприма/сульфаметоксазола включают лечение неосложненного цистита у пациентов без недавнего применения противомикробных препаратов, госпитализации или рецидива ИМП в течение последнего года, а также эмпирическое лечение инфекционной диареи без примеси крови [12]. Из-за высокой резистентности стрептококков и стафилококков он больше не является рекомендуемым средством при инфекциях дыхательных путей или кожи/мягких тканей.
Кроме того, триметоприм/сульфаметоксазол является одним из средств выбора для профилактики инфекций, связанных с ВИЧ/СПИДом, в частности, pneumocystis пневмонии ( P. jiroveci ). Его рекомендации включают его использование в качестве профилактического средства у пациентов с количеством CD4 менее 200 клеток/мкл.[12]
jiroveci ). Его рекомендации включают его использование в качестве профилактического средства у пациентов с количеством CD4 менее 200 клеток/мкл.[12]
Линезолид, впервые получивший широкое распространение в 2000-х годах, обладает широкой активностью против большинства грамположительных микроорганизмов.[13][14][15] В значительной степени из-за его дороговизны, а также усилий по защите от развития резистентности в целом, его основное применение заключается в лечении грамположительных инфекций с множественной лекарственной устойчивостью. Он малоактивен в отношении грамотрицательных и анаэробных бактерий, поэтому клиницисты не должны использовать его в этих условиях. Кроме того, из-за ограниченного спектра действия его не следует использовать в качестве эмпирического противомикробного средства.
Механизм действия
Бактериостатические противомикробные препараты чаще всего действуют посредством ингибирования путей синтеза бактериального белка.
Основным механизмом действия противомикробных препаратов тетрациклинового ряда является обратимое ингибирование 30S бактериальной рибосомальной субъединицы. [5][6][16] Это ингибирование вызывает остановку производства бактериального белка, что подавляет бактериальную защиту и позволяет иммунным клеткам хозяина уничтожать бактерии-нарушители.
[5][6][16] Это ингибирование вызывает остановку производства бактериального белка, что подавляет бактериальную защиту и позволяет иммунным клеткам хозяина уничтожать бактерии-нарушители.
Макролиды действуют посредством ингибирования более крупной субъединицы бактериальных рибосом, субъединицы 50S.[8][9] В частности, они связывают и ингибируют транслокацию аминокислот из рибосом, останавливая синтез белка.[8][9] Клиндамицин дополнительно влияет на бактериальную субъединицу 50S; однако он ингибирует субъединицу в другом месте, чем макролиды.
Триметоприм/сульфаметоксазол оказался успешным комбинированным противомикробным препаратом, поскольку каждый из его компонентов, триметоприм и сульфаметоксазол, препятствует эффективной переработке фолиевой кислоты и ее производных в бактериях.[12] Мысль состоит в том, что синергетический эффект комбинации значительно увеличивает ее эффективность по сравнению с любым агентом по отдельности.[12] Хотя все большее количество исследований предполагает, что это может быть неправдой, комбинированная форма по-прежнему преобладает из-за более низкой распространенности резистентности к комбинации в сообществе. [12]
[12]
Линезолид обладает уникальным механизмом действия по сравнению с другими противомикробными препаратами. Он связывается с сайтом P рибосомы 50 S, что предотвращает образование бактериального рибосомного комплекса fMet-тРНК и, таким образом, предотвращает синтез бактериального белка. В результате у него нет перекрестной резистентности с другими классами противомикробных препаратов.[10][15]
Введение
Противомикробные препараты тетрациклинового ряда вводят перорально или внутривенно.[5][6][7] Другие препараты тетрациклинов не распространены из-за опасений по поводу реакций гиперчувствительности вокруг места введения. Большинство тетрациклинов имеют плохую биодоступность при пероральном приеме: обычно менее 50%. Однако было показано, что доксициклин имеет энтеральное всасывание, превышающее 90% пероральной дозы.[7] Предпочтительным внутривенным препаратом противомикробного препарата тетрациклина является доксициклин, и его следует вводить в центральную венозную систему, чтобы снизить риск гиперчувствительности в месте инфузии.
В то время как введение эритромицина возможно внутривенно, наиболее распространенная форма макролидных противомикробных препаратов находится в пероральных лекарственных формах.[17][8][9] Это связано с тем, что эти агенты вызывают сильную боль и дискомфорт вокруг места инфузии при парентеральном введении. Кроме того, внутривенные макролиды коррелируют с тромбофлебитом.[17][18]
Клиндамицин почти полностью всасывается при приеме внутрь. Однако у него относительно короткий период полувыведения, требующий приема каждые 6 часов.[9] Его можно вводить внутривенно как детям, так и взрослым, если есть противопоказания к пероральному применению лекарств.[9] Наконец, у клиндамицина есть препараты для местного применения, которые чаще всего используются для лечения тазовых или вагинальных инфекций.[9][11]
Триметоприм/сульфаметоксазол имеет доступные на рынке составы как для перорального, так и для внутривенного введения; однако из-за его показаний он почти повсеместно встречается в пероральной форме. Кроме того, он отлично всасывается через кишечную систему и выводится в активной форме с мочой.[12] Триметоприм, однако, более широко распределяется по всему телу и легче выводится с мочой, вызывая изменение концентрации каждого компонента во всем организме с течением времени. [12]
Кроме того, он отлично всасывается через кишечную систему и выводится в активной форме с мочой.[12] Триметоприм, однако, более широко распределяется по всему телу и легче выводится с мочой, вызывая изменение концентрации каждого компонента во всем организме с течением времени. [12]
Линезолид имеет почти 100% абсорбцию при пероральном приеме и может вводиться перорально или внутривенно, в зависимости от клинических условий.[14] Кроме того, препарат можно принимать независимо от приема пищи, а его период полураспада позволяет принимать его дважды в день. Он также, по-видимому, широко проникает в ткани по всему телу и может использоваться при инфекциях различных локализаций.[13][10][15]
Побочные эффекты
Как и показания, побочные эффекты бактериостатических противомикробных препаратов зависят от рассматриваемого препарата.
Благодаря своей превосходной биодоступности в большинстве тканей организма тетрациклины могут легко откладываться в васкуляризированных костях и тканях; это становится проблематичным у плодов и детей в возрасте до восьми лет, когда тетрациклиновые антибиотики могут откладываться и вызывать характерное коричневое обесцвечивание костей, которое сохраняется на протяжении всей жизни. Этот побочный эффект не является токсичным по своей природе и является относительным противопоказанием. Кроме того, этот эффект напрямую зависит от дозы.[6][7]
Этот побочный эффект не является токсичным по своей природе и является относительным противопоказанием. Кроме того, этот эффект напрямую зависит от дозы.[6][7]
Макролидные противомикробные препараты являются значительными ингибиторами CYP3A4 и имеют несколько взаимодействий через эти пути. В частности, они повышают концентрацию в сыворотке карбамазепина, кортикостероидов, циклоспорина, дигоксина, теофиллина, вальпроевой кислоты и варфарина.[8][9] Однако азитромицин, по-видимому, обладает меньшей активностью в отношении CYP3A4 и имеет более слабые лекарственные взаимодействия.
Клиндамицин обычно коррелирует с местной гиперчувствительностью и кожными реакциями, которые могут быть достаточно серьезными, чтобы вызвать токсический эпидермальный некролиз или синдром Стивенса-Джонсона.[9]] Кроме того, как пероральные, так и внутривенные препараты клиндамицина истощают бактериальный резерв кишечника и сильно коррелируют с частотой колита C. difficile (до 20–30%) и высокой частотой диареи без основной инфекции. [9]
[9]
Как правило, триметоприм/сульфаметоксазол хорошо переносится как иммунокомпетентными пациентами, так и пациентами с ослабленным иммунитетом. Однако существуют некоторые лекарственные взаимодействия с варфарином, метотрексатом, фенитоином, дигоксином и оральными контрацептивами.[12] Для большинства этих агентов он увеличивает концентрацию в крови, тем самым увеличивая активность. Однако, по-видимому, он инактивирует оральные контрацептивы.[12] Кроме того, поскольку противомикробный препарат, содержащий сульфаниламиды (сульфаниламиды), существует значительный риск аллергии среди населения в целом.[12] Окончательный эффект триметоприма/сульфаметоксазола заключается в том, что он вызывает примерно 10% повышение концентрации креатинина в сыворотке крови, не влияя на функцию почек, что может имитировать признаки нефротоксичности.[12]
Линезолид обычно хорошо переносится населением в целом.[14] Хотя традиционно показана корреляция с риском серотонинового синдрома при приеме в сочетании с другими серотонинергическими препаратами, этот риск низок.
Противопоказания
Противопоказания к применению различных бактериостатических средств специфичны для каждого класса рассматриваемых препаратов/средств. Противопоказания к большинству антибиотиков тетрациклинового ряда следующие: нарушение функции почек (кроме доксициклина), дети до восьми лет, беременные и активный колит.[6][7] Абсолютных противопоказаний к макролидным противомикробным препаратам нет. Тем не менее, клиницисты должны уделять значительное внимание лекарственным взаимодействиям, сердечным аритмиям и гиперчувствительности, связанной с продуктами распада лекарств [7]. Клиндамицин плохо проникает в центральную нервную систему и противопоказан при инфекциях нервной системы [9].] триметоприм/сульфаметоксазол противопоказан пациентам с аллергией на сульфаниламиды. [12] Линезолид не имеет существенных противопоказаний; однако его использования следует избегать, за исключением устойчивых грамположительных инфекций из-за усилий по контролю противомикробных препаратов.
Мониторинг
Одним из преимуществ большинства бактериостатических противомикробных препаратов как класса является то, что они обычно не требуют интенсивного мониторинга, как другие классы бактерицидных препаратов. Тетрациклиновые противомикробные препараты обычно не требуют мониторинга концентрации лекарственного средства в крови, и при этом у них нет легко идентифицируемого метаболита для мониторинга их активности in vivo .[6][7] Однако необходимо соблюдать осторожность в отношении потребления пациентами некоторых металлических элементов (Ca, Al, Mg и т. д.), особенно из-за их инактивации двухвалентными и трехвалентными катионами.[6][7] 7] Макролиды обычно не требуют специального мониторинга in vivo . Однако, если пациенты принимают другие препараты с макролидами, следует контролировать соответствующие концентрации других препаратов на предмет изменения их активности.[8][9] Клиндамицин не требует лабораторного контроля побочных эффектов; однако рекомендуется клинический мониторинг симптоматической диареи и колита [9]. ] Мониторинг терапии триметопримом/сульфаметоксазолом не требуется.[12] Мониторинг линезолида не требуется.[14]
] Мониторинг терапии триметопримом/сульфаметоксазолом не требуется.[12] Мониторинг линезолида не требуется.[14]
Токсичность
В целом, из-за сравнительно более медленного механизма действия бактериостатических противомикробных препаратов профили токсичности бактериостатических агентов, как правило, ниже, чем у их сопоставимых бактерицидных аналогов.[1][4] Тетрациклиновые противомикробные препараты, хотя обычно хорошо переносятся, обладают следующей токсичностью: раздражающий гастрит, фотосенсибилизация, гепатотоксичность, нефротоксичность (за исключением доксициклина) и реакции гиперчувствительности (могут не быть аллергическими).[6][7] Наиболее распространенными видами токсичности макролидных противомикробных препаратов являются аллергические реакции, желудочно-кишечные расстройства и повышенная моторика, сердечные аритмии (эритромицин, удлинение интервала QTc) и шум в ушах (эритромицин).] Эти агенты, однако, как правило, хорошо переносятся. Триметоприм/сульфаметоксазол имеет менее 10 % желудочно-кишечной, дерматологической токсичности и очень редкий риск апластической анемии. Режим токсичности линезолида обычно ограничивается низким риском желудочно-кишечного расстройства, головной боли и сыпи.[14] Наиболее значительной токсичностью линезолида, описанной в литературе, является миелосупрессия и тромбоцитопения, частота которых приближается к 2,5% [14].
Режим токсичности линезолида обычно ограничивается низким риском желудочно-кишечного расстройства, головной боли и сыпи.[14] Наиболее значительной токсичностью линезолида, описанной в литературе, является миелосупрессия и тромбоцитопения, частота которых приближается к 2,5% [14].
Улучшение результатов работы команды здравоохранения
Существует традиционное предубеждение против бактериостатических противомикробных препаратов по целому ряду показаний, особенно при более острых состояниях, из-за неправильного представления о том, что они имеют клинически более низкую скорость активности и теряют эффективность.[1][3] Однако это восприятие неверно в некоторых случаях.[2][1][3] При надлежащем управлении и понимании риска и преимуществ этих агентов их можно использовать по целому ряду клинических показаний для поддержания эффективности многих бактерицидных агентов широкого спектра действия, обычно используемых в больницах и амбулаторных клиниках.[2] Уровень доказательности комплексных исследований в этой статье — I-II.
Использование этих бактериостатических средств требует подхода межпрофессиональной бригады к лечению пациентов. Лечащий врач решает, какой противомикробный препарат использовать; это решение должно приниматься совместно с сертифицированным фармацевтом-инфекционистом в сочетании с последними данными об антибиотикограммах, особенно в стационарных условиях. Фармацевт также должен провести полную сверку лекарств, чтобы исключить возможные лекарственные взаимодействия. Медсестры будут нести ответственность за введение этих препаратов в стационарных условиях, а для амбулаторных пациентов они по-прежнему могут консультировать пациента по правильному применению. Сестринское дело также может оценить соблюдение пациентом режима лечения и должно быть осведомлено о возможных побочных реакциях, чтобы о них можно было немедленно сообщить лечащему врачу. Этот подход межпрофессиональной команды оптимизирует терапевтический потенциал бактериостатических противомикробных препаратов, одновременно ограничивая лекарственную устойчивость и побочные эффекты. [Уровень 5]
[Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Pankey GA, Sabath LD. Клиническая значимость бактериостатического и бактерицидного механизмов действия при лечении грамположительных бактериальных инфекций. Клин Инфекция Дис. 2004 15 марта; 38 (6): 864-70. [PubMed: 14999632]
- 2.
Немет Дж., Оеш Г., Кустер С.П. Бактериостатические и бактерицидные антибиотики у пациентов с серьезными бактериальными инфекциями: систематический обзор и метаанализ. J Антимикробная химиотерапия. 2015 Февраль; 70 (2): 382-95. [PubMed: 25266070]
- 3.
Фридкин С.К., Гейнс Р.П. Антимикробная резистентность в отделениях интенсивной терапии. Клин Грудь Med. 1999 Jun;20(2):303-16, viii. [PubMed: 10386258]
- 4.
McCabe WR. Антибиотики и эндотоксический шок.
 Бюлл. Н.Ю. акад. мед. 1975 г., октябрь; 51 (9): 1084–95. [Бесплатная статья PMC: PMC1749600] [PubMed: 1058731]
Бюлл. Н.Ю. акад. мед. 1975 г., октябрь; 51 (9): 1084–95. [Бесплатная статья PMC: PMC1749600] [PubMed: 1058731]- 5.
Smilack JD. Тетрациклины. Мэйо Клин Proc. 1999 г., июль; 74 (7): 727-9. [В паблике: 10405705]
- 6.
Висенте Д., Перес-Траллеро Э. [Тетрациклины, сульфаниламиды и метронидазол]. Enferm Infecc Microbiol Clin. 2010 фев; 28 (2): 122-30. [PubMed: 20097452]
- 7.
Кобос-Тригерос Н., Атека О., Питарт С., Вила Дж. [Макролиды и кетолиды]. Enferm Infecc Microbiol Clin. 2009 авг.-сен.;27(7):412-8. [PubMed: 19625112]
- 8.
Елич Д., Антолович Р. От эритромицина к азитромицину и новым потенциальным рибосомосвязывающим противомикробным препаратам. Антибиотики (Базель). 01 сентября 2016 г .; 5 (3) [Бесплатная статья PMC: PMC5039525] [PubMed: 27598215]
- 9.
Смиея М. Текущие показания к применению клиндамицина: критический обзор. Может ли J заразить Dis.
 1998 Январь; 9 (1): 22-8. [Статья PMC бесплатно: PMC3250868] [PubMed: 22346533]
1998 Январь; 9 (1): 22-8. [Статья PMC бесплатно: PMC3250868] [PubMed: 22346533]- 10.
Gudiol C, Cuervo G, Shaw E, Pujol M, Carratalà J. Фармакотерапевтические возможности лечения бактериемии Staphylococcus aureus. Эксперт Опин Фармаколог. 2017 Декабрь;18(18):1947-1963. [PubMed: 29115883]
- 11.
Остин М.Н., Бейги Р.Х., Мейн Л.А., Хиллиер С.Л. Микробиологический ответ на лечение бактериального вагиноза местным применением клиндамицина или метронидазола. Дж. Клин Микробиол. 2005 г., сен; 43 (9): 4492-7. [Статья бесплатно PMC: PMC1234077] [PubMed: 16145097]
- 12.
Мастерс П.А., О’Брайан Т.А., Зурло Дж., Миллер Д.К., Джоши Н. Повторное посещение триметоприма-сульфаметоксазола. Arch Intern Med. 2003 24 февраля; 163 (4): 402-10. [PubMed: 12588198]
- 13.
Guillard P, de La Blanchardière A, Cattoir V, Fischer MO, Verdon R, Saint-Lorant G. Противомикробное управление и линезолид. Int J Клин Фарм.
 2014 Окт;36(5):1059-68. [PubMed: 25135806]
2014 Окт;36(5):1059-68. [PubMed: 25135806]- 14.
Метаксас Э.И., Фалагас М.Э. Обновленная информация о безопасности линезолида. Экспертное заключение Drug Safe. 2009 г., июль; 8 (4): 485–91. [PubMed: 19538105]
- 15.
Манфреди Р. Обновленная информация о надлежащем использовании линезолида в клинической практике. Ther Clin Risk Manag. 2006 г., декабрь; 2(4):455-64. [Статья бесплатно PMC: PMC1936365] [PubMed: 18360656]
- 16.
Maaland MG, Papich MG, Turnidge J, Guardabassi L. Фармакодинамика доксициклина и тетрациклина против Staphylococcus pseudoxycyclines-specificus: предложения для собак. Дж. Клин Микробиол. 2013 ноябрь; 51 (11): 3547-54. [Бесплатная статья PMC: PMC3889732] [PubMed: 23966509]
- 17.
Ratcliffe AT, Ismail KM. Внутривенное введение макролидов: напоминание об опасности высоких скоростей инфузии. Джей Клин Анест. 2012 ноябрь; 24 (7): 602-3. [PubMed: 23101782]
- 18.

де Диос Гарсия-Диас Дж., Сантолайя Перрин Р., Пас Мартинес Ортега М., Морено-Васкес М. [Флебит из-за внутривенного введения макролидных антибиотиков. Сравнительное исследование эритромицина по сравнению с кларитромицином]. Мед Клин (Барк). 2001 03 февраля; 116 (4): 133-5. [В паблике: 11222159]
Отсутствие инноваций может подорвать эффективность антибиотиков и улучшить здоровье
Отсутствие инноваций может подорвать эффективность антибиотиков и пользу для здоровья- All topics »
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- О
- Р
- В
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
- Бюллетени
- Факты в картинках
- Мультимедиа
- Публикации
- Вопросы и Ответы
- Инструменты и наборы инструментов
- Популярный »
- Загрязнение воздуха
- Коронавирусная болезнь (COVID-19)
- Гепатит
- оспа обезьян
- All countries »
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
 Регионы »
Регионы »- Африка
- Америка
- Юго-Восточная Азия
- Европа
- Восточное Средиземноморье
- Западная часть Тихого океана
- ВОЗ в странах »
- Статистика
- Стратегии сотрудничества
- Украина ЧП
- все новости »
- Выпуски новостей
- Заявления
- Кампании
- Комментарии
- События
- Тематические истории
- Выступления
- Прожекторы
- Информационные бюллетени
- Библиотека фотографий
- Список рассылки СМИ
- Заголовки »
- Сосредоточиться на »
- Афганистан кризис
- COVID-19 пандемия
- Кризис в Северной Эфиопии
- Сирийский кризис
- Украина ЧП
- Вспышка оспы обезьян
- Кризис Большого Африканского Рога
- Последний »
- Новости о вспышках болезней
- Советы путешественникам
- Отчеты о ситуации
- Еженедельный эпидемиологический отчет
- ВОЗ в чрезвычайных ситуациях »
- Наблюдение
- Исследовать
- Финансирование
- Партнеры
- Операции
- Независимый контрольно-консультативный комитет
- Данные ВОЗ »
- Глобальные оценки здоровья
- ЦУР в области здравоохранения
- База данных о смертности
- Сборы данных
- Панели инструментов »
- Информационная панель COVID-19
- Приборная панель «Три миллиарда»
- Монитор неравенства в отношении здоровья
- Основные моменты »
- Глобальная обсерватория здравоохранения
- СЧЕТ
- Инсайты и визуализации
- Инструменты сбора данных
- Отчеты »
- Мировая статистика здравоохранения 2022 г.

- избыточная смертность от COVID
- DDI В ФОКУСЕ: 2022 г.
- Мировая статистика здравоохранения 2022 г.
- О ком »
- Люди
- Команды
- Структура
- Партнерство и сотрудничество
- Сотрудничающие центры
- Сети, комитеты и консультативные группы
- Трансформация
- Наша работа »
- Общая программа работы
- Академия ВОЗ
- Деятельность
- Инициативы
- Финансирование »
- Инвестиционный кейс
- Фонд ВОЗ
- Подотчетность »
- Аудит
- Бюджет
- Финансовые отчеты
- Портал программного бюджета
- Отчет о результатах
- Управление »
- Всемирная ассамблея здравоохранения
- Исполнительный совет
- Выборы Генерального директора
- Веб-сайт руководящих органов
- Дом/
- Новости/
- шт/
- Отсутствие инноваций может подорвать эффективность антибиотиков и улучшить здоровье
Согласно ежегодному отчету Всемирной организации здравоохранения, разработка новых антибактериальных препаратов недостаточна для устранения растущей угрозы устойчивости к антибиотикам. В отчете 2021 года антибактериальные клинические и доклинические разработки описываются как застойные и далекие от удовлетворения глобальных потребностей. С 2017 г. одобрено только 12 антибиотиков, 10 из которых относятся к существующим классам с установленными механизмами устойчивости к противомикробным препаратам (УПП).
В отчете 2021 года антибактериальные клинические и доклинические разработки описываются как застойные и далекие от удовлетворения глобальных потребностей. С 2017 г. одобрено только 12 антибиотиков, 10 из которых относятся к существующим классам с установленными механизмами устойчивости к противомикробным препаратам (УПП).
«Существует большой пробел в разработке антибактериальных методов лечения, особенно в разработке инновационных методов лечения», — сказал д-р Ханан Балхи, помощник Генерального директора ВОЗ по УПП. «Это представляет серьезную проблему для преодоления эскалации пандемии устойчивости к противомикробным препаратам и делает каждого из нас все более уязвимым для бактериальных инфекций, включая простейшие инфекции».
Согласно ежегодному анализу ВОЗ, в 2021 г. в клинической разработке против приоритетных патогенов находилось всего 27 новых антибиотиков по сравнению с 31 продуктом в 2017 г. На доклинической стадии – до начала клинических испытаний – количество препаратов остается относительно постоянна в течение последних 3 лет.
В более широком плане в отчете говорится, что из 77 антибактериальных препаратов, находящихся в клинической разработке, 45 представляют собой традиционные низкомолекулярные препараты прямого действия, а 32 представляют собой нетрадиционные препараты. Примерами последних являются моноклональные антитела и бактериофаги, представляющие собой вирусы, способные уничтожать бактерии. Поскольку в настоящее время антибиотики имеют ограниченный срок службы до того, как появится лекарственная устойчивость, нетрадиционные подходы открывают новые возможности для борьбы с инфекциями, вызванными резистентными бактериями, с разных сторон, поскольку их можно использовать дополняюще и синергетически или в качестве альтернативы установленным методам лечения.
Препятствия для разработки новых продуктов включают длительный путь к одобрению, высокую стоимость и низкие показатели успеха. В настоящее время требуется около 10–15 лет, чтобы продвинуть антибиотик-кандидат от доклинической до клинической стадии.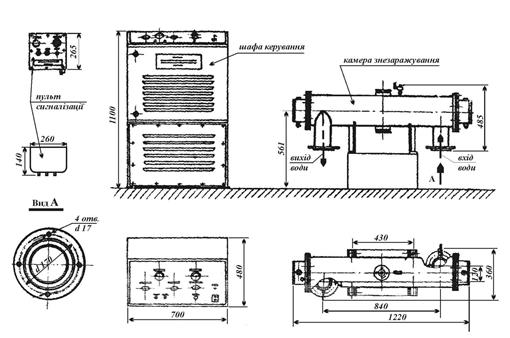 Что касается антибиотиков существующих классов, то в среднем только одно из каждых 15 препаратов, находящихся на стадии доклинической разработки, попадет к пациентам. Что касается новых классов антибиотиков, то только один из 30 кандидатов достигнет пациентов.
Что касается антибиотиков существующих классов, то в среднем только одно из каждых 15 препаратов, находящихся на стадии доклинической разработки, попадет к пациентам. Что касается новых классов антибиотиков, то только один из 30 кандидатов достигнет пациентов.
Из 27 находящихся в клинической разработке антибиотиков, предназначенных для борьбы с приоритетными патогенами, только 6 соответствуют хотя бы одному из критериев ВОЗ для инноваций. Отсутствие инноваций быстро подрывает эффективность ограниченного числа новых антибиотиков, поступающих на рынок. В среднем устойчивость к большинству новых агентов регистрируется через 2–3 года после выхода на рынок.
«Время, чтобы опередить устойчивость к противомикробным препаратам, истекает, темпы и успех инноваций намного ниже того, что нам нужно, чтобы защитить достижения современной медицины от вековых, но разрушительных состояний, таких как неонатальный сепсис», — сказал д-р . Хайлейесус Гетахун, директор ВОЗ по глобальной координации УПП. Примерно 30% новорожденных с сепсисом умирают из-за бактериальных инфекций, устойчивых к антибиотикам первой линии.
Примерно 30% новорожденных с сепсисом умирают из-за бактериальных инфекций, устойчивых к антибиотикам первой линии.
Пандемия COVID-19 также затормозила прогресс, задержала клинические испытания и отвлекла внимание и без того ограниченных инвесторов. Большая часть инноваций в области антибиотиков осуществляется малыми и средними компаниями, которые изо всех сил пытаются найти инвесторов для финансирования поздних стадий клинических исследований до получения разрешения регулирующих органов. Нередко компании приостанавливают разработку продукта на несколько лет в надежде получить финансирование для продолжения разработки на более позднем этапе или в надежде, что продукт может быть куплен другой компанией. Многие банкротятся.
Поэтому необходимы срочные и согласованные инвестиции в исследования и разработки со стороны правительств и частного сектора для ускорения и расширения разработки антибиотиков, особенно тех, которые могут оказать воздействие в условиях ограниченных ресурсов, наиболее пострадавших от УПП.

 Бюлл. Н.Ю. акад. мед. 1975 г., октябрь; 51 (9): 1084–95. [Бесплатная статья PMC: PMC1749600] [PubMed: 1058731]
Бюлл. Н.Ю. акад. мед. 1975 г., октябрь; 51 (9): 1084–95. [Бесплатная статья PMC: PMC1749600] [PubMed: 1058731] 1998 Январь; 9 (1): 22-8. [Статья PMC бесплатно: PMC3250868] [PubMed: 22346533]
1998 Январь; 9 (1): 22-8. [Статья PMC бесплатно: PMC3250868] [PubMed: 22346533] 2014 Окт;36(5):1059-68. [PubMed: 25135806]
2014 Окт;36(5):1059-68. [PubMed: 25135806]
