3. Алюминий
По содержанию в земной коре занимает первое место среди металлов и третье среди всех элементов, после кислорода и кремния.
Металлические свойства его выражены сильнее, чем у бора. Химические связи алюминия с другими металлами в основном ковалентного характера. Тип кристаллической структуры — ГПУ.
В отличие от бора атом алюминия имеет свободные d-подуровни на внешнем уровне. У Al3+ небольшой радиус и довольно высокий заряд, за счет чего он является комплексообразователем с координационным числом 4 или 6. Соединения Al более устойчивы, чем бора.
Получение алюминия
В промышленности Al получают электролизом расплава Al2O3 в криолите (Na3AlF6)
Al2O3 → Al+3 + AlO3-3
K
(-) Al
A (+) 2AlO3-3 – 6e = Al2O3 + O2
Ga,
In, Tl – рассеянные элементы, встречаются
в оксидных и сульфидных рудах. В этом
случае соответствующие соединения
концентрируют и действуют восстановителями.
В этом
случае соответствующие соединения
концентрируют и действуют восстановителями.
Э2O3 + 3H2 → 2Э + 3H2O
Э2O3 + CO → 2Э + CO2
Химические свойства алюминия
Не взаимодействует с Н2.
Как активный металл реагирует почти со всеми неметаллами без нагревания, если снять оксидную пленку.
4Al + 3O2 → 2Al2O3
2Al + 3Cl2 → 2AlCl3
Al + P → AlP
Реагирует с Н2О:
Алюминий
– активный металл с большим сродством
к кислороду. На воздухе покрывается
защитной пленкой оксида. Если пленку
уничтожить, то алюминий активно
взаимодействует с водой.
На воздухе покрывается
защитной пленкой оксида. Если пленку
уничтожить, то алюминий активно
взаимодействует с водой.
2Al + 6H2O = 2Al(OH)3 + 3H2
С разбавленными кислотами:
2Al + 6HCl → 2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
С концентрированными HNO3 и H2SO4 при обычных условиях не реагирует, а только при нагревании.
5. Со щелочами:
2Al + 2NaOH 2NaAlO2 + 3H2
С водными растворами щелочей алюминий образует комплексы:
2Al + 2NaOH + 10 H2O = 2Na+[Al(OH)4(H2O)2]— + 3H2↑
или Na[Al(OH)4], Na3[Al(OH)6], Na2[Al(OH)5] – гидроксоалюминаты. Продукт зависит
от концентрации щелочи.
Продукт зависит
от концентрации щелочи.
4Al + 3O2 → 2Al2O3
Al2O3 (глинозем) встречается в природе в виде минерала корунда (по твердости близок к алмазу). Драгоценные камни рубин и сапфир – тоже Al2O3, окрашенный примесями железа, хрома
Оксид
алюминия –
амфотерен. При сплавлении его со щелочами
получаются соли метаалюминиевой кислоты
HAlO
.
Также взаимодействует с кислотами
.
Белый студенистый осадок гидроксида алюминия растворяется как в кислотах
Al(OH)3 + 3HCl = AlCl3 + 3 H2O,
так и в избытке растворов щелочей, проявляет амфотерность
Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4(H2O)2]
При сплавлении со щелочами гидроксид алюминия образует соли метаалюминиевой или ортоалюминиевой кислот
.
Аl(OH)3 Al2O3 + H2O
Соли алюминия сильно гидролизуются. Соли алюминия и слабых кислот превращаются в основные соли или подвергаются полному гидролизу:
AlCl3 + HOH ↔ AlOHCl2 + HCl
Al+3 + HOH ↔ AlOH+2 + H+ pH>7 протекает по I ступени, но при нагревании может протекать и по II ступени.
AlOHCl2 + HOH ↔ Al(OH)2Cl + HCl
AlOH+2 + HOH ↔ Al(OH)
При кипячении может протекать и III ступень
Al(OH)2Cl + HOH ↔ Al(OH)3 + HCl
Al(OH)2+ + HOH ↔ Al(OH)3 + H+
.
Соли алюминия хорошо растворимы.
AlCl3 – хлорид алюминия является катализатором при переработке нефти и различных органических синтезах.
Al2(SO4)318H2O – сульфат алюминия применяется для очистки воды от коллоидных частиц, захватываемых Al(OH)3 образовавшихся при гидролизе и снижении жесткости
Al 2(SO4)3 + Ca(HCO3)2 = Al(OH)3 + CO2↑ + CaSO4↓
В кожевенной промышленности служит протравой при крошении хлопчатобумажных тканей – KAl(SO4)212H2O –сульфат калия-алюминия (алюмокалиевые квасцы).
Основное
применение алюминия – производство
сплавов на его основе. Дюралюмин – сплав
алюминия, меди, магния и марганца.
Дюралюмин – сплав
алюминия, меди, магния и марганца.
Силумин – алюминий и кремний.
Основное их достоинство – малая плотность, удовлетворительная стойкость против атмосферной коррозии. Из алюминиевых сплавов изготавливают корпуса искусственных спутников Земли и космических кораблей.
Cr2O3 + 2 Al t = 2Cr + Al2O3.
Также применяют для термитной сварки металлических изделий (смесь алюминия и оксида железа Fe3O4) называемая термитом дает температуру около 3000С.
При
движении от Ga
к Tl
кислотные свойства оксидов ослабевают,
а основные усиливаются. В связи с этим
Тl2O3 не
взаимодействует со щелочами. Устойчивость
оксидов сверху вниз падает. Тl2O3 при
небольшом нагревании разлагается.Тl2O
растворяется в H2O.
Тl2O3 при
небольшом нагревании разлагается.Тl2O
растворяется в H2O.
Тl2O + H2 O → 2TlOH TlOH – щелочь
По размерам ион Тl+1 близок к иону К+, отсюда близость свойств этих соединений. Получают их из оксидов восстановлением H2(CO). У Ga как и у алюминия амфотерные свойства.
Ga + NaOH + H2O → Na[Ga(OH)4] + H2
Могут реагировать с галогенами:
Tl + Cl2 → TlCl
Tl + Cl2 → TlCl3
Ga + Cl2 → GaCl3
Соединения
Ga,
In,
Tl
– ядовиты.
Алюминий, его физические и химические свойства
Предмет: химия.
Класс: 9.
Тема урока: «Алюминий».
Педагогическая цель: создать условия для осознания и осмысления блока новой информации.
Учебная цель:
- рассмотреть особенности положения элемента алюминия в П.С.;
- рассмотреть особенности строения атома, обратить внимание на число электронов на внешнем уровне, возможные степени окисления;
- познакомиться с физическими свойствами простого вещества алюминия;
- рассмотреть особенности химических свойств, простого вещества алюминия, как следствие особенности строения атомов алюминия.
Планируемые результаты
Предметные
- Научатся писать уравнения реакций на основании знаний химических свойств алюминия.

- Получат возможность: научиться систематизировать знания о химических свойствах металлов, на примере химических свойств, простого вещества алюминия.
Метапредметные
- Регулятивные: самостоятельно формулировать познавательную цель и строить действия в соответствии с ней.
- Познавательные: выполнять задания в соответствии с поставленной целью.
- Коммуникативные: умение устанавливать доверительные отношения, взаимопонимание.
Тип урока: урок изучения нового материала.
Методы и формы обучения: словесно-наглядные, лабораторная работа, фронтальная беседа, работа с текстом учебника, работа в группах.
Оборудование: компьютер, экран, проектор, презентация (если нужно), лабораторное оборудование.
Структура урока
1. Организационный моментПриветствие, проверка готовности к уроку. Обучающиеся сидят по группам.
Обучающиеся сидят по группам.
Мотивация учебной деятельности.
Начать сегодняшний урок я хочу с отрывка стихотворения Е.Ефимовского:
“Что? Почему? Зачем и где?
Живут в земле, в огне, в воде.
Вот в первый раз огонь добыт.
(а почему огонь горит?)
Дым — лёгкий, а скала тверда
Что значит “лёд”, а что “вода”?
Что? Почему? Зачем и где?
Мы все узнать хотим.
Соль растворяется в воде
А мел не растворим.
…Открытий путь – не лёгкий путь.
Но человеку не свернуть.
Что? Почему? За ним следят,
Чтоб шёл вперёд, а не назад.
Вот почему из года в год
Наука движется вперёд.”
Продолжим движения вперёд и мы, знакомимся с металлами.
Актуализация знанийВспомним, что уже знаем.
1. Название общей темы, которую мы изучаем?
2. Где в П.С. располагаются металлы?
Где в П.С. располагаются металлы?
3. Число электронов на внешнем уровне у атомов металлов?
4. Радиус атомов металлов по отношению к радиусу атомов неметаллов?
5. Классы веществ, с которыми могут взаимодействовать металлы?
6. Какие вещества называются, амфотерными?
Повторили материал необходимый для изучения сегодняшней темы, название которой нужно выяснить.
На столах лежат различные предметы, изготовленные из алюминия. Учитель просит их назвать
(ложки, вилки, проволока и прочее). Что объединяет эти предметы? Они изготовлены из алюминия. Тема урока: «Алюминий».
Цель урока: расширить знания о металлах на примере алюминия.
План, который поможет осуществить поставленную цель.
План:
1.Алюминий — химический элемент
А) положение алюминия в П.С.
Б) схема строения атома и возможные степени окисления
В) роль в реакциях
2. Алюминий – простое вещество
Алюминий – простое вещество
А) физические свойства
Б) химические свойства
Повторили материал по теме, поставили цель, наметили план , можем изучать тему.
Запишите первый вопрос в тетрадь и с помощью П.С. дайте характеристику алюминию — химическому элементу по пунктам.
А) Al (алюминий) – 3 период, 3 группа, главная подгруппа, Ar ( 27)
Б) Al 2e 8e 3e степень окисления 0,+3 В) в реакциях — восстановитель + 13
По окончании отведенного времени проверяется выполнение задания. Обучающиеся зачитывают свои записи.
Алюминий можно отнести к химическим элементам – металлам на основании данной характеристики?
Учитель подводит итог работы над первым вопросом, акцентируя внимание на том, что у атома алюминия на внешнем уровне три электрона, это максимальное число электронов на внешнем уровне, которое может быть у большинства атомов металлов.
Запишите второй вопрос плана, пункт А) в тетрадь. Чтобы познакомиться с физическими свойствами простого вещества- алюминия, обратимся к учебнику, страница 108, абзац первый. Прочитайте и сделайте краткую запись.
Чтобы познакомиться с физическими свойствами простого вещества- алюминия, обратимся к учебнику, страница 108, абзац первый. Прочитайте и сделайте краткую запись.
А) серебристо-белый, легкий, tпл. 660°С, очень пластичный, высокая теплопроводность и электропроводность.
По окончании отведенного времени проверяется выполнение задания. Обучающиеся зачитывают свои записи.
Имеются в физических свойствах алюминия, какие то особые свойства, которых нет у металлов – простых веществ?
Алюминий обладает всеми физическими свойствами металлов.
Переходим к последнему пункту второго вопроса, запишите в тетрадь пункт Б).
В начале урока вспомнили общие химические свойства металлов – простых веществ. Какие химические свойства характерны для алюминия? Как можем это выяснить? Слово учителю, прочитать в учебнике и проверить практически. Обратимся к учебнику, страница 108–109. Рассмотрите уравнения реакций, приведенные в учебнике и сделайте вывод по химическим свойствам алюминия. Назовите классы веществ, с которыми алюминий взаимодействует? Простые вещества – неметаллы, кислоты, оксиды металлов, щелочи. Так же можно включить соли. Какое химическое свойство вас удивило? Число электронов на внешнем уровне атома алюминия повлияло на химические свойства. Алюминий обладает амфотерными свойствами: свойствами металлов и свойствами неметаллов. Это говорится в учебнике, проверим на практике. Лабораторная работа: «Отношение алюминия к кислотам и щелочам». На столах необходимое оборудование и реактивы, повторили технику безопасности. Обучающиеся проводят эксперимент. По окончании работы делается вывод о двойственных свойствах алюминия. Теперь можно записать уравнения реакций.
Назовите классы веществ, с которыми алюминий взаимодействует? Простые вещества – неметаллы, кислоты, оксиды металлов, щелочи. Так же можно включить соли. Какое химическое свойство вас удивило? Число электронов на внешнем уровне атома алюминия повлияло на химические свойства. Алюминий обладает амфотерными свойствами: свойствами металлов и свойствами неметаллов. Это говорится в учебнике, проверим на практике. Лабораторная работа: «Отношение алюминия к кислотам и щелочам». На столах необходимое оборудование и реактивы, повторили технику безопасности. Обучающиеся проводят эксперимент. По окончании работы делается вывод о двойственных свойствах алюминия. Теперь можно записать уравнения реакций.
Б) химические свойства
— простые вещества
- неметаллы (для начала большинства реакций необходимо нагревание) : 4Al + 3O2 = 2Al2O3
— сложные вещества
- кислоты: 2Al + 6HCl = 2 AlCl3 + 3H2
- щелочи: 2Al + 2NaOH + 6H2O = 2Na(Al(OH)4) + 3H2
- соли: Al + CrC3 = AlCl3 + Cr
- оксиды металлов (алюминотермия): 8Al + 3Fe3O4 = 4Al2O3 + 9Fe
После записи, еще раз обращается внимание на особенности химических свойств алюминия.
В результате нашей работы можем сказать: строение и свойства веществ, взаимосвязаны.
3. РефлексияВозвращаемся к плану нашего урока, который помог нам познакомиться с алюминием: элементом и веществом.
- Все вопроса рассмотрели?
- Что узнали нового?
- Можно сказать, что алюминий – особенный металл?
Домашнее задание: читать параграф 16, страница 107–109.
Алюминий: свойства и преимущества
Что такое алюминий? Это химический элемент, который в природе встречается на Земле. Это самый распространенный металл на нашей планете, так как он составляет примерно 8% земной коры. Он очень универсален, что делает его вторым наиболее часто используемым металлом после стали в различных областях, таких как производство автомобилей и зданий. Спустя столетия после начала промышленного производства алюминия спрос на него во всем мире быстро вырос до примерно 29 миллионов тонн в год, из которых примерно 22 миллиона тонн приходится на первичный алюминий. Для сравнения, из металлолома повторно используется 7 млн тонн алюминия. Стоит отметить, что алюминий относится к металлам, используемым в машиностроении, поскольку его соотношение прочности к весу больше, чем у стали.
Для сравнения, из металлолома повторно используется 7 млн тонн алюминия. Стоит отметить, что алюминий относится к металлам, используемым в машиностроении, поскольку его соотношение прочности к весу больше, чем у стали.
Преимущества использования алюминия связаны с его замечательными свойствами:
• Стойкость к коррозииКогда алюминий подвергается воздействию воздуха и влаги, образуется слой оксидной пленки для защиты алюминиевой поверхности от экстремальных воздействий. окисление. Этот самозащитный оксидный слой придает алюминию устойчивость к износу, устойчивость к атмосферным воздействиям даже в промышленной атмосфере, которая способствует атмосферным воздействиям. Анодирование может дополнительно использоваться для повышения стойкости оксидного слоя на поверхностях.
• Тепло- и электропроводность Алюминий отлично проводит тепло и электричество. Теплопроводность алюминия составляет от 50 до 60 процентов теплопроводности меди, что делает его очень применимым в крупномасштабном производстве кухонной утвари. Теплопроводность связана с переходом из одной среды в другую; таким образом, алюминиевые теплообменники используются в химической, пищевой и авиационной промышленности. Высокая проводимость алюминия (1350) составляет около 62 процентов от Международного стандарта на отожженную медь (IACS), что делает его эффективным для использования в качестве электрического проводника и имеет около трети удельного веса меди.
Теплопроводность связана с переходом из одной среды в другую; таким образом, алюминиевые теплообменники используются в химической, пищевой и авиационной промышленности. Высокая проводимость алюминия (1350) составляет около 62 процентов от Международного стандарта на отожженную медь (IACS), что делает его эффективным для использования в качестве электрического проводника и имеет около трети удельного веса меди.
Гладкий алюминий обладает высокой отражательной способностью в электромагнитном спектре от радиоволн, а также в инфракрасном и тепловом диапазонах. Он отражает около 80% света и 90% тепла, попадающего на его поверхность. Эта высокая отражательная способность придает алюминию декоративный вид и делает его эффективным для использования против излучения света и тепла в таких областях, как кровля и автомобильные теплозащитные экраны.
• Нетоксичные свойства Нетоксичность алюминия была открыта столетия назад при его первом промышленном использовании. Эта характеристика делает его пригодным для использования в кухонной утвари, не оказывая вредного воздействия на организм человека. Это также облегчает его использование в фольге для упаковки пищевых продуктов в перерабатывающей промышленности.
Эта характеристика делает его пригодным для использования в кухонной утвари, не оказывая вредного воздействия на организм человека. Это также облегчает его использование в фольге для упаковки пищевых продуктов в перерабатывающей промышленности.
Повторное использование алюминия не имеет себе равных. Примечательно, что существует значительная разница в свойствах между переработанным и первичным алюминием. Около 5% энергии, используемой при производстве первичного алюминия, необходимо для переработки алюминия. В настоящее время около 60% алюминия перерабатывается в конце своего жизненного цикла.
• Обрабатываемость В большинстве случаев алюминий не нуждается в защитном покрытии. Такие методы отделки, как пескоструйная обработка, полировка и чистка проволочной щеткой, удовлетворяют большинство потребностей в отделке, и в большинстве случаев используемая отделка поверхности достаточна и не требует дополнительной отделки. Там, где требуется чистый алюминий или дополнительная защита, применяется широкий спектр отделки поверхности, например, краска, химические и электрохимические методы.
Там, где требуется чистый алюминий или дополнительная защита, применяется широкий спектр отделки поверхности, например, краска, химические и электрохимические методы.
Чистый алюминий для коммерческого использования имеет предел прочности при растяжении 90 МПа, что делает его очень подходящим для конструкционных материалов. Работа над ним с помощью таких процессов, как холодная прокатка, делает его прочнее. Дальнейшее увеличение прочности достигается путем легирования его такими элементами, как медь, марганец и кремний в измеренных процентах. Сплавы намного прочнее и могут быть дополнительно упрочнены путем термической обработки.
• Высокое соотношение прочности и веса Отношение прочности к весу алюминия намного выше, чем у конструкционной стали. Эта функция делает его подходящим для проектирования и строительства прочных и легких конструкций, обладающих многими преимуществами для движущихся конструкций, таких как корабли, транспортные средства и самолеты.
Простота изготовления алюминия является одной из его важнейших особенностей из-за меньшей степени обрабатываемости любыми методами литья. Алюминий можно изготовить нужной толщины из фольги, которая тоньше бумаги, до алюминиевой проволоки, подлежащей прокатке, алюминиевых листов, которые можно прокатывать, штамповать и вытягивать. По сути, скорость и простота обработки алюминия в значительной степени способствуют низкой стоимости производства алюминиевых деталей. Металлический алюминий можно точить, фрезеровать и растачивать на высокой скорости, на что способны машины в сочетании с его гибким характером.
• Пластичность
Алюминий пластичен, что означает, что из него можно втягивать провода без разрушения. Однако его пластичность ниже, чем у меди. Алюминий также имеет низкую плотность и температуру плавления. В расплавленном виде алюминий можно отливать несколькими способами благодаря его гибкости для производства желаемых продуктов, таких как листы, фольга, трубы и стержни.
• Прочность при низких температурах
Алюминий и его сплавы доказали свою пригодность при низких температурах. В отличие от других металлов, таких как сталь, которые становятся хрупкими при воздействии низких температур, алюминий и его сплавы становятся прочнее. При низких температурах увеличивается не только прочность, но и показатели прочности при растяжении, текучести и ударных нагрузках. Кроме того, в этих условиях повышается коррозионная стойкость алюминия, что делает его пригодным для использования в холодных и ледяных регионах без ускоренного разрушения из-за наличия влаги.
• Непроницаемый и не имеющий запаха
Алюминий, даже свернутый в виде фольги, имеет толщину 0,007 мм, является достаточно непроницаемым и не издает ни запаха, ни вкуса. Кроме того, он нетоксичен и в сочетании с отсутствием запаха и непроницаемостью делает его идеальным для упаковки таких продуктов, как фармацевтические препараты и продукты питания.
• Немагнитный
Алюминий не притягивает магниты и поэтому на языке неспециалистов называется парамагнитным. Эта особенность делает его идеальным для экранирования антенн и компьютерных дисков.
Эта особенность делает его идеальным для экранирования антенн и компьютерных дисков.
• Звуко- и звукопоглощение
Алюминий хорошо поглощает звук, что делает его идеальным материалом для изготовления потолков на крышах и амортизаторов в автомобилях. Вспененный алюминий, его пористость, состав материала, толщина и различные виды обработки делают его звуко- и ударопроницаемым.
Источники и дополнительная литература
Алюминиевый сплав – Общая информация – Введение в алюминий и его сплавы . Aalco.co.uk. Получено 27 мая 2020 г. с http://www.aalco.co.uk/datasheets/Aluminium-Alloy_Introduction-to-Aluminium-and-its-alloys_9.ashx.
Асминтернэшнл.орг. (2020). Основные характеристики алюминия . Асминтернэшнл.орг. Получено 27 мая 2020 г. с https://www.asminternational.org/documents/10192/3456792/06787G_Sample.pdf/c4151917-99fc-46e8-a310-d5578d0af160.
ДЖУКАНОВИЧ, Г. (2016). Алюминиевые сплавы в судостроении – быстрорастущее направление . Aluminiuminsider.com. Получено 27 мая 2020 г. с https://aluminiuminsider.com/aluminium-alloys-in-shipbuilding-a-fast-growing-trend/.
Aluminiuminsider.com. Получено 27 мая 2020 г. с https://aluminiuminsider.com/aluminium-alloys-in-shipbuilding-a-fast-growing-trend/.
Физические свойства алюминиевых сплавов
Физические свойства алюминия
основные Физические свойства алюминия и алюминиевого сплава, полезные для применения:
- плотность или удельный вес;
- температура плавления;
- коэффициент теплового расширения; теплопроводность
- ;
- электропроводность.
Эти свойства алюминия представлены ниже в таблицах [1]. Их можно рассматривать только как основу для сравнения сплавов и их состояний и не следует использовать для инженерных расчетов. Они не являются гарантированными значениями, так как в большинстве случаев являются средними значениями для изделий разных размеров, форм и способов изготовления. Следовательно, они могут не точно отражать продукты всех размеров и форм.
Показатели плотности для популярных алюминиевых сплавов основаны на условиях отжига (O). Различия в плотности обусловлены тем, что сплавы имеют разные легирующие элементы и в разном количестве: кремний и магний легче алюминия (2,33 и 1,74 г/см 3 ), а железо, марганец, медь и цинк тяжелее (7,87; 7,40; 8,96 и 7,13 г/см 3 ).
Различия в плотности обусловлены тем, что сплавы имеют разные легирующие элементы и в разном количестве: кремний и магний легче алюминия (2,33 и 1,74 г/см 3 ), а железо, марганец, медь и цинк тяжелее (7,87; 7,40; 8,96 и 7,13 г/см 3 ).
Влияние глинозема и физических свойств, в частности его плотности, на структурные характеристики алюминиевых сплавов см. здесь.
Алюминий как химический элемент
- Алюминий Является третьим по распространенности — после кислорода и кремния — среди примерно 90 химических элементов, встречающихся в земной коре.
- Среди металлических элементов — он первый.
- Этот металл обладает множеством полезных свойств, физических, механических, технологических – благодаря чему он широко используется во всех сферах человеческой деятельности.
- Алюминий — ковкий металл серебристо-белого цвета, легко поддающийся обработке большинством методов обработки металлов давлением: прокаткой, волочением, экструзией (прессованием), ковкой.

- Его плотность — удельный вес — составляет около 2,70 грамма на кубический сантиметр.
- Чистый алюминий плавится при температуре 660 градусов Цельсия. Алюминий
- обладает относительно высокой теплопроводностью и электропроводностью.
- В присутствии кислорода всегда покрывается тонкой невидимой оксидной пленкой. Эта пленка существенно непроницаема и обладает относительно высокими защитными свойствами. Поэтому алюминий обычно демонстрирует стабильность и долгий срок службы при нормальных атмосферных условиях.
Сочетание свойств алюминия и его сплавов
Алюминий и его сплавы обладают уникальным сочетанием физических и других свойств. Он изготовлен из алюминия с использованием одного из самых универсальных, экономичных и привлекательных строительных и потребительских материалов. Алюминий используется в очень широком диапазоне — от мягкой, очень пластичной упаковочной фольги до самых требовательных космических проектов. Алюминий считается вторым после стали среди многочисленных конструкционных материалов.
низкой плотности
Алюминий – это одна из самых легких промышленных конструкций. Плотность алюминия примерно в три раза ниже, чем у стали или меди. Это физическое свойство обеспечивает высокую удельную прочность – прочность на единицу веса.
Рисунок 1.1 – Объем на единицу веса алюминия в сравнении с другими металлами [3]
Рисунок 1.2 – Влияние легирующих элементов на
прочностные свойства, твердость,
хрупкость и пластичность [3]
Рисунок 1 – Прочность на единицу плотности алюминия в сравнении с различными металлами и сплавами [3]
Рисунок 2 – Кривые растяжения алюминия в сравнении с различными металлами и сплавами [3]
Следовательно, алюминиевые сплавы широко применяются в транспортном машиностроении для увеличения грузоподъемности автомобилей и экономии топлива.
- катамараны паромы,
- нефтяные танкеры и
- самолеты —
Вот лучшие примеры использования алюминия в транспорте.
Рисунок 3 – Плотность алюминия в зависимости от его чистоты и температуры [2]
коррозионная стойкость
Алюминий обладает высокой коррозионной стойкостью благодаря тонкому слою оксида алюминия на его поверхности,. Эта оксидная пленка образуется мгновенно, как только свежая алюминиевая поверхность соприкасается с воздухом (рис. 4). Во многих случаях это свойство позволяет использовать алюминий без какой-либо специальной обработки поверхности. Если требуется дополнительное защитное или декоративное покрытие, то применяется анодирование или покраска поверхности.
Рисунок 4
а — естественное оксидное покрытие на сверхчистом алюминии;
б — коррозия алюминия чистотой 99,5 % с естественным оксидным покрытием
в агрессивно-агрессивной среде [2]
Рисунок 5.1 – Влияние легирующих элементов на коррозионную стойкость и усталостную прочность [3]
Рисунок 5.2 — Питтинговая коррозия (питтинговая коррозия) алюминиевых листов
из сплава 3103 в различных коррозионных условиях [3]
Прочность
Прочностные характеристики чистого алюминия довольно низкие (рис.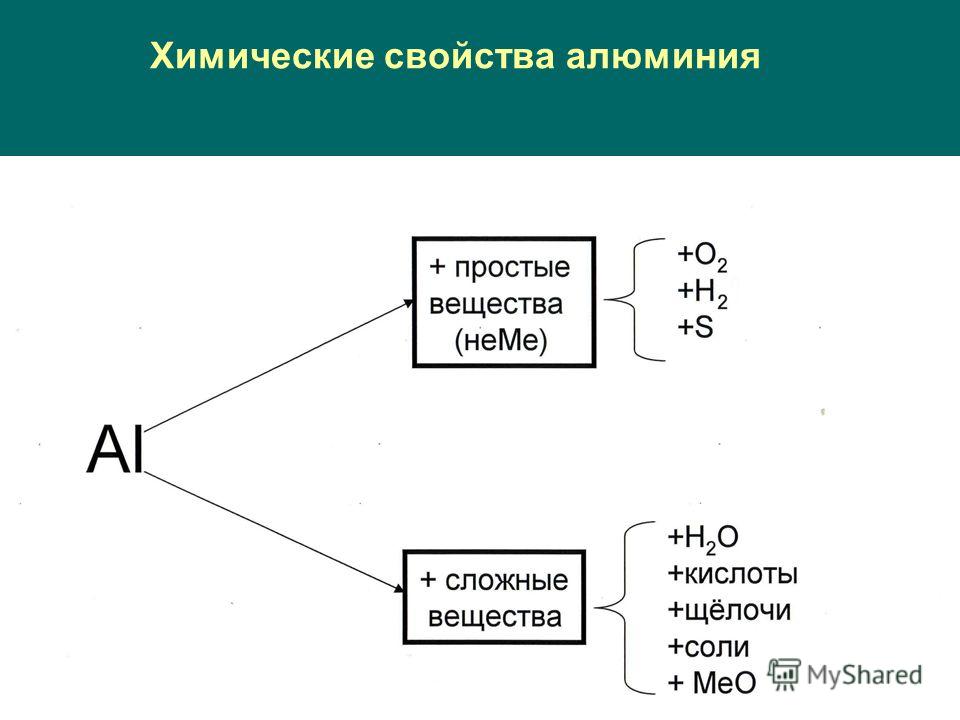 6). Однако эти механические свойства могут сильно возрасти, если в состав легирующих элементов добавить алюминий и, кроме того, подвергнуть его термическому (рис. 6) или деформационному (рис. 7) упрочнению.
6). Однако эти механические свойства могут сильно возрасти, если в состав легирующих элементов добавить алюминий и, кроме того, подвергнуть его термическому (рис. 6) или деформационному (рис. 7) упрочнению.
Типичные легирующие элементы:
- марганец,
- кремний,
- медь,
- магний,
- и цинк.
Рисунок 6 – Влияние чистоты алюминия на его прочность и твердость [2]
Рисунок 7 – Механические свойства высокочистых деформируемых алюминиево-медных сплавов
в различных состояниях [2]
(О – отожженный, Ж – сразу после отпуска, Т4 – естественно состаренный, Т6 – искусственно состаренный)
Рисунок 8 – Механические свойства алюминия 99,50 %
в зависимости от полученной степени холодной деформации [2]
Рисунок 2 – Влияние легирующих элементов на плотность и модуль Юнга [3]
Прочность при низких температурах
Известно, что сталь становится хрупкой при низких температурах. алюминий также, на переднем плане, при низких температурах увеличивает свою прочность и сохраняет высокую вязкость. Именно это физическое свойство сделало возможным его использование в космических аппаратах, условиях работы в холодном космосе.
алюминий также, на переднем плане, при низких температурах увеличивает свою прочность и сохраняет высокую вязкость. Именно это физическое свойство сделало возможным его использование в космических аппаратах, условиях работы в холодном космосе.
Рисунок 9 – Изменение механических свойств алюминиевого сплава 6061
при понижении температуры
Теплопроводность
Алюминий проводит тепло в три раза быстрее, чем сталь. Это физическое свойство очень важно в теплообменниках для нагрева или охлаждения рабочей среды. здесь – широкое использование алюминия и его сплавов в посуде, кондиционерах, промышленном и автомобильном теплообменниках.
Рисунок 10 – Теплопроводность алюминия в сравнении с другими металлами [3]
Отражательная способность
Алюминий является отличным отражателем лучистой энергии во всем диапазоне длин волн. Это физическое свойство позволяет использовать его в устройствах, работающих от ультрафиолетового спектра через видимый спектр к инфракрасному спектру и тепловым волнам, а также таким электромагнитным волнам, как радиоволны и радиолокационные волны [1].
Алюминий обладает способностью отражать более 80 % световых волн, что обеспечивает его широкое применение в осветительных приборах (рисунок 11). Благодаря физическим свойствам применяется в теплоизоляционных материалах. например, алюминиевая кровля отражает большую часть солнечного излучения, что обеспечивает прохладу воздуха в помещении летом и, в то же время, сохраняет тепло в помещении зимой.
Рисунок 11 – Отражательные свойства алюминия [2]
Рисунок 12 – Отражательные свойства и коэффициент излучения алюминия с различной обработкой поверхности [3]
Рисунок 13 – Сравнение отражательных свойств различных металлов [3]
электрические свойства
- Алюминий является одним из двух доступных металлов, обладающих достаточно высокой электропроводностью, чтобы применять их в качестве электрических проводников.
- Электропроводность «электрического» алюминия марки 1350 составляет около 62 % от международного стандарта IACS — электропроводности отожженной меди.

- Однако удельный вес алюминия составляет лишь одну треть от удельного веса меди. Это означает, что он расходует электроэнергии в два раза больше, чем медь того же веса. Это физическое свойство позволяет широко использовать алюминий в высоковольтных линиях электропередач (ЛЭП), трансформаторах, электробусах и патронных лампочках.
Рисунок 14 – Электрические свойства алюминия [3]
магнитные свойства
Алюминий обладает свойством не намагничиваться в электромагнитных полях. Это делает его полезным для защиты оборудования от воздействия электромагнитных полей. Другое применение этой функции — компьютерные диски и параболическая антенна.
Рисунок 15 – Намагничиваемость алюминиевого сплава AlCu [3]
токсические свойства
Это свойство алюминия – отсутствие токсичности – было обнаружено в начале его промышленного освоения. Именно это свойство алюминия позволило использовать его для изготовления кухонной утвари и техники без каких-либо вредных воздействий на организм человека. Алюминий с его гладкой поверхностью легко чистится, важно обеспечить высокую гигиеничность при приготовлении пищи. Алюминиевая фольга и контейнеры широко и безопасно используются в упаковке, непосредственно контактирующей с пищевыми продуктами.
Алюминий с его гладкой поверхностью легко чистится, важно обеспечить высокую гигиеничность при приготовлении пищи. Алюминиевая фольга и контейнеры широко и безопасно используются в упаковке, непосредственно контактирующей с пищевыми продуктами.
звукоизоляционные свойства
Благодаря этому свойству алюминий используется при изготовлении акустических потолков.
Способность поглощать энергию удара
Алюминий имеет модуль в три раза меньший, чем сталь. Это физическое свойство делает его большим преимуществом для изготовления автомобильных бамперов и других средств безопасности автомобилей.
Рисунок 16 – Автомобильные алюминиевые профили
для поглощения энергии удара при аварии
огнезащитные свойства
Алюминиевые детали не образуют искр при ударе друг о друга, а также о другой цветной металл. Это физическое свойство используется при повышенных мерах пожарной безопасности конструкций, например, морских нефтяных вышек.
В то же время при повышении температуры выше 100 градусов Цельсия прочность алюминиевых сплавов значительно снижается (рисунок 17).
Рисунок 17 – Прочность на растяжение алюминиевого сплава 2014-Т6
при различных температурах испытаний [3]
Технологические свойства
Легкость, с которой алюминий может быть переработан в любую форму – обрабатываемость, Это одно из важнейших его преимуществ. Очень часто он может успешно конкурировать с более дешевыми материалами, с которыми гораздо сложнее обращаться:
- Этот металл можно формовать любым способом, известным металлургам, литейщикам.
- Его можно свернуть в рулон до толщины фольги, более тонкие листы бумаги. Алюминиевые пластины
- можно штамповать, вытягивать, сажать и формовать всеми известными методами обработки металлов давлением.
- Алюминий можно ковать всеми способами ковки Алюминиевая проволока
- , вытянутая из круглого стержня, затем может быть вплетена в электрические кабели любого типа и размера.




