Страница 404
Объявления
Свежие публикации
Случайный кадр
Министерство юстиции РФ
информирует
Главная / Страница 404
Извините! Страница не найдена!
Возможные причины:
- она была удалена,
- сменен адресс ссылки,
- вы не верно ввели ссылку.
Сегодня 331 просмотр этой страницы
Поиск по сайту
|
БЕСПЛАТНАЯ ЮРИДИЧЕСКАЯ ПОМОЩЬ Юрисконсульт Яркина Олеся Александровна
Подробнее > |
|
СТРАНИЧКА СОЦИАЛЬНОГО ПЕДАГОГА Телефон +7 (84593) 7-43-84
Подробнее > |
|
Телефон «Горячей линии» Общественной палаты Саратовской области +7 (8452) 277-567
Подробнее > |
Саратовская областная
организация Профсоюза
работников здравоохранения РФ
Пн
Вт
Ср
Чт
Пт
Сб
Вс
12345678910111213141516171819202122232425262728
Опрос
Довольны ли вы качеством услуг предоставляемых в нашем учебном заведении?
- Полностью доволен
- Скорее доволен
- Среднее
- Очень плохо
Посмотреть результаты
Входное тестирование для 9 класса, 1 четверть
Входной контроль по химии 9 класс.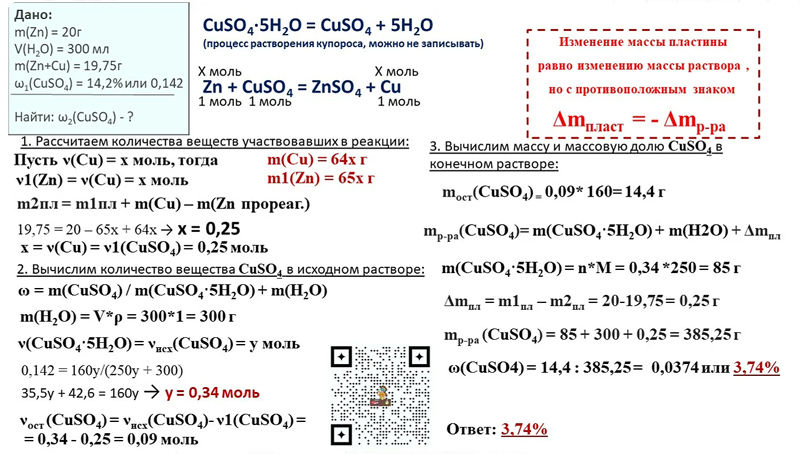
Вариант 2
Часть А. Тестовые задания с выбором ответа
1.(2 балла) Химический элемент, имеющий схему строения атома +8 )2 )6 , в Периодической системе занимает положение:
А. 2-й период, главная подгруппа VII группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа VI группы.
Г. 2-й период, главная подгруппа II группы.
2.(2 балла) Строение внешнего энергетического уровня 2s22p1 соответствует атому элемента:
А. Бора. Б. Серы. В. Кремния. Г. Углерода.
3.(2 балла) Элемент с наиболее ярко выраженными металлическими свойствами:
А. Калий Б. Литий В. Натрий Г. Рубидий
4. (2 балла) Оксид элемента Э с зарядом ядра +11 соответствует общей формуле:
(2 балла) Оксид элемента Э с зарядом ядра +11 соответствует общей формуле:
А. Э2О Б. ЭО В. ЭО2 Г. ЭО3
5.(2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 6 в Периодической системе:
А. Амфотерный. Б. Кислотный. В. Основный.
6.(2 балла) Кислотные свойства наиболее ярко выражены у высшего гидроксида:
А. Алюминия Б. Кремния В. Углерода Г. Фосфора
7.(2 балла) Схема превращения С0C+4 соответствует химическому уравнению:
А. СО2 + СаО = СаСО3 Б. СО2 + Н2О = Н2СО3
В. С + 2СuО = 2Сu + СО2 Г. 2С + О2 = 2СО
2С + О2 = 2СО
8.(2 балла) Сокращённое ионное уравнение реакции Н+ + ОН— = Н2О соответствует взаимодействию:
А. Гидроксида меди (II) и раствора серной кислоты.
Б. Гидроксида натрия и раствора азотной кислоты.
В. Оксида меди (II) и соляной кислоты.
Г.Цинка и раствора серной кислоты.
9.(2 балла) Формула вещества, реагирующего с оксидом меди (II):
А. H2O. Б. MgO. В. CaCl2. Г. H2SO4.
Часть В. Задания со свободным ответом
В11.(6 баллов) Соотнесите.
Формула гидроксида:
1.H3PO4. 2.Ba(OH)2 . 3. Fe(OH)3 . 4. H2SO4..
Формулаоксида:
А. FeO .Б. Fe2O3. В. BaO. Г. SO3. Д. P2O5.
FeO .Б. Fe2O3. В. BaO. Г. SO3. Д. P2O5.
В12.(8 баллов) Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 20 и водородного соединения элемента с порядковым номером 17 в Периодической системе. Назовите все вещества, укажите тип реакции.
Часть С
С13.(4 балла) Составьте уравнение химической реакции, соответствующей схеме С0 C+4. Укажите окислитель и восстановитель.
С14.(8 баллов) По схеме превращений
SO2 SO3 H2SO4 Na2SO4
составьте уравнения реакций в молекулярном виде. Для последнего превращения запишите полное и сокращенное ионные уравнения.
С15.(4 балла) По уравнению реакции СаСО3 =СаО + СО2
рассчитайте массу оксида кальция, который образуется при разложении 200 г карбоната кальция
Входной контроль по химии 9 класс.
Вариант 1
Часть А. Тестовые задания с выбором ответа
1.(2 балла) Химический элемент, имеющий схему строения атома +14 )2 )8 )4 , в Периодической системе занимает положение:
А. 4-й период, главная подгруппа III группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа IV группы.
Г. 3-й период, главная подгруппа II группы.
2.(2 балла) Строение внешнего энергетического уровня 3s23p5 соответствует атому элемента:
А. Магния. Б. Серы. В. Фосфора. Г. Хлора.
3.(2 балла) Элемент с наиболее ярко выраженными неметаллическими свойствами:
А. Кремний. Б. Магний. В. Сера. Г. Фосфор.
4.(2 балла) Оксид элемента Э с зарядом ядра +16 соответствует общей формуле:
А. Э2О Б. ЭО В. Э2О3 Г. ЭО3
5.(2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 7 в Периодической системе:
А. Амфотерный Б. Кислотный В. Основный
6.(2 балла) Основные свойства наиболее ярко выражены у высшего гидроксида:
А. Бария. Б.Бериллия. В.Кальция. Г. Магния
7.(2 балла) Схема превращения Сu+2 Cu0 соответствует химическому уравнению:
А. CuO + H2 = Cu + H2O Б. CuO + 2HCl = CuCl2 + H2O
В. Cu + Cl2 = CuCl2 Г. 2Cu + O2 = 2CuO
2Cu + O2 = 2CuO
8.(2 балла) Сокращённое ионное уравнение реакции Ba2+ + SO42- = BaSO4 соответствует взаимодействию:
А. Бария и раствора серной кислоты.
Б. Оксида бария и соляной кислоты.
В. Оксида бария и раствора серной кислоты.
Г. Хлорида бария и раствора серной кислоты.
9.(2 балла) Формула вещества, реагирующего с раствором гидроксида кальция:
А. HCl. Б.CuO. В. H2O. Г. Mg.
Часть В. Задания со свободным ответом
В11.(6 баллов) Соотнесите.
Формула оксида:
1. CuO. 2. CO2. 3. Al2O3. 4. SO3.
Формулагидроксида:
А. H2SO4. Б. Al(OH)3 .В. Cu(OH)2. Г. CuOH. Д. H2CO3.
H2SO4. Б. Al(OH)3 .В. Cu(OH)2. Г. CuOH. Д. H2CO3.
В12.(8 баллов) Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 3 и водородного соединения элемента с порядковым номером 9 в Периодической системе. Назовите все вещества, укажите тип реакции.
Часть С
С13.(4 балла). Составьте уравнение химической реакции, соответствующей схеме S0 S2. Укажите окислитель и восстановитель.
С14.(8 баллов) По схеме превращений
ВаO Ва(OН)2 ВаСO3 ВаСl2
составьте уравнения реакций в молекулярном виде. Для последнего превращения запишите полное и сокращенное ионные уравнения.
С15.(4 балла) По уравнению реакции 2Mg + O2 = 2MgO
рассчитайте объем кислорода (н. у.), необходимого для полного сгорания 1,2 г магния.
у.), необходимого для полного сгорания 1,2 г магния.
Система выставления оценок.
Вариант №1.
Часть А.
А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
В | Г | В | Г | Б | А | А | Г | А | Г |
Часть В.
В11.(6 баллов)
1 – В, 2 – Д, 3 – Б, 4 – А.
В12.(8 баллов)
LiOH + HF = LiF + H2O обмена, нейтрализации
гидроксид лития + фтороводород = фторид лития + вода.
Часть С
С13. (4 балла).
S0 + H2 = H2S-2
S – окислитель; H – восстановитель.
С14. .(8 баллов) ВаO→ Ва(OН)2→ ВаСO3→ ВаСl2
ВаO + Н2О = Ва(OН)2
Ва(OН)2 +СО2 = ВаСO3 + Н2О
ВаСO3 + 2НCl = ВаСl2 + Н2О + СО2
Ba2+ + CO32- + 2H+ + 2Cl— = Ba2+ + 2Cl— + Н2О + СО2
Ba2+ + CO32- + 2H+ = Ba2+ + Н2О + СО2
С15. (4 балла)
(4 балла)
Дано: | m= 1,2г V– x |
m(Mg) = 1,2г | 2Mg + O2 = 2MgO |
Найти: | n = 2моль n = 1моль |
V(O2) – ? | М = 24г/моль VМ = 22,4 л/моль |
m = 48г V = 22,4л |
1,2/48 = х/22,4 х = 1,2 х 22,4 / 48 = 0,56 л
Ответ: 0,56 л
Вариант №2.
Часть А.
А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
Б | А | Г | А | Б | Г | В | Б | Г | Г |
Часть В.
В11.
1 – Д, 2 – В, 3 – Б, 4 – Г.
В12.
Са(OH)2 + 2HСl = CaCl2 + 2 H2O обмена, нейтрализации
гидроксид кальция + соляная кислота = хлорид кальция + вода.
Часть С С13.
С0 + О2 = С+4О2
О – окислитель; С – восстановитель.
С14. SO2→ SO3→ H2SO4 → Na2SO4
2SO2 + О2 = 2SO3
SO3 + Н2О = H2SO4
H2SO4 + 2 NaOH = Na2SO4 + 2Н2О
2H+ + SO42— + 2Na+ + 2OH— = 2Na+ + SO42— + 2Н2О
H+ + OH— = Н2О
С15.
Дано: | m= 200г m– x |
m(CaCO3)= 200г | CaCO3 = CaO + CO2 |
Найти: | n = 1моль n = 1моль |
m (CaO) – ? | М = 100г/моль M= 56г/моль |
m = 100г m = 56г |
200/100 = х/56
х = 200 х 56 / 100 = 112гОтвет: 112г
КИМ 9 класс 1 четверть
1. Признаком химической реакции являетя:
Признаком химической реакции являетя:
Выделение энергии
Изменение формы тела
Изменение агрегатного состояния
Уменьшение размеров частиц
2. Веществом с ковалентной полярной связью является:
Иодид лития
Алюминий
Оксид азота (IV)
Водрод
3. Какое уравнение соответствует реакции соединения?
Na2O + H2O = 2NaOH
2HCl + MgO = MgCl2 + H2O
2AgNO3 = 2Ag + 2NO2 + O2↑
H2SO4 + Fe = FeSO4 + H2
4. Формулы высших оксидов химических элементов, порядковые номера которых в периодической системе 11, 13,15, записаны в ряду:
BaO, Al2O3, P2O5
Na2O, Al2O3, P2O5
Na2O, Al2O3, P2O3
CaO, Al2O3, P2O5
5. Ионной связью образовано каждое вещество, формулы которых:
Ионной связью образовано каждое вещество, формулы которых:
F2, NH3, NaCl
Na2S, CaO, KI
CO2, MgF2, SO3
H2S, CH4, CuO
6. Ковалентная неполярная связь образуется между атомами:
Углерода и алюминия
Азота и водорода
Кислорода
Алюминия
7. К хорошо растворимым в воде электролитам относится:
Сульфат бария
Сульфат цинка
Сульфид меди (II)
Оксид железа (III)
8. 3 моль катионов образуется при полной диссоциации 1 моль:
Фосфата натрия
Нитрата алюминия
Хлорида железа (III)
Гидроксида кальция
9. Какое уравнение соответствует реакции обмена?
CO2 + C = 2CO
2H2S + 3O2 = 2SO2 + 2H2O
2HCl + Ca(OH)2 = CaCl2 +2H2O
Zn + 2HCl = ZnCl2 + H2↑
10. Сокращенное ионное уравнение Cu+2 + 2OH— = Cu(OH)2↓ соответствует взаимодействию:
Нитрата меди (II) и гидроксида железа (II)
Оксида меди (II) и воды
Сульфата меди (II) и гидроксида калия
Карбоната меди (II) и гидроксида бария
11. Формула кислородсодержащей, двухосновной, растворимой, нестабильной слабой кислоты:
Формула кислородсодержащей, двухосновной, растворимой, нестабильной слабой кислоты:
Азотная
Кремниевая
Угольная
Сероводородная
12. Формулы основания, кислоты и кислотного оксида последовательно расположены в ряду:
Ca(OH)2, HCl, CaO
KOH, KHS, SO3
CuOHCl, HNO3, HBr
NaOH, HCN, SO3
13. В схеме превращений Na → Х → Na2CO3 веществом Х является:
NaOH
NaNO3
NaCl
Na2SO4
14. Окислительно-восстановительной является реакция, схема которой:
K2CO3 + HCl = KCl + CO2 + H2O
BaO + h3O= Ba(OH)2
NaHCO3 = Na2CO3 + CO2 + H2O
H2S + SO2 = S + H2O
15. Определить тип гидролиза образовавшегося раствора: Al(NO3)3
Гидролиз не идет
По катиону
По аниону
16. Определить среду гидролиза образовавшегося раствора: Al(NO3)3
Определить среду гидролиза образовавшегося раствора: Al(NO3)3
Нейтральная
Щелочная
Кислая
17. Определить тип гидролиза образовавшегося раствора: NН4Сl
Гидролиз не идет
По катиону
По аниону
18. Определить среду гидролиза образовавшегося раствора: NН4Сl
Нейтральная
Щелочная
Кислая
19. К физическим явлениям относятся:
Скисание молока
Засахаривание варенья
Горение свечи
Пригорание пищи
20. веществом с металлической связью является:
Оксид калия
Хлорид натрия
Аммиак
Цинк
Ответы записать в таблицу
№ вопроса | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
№ ответа | ||||||||||
№ вопроса | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
№ ответа |
Факты о барии, символ, открытие, свойства, применение
- Что такое барий
- Где встречается барий
- История
- Идентификация
- Свойства и характеристики бария
- Влияние его токсичности
- Интересные факты
- Цена бария
3 Атомные данные бария
3 Барий Используется для
Что такое барий
Принадлежит к семейству щелочноземельных металлов, барий (произносится как BAR-ee-em) представляет собой тяжелый металл, представленный химический символ Ba [1] . Из тридцати семи изотопов бария только семь встречаются в природе с массовыми числами от 130 до 138 (исключая Ва-131), из которых барий-133 является наиболее стабильным, с периодом полураспада 10,51 года . 4] .
Из тридцати семи изотопов бария только семь встречаются в природе с массовыми числами от 130 до 138 (исключая Ва-131), из которых барий-133 является наиболее стабильным, с периодом полураспада 10,51 года . 4] .
Символ бария
Является ли барий радиоактивным
Хотя сульфат бария является широко используемым контрастным веществом в радиологических исследованиях, он не обладает радиоактивными свойствами.
Где содержится барий
Основными источниками этого элемента являются барит и витерит, обнаруженные в нескольких рудных месторождениях. Его также можно получить в лаборатории путем нагревания оксида бария с порошком алюминия, а также путем электролиза расплавленного хлорида бария 9.0027 [1] .
История
Происхождение названия: Название происходит от греческого слова «барыс», что означает тяжелый.
Кто открыл этот элемент: Хамфри Дэви
Когда, где и как был открыт барий
В начале 1600-х годов сапожник по имени Винченцо Кашароло обнаружил гальку недалеко от гор Болоньи, Италия. Он нагрел гальку, пока она не раскалилась докрасна, но обнаружил, что ночью она светится.
Он нагрел гальку, пока она не раскалилась докрасна, но обнаружил, что ночью она светится.
В 1760-х годах Карл Шееле, шведский шпиц, и немецкий химик-фармацевт обнаружили, что камень представляет собой сульфат неизвестного элемента. В Камберленде английский ученый по имени доктор Уильям Уизеринг наткнулся на необычный минерал в свинцовом руднике, который на время получил название витерит. При дальнейшем анализе позже было обнаружено, что это минерал карбонат бария.
Два неизвестных минерала были переплавлены с углеродом для извлечения чистого металла, но ничего не добились. Только в 1808 году Дэви в Королевском институте в Лондоне провел электролиз гидроксида бария для извлечения бария.
Барий
Идентификация | |||
| Атомный номер | 56 [1] | ||
| Номер CAS | 7440-39-3 [1] | ||
| Позиция в таблице Менделеева | Группа | Период | Блок |
| 2 | 6 | с | |
Место бария в периодической таблице
Свойства и характеристики бария
Общие свойства | ||
| Относительная атомная масса | 137. 327 [1] 327 [1] | |
| Атомная масса | 137,327 атомных единиц массы [5] | |
| Молярная масса | 137,33 г/моль [6] | |
| Массовый номер | 138 | |
Физические свойства | ||
| Цвет/внешний вид | Серебристо-белый [1] | |
| Тестовый цвет пламени | бледно-зеленый | |
| Блеск | Стекловидное, жемчужное | |
| Точка плавления/замерзания | 727°C (1341°F) [1] | |
| Температура кипения | 1845°C (3353°F) [1] | |
| Плотность | 3,62 г/см 3 [1] | |
| Удельный вес | 3,5 [7] | |
| Состояние вещества при комнатной температуре (твердое/жидкое/газообразное) | сплошной [1] | |
| Твердость (по Виккерсу) | 1,25 Мооса [5] | |
| Электропроводность | 2,8×10 6 Ш/м | |
Химические свойства | ||
| Степень окисления/число окисления | +2 [1] | |
| Растворимость | Нерастворим в воде (растворим в спирте) | |
Атомные данные бария (элемент 56)
| Валентные электроны | 3 [5] | ||||||
| Ионный заряд | +2 | ||||||
| Квантовые числа [7] | |||||||
| – № | 6 | ||||||
| – ℓ | 0 | ||||||
| – м л | 0 | ||||||
| – м с | -1/2 | ||||||
| Электронная конфигурация (конфигурация благородных газов) | [Хе] 6с 2 [1] | ||||||
| Атомная структура [3] | |||||||
| — Количество электронов | 56 | ||||||
| — Количество нейтронов | 82 | ||||||
| — Количество протонов | 56 | ||||||
| Радиус атома | |||||||
| – Атомный радиус | 2,68 Å [1] | ||||||
| – Ковалентный радиус | 2,06 Å [1] | ||||||
| Электроотрицательность | 0,89 | ||||||
| Энергия ионизации [1] (кДжмоль -1 ) | 1-й | 2-й | 4-й | 5-й | 6-й | 7-й | |
| 547,109 | 1085,46 | 2404. 41 41 | 4119,9 | – | – | – | |
Атомная структура бария (модель Бора)
Для чего используется барий
Металлический барий используется в качестве геттера для удаления следовых газов из вакуумных трубок. Хотя все соединения элемента обладают токсическим действием, сульфат бария используется в качестве контрастного красителя для проведения глотательного теста, который включает рентген пищеварительной системы для выявления таких состояний, как язвенный колит, опухоли и полипы 9.0027 [1] .
Последствия его токсичности
Проглатывание соединений бария может вызвать легкие побочные эффекты, такие как тошнота, рвота и спазмы в животе. Однако отравление барием связано с повреждением почек, проблемами с сердцем и низким уровнем калия в крови. Вдыхание того же вещества может оказывать такое же воздействие на здоровье, как и в некоторых исследованиях на животных [8] .
Интересные факты
- Барий-137m, радиоактивный изотоп бария, образующийся при распаде цезия-137, используется для проведения экспериментов по определению периода полураспада в физических лабораториях средних школ и колледжей [2].

Барий Цена
Стоимость чистого бария может варьироваться от 55 до 60 долларов за 100 граммов.
Ссылки
- http://www.rsc.org/periodic-table/element/56/barium
- https://education.jlab.org/itselemental/ele056.html
- https://pubchem.ncbi.nlm.nih.gov/compound/барий
- https://education.jlab.org/itselemental/iso056.html
- https://study.com/academy/answer/what-is-the-molar-mass-of-barium.html
- http://hobart.k12.in.us/ksms/PeriodicTable/barium.htm
- https://www.thoughtco.com/barium-element-facts-606503
- https://www.atsdr.cdc.gov/ToxProfiles/tp24.pdf
Соединения бария | Encyclopedia.com
Примечание. Эта статья, первоначально опубликованная в 1998 г., была обновлена в 2006 г. для выпуска электронной книги.
Обзор
Барий был впервые выделен в 1808 году английским химиком сэром Хамфри Дэви (1778-1829). В 1807 и 1808 годах Дэви также открыл пять других новых элементов: натрий, калий, стронций, кальций, и магний. Все эти элементы были признаны новыми веществами гораздо раньше, но Дэви первым получил их в чистом виде. (См. врезку о Дэви в статье Calcium .)
Все эти элементы были признаны новыми веществами гораздо раньше, но Дэви первым получил их в чистом виде. (См. врезку о Дэви в статье Calcium .)
Барий впервые был идентифицирован как новый материал в 1774 году шведским химиком Карлом Вильгельмом Шееле (1742-86). Однако форма, с которой работал Шееле, представляла собой соединение бария, сульфат бария (BaSO
SYMBOL
Ba
ATOMIC NUMBER
56
ATOMIC MASS
137.34
FAMILY
Group 2 (IIA)
Alkaline earth metal
PRONUNCIATION
BARE-ee-um
Барий относится к группе щелочноземельных металлов. Щелочноземельные металлы составляют группу 2 (IIA) периодической таблицы. Другими элементами этой группы являются бериллий, магний, кальций, стронций и радий. Эти элементы, как правило, относительно активны химически и образуют ряд важных и полезных соединений. Они также имеют тенденцию в изобилии встречаться в земной коре в ряде известных минералов, таких как арагонит,
кальцит, мел, известняк, мрамор, травертин, магнезит и доломит. Щелочноземельные соединения широко используются в качестве строительных материалов.
Эти элементы, как правило, относительно активны химически и образуют ряд важных и полезных соединений. Они также имеют тенденцию в изобилии встречаться в земной коре в ряде известных минералов, таких как арагонит,
кальцит, мел, известняк, мрамор, травертин, магнезит и доломит. Щелочноземельные соединения широко используются в качестве строительных материалов.
Сам по себе барий имеет относительно небольшое коммерческое применение. Однако его соединения находят широкое применение в промышленности и медицине. Сульфат бария используется при рентгенологических исследованиях желудочно-кишечного тракта (ЖКТ). Система ЖКТ включает желудок, кишечник и связанные с ними органы.
Открытие и наименование
Первое упоминание о соединениях бария относится к началу семнадцатого века. В ранних записях упоминается «болонский камень», названный в честь города Болонья в Италии. Болонский камень светился в темноте.
Более ста лет исследователи работали, но не могли идентифицировать элементы в камне. В 1774 году Шееле объявил о наличии нового элемента в болонском камне. Сегодня ученые знают, что камень был разновидностью барита. Пять лет спустя Шееле продемонстрировал, что барит также присутствует в тяжелом лонжероне. Этот плотный прозрачный минерал очень похож на обычный шпат, соединение кальция.
В 1774 году Шееле объявил о наличии нового элемента в болонском камне. Сегодня ученые знают, что камень был разновидностью барита. Пять лет спустя Шееле продемонстрировал, что барит также присутствует в тяжелом лонжероне. Этот плотный прозрачный минерал очень похож на обычный шпат, соединение кальция.
Физические свойства
Чистый барий представляет собой бледно-желтый, несколько блестящий, несколько ковкий металл. Ковкий означает, что его можно сбивать в тонкие листы. Он имеет температуру плавления около 700°C (1300°F) и точку кипения около 1500°C (2700°F). Его плотность составляет 3,6 грамма на кубический сантиметр.
При нагревании соединения бария выделяют бледное желто-зеленое пламя. Это свойство используется в качестве теста на барий.
Химические свойства
Барий является активным металлом. Легко комбинируется с кислород, галогены и другие неметаллы. Галогены относятся к группе 17 (VIIA) периодической таблицы и включают фтор, хлор, бром, йод, и астат. Барий также реагирует с водой и большинством кислот. Он настолько реакционноспособен, что его необходимо хранить под керосином, бензином или какой-либо другой маслянистой жидкостью, чтобы предотвратить
это от реакции с кислородом и влагой в воздухе. Из щелочного семейства только радий более реакционноспособен.
Барий также реагирует с водой и большинством кислот. Он настолько реакционноспособен, что его необходимо хранить под керосином, бензином или какой-либо другой маслянистой жидкостью, чтобы предотвратить
это от реакции с кислородом и влагой в воздухе. Из щелочного семейства только радий более реакционноспособен.
Встречаемость в природе
Барий является четырнадцатым наиболее распространенным элементом в земной коре. Его численность оценивается примерно в 0,05 процента.
Наиболее распространенными источниками бария являются барит и витерит. Витерит — руда, содержащая карбонат бария (BaCO 3 ). Основными источниками бариевых руд в мире являются Китай, Индия, Марокко, США, Турция и Казахстан. Большая часть бария обработанный в Соединенных Штатах, поступает из Луизианы, Невады и Техаса.
Изотопы
В природе существует семь изотопов бария: барий-130, барий-132, барий-134, барий-135, барий-136, барий-137 и барий-138. Изотопы представляют собой две или более формы элемента. Изотопы отличаются друг от друга массовым числом. Число, написанное справа от названия элемента, является массовым числом. Массовое число представляет
количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждая вариация является изотопом.
Изотопы отличаются друг от друга массовым числом. Число, написанное справа от названия элемента, является массовым числом. Массовое число представляет
количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждая вариация является изотопом.
Известно также около дюжины радиоактивных изотопов бария. Радиоактивный изотоп — это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обстреливают атомы. Эти частицы впиваются в атомы и делают их радиоактивными.
Ни один из изотопов бария не имеет практического коммерческого применения.
Экстракция
Чистый барий получают реакцией оксида бария (BaO) с алюминием или кремнием:
Применение
Металлический барий имеет относительно мало применений, поскольку он очень активен. Эта активность делает его отличным «добытчиком» или «поглотителем» при удалении нежелательного кислорода из запечатанных стеклянных контейнеров. (Например, кислород может мешать работе вакуумной трубки.) Если добавить в трубку небольшое количество бария, свободный кислород внутри будет «поглощен». Кислород реагирует с барием с образованием оксида бария.
(Например, кислород может мешать работе вакуумной трубки.) Если добавить в трубку небольшое количество бария, свободный кислород внутри будет «поглощен». Кислород реагирует с барием с образованием оксида бария.
Соединения
Соединения бария, особенно барита (BaSO 4 ), имеют решающее значение для нефтяной промышленности. Барит используется в качестве утяжелителя при бурении новых нефтяных скважин. Утяжелитель — это материал, который придает нефти плотность.
Бурение на нефть, используемую для получения огромных фонтанов. Фонтан – это нефть, которая выбрасывается из скважины в воздух. Фонтаны нежелательны, потому что они расходуют нефть и могут гореть месяцами, если загорятся.
Фонтаны вызваны давлением нефти, устремляющейся в только что пробуренную скважину в земле. Это давление толкает масло вверх слишком быстро. Барит добавляется в отверстие по мере его бурения. Там он имеет тенденцию смешиваться с нефтью в земле и образовывать очень
густая смесь, которая выходит намного медленнее и под контролем.
Девяносто процентов барита, добываемого в США, используется в нефтяной промышленности. Вот другие области применения барита и других соединений бария:
Взгляд внутрь тела
P Возможно, соединения бария наиболее известны в медицине. Врачи часто хотят знать, что происходит внутри тела пациента. Один из способов узнать это, конечно же, хирургическое вмешательство. Но хирургия — радикальная процедура. Это может вызвать новые проблемы для пациента. В результате медицинские исследователи разработали менее экстремальные процедуры. Один из таких методов называется рентгенографией.
Рентгенография — это метод, при котором рентгеновские лучи проходят через тело. Рентгеновские лучи — это световые волны высокой энергии. Они могут проходить через кожу и ткани, но поглощаются костями. Таким образом, рентгеновские лучи — хороший способ узнать, например, сломана ли кость.
Любой свет, появляющийся на пленке в результате рентгеновского снимка, создает черную область или экспозицию. Рентгеновские лучи проходят через мягкие ткани, обнажая пленку. Кости на пленке выглядят серовато-белыми, в зависимости от того, сколько энергии проходит.
Рентгеновские лучи проходят через мягкие ткани, обнажая пленку. Кости на пленке выглядят серовато-белыми, в зависимости от того, сколько энергии проходит.
Рентгенография также может быть использована для изучения частей тела, в которые вовлечены кости , а не . Например, врач может захотеть изучить желудок человека. Поскольку в желудке нет костей, необходимо использовать какой-то другой метод, чтобы заглянуть внутрь желудка.
В таких случаях часто используется сульфат бария. Сульфат бария обладает некоторыми из тех же свойств, что и костный материал. Следовательно, поскольку рентгеновские лучи не проходят через сульфат бария, это соединение можно использовать для исследования некоторых мягких тканей.
Рентгенография с использованием сульфата бария называется глотанием бария или клизмой с барием. Сульфат бария смешивают с водой в кашицу (смесь), которая по внешнему виду и вкусу напоминает молотый мел. Больной проглатывает густую смесь. Затем врач или медсестра держат флюороскоп над животом пациента.

 00-15.00
00-15.00 