Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Режим работы и обучения
Студенту
Информация для студентов очной и заочной формы обученияЦентр дополнительного образования и профориентационной работы
Факультет последипломного образования
Информация о вузе
Информация о ПМФИВиртуальный кабинет психологической помощи
О приеме заявлений о зачислении в порядке перевода от граждан РФ, Украины, Донецкой и Луганской народных республик
Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВO ВолгГМУ Минздрава России осуществляет прием заявлений о зачислении в порядке перевода от граждан Российской Федерации, а также от граждан Украины, Донецкой и Луганской народных республик, вынужденно покинувших территорию республик и прибывших на территорию Российской Федерации, изъявивших желание перевестись для обучения в ПМФИ.
Перевод осуществляется на программы, реализуемые в ПМФИ, в соответствии с действующим законодательством, Положениями и Уставом ВолгГМУ.
Заявления о переводе принимаются ежедневно с 9:00 до 17:00 (выходные дни: суббота, воскресенье).
Ответственные сотрудники за прием заявлений о переводе:
ЧАХИРОВА Виктория Анатольевна, начальник учебного отдела
Тел. +7 (906) 460-09-80
e-mail: [email protected]
Дирекция ПМФИ
Центр дополнительного образования и профориентационной работы
Повышение квалификации
- Для педагогических работников
Профессиональная переподготовка
- Для педагогических работников
ПМФИ в: Youtube Instagram Вконтакте
Юбилей ПМФИ — 75
СЛОВО ДИРЕКТОРА
О ВУЗЕ
Пятигорский медико-фармацевтический институт, как правопреемник Пятигорской государственной фармацевтической академии, является признанным лидером фармацевтического образования России. Авторитет вуза признан не только в России, но и за её пределами.
Авторитет вуза признан не только в России, но и за её пределами.
Ахвердова Ольга Альбертовна
Директор, доктор психологических наук, кандидат медицинских наук
Подробнее о вузе
Виртуальный кабинет психологической помощи
Очные психологические консультации (с использованием дистанционных технологий)
Время работы: пятница с 18:00 — 20:00 (платформа VooVMeeting)
Психолог invites you to a meeting on VooVMeeting
Meeting Topic: Психологическая служба
Meeting Time: 2022/3/18 17:00-19:00 (GMT+03:00) Moscow Standard Time — Moscow Recurrence:Every Fri
Click the link to join the meeting or to add it to your meeting list: https://voovmeeting.com/dm/9LrpICRwUcOT
#VooVMeeting: 818-0338-2767 Meeting Password: 12345
Attendees: Психолог
Заочные психологические консультации
e-mail: ovz@pmedpharm. ru
ru
Подробнее
Дополнительное профессиональное образование медицинских и фармацевтических специалистов
Все программы разработаны в соответствии с требованиями профессиональных стандартов, нормативной базой министерства здравоохранения и министерства образования Российской Федерации.
Для специалистов с высшим и средним профессиональным фармацевтическим и медицинским образованием:
- Провизоров;
- Фармацевтов;
- Врачей;
- Среднего медицинского персонала;
Больше информации
Новости
Читать все
Актуальные вопросы патофизиологии глазами школьников
8 февраля 2023
Квиз от команды «Твой ход»
6 февраля 2023
Круглый стол «За чистоту речи»
3 февраля 2023
Сегодня Волгоград и вся Россия празднуют 80-летие Победы в Сталинградской битве
2 февраля 2023
30 января 2023
Наши волонтеры посетили школу №6 города Пятигорск
27 января 2023
Расписание он-лайн
Уточните курс и группу для просмотра актуального расписания.
Посмотреть расписание
Материалы
Доступ к методическим,
консультационным и справочным
материалам, лекциям, тестовым
заданиям.
Узнать больше
Галерея Посмотреть фотографии
Кафедры и подразделения
Учебный процесс в вузе осуществляется на 27 кафедрах
и в 41 подразделении.
Узнать больше
Сайт олимпиады ЖМИ здесь и участвуй!
ПМФИ — Соорганизатор направления «Фармация», материалы
Главный корпус ПМФИ —
Пятигорского филиала ФГБОУ ВО ВолгГМУ
Минздрава России
Объявления
Важно
Летняя онлайн языковая школа в Центре мировых языков и культур
26 мая 2022
Важно
Летняя профильная школа Юного провизора Пятигорского медико-фармацевтического института начнет свою работу в июне
23 мая 2022
Важно
Собеседование на восстановление по специальности «Фармация», «Стоматология», «Лечебное дело», «Медицинская биохимия», будет проходить 30 августа 2021 г.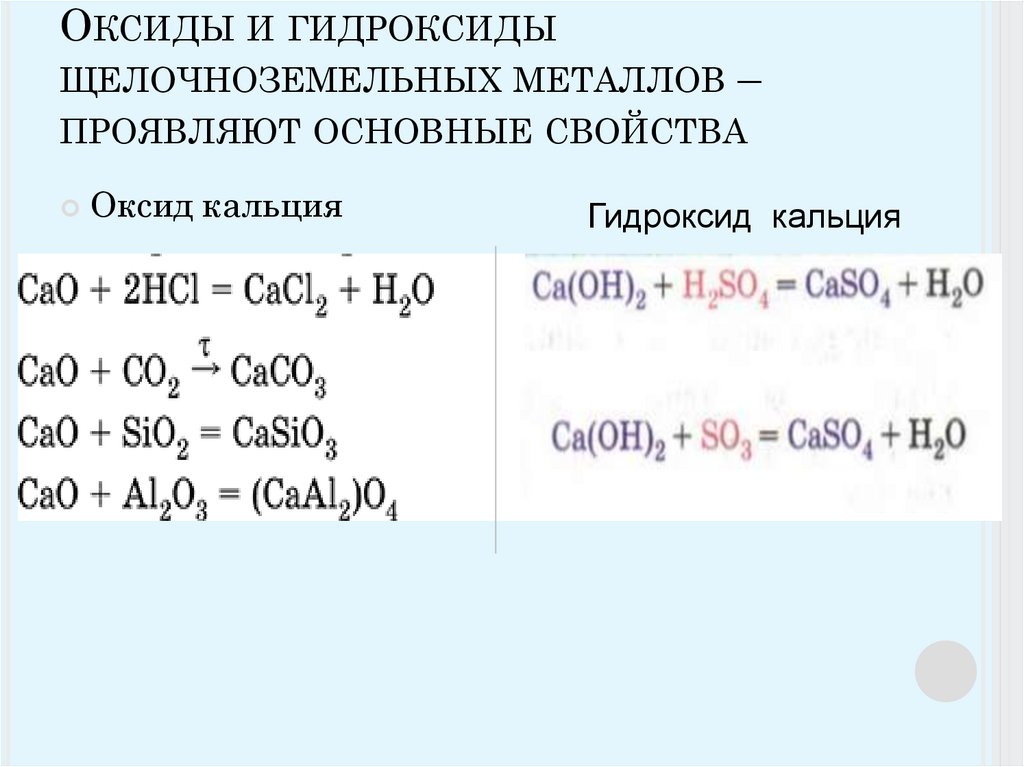 на кафедрах
на кафедрах
6 июля 2021
Читать все
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
№1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13. 07.2016.
07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
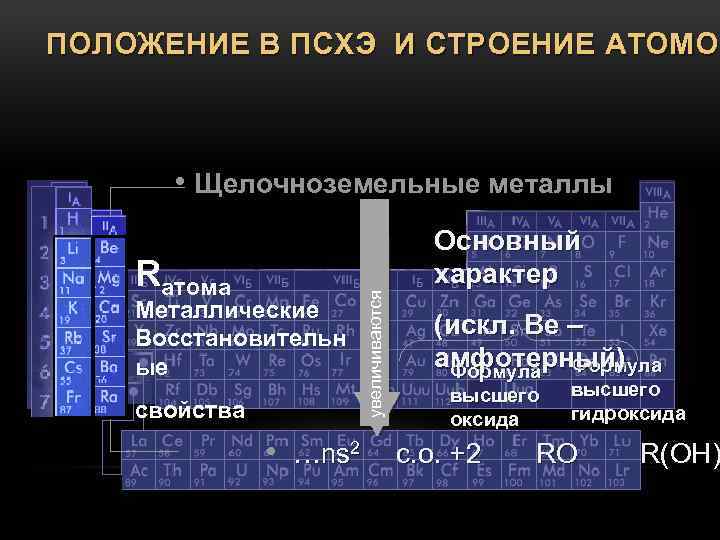
Входной контроль по химии. 9 класс.
Входной контроль
по теме «Повторение курса химии 8 класса»
Вариант 2
Часть А. Тестовые задания с выбором ответа
1.(2 балла) Химический элемент, имеющий схему строения атома +8 )2 )6 , в Периодической системе занимает положение:
А. 2-й период, главная подгруппа VII группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа VI группы.
Г. 2-й период, главная подгруппа II группы.
2.(2 балла) Строение внешнего энергетического уровня 2s22p1 соответствует атому элемента:
А. Бора. Б. Серы. В. Кремния. Г. Углерода.
3.(2 балла) Элемент с наиболее ярко выраженными металлическими свойствами:
А. Калий Б. Литий В. Натрий Г. Рубидий
Калий Б. Литий В. Натрий Г. Рубидий
4.(2 балла) Оксид элемента Э с зарядом ядра +11 соответствует общей формуле:
А. Э2О Б. ЭО В. ЭО2 Г. ЭО3
5.(2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 6 в Периодической системе:
А. Амфотерный. Б. Кислотный. В. Основный.
6.(2 балла) Кислотные свойства наиболее ярко выражены у высшего гидроксида:
А. Алюминия Б. Кремния В. Углерода Г. Фосфора
7.(2 балла) Схема превращения С0 C+4 соответствует химическому уравнению:
А. СО2 + СаО = СаСО3Б. СО2 + Н2О = Н2СО3
В. С + 2СuО = 2Сu + СО2Г. 2С + О2 = 2СО
8.(2 балла) Сокращённое ионное уравнение реакции Н+ + ОН— = Н2О соответствует взаимодействию:
А. Гидроксида меди (II) и раствора серной кислоты.
Гидроксида меди (II) и раствора серной кислоты.
Б. Гидроксида натрия и раствора азотной кислоты.
В. Оксида меди (II) и соляной кислоты.
Г.Цинка и раствора серной кислоты.
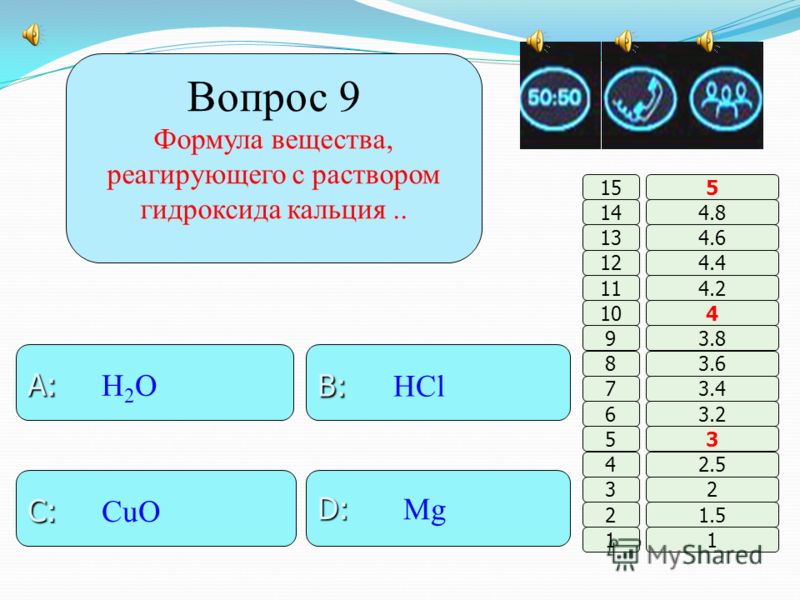
9.(2 балла) Формула вещества, реагирующего с оксидом меди (II):
А. H2O. Б. MgO. В. CaCl2. Г. H2SO4.
10.(2 балла) Элементом Э в схеме превращений Э Э2О5 Н3ЭО4 является:
А. Азот. Б. Сера. В. Углерод. Г. Фосфор.
Часть В. Задания со свободным ответом
В11.(6 баллов) Соотнесите.
Формула гидроксида:
1.H3PO4. 2.Ba(OH)2 . 3. Fe(OH)3 . 4. H2SO4..
Формула оксида:
А. FeO .Б. Fe2O3. В. BaO. Г. SO3. Д. P2O5.
В. BaO. Г. SO3. Д. P2O5.
В12.(8 баллов) Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 20 и водородного соединения элемента с порядковым номером 17 в Периодической системе. Назовите все вещества, укажите тип реакции.
Часть С
С13.(4 балла) Составьте уравнение химической реакции, соответствующей схеме С0 C+4. Укажите окислитель и восстановитель.
С14.(8 баллов) По схеме превращений
SO2 SO3 H2SO4 Na2SO4
составьте уравнения реакций в молекулярном виде. Для последнего превращения запишите полное и сокращенное ионные уравнения.
С15.(4 балла) По уравнению реакции СаСО3 =СаО + СО2
рассчитайте массу оксида кальция, который образуется при разложении 200 г карбоната кальция
Входной контроль
по теме «Повторение курса химии 8 класса»
Вариант 1
Часть А. Тестовые задания с выбором ответа
Тестовые задания с выбором ответа
1.(2 балла) Химический элемент, имеющий схему строения атома +14 )2 )8 )4 , в Периодической системе занимает положение:
А. 4-й период, главная подгруппа III группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа IV группы.
Г. 3-й период, главная подгруппа II группы.
2.(2 балла) Строение внешнего энергетического уровня 3s23p5 соответствует атому элемента:
А. Магния. Б. Серы. В. Фосфора. Г. Хлора.
3.(2 балла) Элемент с наиболее ярко выраженными неметаллическими свойствами:
А. Кремний. Б. Магний. В. Сера. Г. Фосфор.
4.(2 балла) Оксид элемента Э с зарядом ядра +16 соответствует общей формуле:
А. Э2О Б. ЭО В. Э2О3 Г. ЭО3
5. (2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 7 в Периодической системе:
(2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 7 в Периодической системе:
А. Амфотерный Б. Кислотный В. Основный
6.(2 балла) Основные свойства наиболее ярко выражены у высшего гидроксида:
А. Бария. Б.Бериллия. В.Кальция. Г. Магния
7.(2 балла) Схема превращения Сu+2 Cu0 соответствует химическому уравнению:
А. CuO + H2 = Cu + H2O Б. CuO + 2HCl = CuCl2 + H2O
В. Cu + Cl2 = CuCl2Г. 2Cu + O2 = 2CuO
8.(2 балла) Сокращённое ионное уравнение реакции Ba2+ + SO42- = BaSO4 соответствует взаимодействию:
А. Бария и раствора серной кислоты.
Б. Оксида бария и соляной кислоты.
В. Оксида бария и раствора серной кислоты.
Г.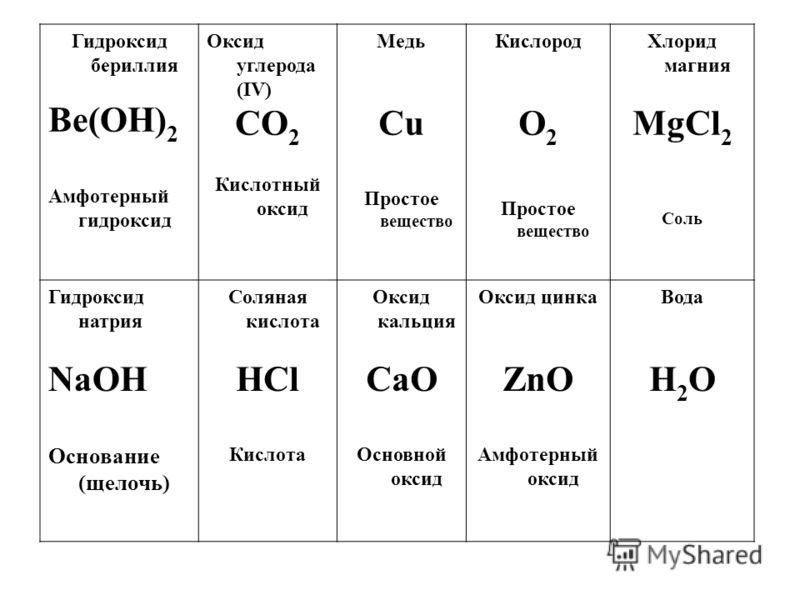 Хлорида бария и раствора серной кислоты.
Хлорида бария и раствора серной кислоты.
9.(2 балла) Формула вещества, реагирующего с раствором гидроксида кальция:
А. HCl. Б.CuO. В. H2O. Г. Mg.
10.(2 балла) Элементом Э в схеме превращений Э ЭО2 Н2ЭО3 является:
А. Азот. Б. Магний. В. Алюминий. Г. Углерод.
Часть В. Задания со свободным ответом
В11.(6 баллов) Соотнесите.
Формула оксида:
1. CuO. 2. CO2. 3. Al2O3. 4. SO3.
Формула гидроксида:
А. H2SO4. Б. Al(OH)3 .В. Cu(OH)2. Г. CuOH. Д. H2CO3.
В12.(8 баллов) Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 3 и водородного соединения элемента с порядковым номером 9 в Периодической системе. Назовите все вещества, укажите тип реакции.
Назовите все вещества, укажите тип реакции.
Часть С
С13.(4 балла). Составьте уравнение химической реакции, соответствующей схеме S0 S-2. Укажите окислитель и восстановитель.
С14.(8 баллов) По схеме превращений
ВаO Ва(OН)2 ВаСO3 ВаСl2
составьте уравнения реакций в молекулярном виде. Для последнего превращения запишите полное и сокращенное ионные уравнения.
С15.(4 балла) По уравнению реакции 2Mg + O2 = 2MgO
рассчитайте объем кислорода (н.у.), необходимого для полного сгорания 1,2 г магния.
Система выставления оценок.
Данная контрольная работа является комбинированной, что позволяет проверить у учащихся имеющиеся знания и подготовить их к сдаче единого государственного экзамена.
Работа состоит из двух частей.
Часть А содержит тестовые задания с выбором ответа, предусматривающие выбор одного правильного ответа на каждый вопрос.
На выполнение этой части предоставляется 15 минут.
Часть В и С содержит задания со свободной формой ответа, которые предусматривают установление последовательности, дополнение пропущенного, проведение расчетов по химическим формулам и уравнениям реакций, написание уравнений химических реакций и на соотнесение
Контрольная работа рассчитана на 40 минут и оценивается в 50 баллов.
Выполнение каждого задания теста части А оценивается двумя баллами. Заданий со свободной формой меньше, но они оцениваются гораздо более высоким баллом. В этих заданиях оценивается не только полнота и правильность выполнения, но и отдельные этапы и элементы.
Шкала перевода в пятибалльную систему оценки:
— 88 — 100% — «5»
— 62 – 86% — «4»
— 36 — 61% — «3»
— 0 — 35% — «2»
Ключи
Вариант №1.
Часть А.
А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
В | Г | В | Г | Б | А | А | Г | А | Г |
Часть В.
В11.(6 баллов)
1 – В, 2 – Д, 3 – Б, 4 – А.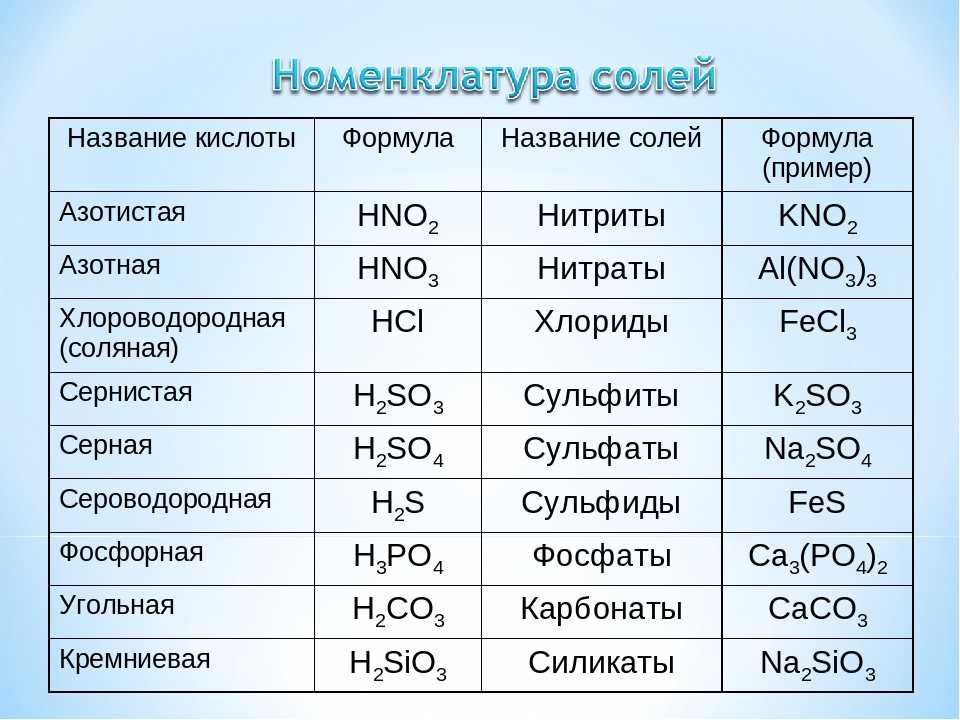
В12.(8 баллов)
LiOH + HF = LiF + H2O обмена, нейтрализации
гидроксид лития + фтороводород = фторид лития + вода.
Часть С
С13. (4 балла).
S0 + H2 = H2S-2
S – окислитель; H – восстановитель.
С14. .(8 баллов) ВаO Ва(OН)2 ВаСO3 ВаСl2
ВаO + Н2О = Ва(OН)2
Ва(OН)2 +СО2 = ВаСO3 + Н2О
ВаСO3 + 2НCl = ВаСl2 + Н2О + СО2
Ba2+ + CO32- + 2H+ + 2Cl— = Ba2+ + 2Cl— + Н2О + СО2
Ba2+ + CO32- + 2H+ = Ba2+ + Н2О + СО2
С15. (4 балла)
(4 балла)
Дано: | m= 1,2г V– x |
m(Mg) = 1,2г | 2Mg + O2 = 2MgO |
Найти: | n = 2моль n = 1моль |
V(O2) – ? | М = 24г/моль VМ = 22,4 л/моль |
m = 48г V = 22,4л |
1,2/48 = х/22,4
х = 1,2 х 22,4 / 48 = 0,56 л
Ответ: 0,56 л
Вариант №2.
Часть А.
А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
Б | А | Г | А | Б | Г | В | Б | Г | Г |
Часть В.
В11.
1 – Д, 2 – В, 3 – Б, 4 – Г.
В12.
Са(OH)2 + 2HСl = CaCl2 + 2 H2O обмена, нейтрализации
гидроксид кальция + соляная кислота = хлорид кальция + вода.
Часть С
С13.
С0 + О2 = С+4О2
О – окислитель; С – восстановитель.
С14. SO2 SO3 H2SO4 Na2SO4
2SO2 + О2 = 2SO3
SO3 + Н2О = H2SO4
H2SO4 + 2 NaOH = Na2SO4 + 2Н2О
2H+ + SO42— + 2Na+ + 2OH— = 2Na+ + SO42— + 2Н2О
H+ + OH— = Н2О
С15.
Дано: | m= 200г m– x |
m(CaCO3)= 200г | CaCO3 = CaO + CO2 |
Найти: | n = 1моль n = 1моль |
m (CaO) – ? | М = 100г/моль M= 56г/моль |
m = 100г m = 56г |
200/100 = х/56
х = 200 х 56 / 100 = 112г
Ответ: 112г
Химический состав бериллия нетипичный 2 группы
НЕКОТОРЫЙ ХИМИЧЕСКИЙ СОСТАВ БЕРИЛЛИЯ, НЕТИПНЫЙ ДЛЯ ГРУППЫ 2 На этой странице описаны и объяснены три примера из химии бериллия, в которых он ведет себя иначе, чем остальная часть группы 2. Бериллий хлорид ковалентный Факты Физические свойства Бериллий хлорид, BeCl 2 , плавится при 405°С, кипит при 520°С. Это сопоставимо с 714°C и 1412°C для хлорида магния. Обратите внимание, насколько значительно ниже температура кипения хлорида бериллия по сравнению с хлоридом магния. Гораздо более высокая температура кипения хлорида магния — это то, что вы можете ожидать от сильных взаимодействий между присутствующими положительными и отрицательными ионами. Поскольку его температура кипения намного ниже, из этого следует, что хлорид бериллия не может содержать ионов — он должен быть ковалентным. С другой стороны, температура плавления такой маленькой ковалентной молекулы довольно высока. Реакция с водой Хлорид бериллия энергично и экзотермически реагирует с водой с выделением кислого парообразного газообразного хлороводорода. Это типично для ковалентных хлоридов. В первом случае он реагирует с образованием гидратированных ионов бериллия [Be(H 2 O) 4 ] 2+ и ионов хлорида. Но гидратированные ионы бериллия (называемые ионами тетрааквабериллия) довольно сильно кислые. Небольшой ион бериллия в центре притягивает к себе электроны связей, и это делает атомы водорода в воде еще более положительными, чем обычно. Если раствор горячий и концентрированный (что, вероятно, будет, если вы добавите воду в твердый хлорид бериллия — очень экзотермическая реакция), ионы хлорида могут удалить один или несколько из этих ионов водорода с образованием газообразного хлористого водорода. Все остальные ионные хлориды группы 2 растворяются в воде без какой-либо очевидной реакции. | ||
Примечание: На самом деле существует очень небольшая реакция между безводным хлоридом магния и водой, хотя вы этого не заметите. Хлорид магния не так чисто ионен, как мы иногда притворяемся! Перейдите по этой ссылке, если вы заинтересованы в изучении названий сложных ионов. . . . или этот для подробных объяснений того, почему комплексные ионы, подобные бериллиевому, являются кислыми. | ||
Структура хлорида бериллия В виде газа. . . Хлорид бериллия, BeCl 2 , представляет собой линейную молекулу, в которой все три атома расположены на одной прямой. Показаны только внешние электроны: Хлорид бериллия известен как электронодефицитное соединение , потому что он имеет две пустые орбитали на уровне связи. В твердом виде . . . Если бы у него была такая же простая структура, как у твердого тела, можно было бы ожидать, что температура плавления будет намного ниже, чем она есть на самом деле. | ||
Примечание: Если вы не уверены в межмолекулярных силах (силах Ван-дер-Ваальса), вы можете перейти по этой ссылке, чтобы узнать о них больше. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
В твердом теле молекулы BeCl 2 полимеризуются с образованием длинных цепей. Они делают это, образуя координированные связи (дательные ковалентные связи) между неподеленными парами атомов хлора и соседними атомами бериллия. На схеме показан простой димер – начало процесса полимеризации. | ||
Примечание: Это точно так же, как координационная связь в хлориде алюминия. Если вас не устраивает координатная (дательная ковалентная) связь, вам будет полезно просмотреть эту страницу, прежде чем продолжить.  Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
На последней диаграмме видно, что атомы бериллия по-прежнему имеют недостаток электронов. Процесс продолжается. На следующей диаграмме координатные связи показаны обычным способом с помощью стрелок. Стрелка идет от атома, поставляющего пару электронов, к атому с пустой орбиталью. Убедитесь, что вы полностью понимаете, как эта диаграмма связана с димером, показанным на предыдущей диаграмме. Почему хлорид бериллия не является ионным? Бериллийимеет довольно высокую электроотрицательность по сравнению с остальными элементами группы. Это означает, что он притягивает к себе связывающую пару электронов сильнее, чем магний и остальные. Чтобы образовалась ионная связь, бериллий должен отпустить свои электроны. Он слишком электроотрицательный для этого. | ||
Примечание: Тенденции электроотрицательности в группе 2 обсуждаются на другой странице.  На этой странице показано, как электроны расположены в связи бериллий-хлор по сравнению со связью магний-хлор. На этой странице показано, как электроны расположены в связи бериллий-хлор по сравнению со связью магний-хлор. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу, или вернитесь через меню группы 2. | ||
Бериллий образует 4-координированные комплексные ионы Простой фон Хотя бериллий обычно не образует простых ионов, Be 2+ , в растворе он образует ионы. В них ион бериллия присоединяется к четырем молекулам воды, образуя комплексный ион с формулой [Be(H 2 O) 4 ] 2+ . Говорят, что ион имеет 4-координацию или имеет координационное число 4 , потому что четыре молекулы воды расположены вокруг центрального бериллия. Многие гидратированные ионы металлов имеют 6-координацию. Например, ионы магния в растворе существуют как [Mg(H 2 O) 6 ] 2+ . Молекулы воды в этих ионах присоединены к центральному иону металла через координационные связи (дативные ковалентные связи). Одна из неподеленных пар каждой молекулы воды используется для образования связи с пустой орбиталью иона металла. Каждый раз, когда образуется одна из этих связей, высвобождается энергия, и ион становится более стабильным. Казалось бы логичным, чтобы ион металла образовывал как можно больше таких связей. | ||
Примечание: Если вас не устраивает связывание координат, вы должны перейти по этой ссылке, прежде чем продолжить. На этой странице вы найдете подробное обсуждение связи в гидратированных ионах металлов. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Почему бериллий прикрепляет только четыре молекулы воды? Гидратация бериллия Проблема в том, что должно быть место, к которому могут прикрепиться неподеленные пары молекул воды. | ||
Примечание: Если вас не устраивают орбитали, вам следует перейти по этой ссылке, прежде чем продолжить. Возможно, вы захотите продолжить изучение этой части сайта. Если вы точно не понимаете, о чем эта диаграмма «электроны в ящиках», вы не сможете понять, что будет дальше. | ||
Когда бериллий образует ион 2+, он теряет 2 электрона на 2s-орбитали. Это оставляет уровень 2 совершенно пустым. Двухуровневые орбитали реорганизуются (гибридизуются), образуя четыре равные орбитали, каждая из которых может принять неподеленную пару электронов от молекулы воды. На следующей диаграмме 1s-электроны не учтены. Они не имеют отношения к соединению. Каждая молекула воды, разумеется, имеет две неподеленные пары электронов. Обратите внимание, что после того, как четыре молекулы воды соединились таким образом, на уровне связи больше не осталось свободного места. Используются все свободные орбитали исходного иона бериллия. Молекулы воды располагаются так, чтобы разойтись как можно дальше друг от друга, что указывает на углы тетраэдра. Таким образом, ион имеет тетраэдрическую форму. Гидратация магния Вы можете подумать, что магний будет вести себя точно так же, но на 3-м уровне доступны 3d-орбитали, а также 3s и 3p. Когда ион магния образуется, он оставляет пустые 3s-, 3p- и 3d-орбитали. Когда этот ион гидратирован, он использует 3s-орбиталь, все три 3p-орбитали и две 3d-орбитали. Они реорганизуются, чтобы оставить в общей сложности шесть пустых орбиталей, которые затем используются для связи. Почему магний останавливается на присоединении шести вод? Почему он не использует оставшиеся 3d-орбитали? Вы не можете физически уместить вокруг магния более шести молекул воды — они занимают слишком много места. А как насчет других ионов группы 2? По мере того, как ионы становятся больше, они менее склонны образовывать надлежащие координационные связи с молекулами воды. Ионы становятся настолько большими, что они недостаточно привлекают неподеленные пары молекул воды для образования формальных связей — вместо этого молекулы воды имеют тенденцию более свободно группироваться вокруг положительных ионов. Однако там, где они образуют координационные связи с водой, они будут иметь 6-координацию, как и магний. Гидроксид бериллия амфотерный Амфотерный означает, что он может реагировать как с кислотами, так и с основаниями с образованием солей. Прочие гидроксиды группы 2 Все остальные гидроксиды металлов группы 2 являются основными. Они реагируют с кислотами с образованием солей. Например: Ca(OH) 2 (т) + 2HCl(водн.) CaCl 2 (водн. Гидроксид кальция реагирует с разбавленной соляной кислотой с образованием хлорида кальция и воды. Гидроксид бериллия Гидроксид бериллия реагирует с кислотами, образуя растворы солей бериллия. Например: Be(OH) 2 (т) + H 2 SO 4 (водн.) BeSO 4 (водн.) + 2H 2 O(л) Но он также реагирует с основаниями, такими как раствор гидроксида натрия. Гидроксид бериллия реагирует с гидроксидом натрия с образованием бесцветного раствора тетрагидроксобериллата натрия. Ве(ОН) 2 (т) + 2NaOH(водн.) Na 2 Be(OH) 4 (водн.) Содержит комплексный ион [Be(OH) 4 ] 2- . Название описывает этот ион. Tetra означает четыре; гидрокси относится к группам ОН; бериллата показывает, что бериллий присутствует в виде отрицательного иона. Окончание «ели» всегда показывает, что ион отрицательный. Давайте рассмотрим это как простую схему потока, начиная с ионов бериллия в растворе: Это показывает, что если к ионам бериллия в растворе добавить ионы гидроксида, то сначала образуется осадок гидроксида бериллия. Но если вы добавите больше ионов гидроксида, осадок снова растворится, дав раствор, содержащий ионы тетрагидроксобериллата. Гидроксид бериллия реагирует с основанием (ионами гидроксида) и поэтому должен обладать кислотными свойствами. Но если к ионам тетрагидроксобериллата добавить кислоту, то снова получится осадок гидроксида бериллия. А если вы добавите еще больше кислоты, вы вернетесь к исходным ионам бериллия в растворе. Поскольку гидроксид бериллия реагирует с кислотой, он должен обладать не только кислотными, но и основными свойствами — он амфотерный. Простое объяснение происходящего Нам нужно взглянуть на это снова, но более подробно об ионе бериллия в растворе — другими словами, как Be(H 2 O) 4 2+ . Очень маленький положительно заряженный ион бериллия в центре комплекса притягивает электроны в молекулах воды к себе — мы говорим, что он оказывает сильное поляризующее действие на молекулы воды. Бериллий оказывает такое сильное поляризующее действие на молекулы воды, что ионы водорода очень легко удаляются из них. Раствор гидроксида натрия содержит ионы гидроксида, которые являются сильными основаниями. Если вы добавите нужное количество раствора гидроксида натрия, вы получите осадок того, что обычно называют «гидроксидом бериллия», но структурно он немного сложнее! [Be(H 2 O) 4 ] 2+ (водн.) + 2OH — (водн.) Be(H 2 O) 2 (OH) 2 (т) + 2H 2 O(л) Продукт (кроме воды) представляет собой нейтральный комплекс, связанный ковалентной связью. Все, что произошло с первоначальным комплексным ионом, это то, что два иона водорода были удалены из молекул воды. Вы получаете осадок нейтрального комплекса из-за отсутствия на нем заряда. Между этим нейтральным комплексом и молекулами воды недостаточно притяжения, чтобы перевести его в раствор. Что произойдет, если добавить больше ионов гидроксида? Добавление большего количества ионов гидроксида к нейтральному комплексу оттягивает больше ионов водорода от молекул воды с образованием иона тетрагидроксобериллата: BE (H 2 O) 2 (OH) 2 (S)+ 2OH — (AQ) [BE (OH) 4 ] 2- (AQ)+ 2H 2 ] О(л) Гидроксид бериллия растворяется, потому что нейтральный комплекс превращается в ион, который будет достаточно притягиваться к молекулам воды. Что произойдет, если к осадку гидроксида бериллия (нейтральный комплекс) добавить кислоту? Первоначально удаленные ионы водорода просто замещаются. Осадок растворяется по мере повторного образования исходного гидратированного иона бериллия. Be(H 2 O) 2 (OH) 2 (т) + 2H + (водн.) Be(H 2 O) 4 0 90 90 8 2 2 Давайте еще раз посмотрим на это как на схему потока, чтобы вы могли сравнить ее с приведенной выше: Гидроксид бериллия (нейтральный комплекс) является амфотерным, поскольку может реагировать с основанием и кислотой. В каждом случае происходит лишь то, что вы либо удаляете ионы водорода из молекул воды, либо заменяете их. Почему этого не происходит, например, с гидроксидом кальция? Гидроксид кальция действительно ионный и содержит простые ионы гидроксида, OH — . Они реагируют с ионами водорода из кислоты с образованием воды, поэтому гидроксид реагирует с кислотами. Однако аналога нейтрального комплекса нет. Добавление большего количества ионов гидроксида из основания не имеет никакого эффекта, потому что им не с чем реагировать. | ||
Примечание: Это было упрощено, чтобы привести его в соответствие с типом обработки, которую вы встретите для кислотно-щелочного поведения гидроксидов переходных металлов.  В частности, структура гидроксида бериллия, вероятно, даже сложнее, чем предполагалось выше! В частности, структура гидроксида бериллия, вероятно, даже сложнее, чем предполагалось выше! | ||
В меню группы 2 . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2002 г. (последнее изменение: декабрь 2021 г.) | ||
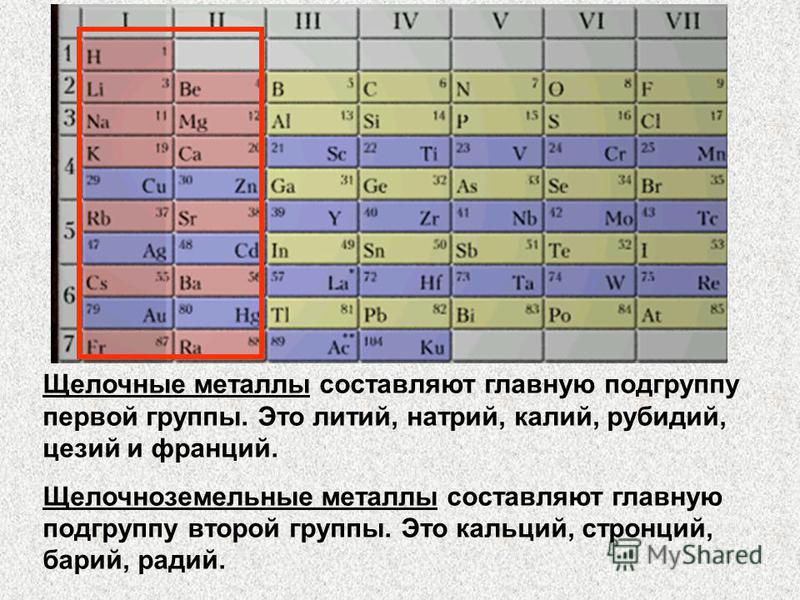
Chemguide: Поддержка уровня CIE по химии Результат обучения 9.2(d) В этом заявлении вас просят определить тенденции свойств элементов группы 2 и их соединений и использовать эти тенденции для прогнозирования. Это может быть предсказание относительно радиоактивного элемента радия в нижней части группы. В качестве альтернативы вам могут дать некоторые подробности, скажем, о кальции или одном из его соединений, и попросить предсказать, каким может быть соответствующий химический состав стронция. Прежде чем продолжить, вам следует найти и прочитать утверждения в вашем экземпляре программы. Свойства элементов Тенденции в атомных свойствах Сейчас самое время пересмотреть свои знания об атомном радиусе, энергии ионизации и электроотрицательности. Вы найдете все это, обсуждаемое в отношении элементов группы 2, на странице Атомные и физические свойства группы 2 периодической таблицы. Прочитайте первую половину страницы до конца части об электроотрицательности. Не забывайте, что вы концентрируетесь на тенденциях, когда спускаетесь по группе. Возможно, вас также спросят об ионном радиусе. Это не совсем свойство элемента, потому что оно имеет значение только в его соединениях, но здесь оно подходит лучше, чем где-либо еще. Элементы образуют простые ионы 2+ со структурой благородного газа. Очевидно, что по мере того, как вы спускаетесь по группе, вы добавляете больше слоев электронов, и поэтому ионы становятся больше. | |
Примечание: Ион Be 2+ настолько мал и обладает высокой плотностью заряда (много заряда в малом объеме), что имеет тенденцию притягивать к себе электроны при образовании связей. Это означает, что даже в соединениях с очень электроотрицательными элементами, такими как кислород или фтор, которые, как вы могли бы ожидать, являются ионными, в значительной степени присутствует ковалентный характер.  | |
Тенденции физических свойств Все это металлические элементы, поэтому они проводят электричество и тепло. Их температуры плавления и кипения выше, чем у металлов группы 1, но ниже, чем у типичных переходных металлов. Если вы снова посмотрите на страницу Атомные и физические свойства группы 2 периодической таблицы, вы найдете гистограммы для точек плавления, точек кипения и энергий атомизации. Температуры плавления показывают общее снижение по мере продвижения вниз по группе, но оно полностью нарушается у магния. Нет никакой очевидной закономерности для температур кипения или энергий атомизации, которые являются лучшими мерами прочности металлических связей, чем температуры плавления. Если вам интересно, вы можете прочитать обсуждение на оставшейся части этой страницы, но это не обязательно. Тенденции изменения химических свойств Это реактивные элементы, их реакционная способность имеет тенденцию к увеличению по мере продвижения вниз по группе. | |
Примечание. Бериллий является исключением из этого списка, о котором вам, вероятно, не нужно беспокоиться. Он имеет степень окисления +2 в своих соединениях, но они, как правило, полностью или в значительной степени ковалентны. | |
Реакция с водой Это лучше всего иллюстрирует увеличение реактивности. Если вы работали с этим разделом программы по порядку, вы уже прочитали страницу Реакции элементов группы 2 с водой. В то время вас интересовали только факты. Посмотрите еще раз на эту страницу и на этот раз прочитайте объяснение увеличения реактивности по мере того, как вы спускаетесь по группе. Из программы не ясно, нужно ли вам это объяснение, но все равно посмотрите. Все, что вам действительно нужно знать, это то, что реактивность увеличивается, потому что энергия активации реакций падает. Причина этого в основном связана с падением энергии ионизации по мере того, как вы спускаетесь по группе. Требуется меньше энергии для образования ионов 2+ по мере того, как вы спускаетесь по группе. | |
Примечание: Если вас не устраивает энергия активации, перейдите по этой ссылке на вводную страницу в разделе скорости реакции Chemguide. | |
Вас могут попросить предсказать реакцию, скажем, радиоактивного элемента радия (в самом низу группы 2) с водой. Вы могли бы предсказать, что
Реакция с кислородом Опять же, если вы работали с этим разделом программы по порядку, вы уже прочитали первую часть страницы Реакции элементов группы 2 с кислородом. Вы, наверное, помните, что трудно выделить какие-либо тенденции в реакционной способности элементов, но есть тенденции, которые вы можете выделить.
Свойства соединений элементов группы 2 Оксиды Помимо оксида бериллия основными являются простые оксиды. (Окись бериллия амфотерна — вы не должны знать об этом.) Они реагируют с водой с образованием гидроксидов, хотя реакция между оксидом магния и водой довольно слабая. Все они реагируют с кислотами с образованием солей. | |
Примечание: Об этом не упоминалось ни на одной из страниц, которые вы читали в разделе 9.2 программы, поэтому вы можете удивиться, почему я ожидаю, что вы знаете, что основные оксиды реагируют с кислотами с образованием солей. Если вы занимались какой-либо химией до того, как начали сдавать уровень A, вы должны были это знать. Вы не должны забывать химические знания, которые вы уже накопили в прошлом. Реакции основных оксидов с кислотами были упомянуты на странице, на которую я указал вам в отношении кислотно-щелочного поведения оксидов периода 3, когда вы смотрели на периодичность в разделе 9. | |
Гидроксиды Помимо гидроксида бериллия, гидроксиды являются основными. (Гидроокись бериллия амфотерна — вы не должны знать об этом.) Гидроксиды становятся более растворимыми по мере продвижения вниз по группе. Растворы гидроксидов имеют щелочной рН. Уровень pH зависит от растворимости гидроксида. Поскольку растворимость увеличивается вниз по группе, pH насыщенного раствора увеличивается вниз по группе. Все гидроксиды реагируют с кислотами с образованием солей. Нитраты Все нитраты разлагаются при нагревании с образованием оксида, диоксида азота и кислорода. По мере того, как вы спускаетесь по группе, разложение затрудняется, и поэтому вам приходится нагревать сильнее. | |
Примечание: Помимо нитрата бария, другие нитраты этой группы содержат кристаллизационную воду. Это означает, что если вы действительно проведете любую из этих реакций, вы также увидите образование пара. Если на экзамене вас спросят о нитратах, просто назовите три основных продукта (оксид, диоксид азота и кислород), если вас конкретно не спросят что-то вроде «Опишите эффект нагревания кристаллов гидратированного нитрата кальция». Если слово «гидратированный» (или его эквивалент) не используется, не упоминайте воду. | |
Карбонаты Карбонаты нерастворимы в воде. Они разлагаются при нагревании с образованием оксида и двуокиси углерода. По мере того, как вы спускаетесь по группе, разложение затрудняется, и поэтому вам приходится нагревать сильнее. Предсказание по этим шаблонам Поскольку не все свойства бериллия типичны для группы в целом, небезопасно делать прогнозы относительно соединений бериллия, находящихся на вершине группы. Некоторые вещи, которые вы могли бы предсказать, включают:
| |

 На самом деле между бериллием и алюминием в группе 3 есть несколько сходств. Это известно как диагональное соотношение и обсуждается на страница об электроотрицательности.
На самом деле между бериллием и алюминием в группе 3 есть несколько сходств. Это известно как диагональное соотношение и обсуждается на страница об электроотрицательности. Должно быть что-то более сложное!
Должно быть что-то более сложное!
 Это очень маленькая молекула, поэтому можно ожидать, что межмолекулярное притяжение будет довольно слабым.
Это очень маленькая молекула, поэтому можно ожидать, что межмолекулярное притяжение будет довольно слабым.
 Бериллий имеет электронную структуру 1s 2 2s 2 . Полезно изобразить это в виде диаграммы «электроны в ящиках»:
Бериллий имеет электронную структуру 1s 2 2s 2 . Полезно изобразить это в виде диаграммы «электроны в ящиках»: Показан только один из них, чтобы не загромождать диаграмму.
Показан только один из них, чтобы не загромождать диаграмму.
 ) + 2H 2 O(л)
) + 2H 2 O(л)


 2(d)
2(d)
 Они реагируют как с водой, так и с кислородом, например, с образованием соединений, в которых степень окисления (степень окисления) элемента равна +2. Эти соединения содержат ионы 2+.
Они реагируют как с водой, так и с кислородом, например, с образованием соединений, в которых степень окисления (степень окисления) элемента равна +2. Эти соединения содержат ионы 2+.

 1 программы — хотя вам не нужно было знать конкретно об этом для этой части программы. См. кислотно-щелочное поведение оксидов периода 3, если вы забыли.
1 программы — хотя вам не нужно было знать конкретно об этом для этой части программы. См. кислотно-щелочное поведение оксидов периода 3, если вы забыли. 
