Природные и синтетические органические соединения » mozok.click
Вспомните: применение органических веществ (§ 22-38).
Природные и синтетические органические вещества на службе человечества
Вы уже ознакомились со многими органическими веществами: углеводородами, этанолом, глицеролом, этановой кислотой, жирами, углеводами и белками. Все эти органические соединения являются природными, поскольку они встречаются в природе. Но это не значит, что их нельзя синтезировать искусственно. В последние десятилетия большинство этих веществ синтезируют на предприятиях химической промышленности, поскольку выделить их из природных объектов в необходимом количестве невозможно: в природе просто нет столько веществ, сколько требуется современному обществу. Сырьем для синтеза многих веществ являются преимущественно нефть и природный газ.
Вам уже известно вещество, относящееся к органическим полимерам,— полиэтилен. Полиэтилен не встречается в природе. Ни один живой организм не может его синтезировать, поэтому такие вещества называют синтетическими.
Конечно, это не все вещества, известные человечеству. В этом параграфе мы рассмотрим еще некоторые природные и синтетические соединения, с которыми вы сталкиваетесь в повседневной жизни.
Природные органические соединения
Жизненно необходимыми органическими соединениями для человека являются витамины. Недаром это слово происходит от латинского vita — «жизнь». Хвоя и черная смородина содержат витамин С, семена подсолнечника — В1 (тиамин хлорид), морковь — витамин А (ретинол) и др.
Лекарственные растения содержат различные природные органические соединения, среди которых выделяют группу алкалоидов. Их использование очень разнообразно: морфин — обезболивающее, кофеин — психостимулятор, кодеин — противокашлевое средство и др.
В местах повреждений на стволах хвойных деревьев часто вытекает густая смола — живица. Это ценный источник органических веществ. Из нее получают скипидар, канифоль, вещества для изготовления лечебных бальзамов и многое другое.
В Бразилии в 1754 году обнаружили уникальное дерево — гевею. Если млечный сок, вытекающий из разрезов на ее стволе, отстоять и подогреть, то получим латекс (или натуральный каучук). Путем обработки латекса получают различные виды резины.
Природным органическим соединением является воск. Он может быть растительным (масло жожоба) и животным (пчелиный). Из воска изготавливают свечи, косметические средства (мази, кремы, помады), защитные покрытия деревянных и мраморных изделий, взрывчатки. Для длительного хранения воском покрывают фрукты и сыры.
Большинство растений обладает неповторимым запахом. Путем особой обработки этот запах у растений «забирают» в виде эфирных масел: мятного, лавандового, эвкалиптового и др. Эти масла используют в парфюмерии, в качестве лекарственных средств и пищевых ароматизаторов.
Из некоторых природных объектов выделяют органические соединения, которые используют как пищевые добавки. Например, для сгущения блюд и приготовления желе используют уже известный вам крахмал (картофельный или кукурузный), желатин (выделяют из костей, копыт и рогов), агар-агар (выделяют из красных и бурых агаровых водорослей).
Синтетические органические соединения
Появление синтетических волокон произвело настоящую революцию в науке и технике. Они дешевле натуральных и позволяют изготавливать одежду, которую из натурального сырья не сделаешь: невозгораемые костюмы для пожарных, герметичные костюмы для космонавтов, прочные канаты и многое другое.
Издавна для стирки использовали мыло и кальцинированную соду. Но по эффективности они не идут ни в какое сравнение с современными синтетическими моющими средствами. Это средства для стирки в разной воде, ручной стирки или в автоматической машине, для мытья посуды, стекла и др.
С развитием промышленности натурального каучука уже не хватало для удовлетворения всех потребностей. Почти 100 лет назад открыли способ получения синтетического каучука, из которого после специальной обработки получают сотни сортов резины.
Благодаря различным добавкам из 20-30 органических полимеров изготавливают тысячи сортов пластмасс, которые могут заменить любой натуральный материал. А некоторые пластмассы по свойствам значительно лучше натуральных материалов и намного дешевле.
До открытия пенициллина в 1928 году даже обычная простуда могла стать смертельной. Антибиотики совершили переворот в медицине. И хотя Флеминг выделил пенициллин из натурального сырья, сегодня все антибиотики — это синтетические соединения. Их уже открыто очень много, и ученые работают над синтезом новых.
Растительное сырье уже не обеспечивает потребностей человечества в лекарствах. Поэтому многие фармацевтические компании синтезируют различные лекарственные вещества. Химические компании занимаются поиском новых лекарственных веществ для лечения заболеваний, которые сегодня считаются неизлечимыми.
До открытия М. Зининым дешевого способа получения анилина натуральные красители были очень дорогими. Сегодня натуральные красители почти не используют, их заменили синтетические красители. Они более устойчивы, не выгорают и, что очень важно, их можно получить любого цвета и оттенка.
Сегодня агрономы используют много различных пестицидов — средств химической защиты культурных растений от сорняков (гербициды), грибков (фунгициды) и др. Вы также пользуетесь инсектицидами, чтобы отгонять комаров и клещей.
Пищевая промышленность использует множество различных синтетических пищевых добавок. Это различные заменители сахара, антиоксиданты, ароматизаторы, пищевые красители, консерванты, эмульгаторы и стабилизаторы, усилители вкуса и многое другое.
Невозможно представить автомобилестроение или строительство без новых синтетических материалов, которые используют для соединения деталей, защиты от коррозии, герметизации стыков и т. п. Это синтетические лаки, эмали, краски, смолы, клеи, герметики и многое другое.
Из синтетических органических соединений изготавливают взрывчатые и пиротехнические материалы. К сожалению, их до сих пор используют для изготовления оружия, но также применяют и в мирных целях: при строительстве тоннелей, добыче полезных ископаемых и др.
Химики создали уникальное волокно, по строению похожее на паутину,— кевлар. Ткань из него устойчива к износу и ударам, поэтому ее используют для изготовления армирующих тканей для бронежилетов и бронешлемов, которыми пользуются военнослужащие Вооруженных сил Украины.
Современная химия нацелена на революцию в информационных технологиях. Миниатюризация электронных устройств обусловила необходимость проведения некоторых процессов на молекулярном уровне. Скоро появятся устройства для записи информации, в которых 1 бит информации будет хранить одна молекула.
Последнее десятилетие бурно развивается «юный» раздел химии — супрамолекулярная химия. Ученые синтезируют вещества, молекулы которых способны выполнять определенную механическую работу. Уже созданы прототипы молекул, которые «работают» как молекулярный мотор, пружина, лифт и т. п.
Защита окружающей среды от стойких органических загрязнителей
К сожалению, развитие цивилизации сопровождается загрязнением нашей планеты.
Во-первых, это отходы промышленных производств, которые выбрасываются в окружающую среду. Основными загрязнителями окружающей среды являются лакокрасочная, бумажная и коксохимическая отрасли. Их выбросы крайне токсичны, не разлагаются в природе, накапливаются в живых организмах, а в водной среде из них могут образовываться еще более опасные вещества.
Во-вторых, это синтетические органические вещества, «чуждые» природе, т. е. ни при каких обстоятельствах они не смогли бы образоваться в живых организмах. Таким веществом, например, является полиэтилен. Он, конечно, очень удобен в использовании. Но его преимущество — стойкость ко многим природным факторам — является и его недостатком. На мусорниках полимерные материалы не гниют, не разлагаются в течение 300 и более лет в отличие от бумаги, которая сгнивает в почве за 2-3 года.
Для решения этой проблемы сегодня разрабатывают новые материалы, которые смогут быстро разлагаться в почве,— биопластики.
Также большую угрозу представляют пестициды. С одной стороны, они защищают урожай, но с дождем попадают в почву, потом — в грунтовые воды, реки, моря и океаны. Они могут отравить обитателей Мирового океана или накапливаться в организмах рыб и других водных животных и вместе с пищей попасть в организм человека, вызывая отравления.
Одним из самых опасных пестицидов, относящихся к группе стойких органических загрязнителей (СОЗ), является ДДТ (дихлордифе-нил-трихлорэтан, бытовое название — дуст). Он очень эффективен
в борьбе с малярийными комарами и вредителями хлопчатника, сои и арахиса. Но он обладает канцерогенным и мутагенным действием. Для отравления достаточно 10-20 мг. Поэтому ДДТ запрещен для использования во многих странах мира, включая Украину.
Для защиты окружающей среды от СОЗ Организация Объединенных Наций инициировала мировую программу по химической безопасности, результатом которой в 2001 году в Стокгольме было подписание Конвенции по СОЗ. В соответствии с ней, запрещено производство и использование двенадцати химических веществ (так называемой «грязной дюжины веществ»). Украина ратифицировала эту Конвенцию в 2007 году.
Но для сохранения окружающей среды одних запретов мало. Необходимо модернизировать производства, воплощать в жизнь новые технологии очистки отходов или безотходные технологии. То, какой Земля будет через 50-100 лет, зависит от нас!
Рис. 39.3. Неподконтрольное и избыточное использование химических средств защиты растений, в частности пестицидов, приводит к загрязнению не только почвы, но и грунтовых вод, рек и морей и представляет угрозу для живых организмов
Ключевая идея
Природные органические соединения содержатся в природных объектах,
а синтетические вещества в природе не встречаются, их получают искусственно, и часто они являются источником загрязнения окружающей среды.
Контрольные вопросы
481. Какие органические соединения называют природными, а какие — синтетическими? Чем они отличаются?
482. Могут ли синтетические органические соединения встречаться в природе?
483. Перечислите и опишите применение природных и синтетических органических веществ.
484. Какие вещества называют стойкими органическими загрязнителями? В чем заключается проблема их использования? Предложите способы защиты окружающей среды от этих веществ.
Задания для усвоения материала
485*. В дополнительных источниках найдите информацию о Стокгольмской Конвенции и перечне веществ, относящихся к стойким органическим загрязнителям. Какие технологические процессы являются источником этих веществ, с какой целью используют эти вещества? Реален ли отказ от производства и использования этих веществ? Насколько актуальна проблема использования этой группы веществ для Украины?
Темы учебных проектов по теме «Начальные понятия об органических соединениях»:
• Использование полимеров — эколого-экономический аспект.
• Альтернативные источники энергии.
• Экотрофология — наука об экологически безопасном питании.
• Изготовление мыла из мыльной основы.
• Исследование химического состава пищи.
• Химический состав жевательных резинок.
• Химический состав средств по уходу за полостью рта.
• Вторая жизнь бумаги.
• Источники органического загрязнения территории общины (микрорайона).
Проверьте свои знания по теме «Начальные понятия об органических соединениях», выполнив тестовые задания на сайте.
Это материал учебника Химия 9 класс Григорович
mozok.click
Органические синтетические вещества
Одним из распространенных, но еще недостаточно изученных видов ухудшения качества подземных вод является загрязнение органическими синтетическими веществами, входящими в состав многочисленных химических веществ, широко применяемых в промышленности, сельском хозяйстве и быту. Присутствие этих веществ уже в очень малых количествах делает воду непригодной для питья. Трудность быстрого выявления и идентификации органических загрязнителей обусловлена необходимостью применения специальных очень чувствительных методов исследований, которые при выборе источника водоснабжения и оценке качества питьевых вод ранее обычно не применялись.
Предварительные представления о масштабе загрязненности подземных вод органическими компонентами можно получить на основании определения содержания в воде летучей и нелетучей фракций общего органического углерода и общего количества хлор-органических соединений. Более точные данные об индивидуальных органических веществах дают методы газовой хроматографии,, масс-спектрометрии, адсорбции на активированном угле с последующим использованием микроколориметрического детектора.
Хлорорганические соединения, входящие в состав дефолиантов, инсектицидов и других сельскохозяйственных ядохимикатов, а также широко используемые в промышленности (в том числе при обработке металлов), в качестве растворителей при чистке одежды и для других целей обнаружены в подземных водах многих стран. Хлорированные углеводороды имеют повышенную плотность, заметно растворимы в воде (от 50 мг/дм3до 40 г/дм3) и отличаются малыми значениями ПДК. В питьевой подземной воде хлороргани-ческие соединения впервые были обнаружены в 1973 г. в ФРГ, а затем после широкого привлечения для анализа воды методов хроматографии и масс-спектрометрии — ив США. Согласно данным Агентства по охране окружающей среды США, приведенным Г. Вестерхоффом и В. Юлом, этими соединениями загрязнены 45% крупных и 12% мелких систем централизованного водоснабжения США, использующих подземные воды.
Дж. Даксен и А. Гесс приводят сведения о том, что при обследовании органические загрязнения подземных вод были обнаружены в 44 системах водоснабжения шт. Массачусетс, B25 — шт. Коннектикут, в 25 — шт. Пенсильвания, в 24 — шт. Нью-Йорк. В г. Джексон по этой причине была прекращена подача воды из 100 питьевых скважин, размещенных в районе городской свалки. В г. Ведфорд (шт. Массачусетс) около 85% скважин в городских водозаборах вышли из строя из-за высокого содержания органики. Большое число водозаборных скважин, воды которых содержали трихлорэтилен, было ликвидировано в долине р. Сан-Габриэль (шт. Калифорния) и в других районах США.
В США в воде питьевых водозаборов установлено уже более 700 специфических органических компонентов, среди которых наиболее часто встречаются тригалометаны и хлорированные углеводородные соединения трихлорэтилен и тетрахлорэтилен. Содержание последних в подземных водах на отдельных участках оказалось более высоким, чем в неочищенных и очищенных водах наиболее загрязненных рек, и достигло 3,5 мг/дм3.
В г. Тусон (шт. Аризона), хозяйственно-питьевое водоснабжение которого целиком основано на использовании аллювиального водоносного горизонта, загрязнение подземных вод трихлорэтиле-ном и тяжелыми металлами связано с поступлением в воду с территории промышленной зоны, где размещены аэропорт, военные заводы, предприятия электронной промышленности и др.
В г. Гровленд (шт. Массачусетс) в 1979 г. в двух основных городских водозаборах в подземных водах было обнаружено значительное количество трихлорэтилена. В город в аварийном порядке пришлось подать воду из соседних городов. Одним из рассмотренных вариантов восстановления качества воды была откачка подземных вод из перехватывающих скважин и очистка воды на фильтрах с активированным углем. В 25 городах шт. Массачусетс после 1978 г. исключена из эксплуатации часть водозаборных скважин из-за загрязнения воды органическими веществами.
В Великобритании, по данным П. Бардена, также обнаружено органическое загрязнение подземных вод, используемых в системе общественного водоснабжения, причем концентрация трихлорэтилена и трихлорэтана в подземных водах намного превысила ПДК. До 30% потенциальных запасов подземных вод были выведены из использования вследствие их опасного загрязнения.
При обследовании водозаборов подземных вод, снабжающих водой южную часть г. Вены (Австрия), в воде были обнаружены хлорированные углеводороды (трихлорэтилен, тетрахлорэтилен, трихлорэтан, дихлорметан), потребление которых в стране велико и составляет в общем примерно 14 тыс. т. Загрязнение подземных вод вызвано потерями этих веществ при транспортировке, складировании и использовании предприятиями бытового обслуживания. Оценка степени загрязненности подземных вод хлорорганическими веществами была выполнена по общему содержанию в воде этих веществ: при концентрации менее 0,001 мг/дм3считалось, что загрязнение отсутствует; при концентрации 0,001 — 0,01 мг/дм3— оно незначительно; при концентрации более 0,01 мг/дм3— загрязнение сильное (данные В. Кашпера, Ф. Зайдельбергера).
В ФРГ на территориях городов земли Баден-Вюртемберг отмечено до 60 случаев загрязнения подземных вод тетрахлорэтиле-ном, хлороформом и трихлорэтиленом.
В г. Милане (Италия) в 1975 г. ликвидированы водозаборные скважины, в которых были обнаружены хлорированные углеводороды в количестве более 0,25 мг/дм3. Длительная откачка из этих скважин не улучшила состава подземных вод из-за большой площади загрязнения.
В Японии в префектуре Тояма в подземных водах были обнаружены такие органические вещества-загрязнители, как метилхлориды, дихлорметан, хлороформ, четыреххлористый углерод, Дихлорэтан, трихлорэтан, дихлорэтилен, тетрахлорэтилен, толуол, ксилол, дибутилфталат и этилметилфталат.
На сельскохозяйственных территориях, особенно при ирригации, определенную роль в загрязнении подземных вод органическими синтетическими веществами играют химические средства защиты растений — пестициды. Вместе с оросительными водами они могут быть вынесены за пределы корнеобитаемого слоя. Хотя в зоне аэрации основная часть ядохимикатов подвергается распаду, однако при большом периоде детоксикации и значительной норме орошения ядохимикаты могут быть вынесены в водоносный горизонт. Большинство пестицидов относятся к высокотоксичным веществам, ПДК многих из них в питьевой воде измеряются сотыми и тысячными долями миллиграмма на кубический дециметр.
Загрязнение подземных вод ядохимикатами особенно опасно в связи с тем, что применение последних имеет площадной характер и, кроме того, для сельскохозяйственных районов характерно децентрализованное водоснабжение населенных пунктов, при котором водозаборные скважины находятся внутри или вблизи массивов, где применяются ядохимикаты. В таких районах пестициды могут содержаться и в водах рек и каналов, поступая в них вместе с загрязненным дренажным и ливневым стоком, а также при обработке полей ядохимикатами с использованием авиации. Возможны и аварийные поступления ядохимикатов в водоносный горизонт на участках их складирования, при транспортировке и т. п.
Загрязнение подземных вод и водозаборов сельскохозяйственными ядохимикатами обнаружено во многих странах.
В сельскохозяйственных районах США входящие в состав пестицидов трихлорэтилен и 1,2-дибромо-З-хлорпропан были обнаружены в водозаборных скважинах в штатах Пенсильвания, Нью-Джерси, Нью-Йорк, Калифорния и др. По данным Р. Ваймара, М. Дугласа, Р. Карселя, С. Коэна, Д. Уолтерса и др., наличие пестицида алдикарба установлено в водозаборах на Лонг-Айленде (шт. Нью-Йорк), ландана и алдрина — в шт. Южная Каролина, паратиона — в шт. Флорида, ДДТ — в районе г. Мэдисон (шт. Висконсин), а также в Южной Каролине, в шт. Вашингтон.
В округе Клейтон (шт. Айова) подземные воды закарстован-ных карбонатных пород содержат гербициды при повышенной концентрации нитратов. В шт. Небраска в грунтовых водах, залегающих под песчано-суглинистыми почвами на глубине 5 — 7 м от поверхности, был обнаружен гербицид атразин. По-видимому, этот препарат был применен в большом количестве, так как специальные полевые опыты показали, что в гидрогеологических условиях данного района безопасная доза внесения атразина на поверхность составляет всего 2,2 — 4,4 кг на 1 га.
В шт. Аризона пестициды в подземных водах были обнаружены после того, как сельскохозяйственные земли, на которых выращивали цитрусовые культуры, были заняты жилой застройкой, а из скважин, которые раньше использовались для орошения, стали отбирать воду для сельскохозяйственных нужд. В 50 водозаборных скважинах установлено заметное содержание канцерогенного пестицида 1,2-дибромо-З-хлорпропана (ДВСР).
По данным А. Хорвата, в ВНР, в одном из сельскохозяйственных районов, где водоснабжение населения осуществляется из неглубоких колодцев, в 1974 г. было установлено загрязнение грунтовых вод мышьяком в концентрации до 0,6 мг/дм3. Мышьяк также был обнаружен в грунтах в количестве до 100 мкг/кг. Загрязнение подземных вод в данном случае было связано с мышь-якосодержащим пестицидом дарсином, использование которого в Венгрии было запрещено еще в 1968 г. К 1975 г. зона загрязнения подземных вод все еще занимала площадь 2,1 км2.
X. Босеа в 1980 г. описал случай загрязнения подземных вод инсектицидом дибутоксом вблизи г. Аджуд (СРР), которое произошло из-за сброса в фильтрующую канаву сточных вод, образующихся на территории областного центра защиты растений при промывке емкостей и приспособлений для приготовления и распыления раствора. Вынос ядохимикатов из залегающих под канавой песчано-гравийных аллювиальных отложений происходил при подъеме уровйя грунтовых вод в периоды паводков и часто выпадающих осадков. Содержание дибутокса в водозаборных скважинах в момент его обнаружения в воде составляло 0,5 — 3,0 мг/дм3; через 9 мес. загрязнение все еще было на уровне 0,1 — 0,3 мг/дм3, а желтая окраска подземных вод в ареале загрязнения исчезла только через 2 года.
Загрязнение 28 водозаборных скважин при аварийной утечке пестицидов в ЧССР в пос. Храсте в 1978 г. описано Р. Хонсом и О. Марковой. В связи с длительным временем (по расчету 150 — 200 сут) деградации этих веществ в грунтах, для локализации загрязнения и восстановления качества воды запроектирован дренаж.
studfiles.net
Синтетические органические вещества — Справочник химика 21
КРАСИТЕЛИ СИНТЕТИЧЕСКИЕ — органические вещества для окраски различных материалов. Первый К. с. получен в 1857 г. английским химиком Перкином. Исходными веществами для нолучения К. с. были анилин и его производные, откуда и пошло название анилиновые красители как синоним К- с. Термин краситель используют вместо терминов краска и пигмент , которым теперь придают конкретное значение краской называют смесь веществ, применяемую для окрашивания поверх- [c.136]Круг рассматриваемых в книге вопросов ограничен, как и в предыдущем издании, изложением технологии синтетических органических веществ. Общая структура книги сохранена. Она состоит из трех частей, однако несколько изменена последовательность изложения, введены новые разделы и исключены некоторые разделы, входившие в предыдущее издание. [c.7]
Поглощающие свойства синтетических органических веществ [c.65]
МИКРОБНАЯ ДЕСТРУКЦИЯ НЕКОТОРЫХ СИНТЕТИЧЕСКИХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ [c.144]
Наиболее важный, нуждающийся в разрешении практический вопрос состоит в подборе соответствующих культур микроорганизмов и нахождении подходящих условий для разрушения синтетических органических веществ. Но уже сейчас в сточных водах встречается более 55 тысяч разнообразных синтетических соединений [178] и найти для каждого из них оптимальный релмикроорганизм-деструктор представляется нереальной задачей. [c.146]
В последнее время некоторые синтетические органические вещества с успехом используются в животноводстве в качестве добавок к кормам. Применение их восполняет белковую недостаточность кормов, ускоряет рост животных и сокращает затраты кормов на единицу продукции. [c.15]
Извлечение вещества из смеси растворителем применяют либо с целью концентрирования и очистки одного вещества, либо для разделения и очистки всех компонентов данной смеси. При этом возможно решение как чисто аналитических задач, так и задач препаративного выделения. В промышленности экстракцию применяют в крупнотоннажном производстве. В лаборатории противоточное распределение стало одним из наиболее чувствительных методов определения чистоты миллиграммовых количеств природных и синтетических органических веществ. [c.379]
Условия для развития промышленного производства синтетических органических веществ появились в середине XIX в., когда бурное развитие текстильной и других отраслей промышленности вызвало увеличение спроса на ряд продуктов, ранее получавшихся из растительного и животного сырья. Благодаря развитию металлургии и связанного с ним увеличения производства кокса одновременно была создана сырьевая база (смола, сырой бензол), необходимая для синтеза органических продуктов-Замечательные научные открытия Ф. Велера, Н. Н. Зинина, А. М. Бутлерова, Ф. Кекуле, М. Вертело и других ученых позволили решить практические задачи, связанные с организацией первых производств органического синтеза. К этому времени в ранее возникших отраслях химической промышленности, производивших соду, серную кислоту и другие минеральные вещества, уже был накоплен большой опыт конструирования различной химической аппаратуры и проведения разнообразных химических процессов. [c.119]
Реакции конденсации широко используются в производстве полупродуктов, красителей и других синтетических органических веществ. Реакции описанного типа используются также при синтезе ряда важных полимеров методом поликонденсации (стр. 385). [c.282]
В томах 1—3 МЫ занимались, образно говоря, сооружением каркаса здания органической химии. Химические реакции были классифицированы по их механизму, а органические соединения— по их химическим свойствам и (или) строению. Том 4 был посвящен применению представлений, развитых ранее, к природным соединениям. Последние классифицировали по методам их биосинтеза, однако основное внимание по-прежнему уделялось механизмам реакций, в которые вступают эти соединения. Данный том посвящен синтетическим органическим веществам, т. е. веществам, получаемым в лаборатории или на заводе. В т. 4 упоминалось о синтезах сложных природных соединений, преследующих не более чем дилетантскую цель соревнования с природой, хотя, как было подчеркнуто, обычно при проведении таких синтезов имеют в виду гораздо более важные цели. Общим свойством химических веществ и методов синтеза, описанных в данном томе, является их практическая польза, будь то духи, которые делают человека более привлекательным, взрывчатые, вещества для разработки залежей полезных ископаемых или волокно, из которого можно соткать ткань для одежды. Важность того или иного химического вещества оценивается в этой книге не с точки зрения химии, а с точки зрения практической пользы. [c.11]
Активный уголь получают термическим разложением природных или синтетических органических веществ обычно при температуре менее 970 К и последующей активацией — регулируемым окислением, как правило, при 1170 К. Это приводит к удалению продуктов пиролиза с новерхности угля и увеличению доступной поверхности как вследствие частичного сгорания углерода и раскрытия блокированных пор, так и в силу роста шероховатости внутренней новерхности. Активный уголь содержит водород (1—3%), кислород (2—20%), серу (до 0,1%), азот (до 0,2%) и неорганические примеси (зола). Основное количество кислорода адсорбируется в процессе активации. Состав золы зависит от исходного материала активные угли хорошего качества обычно содержат 0,3—3% неорганического остатка, состоящего из соединений щелочных и щелочноземельных металлов, соединений железа и алюминия и двуокиси кремния. [c.91]
Для успешного развития этой новой и весьма обширной области науки и техники потребовалось создать целый арсенал методов научного исследования и новые технологические процессы, с учетом состава, строения и свойств высокополимерных материалов. В разработке этих методов исследования исключительная роль принадлежит физике, физической химии и коллоидной химии. Высокомолекулярные соединения, содержащиеся в природных нефтях, весьма существенно отличаются по строению и свойствам от таких классических представителей высокомолекулярных природных и синтетических соединений, как белок, целлюлоза, каучук, эбонит и др., но все же они имеют и много общего с последними. Поэтому многие методы исследования, разработанные в химии высокомолекулярных соединений за последние 25—30 лет, вполне применимы для исследования высокомолекулярных соединений, содержащихся в нефти. Высокомолекулярные соединения, составляющие наиболее тяжелую часть нефти, по размерам молекул относятся к начальной, самой низшей ступени обширной области высокомолекулярных природных и синтетических органических веществ.
www.chem21.info
Презентация к уроку по химии (10 класс) по теме: СИНТЕТИЧЕСКИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА. 10 класс
СИНТЕТИЧЕСКИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Цель: Сформировать представление о синтетических полимерах и их классификации. Познакомить учащихся с некоторыми ос¬новными синтетическими полимерами и волокнами, а также их получением и применением. Познакомить с составом, строени¬ем, свойствами и получением синтетических каучуков.
Классификация полимеров
Природные – крахмал, целлюлоза, гликоген
Искусственные — вискоза, целлулоид, ацетатное волокно
Синтетические – полиэтилен, полипропилен, полистирол
Полимеры
Полимеризационные получены полимеризацией
Поликонденсационные получены поликонденсацией
Синтетические полимеры – получают в результате полимеризации или поликонденсации низкомолекулярных веществ.
Различия полимеризации и поликонденсации
Признаки сравнения Полимеризация Поликонденсация
Обратимость Плохая Хорошая (р-ции не идут до конца)
Обратный процесс Деполяризация Гидролиз
Относительно молекулярная масса От 104 — 106 Менее 50 тыс.
Тип реакции Соединения Обмена
Исходные мономеры Непредельные соединения Соед-я, с не менее чем с двумя функцион. группами
Синтетические полимеры результат работы химиков. Классификация полимеров по форме макромолекул — линейные, разветвленные, пространственные.
Полиэтилен низкого давления — линейное строение, катализаторы, без высокого давления высокая плотность, боль¬шая прочность. Применение (трубы, бытовая посуда, химиче¬ская посуда).
Полиэтилен высокого давления — разветвленное строение, без катализаторов, высокое давление, плотность не¬высокая, эластичность. Применение (упаковка для пищевых продуктов, пакеты).
Полипропилен — большая прочность.
Применение (ка¬наты, тросы, веревки, мешки, сумки, ковры, детские игрушки, химические реакторы, посуда, корпус компьютера).
Классификация волокон.
Природные (животные, рас¬тительные, минеральные).
Химические (искусственные, синте¬тические).
Классификация синтетических волокон.
Полиэфирные
Лавсан – сложный эфир терефталетовой кислоты и этиленгликоля. (-СОС6Н4СООСН2СН2О-)n
Применение: добавляют к шерсти, тканей трикотажного производства
Нитрон – получают из полиакрилонитрила.
Свойства: имеют высокую t0 размягчения, свето- и морозоустойчивы, гидрофобны, устойчивы к действию органических растворителей.
Применение: трикотажные изделия, костюмные ткани.
Полипропилен – линейный полимер, жесткий, термопластичный с высокими механическими свойствами, t0 размягчения 1500-1600
Применение: электроизоляция, упаковочная пленка, химически стойкие вещества, детали приборов холодильников, радиоприборы, высокопрочное волокно, посуда
Капрон
Высокая прочность, устойчивость к истиранию, не впитывает влагу, не мнутся, не выдерживают высоких t0, разрушается кислотами.
Виды тканей (найлон, лавсан, нитрон).
СИНТЕТИЧЕСКИЕ КАУЧУКИ
Разветвленная структура
Общего назначения
бутадиеновые
бутадиен-стирольные шины
ленты
Специального назначения
бутадиен-нитрильные (бензо- и кислотоустойчивые изделия) кремнийорганические (тепло- и морозоустойчивые изделия)
уретановые (износостойкие и морозоустойчивые изделия)
Трехмерная структура
Фенолформальдегидные смолы
Резина
Полимеры
Термопластичные. Обратимо твердеют и размягчаются.
Термореактивные. Твердеют, и возвратить в вязко текучее состояние нельзя.
nsportal.ru
Тема 1. ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИ. СРАВНЕНИЕ ОРГАНИЧЕСКИХ ВЕЩЕСТВ С НЕОРГАНИЧЕСКИМИ.
План:
1. Предмет органической химии.
2. Природные, искусственные и синтетические органические вещества.
3. Сравнение органических веществ с неорганическими.
4. Валентность.
5. Химическое строение как порядок соединения атомов в молекулы по валентности.
Предмет органической химии
Органическая химия – наука, всесторонне изучающая органические соединения.
Органические соединения – это углеводороды и их функциональных производные.
Органические соединения известны человеку с глубокой древности: этиловый спирт, уксусная кислота, масла, растительные красители и другие. Однако систематическое изучение органических соединений началось во второй половине 18 века.
Термины «органическая химия», «органические вещества» введены в начале 19 века (1809г.) шведом Й.Я. Берцелиусом для обозначения веществ, выделяемых из животных и растительных организмов. В настоящее время известно более 10 миллионов органических соединений, при этом число синтетических органических соединений несравнимо больше веществ, встречающихся в природе.
А. М. Бутлеров определил органическую химию как химию соединений углерода. В организме растений и животных синтезируется большое количество соединений углерода, многие из которых необходимы человеку. Это сахар, крахмал, растительные масла и воск, белки, жиры, красители, волокна и другие. Но существуют и простые вещества, содержащие углерод (CO, CO2, CS2, цианиды, карбонаты), которые относят к неорганическим соединениям и изучают в курсе общей и неорганической химии. Поэтому более удачным считается определение органической химии как науки, данное немецким химиком К. Шорлеммером в 1889 г.: «ОРГАНИЧЕСКАЯ ХИМИЯ – ХИМИЯ УГЛЕВОДОРОДОВ И ИХ ПРОИЗВОДНЫХ».
Причины выделения органической химии в отдельную науку:
1) многочисленность и многообразие органических соединений. Сейчас они составляют большую часть из 60 миллионов соединений, зарегистрированных к маю 2012 года в Chemical Abstracts Service (CAS), и их число постоянно возрастает.
2) сложность и своеобразие органических соединений, которые существенно отличаются в свойствах и реакционной способности от неорганических соединений: органические соединения обычно менее стойки, имеют более низкие температуры фазовых переходов (tкип, tпл), почти все они горят или легко разрушаются при нагревании с окислителями, выделяя СО2; молекулы большинства органических соединений не диссоциируют на ионы; реакции органических соединений протекают значительно медленнее и в большинстве случаев не доходят до конца; среди органических соединений широко распространено явление изомерии. Отсюда необходимость в развитии специфических методов исследования органических веществ.
3) многообразие практического применения органических соединений ввиду их важной роли в процессах жизнедеятельности животных и растительных организмов. Органическая химия является химическим фундаментом биохимии и молекулярной биологии – наук, изучающих процессы, происходящие в клетках организмов на молекулярном уровне. Множество синтетических органических соединений производится крупномасштабно для использования в разных отраслях человеческой деятельности.
Это – нефтепродукты, горючее для различных двигателей, растворители, взрывчатые вещества, полимерные материалы (каучуки, пластмассы, волокна, пленки, лаки, клеи), поверхностно-активные вещества, лекарственные препараты, красители, средства защиты растений, душистые вещества, парфюмерно-косметические продукты и многие другие.
Органические веществав своем составе наряду с другими элементами всегда содержат углерод. Изучение соединений углерода – их строения, химических превращений – и составляет предмет органической химии.
Резкой грани между органическими и неорганическими веществами не существует. Оксиды углерода, угольная кислота, ее соли и некоторые другие вещества по наличию в них углерода должны считаться органическими, но по свойствам они близки к неорганическим соединениям подобного типа и изучаются обычно в неорганической химии.
Можно сказать, что такое название получило и новое подтверждение, так как ведущей познавательной задачей современной органической химииявляется глубокое изучение процессов, происходящих в клетках организмов на молекулярном уровне, выяснение тех тонких механизмов, которые составляют материальную основу явлений жизни.
2. Природные, искусственные и синтетические органические вещества.
Природные органические вещества образуются естественным путем, без вмешательства человека.
Искусственные органические вещества человек получает по образцу известных ему природных веществ.
Синтетические органические вещества – это новые вещества, полученные человеком, которые в природе не существуют.
cyberpedia.su
Органическая химия и органический синтез
Органическим синтезом называется получение более сложных органических веществ из менее сложных органических или неорганических веществ. Путём органического синтеза из угля можно получить мыло и уксус, из дерева — шёлк и шерсть, из спирта — каучук. В настоящее время мы широко пользуемся предметами, материал которых изготовляется с помощью органического синтеза. Это — платье, обувь, детали машин, игрушки, лекарства, краски, посуда, женские сумки, пуговицы и многое, многое другое.
Органический синтез — яркий пример великого значения науки, пример того, как человек, вооружённый знанием, подчиняет себе природу, заставляет её служить своим интересам.
Чудесный элемент
Все окружающие нас тела — земля, люди, животные и растения — состоят из химических элементов. Соединяясь друг с другом в различных комбинациях, эти элементы дают большое число разнообразных химических соединений. Среди ста известных химических элементов особое место занимает углерод. Большинство химиков занимается исследованием соединений углерода. Это не случайно. Углерод входит в состав многих химических соединений. Число известных в настоящее время соединений углерода, так называемых органических, уже превысило 3 миллиона и продолжает быстро возрастать (на данный момент их известно более 27 млн. -прим. ред.). Химики сейчас ежемесячно получают более двух тысяч новых соединений углерода. Химических же соединений, в которые не входит углерод, — неорганических — известно гораздо меньше — менее 100 тысяч.
Быстрое развитие химии углерода или, как её обычно называют, органической химии, связано также с тем, что соединения углерода играют особо важную роль в жизни человеческого организма. Атомы углерода легко соединяются друг с другом и с другими элементами; в результате этого могут образовываться чрезвычайно сложные молекулы с очень большим количеством атомов. Эти сложные молекулы, содержащие углерод, составляют основу всех животных и растительных организмов на Земле. Несомненно, что эти молекулы являются основой жизненных процессов и за пределами нашей планеты. Известно, что вселенная состоит из тех же элементов, что и Земля; известно далее, что основой любых жизненных процессов могут быть только очень сложные химические соединения; известно, наконец, что только один углерод может давать очень сложные молекулы. Таким образом, основой жизни, независимо от того, где она находится, могут быть только соединения углерода.
Органическая химия
Органическая химия как наука возникла более ста лет назад. Впервые начал говорить об органических веществах и органической химии шведский химик Берцелиус. Изучая вещества, содержащиеся в растительных и животных организмах, он убедился, что исследовать эти вещества значительно труднее, чем изучать вещества, получаемые из различных минералов и других неживых тел природы. Эти трудности и заставили Берцелиуса выделить изучение органических веществ в особую отрасль химии.
Однако Берцелиус ошибочно считал, что органические вещества принципиально отличаются от минеральных. В своём учебнике химии, вышедшем в 1827 году, он писал, что «…в живой природе элементы повинуются иным законам, чем в безжизненной», что органические вещества не могут образоваться под влиянием обычных физических и химических сил. Поэтому органическую химию Берцелиус определял как «химию растительных и животных веществ, или веществ, образующихся под влиянием жизненной силы».
Такой взгляд Берцелиуса и его последователей — виталистов {от латинского слова «вита» — жизнь) на происхождение органических веществ был глубоко неверным, идеалистическим. Всё последующее развитие органической химии доказало ошибочность взглядов виталистов.
«Жизненной силы» нет
Уже в 1824 году ученик Берцелиуса Вёлер впервые синтезировал, то-есть получил искусственным путём, органическое вещество — щавелевую кислоту. Щавелевая кислота — вещество растительного происхождения. Она находится в больших количествах в водорослях, грибах, лишайниках, папоротниках. Она придаёт кислый вкус всем известному щавелю. Вёлер получил щавелевую кислоту, нагревая неорганический газ дициан с водой. Эта работа Вёлера долгое время оставалась незамеченной. Более того, сам Вёлер не сумел увидеть её принципиального значения. Четыре года спустя, в 1828 году, Вёлер сделал второе открытие. Он показал, что неорганическое вещество циановокислый аммоний легко можно превратить в продукт жизнедеятельности животного организма — мочевину.
Получение мочевины искусственным путём привлекло широкое внимание научного мира. Однако этот факт ещё не мог поколебать веру в таинственную «жизненную силу». Сторонники «жизненной силы» утверждали, что мочевина, как продукт выделения животного организма, не может считаться настоящим органическим веществом, а находится на грани между органическими и неорганическими соединениями. Если ещё можно приготовить искусственно такие вещества, — говорили они,— то это несомненно нельзя сделать по отношению к более сложным органическим веществам.
Однако развитие науки быстро опровергло эти взгляды. Главную роль здесь сыграли бурные успехи органического синтеза. В 1845 году немецкий химик Кольбе получил искусственным путём уксусную кислоту. Эта кислота — органическое вещество. Образуется она при скисании вина и в виде 3—5%-ного водного раствора употребляется в пищу под названием «уксус». Молекула уксусной кислоты состоит из двух атомов углерода, четырёх атомов водорода и двух атомов кислорода. Кольбе получил уксусную кислоту, взяв в качестве исходных веществ древесный уголь, серу, хлор и воду. После синтеза такого типичного органического вещества, как уксусная кислота, стало ясно, что никакой «жизненной силы» не существует, что процесс образования органических веществ подчиняется обычным физическим и химическим законам.
За сравнительно короткий срок был получен ряд других органических кислот, выделявшихся ранее из растений. Это — винная кислота (встречается в винограде), лимонная (в лимонах, апельсинах), янтарная (в незрелом крыжовнике, винограде), яблочная (в большинстве незрелых плодов) и другие. Постепенно химики научились получать и более сложные органические вещества. Так, в 1854 году, когда было установлено, что жиры представляют собой соединения глицерина с различными органическими кислотами (молекулы которых обычно содержат 16—18 углеродных атомов), был получен искусственным путем жир.
Однако до 60-х годов прошлого столетия синтетические работы химиков носили в значительной степени случайный характер. В своих исследованиях химики-органики действовали неуверенно, наощупь; в теоретических вопросах царил разброд. Отражая общее настроение химиков того времени, Вёлер писал: «Органическая химия может в настоящее время кого угодно свести с ума. Она представляется мне дремучим лесом, полным чудесных вещей, огромной чащей без выхода, без конца, куда не осмеливаешься проникнуть». Теория значительно отставала от практических успехов органической химии. Отставание же теории в свою очередь препятствовало успешной работе в лабораториях.
Создавшееся в органической химии положение хорошо понимал молодой химик, работавший в лаборатории Казанского университета. Этот химик — Александр Михайлович Бутлеров — сыграл в дальнейшем исключительно важную роль в развитии химии.
Структурная теория Бутлерова

Александр Михайлович Бутлеров (1828—1886).
Александр Бутлеров с детских лет увлекался химией, и когда пришло время поступать в университет, он без колебания выбрал естественное отделение философского факультета. В Казанском университете, куда поступил Бутлеров, преподавали выдающиеся учёные, которые горячо любили химию сами и умели увлечь за собой студенческую молодёжь. Огромное влияние оказал на Бутлерова его учитель — знаменитый химик Николай Николаевич Зинин.
Особенно заботливо относился к Бутлерову гениальный русский математик Николай Иванович Лобачевский, бывший в то время попечителем учебного округа. По рекомендации Зинина, Лобачевского и других учёных Бутлеров был оставлен при университете. Защитив магистерскую, а затем и докторскую диссертацию, Бутлеров в 26 лет стал профессором химии. К 30 годам он был одним из самых образованных химиков своего времени. Уже первые работы A. M. Бутлерова затрагивали очень важные вопросы органической химии.
В 1861 году Бутлеров впервые осуществил синтез сахара, действуя на водный раствор формальдегида (применяемого для протравливания семян и известного под названием «формалин») раствором гашёной извести. Сахара — это сложные органические соединения. Даже такой сравнительно простой сахар, как виноградный, называемый глюкозой, содержит в своей молекуле 24 атома. Сахара относятся к важным для питания человека и животных веществам — углеводам. Из этого ясно, какой выдающийся интерес представлял синтез, сахара.
В том же 1861 году A. M. Бутлеров начал блестящие теоретические исследования, прославившие русскую науку. До Бутлерова учёные думали, что установить, как построены молекулы,— невозможно. Такая задача была объявлена неразрешимой. Любые попытки определить взаимное расположение атомш в молекулах считались безнадёжным занятием. Многие учёные, последователи философа-идеалиста Канта, объявили, что строение молекул является непознаваемой «вещью в себе». Считалось поэтому, что химики должны ограничиться только изучением поведения химических веществ во время реакций и не пытаться проникнуть в тайны строения самих молекул. А между тем накопленный в химии большой фактический материал находился в явном противоречии с такими взглядами.
Ещё в 1853 году при исследовании летучих органических соединений металлов было обнаружено, что различные атомы соединяются друг с другом только по определённым законам. Каждый атом одного вещества способен соединяться только с определённым числом атомов другого вещества. Чтобы сравнивать атомы в этом отношении, рассматривают их способность соединяться с атомами водорода. Есть атомы (например, атомы хлора), способные соединяться не более чем с одним атомом водорода. Атомы серы и кислорода соединяются с двумя атомами водорода, азота — с тремя, а углерода — с четырьмя атомами водорода. Водород может всегда соединяться только с одним атомом какого-либо другого элемента.
Способность атома соединяться с определённым числом атомов другого элемента называется валентностью. Атом хлора может соединиться только с одним атомом водорода, и поэтому хлор считается одновалентным; кислород и сера — двухвалентны, азот — трёхвалентен, углерод — четырёхвалентен. Ниже условно изображены атомы наиболее часто встречающихся в органических соединениях элементов с их валентностями.
Глубоко изучив весь этот материал, Бутлеров неопровержимо доказал, что молекулы представляют собой не хаотические скопления атомов, а стройные устойчивые системы, где существует определённый порядок в расположении атомов. В самом деле, молекула воды, например, может быть построена только так, что оба атома водорода соединены с одним атомом кислорода. Никакого другого порядка связи быть не может. Если бы оба атома водорода были прямо связаны друг с другом, то они использовали бы свои валентности полностью и не смогли бы соединиться с кислородом.
Единственный порядок расположения атомов возможен и для молекулы аммиака, состоящей из одного атома азота и трёх атомов водорода.
Точно так же обстоит дело и с метаном, или болотным газом, в котором молекула вещества состоит из одного атома углерода и четырёх атомов водорода.
В молекуле углекислого газа на один четырёхвалентный атом углерода приходится два двухвалентных атома кислорода.
Химики изображают атомы различными буквами латинского алфавита. Вот современное изображение некоторых элементов: водород — H (аш), хлор — Cl (хлор), кислород О (о), сера — S (эс), азот — N (эн, фосфор — P (пэ). Соответственно, молекулы изображаются следующим образом: вода H—О—H (чёрточки между атомами обозначают валентность), аммиак , метан , углекислый газ О = С = О.
Таким образом, атомы в молекулах расположены в определённом порядке; молекулы обладают определённым химическим строением, которое химик может установить, исследуя вещество. Основную идею своей теории A. M.Бутлеров высказал так: «Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу».
Установив понятие химического строения, A.M.Бутлеров создаёт новое понятие природы вещества вообще. Он пишет: «Химическая натура сложной частицы (то-есть молекулы) определяется натурой элементарных составных частей (то-есть атомов), количеством их и химическим строением».
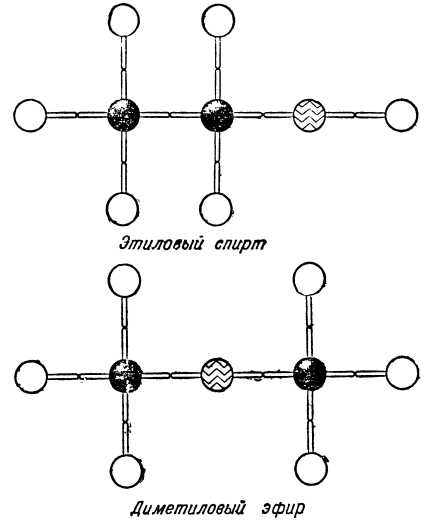
Создав понятия химического строения и природы вещества, A.M.Бутлеров вывел органическую химию из теоретического тупика, указал путь к проникновению в глубь молекул, к познанию их внутреннего строения. Он дал основу для понимания химических процессов, для открытия новых путей органического синтеза. Теория Бутлерова сразу же получила боевое крещение, блестяще объяснив ряд вопросов, раньше совершенно непонятных. Следуя за Берцелиусом, химики считали, что свойства вещества могут изменяться только после изменения его состава. Другими словами, если молекула вещества состоит, например, из двух атомов углерода, шести атомов водорода и одного атома кислорода (C2H6O), то никак нельзя ожидать, чтобы нашлось другое вещество, обладающее таким же составом, но другими свойствами.
Однако химики открыли два различных вещества с одинаковым составом: C2H6O. Одно из них было давно известно: это — этиловый или винный спирт — жидкость, кипящая при 78,4°. Другое вещество, открытое значительно позднее,— диметиловый эфир — представляет собой газ с приятным эфирным запахом, превращающийся в жидкость при охлаждении его до минус 23,6°. Два совершенно различных вещества имеют одинаковый состав! Как это можно объяснить? Да ведь всё это совершенно ясно,— решил Бутлеров,— что из того, что состав этих веществ один и тот же? Ведь из одинакового количества строительного материала, например, кирпича, досок, железа, стекла, можно выстроить различные здания. Сходным образом природа построила из двух атомов углерода, шести атомов водорода и одного атома кислорода две различные молекулы, расположив в каждой из них «строительный материал» по-разному.
В молекуле спирта кислород связан с углеродом и водородом, а в молекуле эфира — с двумя атомами углерода. Бутлерову стала ясной тайна огромного многообразия органических соединений. Оказывается, дело не только в том, что углерод способен образовывать длинные цепи. Не менее важная причина заключается в возможности различного расположения атомов в молекулах, обладающих одинаковым составом. Честь открытия и объяснения этого замечательного явления, называемого изомерией, принадлежит Бутлерову.
Число изомеров — веществ с одинаковым составом, но разным строением — может быть огромным даже для таких веществ, которые в своём составе имеют только два рода атомов — углерод и водород. Так, для гексана, молекула которого состоит из шести атомов углерода и 14 атомов водорода, возможно пять изомеров; уэйкозана, молекула которого состоит из 20 углеродных и 42 водородных атомов, число возможных изомеров равняется 366 319, а у тетраоконтана (40 углеродов и 82 водорода) может быть 62 491178 805 831 изомер!
Молекулы изомеров отличаются друг от друга внутренним расположением атомов, то-есть своим строением, структурой. Свойства органических веществ в первую очередь определяются строением, структурой молекул. Вот почему Бутлеров назвал свою теорию теорией строения, или структурной теорией.
Могущество теории строения
Теория Бутлерова явилась факелом, который отныне стал освещать путь химиков в их практических исследованиях. Бутлеров первый блестяще доказал силу своей теории на практике. Изучая различные бутиловые спирты, содержащие в молекуле четыре углеродных, 10 водородных и один кислородный атом, Бутлеров обратил внимание на расхождение его теории с практикой. Согласно теории Бутлерова, среди различных спиртов этого состава должен быть спирт, который имеет следующее строение:
Однако химики такого спирта не знали. И вот Бутлеров, глубоко веря в правильность своей теории, решил получить этот спирт искусственным путём, наметив план синтеза заранее, подобно инженеру, который, прежде чем конструировать машину, составляет ее чертёж. Упорная работа в лаборатории увенчалась успехом: Бутлеров получил этот изомер; впервые в мире на основании научного предвидения было синтезировано вещество неизвестного ранее класса спиртов. Это открытие можно поставить рядом с научным подвигом Д. И. Менделеева, который не только предсказал существование неизвестных химических элементов, но и точно описал свойства этих элементов задолго до их открытия. В дальнейшем Бутлеров, руководствуясь своей теорией, синтезировал целый ряд других спиртов.
Теперь химикам не нужно было блуждать в потёмках и тратить время на огромное число опытов, поставленных наудачу. Стало возможным работать по заранее намеченному плану. Заслуги Бутлерова перед наукой поистине огромны. В 1868 году, рекомендуя A. M. Бутлерова в Петербургский университет, великий химик Д.И. Менделеев писал: «Бутлеров… путём изучения химических превращений стремится проникнуть в самую глубь связей, скрепляющих разнородные элементы в одно целое, принимает за каждой из них врождённую способность вступать в известное число соединений, а различие свойств приписывает различному способу связи элементов. Никто не проводил этих мыслей столь последовательно… A. M. Бутлеров — один из замечательнейших русских учёных. Он русский и по учёному образованию и по оригинальности трудов. Ученик знаменитого нашего академика H. Зинина, он сделался химиком не в чужих краях, а в Казани, где и продолжает развивать самостоятельную химическую школу. Направление учёных трудов A.M. не составляет продолжения или развития идей его предшественников, но принадлежит ему самому. В химии существуют бутлеровская школа, бутлеровское направление».
Со времени создания теории строения Бутлерова прошло более ста лет. Все эти годы химики руководствовались этой теорией и добились огромных успехов. Теория строения нисколько не устарела; сейчас она так же необходима химикам, как и сто лет назад. Характеризуя успехи органической химии, Фридрих Энгельс ещё в 1894 году писал: «Для химии первой половины нашего (XIX) столетия органические соединения были… таинственными вещами. Теперь нам удаётся одно за другим получить их путём синтеза из химических элементов и без помощи органических процессов. Новейшая химия утверждает: как скоро химический состав какого-либо тела известен, оно может быть составлено из элементов. Нам ещё, правда, очень далеко до точного знания состава высших органических соединений, так называемых белковых; однако нет никакого основания сомневаться, что мы, хотя бы спустя столетия, достигнем этого знания и с его помощью будем добывать искусственный белок. Если мы этого достигнем, то вместе с тем мы воспроизведём органическую жизнь, ибо жизнь от самых низших до самых её высших форм есть не что иное, как нормальная форма существования белковых тел».
Глава из книги О.А. Реутова «Органический синтез»
scientifically.info
Синтетическая органическая химия
Красители
Первая половина XIX в. ознаменовалась развитием новой области химии — синтетической органической химии . Химики вслед за Бертло (см. гл. 6) начали соединять в цепи органические молекулы. Недостаточное понимание строения молекул мешало химикам-органикам середины XIX в., но прогресс науки настолько неотвратим, что этот недостаток, по крайней мере в одном знаменательном эпизоде, оказался преимуществом.
В то время (40-е годы прошлого века) в Великобритании было немного известных химиков-органиков, и работавший у Либиха (см. гл. 6) Август Вильгельм Гофман (1812—1892) был приглашен в Лондон из Германии. Спустя несколько лет Гофман взял к себе в качестве помощника совсем еще юного Уильяма Генри Перкина (1838—1907). В то время Гофман исследовал химические вещества, получаемые из каменноугольного дегтя (густой черной жидкости, образующейся при нагревании каменного угля без доступа воздуха). Однажды Гофман в присутствии Перкина начал рассуждать вслух о возможности синтеза хинина — ценного лекарственного средства против малярии — из каменноугольного дегтя. Если бы синтез хинина удался, Европа избавилась бы от зависимости от поставщиков хинина, привозивших его из далеких тропиков.
Загоревшись этой идеей, Перкин сразу же принялся за дело (дома у него была своя небольшая лаборатория). Если бы он или Гофман больше знали о строении молекулы хинина, то они поняли бы, что эту задачу нельзя решить, основываясь на методах химии середины XIX в. К счастью, Перкин был относительно этого в блаженном неведении, и хотя ему не удалось синтезировать хинин, он достиг, возможно, большего.
Во время пасхальных каникул 1856 г. Перкин, пропадая в лаборатории, обработал анилин бихроматом калия и, разочарованный результатом, уже собрался было выбросить полученную массу, как вдруг заметил, что она приобрела пурпурный оттенок. Перкин добавил спирт, который извлек из реакционной смеси вещество, окрасившее спирт в великолепный пурпурный цвет.
Перкин понял, что у него в руках краситель. Он бросил учебу и на деньги своей семьи построил фабрику. Уже через шесть месяцев фабрика начала выпускать то, что Перкин назвал «анилиновым пурпуром». Новый краситель очень понравился французским красильщикам, они назвали его сиреневым, и этот цвет сделался настолько популярным, что связанный с ним период истории известен как «сиреневое десятилетие». Перкин, первым организовавший промышленное производство синтетического красителя , разбогател и в тридцать пять лет смог отойти от дел.
Несколько лет спустя после поразительного успеха Перкина химики познакомились со структурными формулами органических соединений. Эти формулы могли служить химикам своего рода картой «территории», на которой им предстояло действовать. Используя эту карту, можно было вывести логические схемы реакций, подобрать методы, позволяющие, постепенно меняя строение молекул, превратить одну молекулу в другую и, наконец, синтезировать новые органические соединения не случайно, как это вышло у Перкина, а целенаправленно.
Часто реакциям присваивали имя их первооткрывателя. Так, способ добавления двух атомов углерода в молекулу, открытый Перкином, был назван реакцией Перкина , а способ расщепления гидроокисей четвертичных аммониевых оснований с образованием третичного амина и олефина, открытый учителем Перкина, был назван реакцией Гофмана .
Гофман вернулся в Германию в 1864 г. и занялся там синтетической органической химией — новой областью химии, в которой так успешно проявил себя его юный ученик Перкин. И, в частности, благодаря работам Гофмана синтетическая органическая химия оставалась вплоть до первой мировой войны почти полной монополией Германии.
В лабораториях осуществлялся синтез природных красителей. В 1867 г. Адольф Байер (автор теории напряжений) начал осуществление плана исследований, которые в итоге привели его к синтезу индиго . (Ранее индиго получали из индигоносных растений, крупные плантации которых расположены на Дальнем Востоке и в Южной Азии.) В 1868 г. ученик Байера Карл Гребе (1841—1927) синтезировал другой важный природный краситель — ализарин .
Эти и подобные им достижения заложили основы теории и технологии прикладной химии, благодаря успехам которой наша жизнь преобразилась столь значительным образом за последние несколько десятилетий и продолжает преображаться в еще более ускоренном темпе.
Вплоть до настоящего момента мы последовательно излагали факты, четко следуя за развитием событий, но в этой и следующей главах мы рассмотрим несколько отдельных достижений, благодаря которым химия начала служить человечеству. При этом мы несколько отклонимся от главного пути развития химии. В последующих трех главах мы вновь вернемся к принятой нами схеме изложения.
Лекарственные средства
Вслед за Перкином химики начали синтезировать соединения все возрастающей сложности. Конечно, синтетические соединения в то время не могли конкурировать с природными [87], однако существовало несколько исключений, в частности синтетический индиго. Кроме того, синтез обычно позволял установить молекулярное строение, что всегда представляло огромный теоретический (а иногда и практический) интерес.
Так, немецкий химик Рихард Вильштеттер (1872—1942) тщательно определил строение хлорофилла — зеленого пигмента растений, который позволяет использовать энергию солнечного света при превращении растениями углекислого газа в углеводы.
Два немецких химика, Генрих Отто Виланд (1877—1957) и Адольф Виндаус (1876—1959), определили строение стероидов и родственных им соединений. (К числу стероидов относится ряд важных гормонов.) Еще один немецкий химик, Отто Баллах (1847—1931), установил строение терпенов — практически важных растительных масел, а его соотечественник Ганс Фишер (1881—1945) установил строение гема — красящего вещества крови.
В XX в. проводилось исследование витаминов, гормонов, алкалоидов, и во многих случаях строение их молекул было установлено. Например, в 30-х годах нашего столетия швейцарский химик Пауль Каррер (1889—1971) определил строение каротиноидов — важных растительных пигментов.
Английский химик Роберт Робинсон (1886—1975) систематически изучал алкалоиды. Наибольший успех ему принесли работы по определению строения морфина (1925 г.) и стрихнина (1946 г.). Последняя работа Робинсона была подкреплена работой американского химика Роберта Бернса Вудворда (1917—1979), который в 1954 г. синтезировал стрихнин. Вудворд завоевал признание как химик-синтетик после того, как он и его американский коллега Уильям Эггерс Дёринг (род. в 1917 г.) в 1944 г. синтезировали хинин — то самое соединение, за которым вслепую охотился Перкин (правда, эта «охота» в конце концов принесла ему огромные доходы).
В последующие годы Вудворд продолжал заниматься синтезом и получил ряд соединений все более и более сложной структуры. Так, в 1951 г. он синтезировал холестерин (наиболее известный из стероидов) и кортизон (стероидный гормон), в 1956 г.— резерпин (первый из транквилизаторов) а в 1960 г.— хлорофилл . В 1962 г. Вудворд [88] синтезировал сложное соединение — производное хорошо известного антибиотика тетрациклина [89].
Американский химик (уроженец России) Фебус Аарон Теодор Левин (1869—1940) работал в другом направлении. Он изучал строение нуклеотидов — тех блоков, из которых построены гигантские молекулы нуклеиновых кислот. (В настоящее время установлено, что нуклеиновые кислоты управляют химическими процессами, протекающими в организме человека.) Правильность выводов Левина полностью подтвердили результаты работы шотландского химика Александра Робертуса Тодда (род. в 1907 г.), который в 40-х — начале 50-х годов нашего века синтезировал ряд нуклеотидов и родственных им соединений.
Некоторые из этих соединений, в частности алкалоиды, применяются в медицине и, следовательно, попадают под общую рубрику лекарственные средства . В самом начале XX в. было показано, что ряд синтезированных соединений может использоваться в медицине как лекарственные средства.
В 1909 г. немецкий бактериолог Пауль Эрлих (1854—1915) применил при лечении сифилиса синтетическое соединение сальварсан . Таким образом было положено начало исследованиям в области химиотерапии — лечения болезней с применением специальных химических препаратов.
В 1908 г. было синтезировано соединение, названное сульфаниламидом (аминобензолсульфамид), которое пополнило обширный ряд синтетических соединений, не нашедших применения. Однако в 1932 г. благодаря исследованиям немецкого химика Герхарда Домагка (1895—1964) было установлено, что сульфаниламид и некоторые родственные ему соединения можно использовать для лечения ряда инфекционных заболеваний. Правда, в этой области природные соединения оказались более эффективными, чем синтетические. Примером тому может служить пенициллин — первый антибиотик, который был случайно открыт в 1928 г. шотландским бактериологом Александром Флемингом (1881—1955). Флеминг оставил на несколько дней открытой культуру стафилококковых бактерий, а затем обнаружил, что она покрылась плесенью. Внимательно разглядывая плесень, Флеминг увидел, что вокруг каждого пятнышка плесени располагаются «чистые» области, где культура бактерий исчезла. Флеминг на уровне своего времени изучил этот факт и предположил, что в этих «чистых» областях присутствует соединение с сильным антибактериальным действием, однако выделить это соединение оказалось непростым делом.
В связи с острой необходимостью в лекарственных средствах, необходимых для борьбы с инфекционными заболеваниями, во время второй мировой войны интерес к такого рода соединениям значительно возрос, и этой проблемой начали заниматься более обстоятельно.
Группе ученых под руководством английского биохимика-патолога (уроженца Австралии) Хоуарда Уолтера Флори (1898—1968) и английского биохимика (уроженца Германии) Эрнста Бориса Чейна (род. в 1906 г.) удалось выделить пенициллин и определить его строение. К 1945 г. была разработана технология получения пенициллина с использованием культуры плесени, которая позволяла получать полтонны продукта в месяц.
В 1958 г. химики научились «снимать» с готового пенициллина бензильную группу и присоединять взамен нее другие органические группы. Некоторые из этих полусинтетических веществ, не имеющих аналогов среди природных соединений, обладали более высокой антибактериальной активностью, чем сам пенициллин. Между 40-ми и 50-ми годами из различных видов микроорганизмов были выделены и другие антибиотики, в частности стрептомицин.
В ходе синтеза сложных органических соединений необходимо время от времени проводить анализ с целью идентификации продуктов, образующихся на разных стадиях процесса. Количество вещества, которое можно было бы отобрать для анализа, как правило, весьма невелико, и поэтому анализ в лучшем случае давал неточные результаты, а в худшем и вовсе был невозможен.
Австрийский химик Фриц Прегль (1869—1930) удачно модифицировал оборудование, используемое при анализе, уменьшив его размеры. Он создал особо точные весы, сконструировал образцы тонкой стеклянной посуды, а к 1913 г. разработал методику микроанализа . С этого времени анализ малых проб стал точным.
Классическими методами анализа обычно называют определение объема вещества, расходуемого при реакции (объемный анализ , иначе титриметрический анализ ), или массы вещества, полученного в результате реакции (весовой анализ , иначе гравиметрический анализ ). В XX в. были разработаны новые, физические, методы анализа, а именно измерение поглощения света, изменения электрической проводимости и другие более тонкие и более сложные методы [90].
Белки
Почти все органические соединения, перечисленные в предыдущем разделе, состоят из молекул, количество атомов в которых чаще всего не превышает пятидесяти; эти атомы с трудом распадаются в условиях умеренной химической обработки. Однако существуют органические соединения с поистине гигантскими молекулами, построенными из тысяч и даже миллионов атомов. Эти молекулы состоят из сравнительно небольших «строительных блоков» [91]. Такие гигантские молекулы легко разложить на образующие их блоки, которые можно исследовать. Так, например, поступил Левин, изучая нуклеотиды (см. предыдущий раздел). Предпринимались также попытки изучать эти гигантские молекулы как таковые, не разрушая их предварительно. Первые шаги в этом направлении предпринял шотландский химик Томас Грэхем (1805—1869). Заинтересовавшись диффузией — движением частиц среды, приводящим к переносу вещества и выравниванию концентраций, он начал изучать диффузию газов через мельчайшие поры или тонкие трубки. В 1829 г. ему удалось показать, что скорость диффузии газа обратно пропорциональна корню квадратному из его плотности (закон Грэхема ).
Далее Грэхем перешел к изучению диффузии растворенных веществ. Он обнаружил, что растворы веществ, подобных соли, сахару или сульфату меди, проходят через разделяющую перегородку из пергаментной бумаги (имеющей, как он предполагал, микроскопические поры). В то же время растворы таких соединений, как гуммиарабик, животный клей и желатина, пройти через разделяющую перегородку не могут — очевидно, молекулы соединений последней группы для этого слишком велики.
Соединения, способные проходить через поры пергамента (и, как выяснилось, легко кристаллизующиеся), Грэхем назвал кристаллоидами . Соединения другой группы, не способные, подобно животному клею (по-гречески κόλλα). проходить через поры пергамента, он назвал коллоидами . Наука о гигантских молекулах стала впоследствии важным разделом коллоидной химии , которой, таким образом, Грэхем положил начало [92].
Предположим, что с одной стороны разделяющей перегородки находится чистая вода, а с другой — коллоидный раствор. Молекулы воды могут свободно проникать через перегородку в оба отсека. В первый момент в отсек с коллоидным раствором будет попадать большее число молекул воды, чем покидать его, поскольку выравнивание концентраций по обе стороны перегородки — самопроизвольный энергетически выгодный процесс. Суммарный поток молекул воды в отсек с коллоидным раствором будет продолжаться до тех пор, пока возникающая разность давлений жидкости с обеих сторон перегородки не достигнет определенной величины. Величина этого давления, приводящего к вынужденному равновесию, называется осмотическим давлением раствора .
В 1877 г. немецкий ботаник Вильгельм Пфеффер (1845—1920) показал, как можно измерить осмотическое давление и как, исходя из полученных результатов, можно определить молекулярную массу больших молекул, образующих коллоидные растворы. Это был первый удачный метод оценки размера таких молекул.
В 1923 г. шведский химик Теодор Сведберг (1884—1971) сконструировал центрифугу и разработал седиментационный метод определения молекулярной массы макромолекул, главным образом белков.
Ассистент Сведберга Арне Вильгельм Каурин Тиселиус (1902—1971), также швед, в 1923 г. разработал более совершенный метод разделения гигантских молекул, основанный на характере распределения электрического заряда по поверхности молекулы. Этот способ — электрофорез — оказался особенно важным при разделении и очистке белков.
С помощью физических методов химики могли получить представление об общей структуре гигантских молекул, однако они стремились установить детальное строение этих соединений. Особый интерес вызывали у них белки.
В то время как гигантские молекулы таких веществ, как крахмал или клетчатка древесины, построены из одного многократно повторяемого блока, молекула белка строится из двадцати различных, но тесно связанных блоков — различных аминокислот (см. гл. 6). Именно по этой причине молекулы белков так разнообразны, но это же создает большие трудности при попытке их характеризовать.
Эмиль Фишер, который ранее установил детальное строение молекул сахаров (см. гл. 7), в начале нашего века обратил внимание на молекулу белка [93]. Он показал, что аминогруппа одной аминокислоты связана с остатком молекулы другой кислоты пептидной связью . В 1907 г. Фишер получил соединение, объединяющее восемнадцать аминокислот, и показал, что оно обладает рядом свойств, характерных для белков.
Однако определить порядок аминокислот в полипептидной цепи молекулы природного белка удалось лишь полстолетия спустя, после того как был разработан еще один метод анализа.
Открыл этот метод русский ботаник Михаил Семенович Цвет (1872—1919). Исследуя пигменты растений, Цвет пропустил раствор смеси очень мало различающихся по цвету пигментов через трубку, заполненную адсорбентом — порошкообразным карбонатом кальция, и промыл затем адсорбент чистым растворителем. Отдельные компоненты смеси при этом разделились и образовали цветные полосы. Цвет опубликовал статью с описанием открытого им метода разделения, который он назвал хроматографией («цветописью») [94].
Статья русского ученого осталась незамеченной, но в 20-е годы Вильштеттер (см. разд. «Лекарственные средства») и его ученик, немецкий химик (австриец по происхождению) Рихард Кун (1900—1967), вновь открыли этот способ разделения. В 1944 г. английские химики Арчер Джон Портер Мартин (род. в 1910 г.) и Ричард Лоуренс Миллингтон Синг (род. в 1914 г.) предложили новый вариант этого метода: они заменили трубку с адсорбентом на фильтровальную бумагу. Анализируемая смесь распределялась по фильтровальной бумаге, и компоненты смеси при этом разделялись. Этот способ был назван бумажной хроматографией .
В конце 40-х — начале 50-х годов нашего века химикам удалось обстоятельно проанализировать с помощью метода бумажной хроматографии смеси аминокислот, полученные при расщеплении ряда белков. В результате удалось установить общее число остатков каждой аминокислоты, содержащихся в молекуле белка, однако порядок расположения аминокислот в полипептидной цепи при этом определить, естественно, было нельзя. Английский химик Фредерик Сенгер (род. в 1918 г.) изучал инсулин — белковый гормон, состоящий примерно из пятидесяти аминокислот, распределенных между двумя взаимосвязанными полипептидными цепями. Сенгер расщепил молекулу на несколько более коротких цепей и проанализировал каждую из них методом бумажной хроматографии. Восемь лет продолжалась кропотливая работа по «складыванию мозаики», но к 1953 г. был установлен точный порядок расположения аминокислот в молекуле инсулина. Позднее таким же способом было установлено детальное строение даже больших молекул белка [95].
Следующий шаг состоял в том, чтобы подкрепить этот труд реальным синтезом заданной молекулы белка. В 1954 г. американец Винсент Дю-Виньо (1901—1978) положил начало такому синтезу. Он получил окситоцин — пептид, состоящий всего лишь из восьми аминокислотных остатков. Однако с более сложными молекулами дело пошло быстрее, и вскоре были синтезированы цепи, содержащие несколько десятков аминокислот. К 1963 г. в лабораторных условиях были получены полипептидные цепи инсулина.
Однако, зная только порядок расположения аминокислот, нельзя еще представить себе совершенно отчетливо все уровни организации белковой молекулы. Даже при осторожном нагревании белки нередко необратимо утрачивают свойства, присущие им в природном состоянии, иными словами, происходит денатурация белков. Причем обычно денатурация не сопровождается расщеплением полипептидной цепи; чтобы расщепить цепь, нужны более жесткие условия. Следовательно, цепи образуют какую-то определенную структуру под действием слабых «вторичных связей». В образовании таких вторичных связей обычно участвует атом водорода, находящийся между атомами азота и кислорода. Такая водородная связь в двадцать раз слабее обычной валентной связи.
В начале 50-х годов американский химик Лайнус Полинг (род. в 1901 г.) предположил, что полипептидная цепь свернута в спираль (подобна «винтовой лестнице») и удерживается в этом положении водородными связями. Эта идея оказалась особенно плодотворной применительно к относительно простым фибриллярным белкам , из которых состоят покровные и соединительные ткани.
Более того, спирали образуют даже более сложные по структуре глобулярные белки . Английские химики Макс Фердинанд Перутц (уроженец Австрии) (род. в 1914 г.) и Джон Коудери Кендрю (род. в 1917 г.) обнаружили это при детальном исследовании строения гемоглобина и миоглобина (белков крови и мышц соответственно, способных обратимо присоединять кислород). В своей работе они использовали новый метод анализа — метод дифракции рентгеновских лучей : пучок рентгеновских лучей, проходящий через кристаллы, рассеивается атомами, образующими кристаллы. Рассеивание в заданном направлении и при заданном угле наиболее эффективно в том случае, когда атомы располагаются последовательно. Определяя величину отклонения, можно выявить расположение атомов внутри молекулы. Исследовать таким образом большие молекулы сложной структуры, подобные белковой молекуле,— задача весьма трудоемкая, и тем не менее к 1960 г. таким образом удалось уточнить последние детали строения молекулы миоглобина (состоящей из двенадцати тысяч атомов).
Полинг считал, что предложенную им спиральную модель молекулы можно распространить и на нуклеиновые кислоты. В начале 50-х годов английский физик Морис Хью Фредерик Уилкинс (род. в 1916 г.) изучал нуклеиновые кислоты методом дифракции рентгеновских лучей, и результаты его работы можно было использовать для проверки справедливости предположения Полинга. Английский физик Фрэнсис Гарри Комптон Крик (род. в 1916 г.) и американский химик Джеймс Дьюи Уотсон (род. в 1928 г.) установили, что удовлетворительно объяснить результаты дифракционных исследований можно, лишь несколько усложнив модель молекулы. Каждая молекула нуклеиновой кислоты должна представлять собой двойную спираль, образованную навитыми вокруг общей оси цепями. Эта модель Уотсона — Крика, предложенная ими впервые в 1953 г., сыграла важную роль в развитии генетики [96][97].
Взрывчатые вещества
Не избежали молекулы-гиганты и преобразующей руки химика. Произошло это вначале случайно. В 1845 г. швейцарский химик Христиан Фридрих Шенбайн (1799—1868), уже прославивший себя открытием озона (аллотропной модификации кислорода), проводил опыты в своей домашней лаборатории. Разлив смесь азотной и серной кислот, он вытер эту смесь хлопчатобумажным фартуком и повесил его сушиться над печкой. Как только фартук высох, раздался несильный взрыв и фартука не стало. Сам того не зная, Шенбайн превратил целлюлозу фартука в нитроцеллюлозу [98]. Нитрогруппы (перешедшие из азотной кислоты) послужили внутренним источником кислорода, и при нагревании целлюлоза сразу же полностью окислилась.
Шенбайн понял важность сделанного им открытия. Обычный черный порох при взрыве дает много дыма, покрывает сажей артиллеристов, загрязняет пушки и стрелковое оружие, а на основе нитроцеллюлозы (нитроклетчатки) можно было получить «бездымный порох».
Однако наладить производство нитроклетчатки для военных целей долгое время не удавалось: фабрики, как правило, взрывались. Только в 1891 г. Дьюару (см. гл. 9) и английскому химику Фредерику Аугустусу Абелю (1872—1902) удалось получить безопасную смесь. Поскольку эту смесь можно было прессовать в длинные шнуры, ее назвали кордитом .
В состав кордита кроме нитроклетчатки входит также нитроглицерин , который был получен в 1847 г. итальянским химиком Асканио Собреро (1812—1888). Это мощное бризантное взрывчатое вещество отличается очень высокой чувствительностью, и использовать его как таковое в военных целях оказалось невозможным. Однако, невзирая на чрезвычайную опасность работы с большими количествами этого соединения, его стали применять при прокладке дорог в горах.
Производством нитроглицерина занялось семейство шведского изобретателя Альфреда Бернарда Нобеля (1833—1896). Когда в результате взрыва погиб брат Нобеля, он сосредоточил свои усилия на «усмирении» этого взрывчатого вещества. В 1866 г. Нобель обнаружил, что кизельгур может впитывать значительные количества нитроглицерина. Пропитанный нитроглицерином кизельгур можно было формовать в брикеты. Такие брикеты были совершенно безопасны в обращении, хотя пропитывающий кизельгур нитроглицерин сохранял свою разрушительную силу. Нобель назвал полученную им смесь динамитом .
Получение новых и более мощных по сравнению с черным порохом (изобретенным более пяти столетий назад) взрывчатых веществ в конце XIX в. положило начало гонке вооружений. Его применение для военных целей, как и разработка отравляющих газов во время первой мировой войны, отчетливо продемонстрировало, что задачи науки можно извратить и заставить ее служить целям разрушения. Еще более наглядный урок преподало изобретение самолета и в конечном счете ядерного оружия (см. гл. 14). Наука, которая до конца XIX в. казалась средством создания на земле утопии, стала служить уничтожению.
Полимеры
Однако существует много направлений, позволяющих использовать молекулы-гиганты в мирных целях. Так, если полностью нитрованная целлюлоза — это взрывчатое вещество и может применяться только как таковое, то частично нитрованная целлюлоза (пироксилин ) более безопасна в обращении, и ее можно применять не только в военных целях.
Американский изобретатель Джон Уэсли Хайятт (1837—1920), пытаясь завоевать приз, установленный за создание заменителя слоновой кости для биллиардных шаров, прежде всего обратил внимание именно на частично нитрованную целлюлозу. Он растворил ее в смеси спирта и эфира, добавил камфору, чтобы новое вещество легче было обрабатывать. К 1869 г. Хайятт получил то, что он назвал целлулоидом , и завоевал приз [99]. Целлулоид был первой синтетической пластмассой — материалом, который можно отливать в формы [100].
Однако, как выяснилось, частично нитрованную целлюлозу можно не только формовать в шары, но и вытягивать в волокна и пленки. Французский химик Луи Мари Гиляр Берниго, граф Шар-донне (1839—1924), получил такие волокна, продавливая раствор нитроцеллюлозы через тончайшие отверстия. Растворитель при этом почти сразу же испарялся.
Из полученных волокон можно было ткать материал, который своим блеском напоминал шелк. В 1884 г. Шардонне запатентовал полученный им искусственный шелк . Шардонне назвал эту ткань рейон — излучающая свет, так как ткань блестела и казалось, что она излучает свет.
Появлением пластмассовых пленок мы обязаны американскому изобретателю Джорджу Истмену (1854—1932). Истмен увлекался фотографией. Пытаясь упростить процесс проявления, он начал смешивать эмульсию соединений серебра с желатиной, чтобы сделать эту эмульсию сухой. Полученную таким образом смесь можно было хранить, а следовательно, и готовить впрок. В 1884 г. Истмен заменил стеклянные пластинки на целлулоидные.
Целлулоид невзрывоопасен, но он легко воспламеняется, что может быть причиной пожара, поэтому Истмен начал поиски менее горючих материалов. Когда в целлюлозу вместо нитрогрупп ввели ацетильные группы, полученный продукт остался столь же пластичным, как и нитроцеллюлоза, но он уже не был легко воспламеняющимся. С 1924 г. ацетилцеллюлозные пленки начали использовать в производстве кинофильмов, так как развивающаяся кинопромышленность особенно остро нуждалась в заменителе целлулоида.
Изучая высокомолекулярные природные соединения, химики рассчитывали не только получить их синтетические аналоги, но и открыть новые типы соединений. Одним из методов синтеза молекул-гигантов является полимеризация мономеров (мономер — вещество, молекулы которого способны реагировать между собой или с молекулами других веществ с образованием полимера).
Способ объединения мономеров в гигантскую молекулу можно пояснить хотя бы на примере этилена С2Н4. Напишем структурные формулы двух молекул этилена:
Представим себе, что атом водорода переместился из одной молекулы в другую, в результате в этой молекуле вместо двойной связи появилась свободная одинарная связь. Свободная связь появилась и у первой молекулы, из которой ушел водород. Поэтому эти две молекулы могут соединиться друг с другом.
Такая молекула содержит уже четыре углеродных атома и одну двойную связь, как и молекула исходного этилена. Следовательно, при взаимодействии этой молекулы с еще одной молекулой этилена также может произойти перемещение атома водорода и разрыв двойной связи. Образующаяся в результате молекула будет содержать шесть атомов углерода и одну двойную связь. Таким способом можно получить последовательно молекулу с восемью, десятью и более атомами углерода. Фактически так можно получать молекулы почти любой заданной длины.
Американский химик Лео Хендрик Бакеланд (1863—1944) искал заменитель шеллака — воскоподобного вещества, выделяемого некоторыми видами тропических насекомых. Для этой цели ему необходим был раствор клейкого дегтеобразного вещества. Бакеланд начал с того, что провел полимеризацию фенола и формальдегида и получил полимер, для которого не смог подобрать растворитель. Этот факт привел его к мысли, что такой твердый, практически нерастворимый и, как выяснилось, не проводящий электричество полимер может оказаться ценным материалом. Так, например, из него можно отливать детали, которые легко будет обрабатывать на станках. В 1909 г. Бакеланд сообщил о полученном им материале, который он назвал бакелит . Эта фенолформальдегидная смола была первой синтетической пластмассой [101], которая по ряду свойств осталась непревзойденной.
Нашли применение и синтетические волокна. Это направление возглавил американский химик Уоллес Хьюм Карозерс (1896—1937). Вместе с американским химиком Джулиусом Артуром Ньюлендом (1878—1936) он исследовал родственные каучуку [102]эластомеры . Результатом его работ было получение в 1932 г. неопрена — одного из синтетических каучуков [103].
Продолжая изучение полимеров, Карозерс попытался полимеризовать смесь диаминов и дикарбоновых кислот и получил волокнистый полимер. Длинные молекулы этого полимера содержат комбинации атомов, подобные пептидным связям (см. разд. «Белки») в белке шелка. Вытягивая эти волокна, получают то, что мы сегодня называем найлоном . Карозерс завершил эту работу буквально накануне преждевременной смерти. Разразившаяся вторая мировая война заставила химиков на время забыть об открытии Карозерса. Однако после окончания войны найлон начал вытеснять шелк и вскоре пришел ему на смену (в частности, в производстве чулочного трикотажа).
Первые синтетические полимеры были получены, как правило, случайно, методом проб и ошибок, поскольку и о строении молекул-гигантов, и о механизме полимеризации было в ту пору мало что известно. Первым за изучение строения полимеров взялся немецкий химик Герман Штаудингер (1881—1965) и сделал в этой области немало. Штаудингеру удалось раскрыть общий принцип построения многих высокомолекулярных природных и искусственных веществ и наметить пути их исследования и синтеза. Благодаря работам Штаудингера выяснилось, что присоединение мономеров друг к другу может происходить беспорядочно и приводить к образованию разветвленных цепей, прочность которых значительно ниже.
Начались интенсивные поиски способов получения линейных неразветвленных полимеров. И в 1953 г. немецкий химик Карл Циглер (1898—1973) открыл свой знаменитый титан-алюминиевый катализатор, на котором был получен полиэтилен с регулярной структурой.
Итальянский химик Джулио Натта (1903—1979) модифицировал катализатор Циглера и разработал метод получения нового класса синтетических высокомолекулярных соединений — стерео-регулярных полимеров [104]. Был разработан метод получения полимеров с заданными свойствами.
Одним из главных источников основных органических соединений, необходимых для производства новых синтетических продуктов, является нефть . Эта жидкость известна с античных времен, но чтобы использовать ее в больших количествах, необходимо было открыть способ выкачивания нефти из обширных подземных месторождений. Американский изобретатель Эдвин Лаурентин Дрейк (1819—1880) первым в 1859 г. начал бурить нефтяные скважины. Столетие спустя нефть стала основным источником органических соединений, источником тепла и энергии.
Еще более важным источником органических продуктов является каменный уголь, хотя в век двигателей внутреннего сгорания мы обычно забываем о нем. Русский химик Владимир Николаевич Ипатьев (1867—1952) на рубеже веков начал исследовать сложные углеводороды, содержащиеся в нефти и каменноугольном дегте, и, в частности, изучать их реакции, идущие при высоких температурах. Немецкий химик Фридрих Карл Рудольф Бергиус (1884—1949), используя данные Ипатьева, разработал в 1912 г. практические способы обработки каменного угля и нефти водородом с целью получения бензина.
Однако мировые запасы ископаемого топлива (каменный уголь плюс нефть) ограничены и невосполнимы. Все прогнозы говорят о том, что наступит день, когда запасы ископаемого топлива будут исчерпаны, и что этот день не за горами, особенно если учесть, что численность населения земли быстро увеличивается, а, следовательно, увеличивается и потребность в энергии [105].
Глава 11
Неорганическая химия
Новая металлургия
Хотя читателю может показаться, что XIX в., особенно его вторая половина, был веком органической химии, неорганическая химия в этот период также продолжала развиваться.
Одним из достижений в этой области явилось изобретение фотографии (см. гл. 9). Однако на развитии экономики или благосостоянии общества это изобретение, естественно, практически не сказалось. Еще одним достижением неорганической химии явилось усовершенствование способа зажигания огня. На протяжении тысячелетий человек добывал огонь трением. Со времени появления железа он научился высекать искры, ударяя огнивом (кресалом) о кремень. Оба способа были неудобны и утомительны, и со временем люди начали пытаться использовать для получения огня химические вещества, способные загораться при низких температурах в результате кратковременного трения. В 1827 г. английский изобретатель Джон Уолкер (приблизительно 1781—1859 гг.) предложил первые вполне пригодные для употребления фосфорные спички. За последующие полтора столетия спички значительно усовершенствовались, однако принцип их действия остался тем же.
Фотография и фосфорные спички — только два примера практических успехов неорганической химии. В полных и подробных трудах по истории химической науки эти и подобные им примеры заслуживают более чем простого упоминания, но в нашей краткой работе мы должны сосредоточить свое внимание на открытиях более крупных.
Самые большие успехи в области прикладной неорганической химии, безусловно, связаны с получением металлов и прежде всего стали, производство которой было и остается наиболее важной статьей экономики любой промышленно развитой страны. Если нефть для современного общества — источник сырья и топлива, то сталь — материальная основа практически всех отраслей промышленности.
Сталь, как мы отметили, начали получать и широко использовать еще три тысячелетия назад, но только в середине XIX в. был разработан способ, который обеспечивал массовое производство литой стали. Большая заслуга в этом принадлежит английскому металлургу Генри Бессемеру (1813—1898).
infopedia.su
