Нахождение в природе
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее:
алюминия — 8,2%
железа — 4,1%
кальция — 4,1%
натрия — 2,3%
магния — 2,3%
калия — 2,1 %
титана — 0,56%
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%.
В природе металлы встречаются в различном виде:
— в самородном состоянии: серебро , золото , платина , медь , иногда ртуть
— в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.
— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др.
— различных солей:
сульфидов: галенит PbS, киноварь НgS,

Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные.
Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
Билет №53
А) s-элементы I-А группы. Щелочные металлы. Общая характеристика. Электронная оболочка, положение в ПТ, валентность, свойства. Физические и химические свойства. Соединения щелочных металлов.
Б) Элементы II-А группы. Общая характеристика. Получение, свойства, применение.
В) Биологическая роль натрия, калия, магния и кальция.
В I-А группу входят щелочные металлы – Li, Na, K, Rb, Cs и Fr. В ПТ они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1.
 Очевидно, что валентные
электроны щелочных металлов могут
быть легко удалены, потому
что атому энергетически
выгодно отдать электрон и приобрести конфигурацию инертного
газа.
Поэтому для всех щелочных металлов
характерны восстановительные свойства. При
растворении щелочных металлов в воде
образуются растворимые гидроксиды,
называемые щелочами. Важным
продуктом, содержащим щелочной металл,
является сода
Na2CO3 (карбонаты).
Очевидно, что валентные
электроны щелочных металлов могут
быть легко удалены, потому
что атому энергетически
выгодно отдать электрон и приобрести конфигурацию инертного
газа.
Поэтому для всех щелочных металлов
характерны восстановительные свойства. При
растворении щелочных металлов в воде
образуются растворимые гидроксиды,
называемые щелочами. Важным
продуктом, содержащим щелочной металл,
является сода
Na2CO3 (карбонаты).Щёлочноземельные металлы — химические элементы 2-й группы главной подгруппы, кроме бериллия и магния: кальций, стронций, барий и радий. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Щелочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами.
 Имея два валентных электрона,
щелочноземельные металлы легко их
отдают, и во всех соединениях имеют
степень окисления +2 (очень редко +1).
Химическая активность щелочноземельных
металлов растёт с ростом порядкового
номера. Используются
в черной металлургии. Оксиды
и гидроксиды щелочноземельных металлов
имеют тенденцию к усилению основных
свойств с ростом порядкового номера.
Имея два валентных электрона,
щелочноземельные металлы легко их
отдают, и во всех соединениях имеют
степень окисления +2 (очень редко +1).
Химическая активность щелочноземельных
металлов растёт с ростом порядкового
номера. Используются
в черной металлургии. Оксиды
и гидроксиды щелочноземельных металлов
имеют тенденцию к усилению основных
свойств с ростом порядкового номера.
Магний нужен для высвобождения энергии углеводов при их окислении в организме, участвует в нормализации возбудимости нервной системы, благоприятно влияет на функциональное состояние мышц сердца и его кровоснабжения, обладает антиспастическим и сосудорасширяющим действием, стимулирует двигательную функцию кишечника и желчеотделение, способствует выведению холестерина из организма.
Калий играет важную роль в функционировании клеток всех тканей организма, является непременным компонентом систем обеспечения кислотно-щелочного равновесия в тканевых и межтканевых жидкостях.
 Это необходимо для нормального
обмена веществ, что в свою очередь
предопределяет хорошее самочувствие
и высокую работоспособность человека.
Это необходимо для нормального
обмена веществ, что в свою очередь
предопределяет хорошее самочувствие
и высокую работоспособность человека.Кальций необходим для обеспечения деятельности сердца, входит в состав крови, участвует в процессах ее свертывания, а также в стабилизации защитных механизмов, повышающих устойчивость организма к болезням и действию внешних неблагоприятных факторов.
Биологическая активность и роль натрия в процессах жизнедеятельности организма человека исключительно велика. Больше всего натрия содержится во внеклеточных жидкостях (лимфе и сыворотке крови), так же он присутствует практически во всех органах и тканях. Натрий активно участвует в процессах внутриклеточного обмена, поддержании кислотно-щелочного равновесия.
Билет №54
Металлы p-элементы.
III-А группа. Общая характеристика.
Электронная оболочка, положение в ПТ,
валентность, свойства. Алюминий нахождение
в природе. Получение, свойства. Оксид и
гидроксид Алюминия. Комплексные
соединения. Квасцы. Применение Алюминия
и его соединений.
Алюминий нахождение
в природе. Получение, свойства. Оксид и
гидроксид Алюминия. Комплексные
соединения. Квасцы. Применение Алюминия
и его соединений.
Алюминий — основной представитель металлов главной под группы III группы Периодической системы. Свойства его аналогов — галлия, индия и таллия — напоминают свойства алюминия, поскольку все эти элементы имеют одинаковую электронную конфигурацию внешнего уровня ns2nр1 и могут проявлять степень окисления +3. Все элементы группы трехвалентны, но с увеличением атомного номера более характерной становится валентность 1 (Тl преимущественно одновалентен). В ряду Аl—Gа—In—Тl уменьшается кислотность и увеличивается основность гидроксидов R(ОН)3.
Алюминий —
самый рас пространенный металл на Земле
(3-е место среди всех элементов; 8% состава
земной коры). В виде свободного металла
в при роде не встречается; входит в
состав глиноземов (Аl2О3),
бокситов (Аl2О3 • xН Кроме того, алюминий обнаруживается в
виде силикатов в таких породах, как
глины, слюды и полевые шпаты.
Кроме того, алюминий обнаруживается в
виде силикатов в таких породах, как
глины, слюды и полевые шпаты.
Физические свойства. Алюминий в свободном виде — се ребристо-белый металл, обладающий высокой тепло- и электропроводностью. Алюминий имеет невысокую плотность — при мерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
Химические
свойства. Поверхность
алюминия обычно по крыта прочной пленкой
оксида Аl2О3,
которая предохраняет его от взаимодействия
с окружающей средой. Если эту пленку
удаляют, то металл может энергично
реагировать с водой. В виде стружек или
порошка он ярко горит на воздухе, выделяя
большое количество теплоты. алюминий
уже при комнатной температуре активно
реагирует со всеми галогенами, образуя
галогениды. При нагревании он
взаимодействует с серой (200 °С), азотом
(800 °С), фосфором (500 °С) и углеродом (2000
°С). Алюминий легко растворяется в
соляной кислоте любой концентрации.
Оксид алюминия (III) Аl2О3 (глинозем) — вещество белого цвета, тугоплавкое (tпл=2044°С, tкип=3530°С), практически нерастворимое в воде, с очень высокой твердостью. Является исходным сырьем для получения алюминия.
Гидроксид алюминия — типичный амфотерный гидроксид. При взаимодействии с кислотами образуются соли, содержащие катионы алюминия, а с растворами щелочей (взятыми в избытке) образуются алюминаты, т.е. соли, в которых алюминий входит в состав аниона.
Широко используются
двойные соли алюминия —
квасцы KAl(SO4)2•12h3O, NaAl(SO4)2•12h3O, Nh5Al(SO4)2•12h3O
и др. — обладают сильными вяжущими
свойствами и применяются при дублении
кожи, а также в медицинской практике
как кровоостанавливающее средство.
— обладают сильными вяжущими
свойствами и применяются при дублении
кожи, а также в медицинской практике
как кровоостанавливающее средство.
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость, высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки.
Билет №55
Металлы IV-А группы. Общая характеристика. Нахождение в природе. Получение, свойства. Оксиды и гидроксиды. Кислотно-основные и окислительно-восстановительные свойства соединений. Комплексные соединения.В химических соединениях германий обычно проявляет валентности 4 или 2. Соединения с валентностью 4 стабильнее. Принормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода.
 Применение находят сплавы германия и
стёкла на основе диоксида германия.
Применение находят сплавы германия и
стёкла на основе диоксида германия.Олово относится к группе лёгких металлов. При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C. При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Четырехвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.
Комплексные
соединения олова
изучены при растворении касситерита
во фторированных средах. Эти соединения
отличаются высокой растворимостью.
Этими же свойствами обладают соединения,
полученные в хлоридных растворах. В
качестве основных форм комплексных
соединений, известных из экспериментов,
можно назвать Na2[Sn(OH)6],
Na2[SnF6],
Na2[Sn(OH)2F4]
и пр. Эксперименты показали, что комплекс
Sn(OH)4F2−2 будет
преобладать при Т = 200 °C.
Эксперименты показали, что комплекс
Sn(OH)4F2−2 будет
преобладать при Т = 200 °C.
Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами.
С кислородом образует ряд соединений Pb2О, PbO, Pb2О3, Pb3О4, PbO2. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре при взаимодействии свинца и горячего водяного пара получаются оксиды свинца и водород.Оксидам PbO и PbO2 соответствуют амфотерные гидроксиды Pb(ОН)2 и Pb(ОН)4. С ним образуются растворимые комплексные соединения состава Pb(HSO4)2 и Н2[PbCl4]
Нитрат
свинца применяется
для производства мощных смесевых
взрывчатых веществ. Азид
свинца применяется
как наиболее широкоупотребляемый детонатор. Хромат
свинца PbCrO4 известен
как хромовый жёлтый краситель,
является важным пигментом для приготовления
красок, для окраски фарфора и тканей. Сульфид
свинца PbS,
чёрный нерастворимый в воде порошок,
используют при обжиге глиняной посуды
и для обнаружения ионов свинца.
Хромат
свинца PbCrO4 известен
как хромовый жёлтый краситель,
является важным пигментом для приготовления
красок, для окраски фарфора и тканей. Сульфид
свинца PbS,
чёрный нерастворимый в воде порошок,
используют при обжиге глиняной посуды
и для обнаружения ионов свинца.
Билет 58
Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 25.
Оксиды марганца (II) и (IV). Гидроксид и соли марганца (II)
Оксид
марганца (II) MnO — твердое вещество зеленого цвета —
можно получить восстановлением оксида
марганца (IV) в токе водорода:
MnO2+Н2=MnO+Н2О MnO — типичный основной оксид, с водой в
реакцию не вступает. Ему соответствует
гидроксид марганца (II), Mn(ОН)3, представляющий
собой слабое основание. В виде осадка
телесного цвета выпадает при взаимодействии
щелочей с солями марганца
(II):
+2NaClMnСl2+2NaOH=Mn(OH)2
Mn(OH)2+2HCl=MnСl2+2h3O
Соли
марганца (II), как правило, хорошо растворимы
в воде, кроме Mn3(PO4)2, MnS, MnCO3. Сульфат
марганца (II) MnSO4 — соль белого цвета,
одно из наиболее устойчивых соединений
марганца (II). В виде кристаллогидрата
MnSO4•7Н2O встречается в природе. Он
используется при крашении тканей, а
также наряду с хлоридом марганца (II)
MnСl2 — для получения других соединений
марганца.
Карбонат марганца (II) MnСO3
встречается в природе в виде марганцевого
пшата и используется в металлургии.
Нитрат
марганца (II) Mn(NO3)2 получают только
искусственным путем и используют для
разделения редкоземельных металлов.
В
окислительно-восстановительных реакциях
соединения марганца (II) — хорошие
восстановители.
Сульфат
марганца (II) MnSO4 — соль белого цвета,
одно из наиболее устойчивых соединений
марганца (II). В виде кристаллогидрата
MnSO4•7Н2O встречается в природе. Он
используется при крашении тканей, а
также наряду с хлоридом марганца (II)
MnСl2 — для получения других соединений
марганца.
Карбонат марганца (II) MnСO3
встречается в природе в виде марганцевого
пшата и используется в металлургии.
Нитрат
марганца (II) Mn(NO3)2 получают только
искусственным путем и используют для
разделения редкоземельных металлов.
В
окислительно-восстановительных реакциях
соединения марганца (II) — хорошие
восстановители.
Оксид
марганца (IV) MnO2 встречается в природе в
виде минерала пиролюзита, который
является важнейшей марганцевой рудой.
Оксид марганца (IV) темно-бурого цвета,
при хранении устойчив, обладает
амфотерными свойствами, с преобладанием
кислотных свойств:
MnO2+2KOH=K2MnO3+Н2О
(реакция идет при сплавлении)
А в
окислительно-восстановительных процессах
в зависимости от условий может вести
себя либо как окислитель, либо как
восстановитель. Например, одним из
способов получения хлора служит окисление
концентрированной соляной кислотой
HСl оксида марганца (IV) по уравнению:
Например, одним из
способов получения хлора служит окисление
концентрированной соляной кислотой
HСl оксида марганца (IV) по уравнению:
В реакции (идет при сплавлении) MnO2 является восстановителем.
Оксид
марганца (IV) служит катализатором в
реакциях, протекающих с отщеплением
кислорода, таких, как разложение
бертолетовой соли или пероксида
водорода:
2КСlO3=MnO2 2КСl+3O2
2Н2O2=MnO22Н2O+O2 Оксид
марганца (IV) применяют в производстве
стекла и в металлургии. Гидроксид
марганца (IV) неустойчив, его формула
может быть представлена в двух видах:
Mn(ОН)4 и Н4MnO4 ортомарганцоватистая и
Н2MnO3 метамарганцоватистая кислота.
Также, как и оксид марганца (IV), гидроксид
марганца (IV) амфотерен.
Существует
два типа солей четырехвалентного
марганца. Это хлорид, сульфат марганца
(IV) (MnСl4, Mn(SO4)2). Они неустойчивы. Манганиты — соли мета- и ортомарганцоватистой
кислоты. Так, закись-окись Mn3O4 (минерал
гаусманит) можно рассматривать как соль
Mn2MnO4, то есть манганит двухвалентного
марганца. +2 +4 -2
+2 +4 -2
Соединения марганца 6 и манганаты.
Манганаты VI — соли нестойкой марганцоватой кислоты H2MnO4, в кристаллическом состоянии известны только для щелочных металлов и бария. Кристаллы темно-зелёного цвета, растворы также зелёные. Термически неустойчивы, при нагревании разлагаются с выделением кислорода до MnO2 и манганатов V.
Манганаты VI — являются окислителями, в нейтральной среде восстанавливаются до соединений Mn(IV), в кислой — до Mn2+. В нейтральных и кислых растворах возможно диспропорционирование до перманганатов и соединений Mn(IV):
3 H2MnO4 =2 HMnO4 + MnO2 + 2 H2O
Сильными окислителями манганаты VI окисляются до перманганатов. Образуют двойные соли с сульфатами и хроматами.
Манганаты — соли нестойких, несуществующих в свободном
состоянии кислородных
кислот марганца в степенях
окисления V, VI и VII и содержащие тетраэдрические анионы MnO43− (гипоманганаты), MnO42− (манганаты) и MnO4− (перманганаты)
соответственно.
Соединения марганца 7.
Перманганаты, манганаты VII — соли нестойкой марганцовой кислоты HMnO4, известны для щелочных и щелочноземельных металлов. Кристаллы фиолетово-черного цвета, с зеленоватым блеском, растворимые в воде, растворы малиново-фиолетовые. Перманганаты лития, натрия и кальция образуют кристаллогидраты. Термически неустойчивы, разлагаются с выделением кислорода, образуя, в зависимости от условий, различные продукты, при умеренном нагревании разлагаются до манганатов VI, например:
2KMnO4 =K2MnO4 + MnO2 + O2
В присутствии восстановителей могут разлагаться со взрывом.
Перманганаты
являются сильными окислителями, в
щелочной среде восстанавливаются до
манганатов MnO42−,
в нейтральной — до диоксида марганца
MnO2,
в кислой — до солей Mn2+.
Используются в аналитической химии в
качестве окислителей в редокс-титровании
(перманганатометрия). Широко используются
в качестве окислителей в органическом
синтезе — при син-дигидроксилировании
окислением алкенов, окисление боковых
цепей ароматических соединений до карбоксильных
групп и т. д.
Широко используются
в качестве окислителей в органическом
синтезе — при син-дигидроксилировании
окислением алкенов, окисление боковых
цепей ароматических соединений до карбоксильных
групп и т. д.
Абросимова Елена Владимировна учитель химии и биологии
Оксиды щелочноземельных металлов
Получение оксидив
1) Окисление металлов (кроме Ba, который образует пероксид)
2) Термическое разложение нитратов или карбонатов
CaCO3 t˚C→ CaO + CO2
2Mg(NO3)2 t˚C→ 2MgO + 4NO2 + O2
Химические свойства оксидов щелочноземельных металлов
Типичные основные оксиды. Реагируют с водой (кроме BeO и MgO), кислотными оксидами и кислотами
Реагируют с водой (кроме BeO и MgO), кислотными оксидами и кислотами
СаO + H2O → Са(OH)2
3CaO + P2O5 → Ca3(PO4)2
BeO + 2HNO3 → Be(NO3)2 + H2O
Гидроксиды щелочноземельных металлов R(OH)2
Получение гидроксидов
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2H2O → Ba(OH)2 + H2
CaO (негашеная известь) + H2O → Ca(OH)2(гашеная известь) Видео-опыт
Химические свойства гидроксидов
Гидроксиды R(OH)2 — белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера:
Основность R(OH)2 увеличивается с увеличением атомного номера:
Be(OH)2 – амфотерный гидроксид (т.е. проявляет свойства и кислоты и основания, в зависимости от условий реакции)
Mg(OH)2 – слабое основание
Са(OH)2 — щелочь
остальные гидроксиды — сильные основания (щелочи).
1. Взаимодействие с кислотными оксидами:
Ca(OH)2 + СO2 → CaСO3↓ + H2O ! Качественная реакция на углекислый газ
Ba(OH)2 + SO2 → BaSO3↓ + H2O
2. Взаимодействие с кислотами:
Взаимодействие с кислотами:
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
3. Реакции обмена с солями, если образуется осадок:
Ba(OH)2 + K2SO4 → BaSO4↓+ 2KOH
ТРЕНАЖЁРЫ
Тренажёр №1 » Строение атомов элементов главной подгруппы II группы и изменение свойств атомов с увеличением порядкового номера элемента»
Тренажёр №2 » Уравнения реакций магния и щелочноземельных металлов с кислородом»
Тренажёр №3 «Уравнения реакций, характеризующих химические свойства оксидов магния и щелочноземельных металлов»
Тренажёр №4 » Характеристика реакции гидроксида кальция с соляной кислотой»
Тренажёр №5 » Характеристика кальция по положению в Периодической системе Д. И. Менделеева»
И. Менделеева»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Используя дополнительные источники и учебник, заполните таблицу «Соединения кальция»
1.4. Оксиды — ЗФТШ, МФТИ
Многие элементы проявляют переменную валентность и дают оксиды различного состава, что учитывается по международной номенклатуре с указанием степени окисления элемента римскими цифрами, например, `»SO»_3` — оксид серы (VI), `»SO»_2` — оксид серы (IV).
Можно представить следующую схему:
Название оксида `=` «Оксид» `+` название элемента в род. падеже `+` (валентность римскими цифрами).
По своим химическим свойствам все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие оксиды принято делить на три основные группы: основные, амфотерные и кислотные.
Получение основных оксидов
а) разложение нерастворимых гидроксидов:
нерастворимые основания при нагревании разлагаются на соответствующий оксид и воду:
$$ \mathrm{Cu}{\left(\mathrm{OH}\right)}_{2}\stackrel{\mathrm{t}°\mathrm{C}}{\to }\mathrm{CuO}+{\mathrm{H}}_{2}\mathrm{O}$$.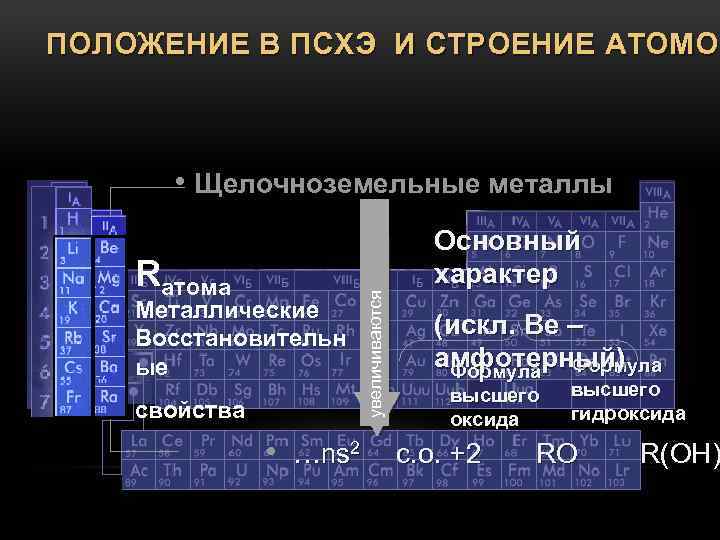
Этим методом нельзя получить гидроксиды щелочных металлов.
б) разложение солей кислородсодержащих кислот:
- разложение карбонатов:
карбонаты щелочноземельных металлов и магния разлагаются на соответствующие основный и кислотный оксиды:
$$ {\mathrm{BaCO}}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to }\mathrm{BaO}+{\mathrm{CO}}_{2}\uparrow $$.
Ниже приведены уравнения реакций разложения карбоната аммония и карбоната серебра:
$$ {\left({\mathrm{NH}}_{4}\right)}_{2}{\mathrm{CO}}_{3}\stackrel{t°\mathrm{C}}{\to }2{\mathrm{NH}}_{3}\uparrow +{\mathrm{CO}}_{2}+{\mathrm{H}}_{2}\mathrm{O}$$;
$$ 2{\mathrm{Ag}}_{2}{\mathrm{CO}}_{3}\stackrel{t°\mathrm{C}}{\to }4\mathrm{Ag}\downarrow +2{\mathrm{CO}}_{2}\uparrow +{\mathrm{O}}_{2}\uparrow $$.
Карбонаты щелочных металлов плавятся без разложения, исключение составляет карбонат лития :
$$ {\mathrm{Li}}_{2}{\mathrm{CO}}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to }{\mathrm{Li}}_{2}\mathrm{O}+{\mathrm{CO}}_{2}\uparrow $$.
- разложение гидрокарбонатов металлов:
гидрокарбонаты разлагаются на карбонат, воду и углекислый газ.
$$ 2{\mathrm{NaHCO}}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to }{\mathrm{Na}}_{2}{\mathrm{CO}}_{3} + {\mathrm{CO}}_{2}\uparrow + {\mathrm{H}}_{2}\mathrm{O}$$.
- разложение нитратов
разложение нитратов металлов определяется положением металла в электрохимическом ряду напряжений металлов:
$$ 2{\mathrm{KNO}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to }2{\mathrm{KNO}}_{2} + {\mathrm{O}}_{2}\uparrow $$
(если металл в ряду напряжения стоит до магния),
$$ 2\mathrm{Pb}({\mathrm{NO}}_{3}{)}_{2} \stackrel{\mathrm{t}°\mathrm{C}}{\to } 2\mathrm{PbO} + 4{\mathrm{NO}}_{2}\uparrow + {\mathrm{O}}_{2}\uparrow $$
(если металл в ряду напряжения стоит от магния до меди включительно),
$$ 2{\mathrm{AgNO}}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to } 2\mathrm{Ag} + 2{\mathrm{NO}}_{2}\uparrow + {\mathrm{O}}_{2}\uparrow $$
(если металл в ряду напряжения стоит после меди).
ВНИМАНИЕ!!!
$$ {\mathrm{NH}}_{4}{\mathrm{NO}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{N}}_{2}\mathrm{O}\uparrow + 2{\mathrm{H}}_{2}\mathrm{O}$$;
$$ 4{\mathrm{LiNO}}_{3}\stackrel{t°\mathrm{C}}{\to }2\mathrm{LiO}+4{\mathrm{NO}}_{2}\uparrow +{\mathrm{O}}_{2}\uparrow $$;
$$ 4\mathrm{Fe}{\left({\mathrm{NO}}_{3}\right)}_{2}\stackrel{t°\mathrm{C}}{\to }2{\mathrm{Fe}}_{2}{\mathrm{O}}_{3}+8{\mathrm{NO}}_{2}\uparrow +{\mathrm{O}}_{2}\uparrow $$;
$$ \mathrm{Mn}{\left({\mathrm{NO}}_{3}\right)}_{2}\stackrel{\mathrm{t}°\mathrm{C}}{\to }{\mathrm{MnO}}_{2}\downarrow +2{\mathrm{NO}}_{2}\uparrow $$.
- разложение основных солей:
$$ (\mathrm{ZnOH}{)}_{2}{\mathrm{CO}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to } 2\mathrm{ZnO} + {\mathrm{CO}}_{2}\uparrow + {\mathrm{H}}_{2}\mathrm{O}$$.
в) разложение кислородсодержащих кислот:
`»H»_2″SO»_3 → «SO»_2 + «H»_2″O»`.
г) обработка солей растворами кислот:
`»K»_2″Cr»_2″O»_7 + «H»_2″SO»_4 →2″CrO»_3+»K»_2″SO»_4+»H»_2″O»`,
`»Na»_2″SiO»_3+2″HCl» -> 2″NaCl»+»SiO»_2+»H»_2″O»`.
Химические свойства основных оксидов
Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, амфотерными гидроксидами, с кислотами.
Большинство кислотных оксидов непосредственно взаимодействуют с водой с образованием кислот (исключение `»SiO»_2`):
`»P»_2″O»_5+3″H»_2″O» -> 2″H»_3″PO»_4`;
Оксиды, которым соответствуют неустойчивые кислоты, реагируют с водой обратимо и в очень малой степени.
$$ {\mathrm{CO}}_{2} + {\mathrm{H}}_{2}\mathrm{O}\rightleftarrows {\mathrm{H}}_{2}{\mathrm{CO}}_{3}$$;
$$ {\mathrm{SO}}_{2} + {\mathrm{H}}_{2}\mathrm{O}\rightleftarrows {\mathrm{H}}_{2}{\mathrm{SO}}_{3}$$.
Азот в оксидах способен проявлять в соединениях степени окисления `+1`, `+2`, `+3`, `+4`, `+5`. Оксиды `»N»_2″O»` и `»NO»` является несолеобразующими оксидами, оксиды `»N»_2″O»_3` и `»N»_2″O»_5` являются кислотными оксидами, которым соответствуют азотистая и азотная кислота соответственно:
$$ {\mathrm{N}}_{2}{\mathrm{O}}_{3} + {\mathrm{H}}_{2}\mathrm{O} \to 2{\mathrm{HNO}}_{2}$$;
$$ {\mathrm{N}}_{2}{\mathrm{O}}_{5} + {\mathrm{H}}_{2}\mathrm{O} \to 2{\mathrm{HNO}}_{3}$$.
Оксид `»NO»_2` является кислотным оксидом, которому соответствуют сразу две кислоты:
$$ 2{\mathrm{NO}}_{2} + {\mathrm{H}}_{2}\mathrm{O} \to {\mathrm{HNO}}_{2} + {\mathrm{HNO}}_{3} $$.
Наряду с современной номенклатурой для кислотных оксидов до сих пор широко используется старинная система названий как ангидридов кислот – продуктов отщепления воды от соответствующих кислот. Например, `»SO»_3` – ангидрид серной кислоты, `»SO»_2` – ангидрид сернистой кислоты. Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, амфотерными гидроксидами, щелочами:
$$ {\mathrm{SO}}_{3} + \mathrm{CuO} \to {\mathrm{CuSO}}_{4}$$;
$$ {\mathrm{SO}}_{3} + {\mathrm{Na}}_{2}\mathrm{O} \to {\mathrm{Na}}_{2}{\mathrm{SO}}_{4}$$.
$$ {\mathrm{P}}_{2}{\mathrm{O}}_{5}+ {\mathrm{Al}}_{2}{\mathrm{O}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to } 2{\mathrm{AlPO}}_{4}$$;
$$ 3{\mathrm{SO}}_{3} + 2\mathrm{Al}(\mathrm{OH}{)}_{3} \to {\mathrm{Al}}_{2}({\mathrm{SO}}_{4}{)}_{3} +3{\mathrm{H}}_{2}\mathrm{O}$$.
$$ \mathrm{Ca}(\mathrm{OH}{)}_{2} + {\mathrm{CO}}_{2} \to {\mathrm{CaCO}}_{3} \downarrow + {\mathrm{H}}_{2}\mathrm{O}$$;
$$ {\mathrm{SO}}_{3} + 2\mathrm{NaOH} \to {\mathrm{Na}}_{2}{\mathrm{SO}}_{4} + {\mathrm{H}}_{2}\mathrm{O}$$;
$$ {\mathrm{SO}}_{3} + \mathrm{NaOH} \to {\mathrm{NaHSO}}_{4}$$.
Кислотные оксиды слабых кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами:
$$ {\mathrm{Na}}_{2}\mathrm{O}+{\mathrm{CO}}_{2}\to {\mathrm{Na}}_{2}{\mathrm{CO}}_{3}$$;
`»CuO»+»CO»_2`$$ \overline{)\to }$$.
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
$$ {\mathrm{CO}}_{2} + \mathrm{C} \to 2\mathrm{CO}\uparrow $$;
$$ {\mathrm{SO}}_{2} + 2{\mathrm{H}}_{2}\mathrm{S} \to 3\mathrm{S}\downarrow + 2{\mathrm{H}}_{2}\mathrm{O}$$.
В состав амфотерного окcида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка `»ZnO»` может быть как основанием, так и кислотой (`»Zn»(«OH»)_2` и `»H»_2″ZnO»_2`). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства:
Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка `»ZnO»` может быть как основанием, так и кислотой (`»Zn»(«OH»)_2` и `»H»_2″ZnO»_2`). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства:
$$ \mathrm{ZnO} + {\mathrm{CO}}_{2} \to {\mathrm{ZnCO}}_{3}$$;
$$ \mathrm{ZnO} + {\mathrm{Na}}_{2}\mathrm{O} \to {\mathrm{Na}}_{2}{\mathrm{ZnO}}_{2}$$;
$$ \mathrm{ZnO} + 2{\mathrm{NaOH}}_{\left(\mathrm{расплав}\right)} \to {\mathrm{Na}}_{2}{\mathrm{ZnO}}_{2} + {\mathrm{H}}_{2}\mathrm{O}$$;
$$ \mathrm{ZnO} + 2\mathrm{NaOH} + {\mathrm{H}}_{2}\mathrm{O} \to {\mathrm{Na}}_{2}[\mathrm{Zn} (\mathrm{OH}{)}_{4}]$$;
$$ \mathrm{ZnO} + 2\mathrm{HCl} \to {\mathrm{ZnCl}}_{2} + {\mathrm{H}}_{2}\mathrm{O}$$.
Щелочные земли
| Ежемесячная техническая подсказка от Тони ХансенаПодписаться | Нет отслеживания ! Нет объявлений ! Вот почему эта страница загружается быстро! |
Весь глоссарий
200 меш |325 меш |3D-дизайн |3D-принтер |3D-слайсер |3D-печать на глине |3D-печать |Абразионная керамика |Кислотные оксиды |Агломерация |Щелочные |Щелочноземельные |Аморфные | пористость |Шаровая мельница |Бамбуковая глазурь |Основная глазурь |Основное покрытие для окунания глазури |Основные оксиды |Периодический рецепт |Биск |Битовое изображение |Черная сердцевина |Выкрашивание красок |Смешивание блендером |Волдыри |Вздутие |Влучение |Костяной фарфор |Борат |Боровый синий |Борная фритта |Боросиликат |Разрушающая глазурь |Нанесение глазури кистью |Прокаливание |Расчетное тепловое расширение |Свечение |Выгорание углерода |Глазурь с углеродной ловушкой |Номера CAS |Отливка-отсадка |Селадоновая глазурь |Керамика |Керамическое связующее |Керамические наклейки |Керамическая глазурь |Керамическая глазурь Дефекты |Керамическая краска |Керамический материал |Окись керамики |Скольжение керамики |Керамическое пятно |Керамическая плитка |Керамика |Характеризация |Химический анализ |Цветность |Глина |Глиняная масса |Пористость глиняной массы |Глина для печей и обогревателей |Жесткость глины |Коэффициент Тер mal Расширение |Кодовая нумерация |Гончарная керамика |Коллоид |Краситель |Конус 1 |Конус 5 |Конус 6 |Конусная пластинка |Красная медь |Кордиерит Керамика |Кракл глазурь |Ползание |Крэйзинг |Кристобалит |Кристобалит Инверсия |Тигель |Кристаллические глазури |Кристаллизация | Cuerda Seca |Маркировка столовых приборов |Разложение |Дефлокуляция |Деоксилидрация |Digitalfire Foresight |Digitalfire Insight |Справочная библиотека Digitalfire |Глазурь с ямочками |Глазурь погружением |Глазурь погружением |Мойка в посудомоечной машине |Доломитовый матовый |Обжиг методом капельного замачивания |Сушка трещин |Эффективность сушки | Усадка при высыхании |Дунтинг |Пылепрессование |Фаянс |Высолы |Инкапсулированная морилка |Ангоб |Эвтектика |Быстровоспламеняющиеся глазури |Жировая глазурь |Полевошпатовые глазури |Оклеивающий агент |Огнеупорный кирпич |Фейерверк |Прочность при обжиге |График обжига |Усадка при обжиге |Пламенные изделия |Флокуляция |Флокуляция |Жидкие глазури расплава |Флюс |Безопасно для пищевых продуктов |Подошвенное кольцо |Метод формования |Соотношения формул |Вес формулы |Фритта |Fritware |Функциональность |Паспорта безопасности GHS |Стекло и кристаллическая глазурь |Стеклокерамическая глазурь es |Пузырьки глазури |Химия глазури |Сжатие глазури |Стойкость глазури |Подгонка глазури |Гелеобразование глазури |Нанесение глазури |Наслоение глазури |Смешивание глазури |Рецепты глазури |Усадка глазури |Толщина глазури |Глобально согласованные таблицы данных |Глянцевая глазурь |Прочность зеленого цвета |Grog |Глазурь из пушечной бронзы |Ручки |Высокотемпературная глазурь |Горячее прессование |Вырезанное украшение |Промышленная глина |Струйная печать |Остекление только внутри |Insight-Live |Интерфейс |Железно-красная глазурь |Посуда из яшмы |Отсадка |Каки |Контроллер печи |Печь Обжиг |Печные дымы |Система вентиляции печи |Промывка печи |Коварский металл |Ламинирование |Выщелачивание |Свинец в керамической глазури |Твердая кожа |Известковое напыление |Limit Formula |Limit Recipe |Liner Glaze |Liner glaze |LOI |Низкотемпературная глазурь |Lustre Colors |Майолика |Мраморность |Замена материала |Матовая глазурь |Зрелость |Максимальная плотность |МДТ |Механизм |Среднетемпературная глазурь |Текучесть расплава |Температура плавления |Оксиды металлов |Металлические глазури |Микроорганизмы |Микроволновая безопасность |Минеральная фаза |Минералогия |Мокко гла zes |Твердость по шкале Мооса |Моль% |Монокоттура |Мозаичная плитка |Крапчатая |Кристаллы муллита |Самородная глина |Безоксидная керамика |Масляная глазурь |После огневого остекления |Замутнитель |Непрозрачность |Посуда |Надглазурь |Окислительный обжиг |Формула оксида |Взаимодействие оксидов |Оксидная система |Ориентация частиц |Распределение частиц по размерам |Размеры частиц |PCE |Проницаемость |Фазовая диаграмма |Фазовое разделение |Физические испытания |Пинхолинг |Глины Plainsman |Гипсовая бита |Гипсовый стол |Пластилин |Пластичность |Выщипывание |Фарфор |Фарфоровый керамогранит |Заливка Глазурование | Обработка порошка | Осаждение | Первичная глина | Первичный обжиг | Пропан | Пропеллерный смеситель | Pugmill | Пирокерамика | Пирометрический конус | Инверсия кварца | Раку | Реактивные глазури | Восстановительный обжиг | Восстановительный спекл | Огнеупоры | Огнеупорные керамические покрытия | Репрезентативный образец | Вдыхаемый кристаллический Кремнезем |Посуда для ресторанов |Реология |Рутиловая глазурь |Солевой обжиг |Сантехнические изделия |Скульптура |Вторичная глина |Шино глазури |Дрожь |Сито |Вибросито |Соотношение диоксида кремния:глинозема | Трафаретная печать |Спекание |Гашение |Шликерное литье |Шликерное литье |Шлам |Обработка шлама |Растворение суспензии |Замачивание |Растворимые красители |Растворимые соли |Удельный вес |Расщепление |Остекление распылением |Среда окрашивания |Герамита |Stull Chart |Сульфатная пена |Сульфаты |Площадь поверхности |Поверхностное натяжение |Подвеска |Топперная глина |Tenmoku |Terra Cotta |Terra Sigilatta |Испытательная печь |Теоретический материал |Теплопроводность |Тепловой удар |Термопара |Тиксотропия |Метание |Тони Хансен |Токсичность |Торговля людьми |Прозрачность |Прозрачная глазурь | Смешивание трехосной глазури |Ultimate Particles |Подглазурная глазурь |Формула единства |Upwork |Разнообразие |Вязкость |Стекловидность |Витрификация |Летучие вещества |Деформация |Вода в керамике |Копение в воде |Растворимость в воде |Расклинивание |Белая посуда |Глазурь из древесной золы |Обжиг древесины |Zero3 |Zero4 |Дзета-потенциал
Относится к группе керамических флюсовых оксидов, которые придают свойства, аналогичные обожженным глазури. Они контрастируют с щелочами, которые являются более сильными флюсами.
Они контрастируют с щелочами, которые являются более сильными флюсами.
Детали
Химия глазури моделирует обожженную глазурь как состоящую из оксидов, разложившихся из материалов по рецепту. Свойства глазури при обжиге (например, температура плавления, тепловое расширение, характер поверхности, равномерный цвет) являются результатом оксидного состава (химии). Оксиды сгруппированы по-разному, чтобы упростить установление взаимосвязи между химическим составом глазури и тем, что происходит при ее обжиге. Эта группа является хорошим примером.
Обычные щелочноземельные металлы представляют собой плавящиеся при средних и высоких температурах печи оксиды: MgO, CaO, SrO, BaO, ZnO. Они не так активны, как щелочи, но имеют гораздо меньшее тепловое расширение. Они также имеют тенденцию создавать матовые глазури, когда присутствуют достаточные количества и химический состав глазури-хозяина имеет правильный баланс. Таким образом, имеет смысл заменить их друг на друга, чтобы сохранить общий характер глазури, но точно настроить конкретное свойство, которое одно предпочитает другому.
Хотя в общем смысле каждый из этих оксидов может придавать глазури матовость, каждый из них имеет свой собственный механизм, создающий визуальное явление, которое может варьироваться в зависимости от диапазона температур (например, кристаллизация, рябь на поверхности, множественные фазы расплава). Матовые глазури довольно сложно составить, оксидный баланс для создания эффекта может быть хрупким и легко превратиться в глянец. Конечно, каждый из этих оксидов может присутствовать и в глянцевой глазури, и, таким образом, стабильность этого матового эффекта варьируется.
Дополнительная информация
Ссылки
| Глоссарий | щелочь |
|---|---|
| Глоссарий | Керамический оксид В химии глазури оксид является основной единицей формул и анализов. Знание того, какие материалы поставляют оксид и как он влияет на обожженное стекло или глазурь, является ключом к контролю.  |
| Глоссарий | Матовая глазурь Случайные смеси материалов, которые хорошо плавятся, в подавляющем большинстве случаев хотят быть глянцевыми, создание матовой глазури, которая также функциональна, — непростая задача. |
| Оксиды | BaO — оксид бария, бария |
| Оксиды | CaO — оксид кальция, кальций |
| Оксиды | MgO — оксид магния, магнезия |
| Оксиды | SrO — оксид стронция, стронций |
| Автор: Тони Хансен Следуйте за мной на |
Расскажите нам, как улучшить эту страницу
Или задайте вопрос, и мы изменим эту страницу, чтобы лучше ответить на него.
Адрес электронной почты
Имя
Субъект
Сообщение
Сообщение Введите это, чтобы доказать, что вы не робот, или Обновить
Оставьте следующее пустым
https://digitalfire.
 com, все права защищены
com, все права защищены Политика конфиденциальности
6 Щелочноземельные металлы и их оксиды
Лиза К. Росс | 0 комментарий
Шесть щелочноземельных металлов и их оксидов
Просмотры сообщений: 254
Введение
Существует 6 щелочноземельных металлов, и их можно найти во 2 группе периодической таблицы. Эти шесть щелочноземельных металлов имеют сходные характеристики. Например, все они имеют блестящий и серебристо-белый вид. Щелочноземельные металлы образуют оксиды при взаимодействии с кислородом. До 19 века оксиды щелочноземельных металлов считались самими элементами. Это означает, что в то время образец оксида кальция распознавался не как оксид, а как сам кальций. В этой статье будут представлены эти 6 элементов и их оксиды.
Шесть щелочноземельных металлов и их оксиды
Бериллий (Be) и оксид бериллия (BeO)
Бериллий — относительно редкий щелочноземельный металл. Этот элемент является твердым при комнатной температуре. Известно также, что он становится хрупким при комнатной температуре. Бериллий — химически активный элемент. При воспламенении он реагирует с кислородом с образованием оксида бериллия.
Известно также, что он становится хрупким при комнатной температуре. Бериллий — химически активный элемент. При воспламенении он реагирует с кислородом с образованием оксида бериллия.
Оксид бериллия также называют бериллием. Как упоминалось ранее, он образуется при воспламенении бериллия. Однако его также можно получить путем дегидратации гидроксида бериллия или обжига карбоната бериллия. Оксид бериллия имеет белый цвет. Среди неметаллов он имеет вторую по величине теплопроводность. Кроме того, он имеет характерный сладкий вкус, за что получил название глюцина.
BE (OH) 2 → BEO+H 2 O
BECO 3 → BEO+CO 2
99009
9.1015 (MAGINES4 9.1014 9.1014141414 9.1014 9014 9.1014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9014 9. 9.1914 9.1914 9.1914 9.1914 9.1914 9.1914 9014 9.1914 9.1914. Магний твердый при комнатной температуре с блестящим серым оттенком. Интересно, что это распространенный химический элемент. При 923 К и 1363 К магний имеет наименьшую температуру плавления и кипения из всех щелочноземельных металлов.
Интересно, что это распространенный химический элемент. При 923 К и 1363 К магний имеет наименьшую температуру плавления и кипения из всех щелочноземельных металлов.Оксид магния, также известный как магнезия, представляет собой тип керамического материала. Он белый и твердый при комнатной температуре, как и большинство оксидов щелочноземельных металлов. Оксид магния обычно образуется, когда магний реагирует с воздухом, а также может образовываться при прокаливании гидроксида магния или карбоната магния.
мг (OH) 2 → MGO+H 2 O
MGCO 3 → MGO+CO 2 → MGO+CO 2
9. Кальций (Ca) Оксид кальция (CaO)
Кальций занимает пятое место в списке самых распространенных элементов в земной коре. Это высокореактивный элемент серебристо-белого цвета. Этот элемент является твердым при комнатной температуре. Он кипит при 1757 К и плавится при 1115 К. Когда кальций реагирует с кислородом воздуха, он образует оксид кальция.
Когда кальций реагирует с кислородом воздуха, он образует оксид кальция.
Соединение CaO также известно как негашеная известь. Это универсальное соединение, которое широко используется в различных отраслях промышленности. Оксид кальция образуется при прокаливании карбоната кальция. Этот процесс выделяет CO2 в качестве побочного продукта.
CaCO3 → CaO + CO2
Стронций (Sr) и оксид стронция (SrO)
Стронций является одним из более тяжелых щелочноземельных металлов. Он мягкий и имеет серебристо-белый желтоватый оттенок. Плотность стронция составляет около 2,64 г/см3. Этот щелочноземельный металл является твердым при комнатной температуре. Его температура плавления составляет 1050 К, а температура кипения — 1650 К.
Оксид стронция, также известный как стронций, образуется при горении стронция на воздухе. Он также образуется при разложении карбоната стронция. Плотность оксида стронция составляет около 4,70 г/см3. Кроме того, оксид стронция имеет температуру плавления 2804 К и температуру кипения 3470 К.
SrCO3 → SrO + CO2
Барий (Ba) и оксид бария (BaO)
Этот серебристый элемент является пятой щелочной земляной металл. Это очень реактивный химический элемент. Из-за высокой реакционной способности барий практически не встречается в чистом виде в природе. Он обычно присутствует в природе в виде соединения. Барий — отличный проводник электричества.
Оксид бария обычно получают нагреванием карбоната бария с коксом или термическим разложением нитрида бария. Это соединение гигроскопично и имеет белый цвет. Он может вызвать раздражение при попадании в глаза или на кожу. Кроме того, он может привести к осложнениям или даже смерти при приеме внутрь. Несмотря на все свои вредные побочные эффекты, оксид бария имеет свои преимущества в качестве покрытия.
BaOCO3 → BaOO + CO2
Ba3N2 + 3Na2O → 3BaO + 2Na3N
Радий (Ra) и оксид радия (RaO)
Радий является шестым щелочноземельным металлом. Это высокорадиоактивный химический элемент. Радий обычно находится в твердом состоянии при комнатной температуре. Он испаряется при 2010 К и плавится при 973 К.
Это высокорадиоактивный химический элемент. Радий обычно находится в твердом состоянии при комнатной температуре. Он испаряется при 2010 К и плавится при 973 К.
Хотя оксиды являются соединениями, общими для других щелочноземельных металлов, оксид радия (RaO) не был охарактеризован задолго до его существования.
Применение щелочноземельных металлов и их оксидов
Медицина и стоматологияЩелочноземельные металлы обычно используются в здравоохранении. Бериллий часто используется в качестве компонента зубных имплантатов. Радий и стронций используются для радиоактивной терапии при лечении рака. Кроме того, оксид магния иногда используется для изготовления антацидов и слабительных средств.
Аэрокосмическая промышленность Щелочноземельные металлы, такие как магний и бериллий, обычно используются в аэрокосмических конструкциях. Они используются в производстве компонентов аэрокосмической промышленности из-за их легкого веса.
Магний, бериллий, кальций и барий часто добавляют к алюминию для получения сплавов с желаемыми свойствами. Они также используются в производстве стальных сплавов и подшипниковых сплавов.
Электроника
Щелочноземельные металлы и их оксиды обычно используются в производстве электроники. Оксид магния используется в качестве изолятора в некоторых электронных устройствах. Оксид бериллия, с другой стороны, используется в качестве полупроводникового компонента в радиооборудовании.
Пищевая добавкаОксид кальция и оксид магния обычно используются в качестве пищевых добавок. Оксид магния часто используется в качестве противослеживающего агента при производстве какао-порошка. Оксид кальция используется как разрыхлитель. Он также используется для регулирования кислотности пищи.
Автомобили Магний используется в кузовах некоторых автомобилей. Кроме того, магний и бериллий также используются в производстве автомобильных двигателей, а кальций иногда используется для изготовления аккумуляторов.
Кроме того, магний и бериллий также используются в производстве автомобильных двигателей, а кальций иногда используется для изготовления аккумуляторов.
Оксид магния обычно химически и физически стабилен при высоких температурах. Это делает его пригодным в качестве огнеупорного материала.
Дополнительная информация: Является ли оксид магния (MgO) огнеупорным материалом?
Строительство зданийОксид кальция является важным компонентом цемента и бетона. Эти материалы используются в строительстве неотъемлемых частей зданий.
Вывод Щелочноземельные металлы и их оксиды в основном проявляют схожие свойства, что связано с относительно схожим химическим строением металлов. Тем не менее, они также имеют различные свойства, которые делают их подходящими для различных отраслей промышленности. Они широко используются в аэрокосмической промышленности, на строительных площадках, в автомобильной промышленности и в области медицины, а также в ряде других секторов. Для получения дополнительной информации о современных материалах посетите https://www.preciseceramic.com/.
Для получения дополнительной информации о современных материалах посетите https://www.preciseceramic.com/.
Похожие сообщения:
Является ли оксид магния (MgO) огнеупорным материалом?
Применение керамики из карбида кремния в этих 4 отраслях промышленности
Как сделать гексагональный порошок нитрида бора?
Как изготавливаются керамические компоненты? (С инфографикой)
Теги: оксиды щелочноземельных металлов, щелочноземельные металлы, щелочноземельные металлы и их оксиды, оксид бериллия, оксид магния, шесть щелочноземельных металлов и их оксиды
Характеристики соединений щелочноземельных металлов
Все элементы, существующие в природе, расположены в периодической таблице после нескольких лет исследовательской работы, они размещены в группы и строки на основе некоторых заранее определенных критериев. Некоторые элементы могут не соответствовать критериям, но тем не менее они помещаются в один и тот же столбец или группу из-за сходства их массовых чисел или сходства свойств.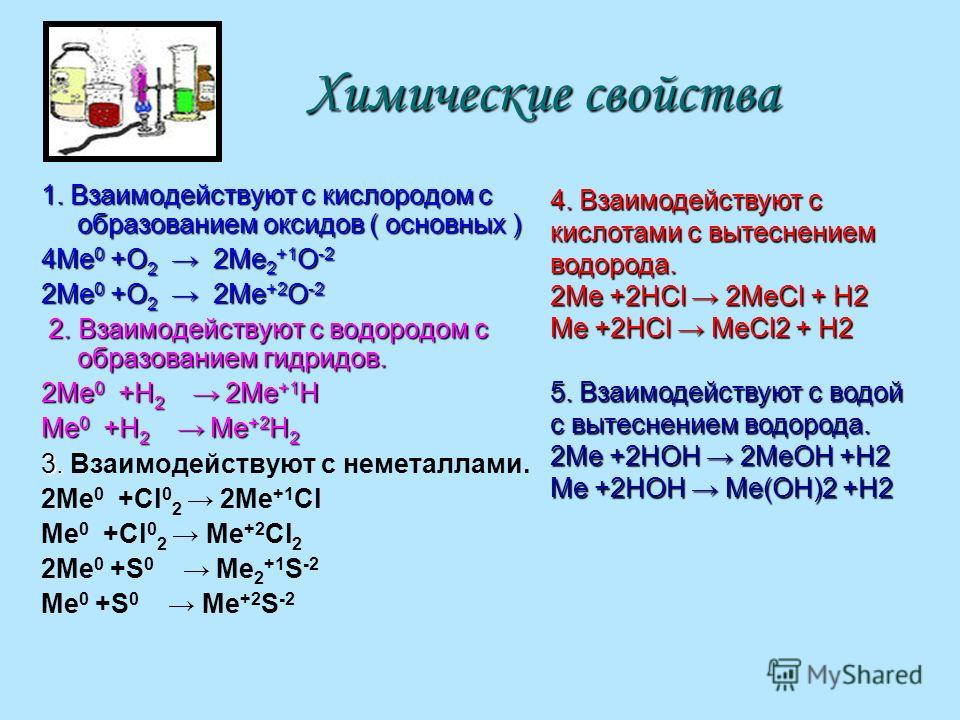 Щелочноземельные металлы помещены во 2-ю группу, в эту группу входят следующие элементы: бериллий, магний, кальций, стронций, барий и радий. Бериллий имеет свойства, отличные от остальных элементов, и следует диагональному соотношению с алюминием.
Щелочноземельные металлы помещены во 2-ю группу, в эту группу входят следующие элементы: бериллий, магний, кальций, стронций, барий и радий. Бериллий имеет свойства, отличные от остальных элементов, и следует диагональному соотношению с алюминием.
- Радиусы: Атомы имеют два типа радиусов: металлический радиус и ионные радиусы. Атомные и ионные радиусы следуют одной и той же тенденции, что означает, что атомный размер щелочноземельных металлов увеличивается вниз по группе. Металлические радиусы больше ионных радиусов. Оба следуют одной и той же тенденции сверху вниз, а также слева направо в периодической таблице.
Be< Mg< Ca< Sr< Ba< Ra
- Энтальпия ионизации: Энтальпия ионизации бывает двух типов: энтальпия ионизации (I) и энтальпия ионизации (II). Энтальпия ионизации (II) каждого элемента больше энтальпии ионизации (I), хотя обе энтальпии выше энтальпий ионизации щелочных металлов.
 Энтальпия ионизации (I) и энтальпия ионизации (II) уменьшаются вниз по группе.
Энтальпия ионизации (I) и энтальпия ионизации (II) уменьшаются вниз по группе.
Be> Mg> Ca> Sr> Ba> Ra
- Электронная конфигурация: Электронная конфигурация щелочноземельных металлов может быть представлена благородным газом, а два валентных электрона размещены на s-орбитали. Таким образом, представление выглядит как [благородный газ] ns 2 .
- Стандартный потенциал: Стандартный потенциал щелочноземельных металлов следует противоположной тенденции, поскольку атомный размер означает, что отрицательный стандартный потенциал ионов уменьшается вниз по группе по мере увеличения атомного размера.
Be> Mg> Ca> Sr> Ba> Ra
Физические свойства щелочноземельных металлов- Щелочноземельные металлы по своей природе блестящие.
- Эта категория элементов относится к мягким металлам, так как почти все элементы этой группы являются мягкими.

- Температура плавления и кипения щелочноземельных металлов значительно выше, чем у щелочных металлов.
- Под воздействием тепла электроны возбуждаются, и когда они возвращаются на свои энергетические уровни, они окрашиваются в разные цвета.
- Эти металлы имеют свободные электроны, что делает их проводящими по своей природе.
- Щелочноземельные металлы обладают высокой энергией ионизации.
- Бериллий и магний из этой группы не дают окраски при воздействии пламени, так как электроны в этих элементах прочно связаны.
- Щелочноземельные металлы имеют большую плотность, чем щелочные металлы.
- Среди щелочноземельных металлов плотность радия самая высокая.
- Эти металлы в основном гидратированы по своей природе.
- Щелочноземельные металлы реагируют с водой с образованием гидроксидов. Среди элементов 2 группы Be и Mg являются единственными элементами, которые не реагируют с водой из-за защитного слоя, который образовался на поверхности этих щелочных металлов.

- Они также реагируют с воздухом с образованием различных оксидов металлов. Среди элементов 2 группы Be и Mg являются единственными элементами, которые не реагируют с воздухом также из-за защитного слоя, который образовался на поверхности этих металлов.
- Эти элементы реагируют с группой галогенов, состоящей из фтора, хлора, брома и йода, с образованием соответствующих галогенидов.
M + X 2 → MX 2
(где X — галоген, а M — щелочноземельный металл)
- При нагревании щелочноземельные металлы могут реагировать с образованием соответствующих гидридов. Гидрид кальция также известен как Hydrolith. Гидриды щелочноземельных металлов представляют собой гидриды металлов, за исключением Be и Mg, которые образуют ковалентные гидриды.
X + H 2 → 2XH 2
(где X — щелочноземельный металл)
- Эти элементы имеют тенденцию реагировать с кислотами с выделением газообразного водорода.

X + 2HCl → XCl 2 + H 2
- Природа щелочноземельных металлов носит восстановительный характер.
- Щелочноземельные металлы образуют карбиды при взаимодействии с углеродом.
X + 2C → XC 2 XC 2
(где X — щелочноземельный металл, кроме Be)
XC 2 XC 2 + 2H 2 O → X (OH) 2 + C 2 H 2 9004 2 H 2 9004
333333333333333333333333333333330 гг.- Магний в основном используется в фейерверках из-за его свойств горения.
- Магний также используется в лекарствах для изготовления таблеток, применяемых при осложнениях беременности.

- Изотопы радия используются в ядерных реакторах.
- Кальций используется в производстве цемента.
- Барий используется при изготовлении свечей зажигания для автомобилей.
- Кальций используется для производства карбида кальция, который, в свою очередь, используется для изготовления различных видов пластмасс.
- Щелочноземельные металлы выделяют газообразный водород при взаимодействии с кислотами, этот газообразный водород можно использовать для других целей.
- Щелочноземельные металлы используются в производстве различных типов элементов, известных как щелочные топливные элементы (AFC).
- Стронций используется в процессе рафинирования цинка и в производстве магнитов.
- Стронций также используется в лакокрасочной промышленности для изготовления специальных красок, светящихся в темноте.
Характеристики соединений, образованных щелочноземельными металламиДва или более элемента соединяются с образованием соединений, поэтому щелочноземельные металлы образуют ионные соединения, поскольку щелочноземельные металлы относятся к группе 2 и имеют степень окисления +2.
Оксиды
Щелочноземельные металлы могут образовывать соответствующие оксиды при взаимодействии с кислородом. Эти оксиды имеют ионную природу. Структура этих оксидов относится к типу каменной соли. Барий — единственный элемент среди щелочноземельных металлов, который образует перекись, а не окись. Эти оксиды являются основными по своей природе. Эти оксиды, за исключением оксида магния, имеют ионную природу, но оксид магния имеет ковалентную природу.
X + O 2 → 2XO
(где X – щелочноземельный металл)
Гидроксиды
Оксиды щелочноземельных металлов при взаимодействии с водой образуют гидроксиды. Эти гидроксиды также являются основными по своей природе и также термически стабильны. Эти гидроксиды могут быть растворены в воде.
XO + H 2 O → X(OH) 2
(где X — щелочноземельный металл)
Галогениды
фтор, хлор, бром и йод с образованием соответствующих галогенидов.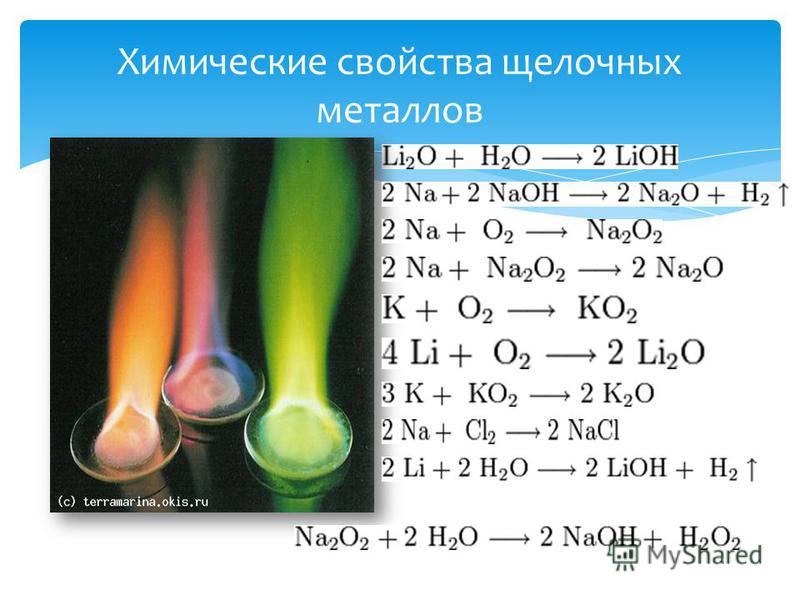 Эти галогениды являются ионными по своей природе, за исключением галогенида бериллия, который является ковалентным по своей природе. Эти галогениды могут растворяться в воде, за исключением фторидов, поскольку они нерастворимы в воде. Эти галогениды можно использовать для многих целей, например, в качестве дегидратирующих агентов. Большинство этих галогенидов встречается с кристаллизационной водой. В твердой фазе галогениды не могут находиться в виде отдельных молекул, кроме Be.
Эти галогениды являются ионными по своей природе, за исключением галогенида бериллия, который является ковалентным по своей природе. Эти галогениды могут растворяться в воде, за исключением фторидов, поскольку они нерастворимы в воде. Эти галогениды можно использовать для многих целей, например, в качестве дегидратирующих агентов. Большинство этих галогенидов встречается с кристаллизационной водой. В твердой фазе галогениды не могут находиться в виде отдельных молекул, кроме Be.
Щелочноземельные металлы также могут образовывать соли в виде карбонатов, сульфатов и нитратов.
Карбонаты
Щелочноземельные металлы могут образовывать карбонаты. Эти карбонаты имеют основную природу и при воздействии тепла разлагаются с выделением углекислого газа. Карбонаты могут образовываться, если гидроксиды щелочноземельных металлов вступают в реакцию с углекислым газом, тогда карбонаты будут образовываться вместе с водой. Эти карбонаты не могут быть растворены в воде из-за их нерастворимой природы. Карбонаты щелочноземельных металлов находятся в твердой фазе и эти карбонаты устойчивы к нагреванию. Бикарбонаты могут быть легко образованы из карбонатов при взаимодействии их с CO 2 также эти карбонаты имеют ионную природу.
Карбонаты щелочноземельных металлов находятся в твердой фазе и эти карбонаты устойчивы к нагреванию. Бикарбонаты могут быть легко образованы из карбонатов при взаимодействии их с CO 2 также эти карбонаты имеют ионную природу.
x (OH) 2 + CO 2 → XCO 3 + H 2 O
Sulphates
Alkaline. Эти сульфаты устойчивы к нагреванию и имеют белый цвет. Эти сульфаты находятся в твердой фазе и легко растворяются в воде. Тенденция растворимости сульфатов щелочноземельных металлов зависит от энтальпии гидратации, которая имеет заданный тренд Be > Mg > Ca > Sr > Ba > Ra, поэтому соответствующие сульфаты также следуют той же закономерности:
BeSO 4 > MgSO 4 > CaSO 4 > SrSO 4 > BaSO 4 > RaSO 4
Nitrates
Nitrates of alkaline earth metals can be formed by mixing карбонаты в азотной кислоте, кроме карбонатов, оксидов и гидроксидов, также могут быть использованы с азотной кислотой для образования нитратов. Используемая азотная кислота должна быть разбавленной. Нитраты растворимы в воде. Эти нитраты неустойчивы к нагреванию и разлагаются при нагревании до соответствующих оксидов щелочноземельных металлов. Нитраты при разложении под действием тепла образуют кислород, оксид металла и диоксид азота коричневого цвета.
Используемая азотная кислота должна быть разбавленной. Нитраты растворимы в воде. Эти нитраты неустойчивы к нагреванию и разлагаются при нагревании до соответствующих оксидов щелочноземельных металлов. Нитраты при разложении под действием тепла образуют кислород, оксид металла и диоксид азота коричневого цвета.
2x (№ 3 ) 2 → 2xo + 4no 2 + O 2
Образец 99 . Объяснять.Ответ:
Бериллий и магний не реагируют с водой или кислородом, так как эти элементы защищены слоем оксидной пленки, образующейся на их поверхности. Но бериллий и магний реагируют с кислородом, когда они находятся в порошкообразной форме.
Вопрос 2: Как можно проверить щелочноземельные металлы?
Ответ:
Щелочноземельные металлы можно проверить, растворив их в жидком аммиаке, так как в жидком аммиаке они дают темно-синий черный цвет.
Аммиаки образуются при растворении щелочноземельных металлов в растворе аммиака.
Вопрос 3: Как образуется BeH 2 ?
Ответ:
Бериллий не соединяется с водородом с образованием гидрида, поэтому BeH 2 не может быть образован непосредственно с водородом, однако мы можем получить BeH 2 реакцией BeCl 2 с LiAlH 4 .
2BeCl 2 + LiAlH 4 → 2BeH 2 + LiCl + AlCl 3
Вопрос 4: Какова природа оксида бериллия?
Ответ:
Гидроксид бериллия (Be(OH) 2 ) является амфотерным по своей природе, так как реагирует как с кислотой, так и с основанием.
BE (OH) 2 + 2OH — → [BE (OH) 4 ] 2- ION
2 9 2 9 2 9 2 9 2 9 2 2 2.

 Очевидно, что валентные
электроны щелочных металлов могут
быть легко удалены, потому
что атому энергетически
выгодно отдать электрон и приобрести конфигурацию инертного
газа.
Поэтому для всех щелочных металлов
характерны восстановительные свойства. При
растворении щелочных металлов в воде
образуются растворимые гидроксиды,
называемые щелочами. Важным
продуктом, содержащим щелочной металл,
является сода
Na2CO3 (карбонаты).
Очевидно, что валентные
электроны щелочных металлов могут
быть легко удалены, потому
что атому энергетически
выгодно отдать электрон и приобрести конфигурацию инертного
газа.
Поэтому для всех щелочных металлов
характерны восстановительные свойства. При
растворении щелочных металлов в воде
образуются растворимые гидроксиды,
называемые щелочами. Важным
продуктом, содержащим щелочной металл,
является сода
Na2CO3 (карбонаты). Имея два валентных электрона,
щелочноземельные металлы легко их
отдают, и во всех соединениях имеют
степень окисления +2 (очень редко +1).
Химическая активность щелочноземельных
металлов растёт с ростом порядкового
номера. Используются
в черной металлургии. Оксиды
и гидроксиды щелочноземельных металлов
имеют тенденцию к усилению основных
свойств с ростом порядкового номера.
Имея два валентных электрона,
щелочноземельные металлы легко их
отдают, и во всех соединениях имеют
степень окисления +2 (очень редко +1).
Химическая активность щелочноземельных
металлов растёт с ростом порядкового
номера. Используются
в черной металлургии. Оксиды
и гидроксиды щелочноземельных металлов
имеют тенденцию к усилению основных
свойств с ростом порядкового номера. Это необходимо для нормального
обмена веществ, что в свою очередь
предопределяет хорошее самочувствие
и высокую работоспособность человека.
Это необходимо для нормального
обмена веществ, что в свою очередь
предопределяет хорошее самочувствие
и высокую работоспособность человека.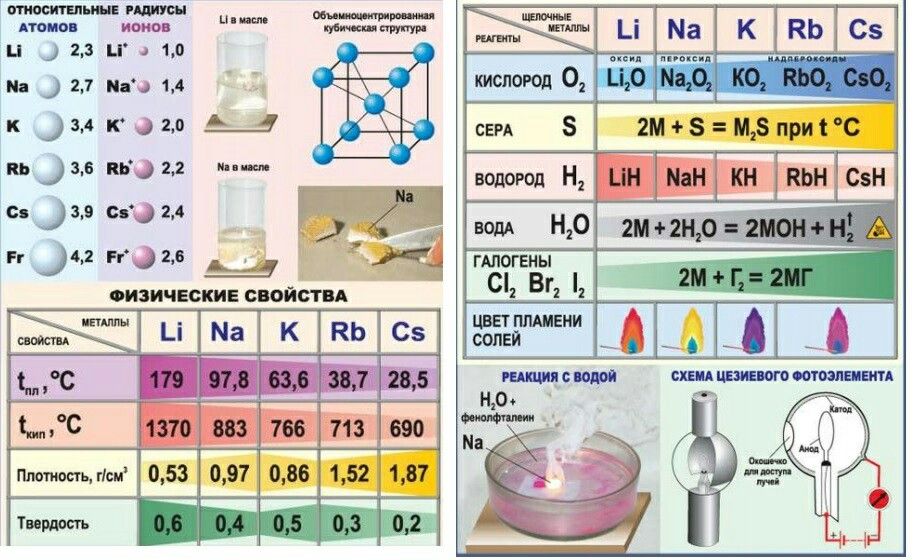 Применение находят сплавы германия и
стёкла на основе диоксида германия.
Применение находят сплавы германия и
стёкла на основе диоксида германия. Энтальпия ионизации (I) и энтальпия ионизации (II) уменьшаются вниз по группе.
Энтальпия ионизации (I) и энтальпия ионизации (II) уменьшаются вниз по группе.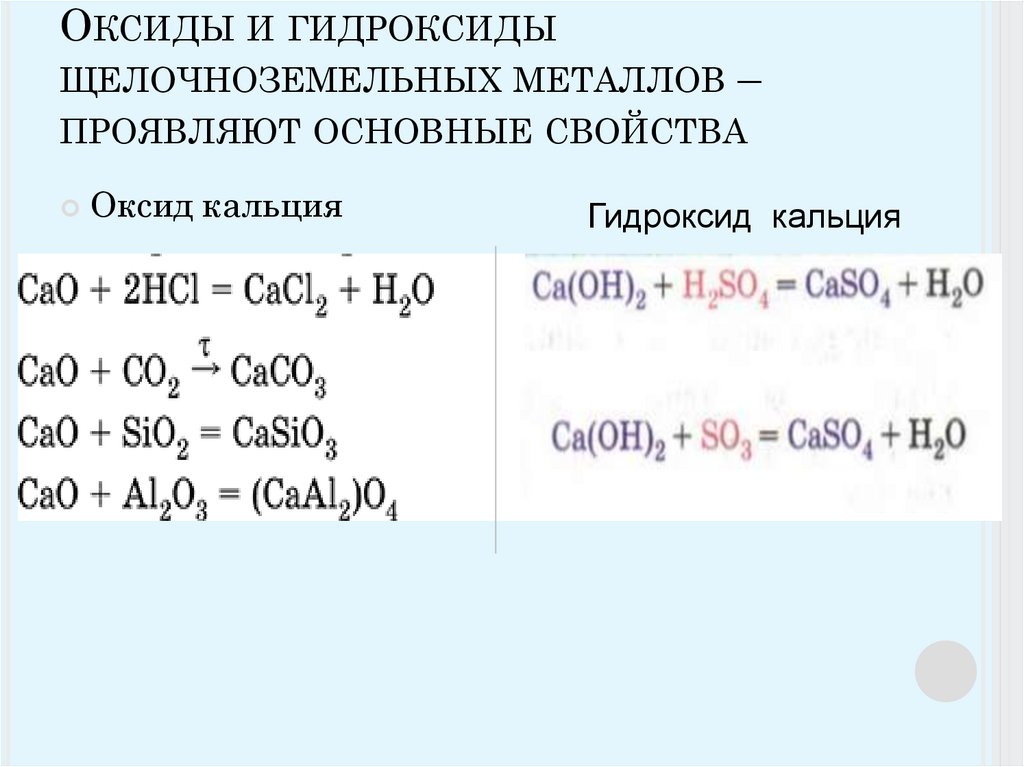




 Аммиаки образуются при растворении щелочноземельных металлов в растворе аммиака.
Аммиаки образуются при растворении щелочноземельных металлов в растворе аммиака.