Оксид бария — frwiki.wiki
«BaO» перенаправляется сюда. Для других значений см. Бао .
Оксид бария , ранее известный как барит , является оксидом элемента бария , из формулы BaO. Он присутствует при комнатной температуре в виде сильно гидрофильного белого порошка, поэтому его следует хранить вдали от окружающего воздуха.
Резюме
- 1 Реакционная способность
- 2 Производство
- 3 использования
- 4 Опасность
- 5 Примечания и ссылки
- 6 Статьи по теме
Реактивность
Это гигроскопичное соединение реагирует с водой с образованием гидроксида бария в соответствии с реакцией:
- ВаО + Н 2 О → Ва (ОН) 2 .
Он может взорваться при контакте с влагой, углекислым газом или сероводородом .
Производство
Есть несколько путей синтеза, например:
- нагрев смеси карбоната бария с коксом , сажей или дегтем ;
- Прокаливание из нитрата бария ;
- прокаливание минерала витерита : BaCO
- реакция бария с кислородом : 2Ba + O 2 + тепло → 2BaO.

Использует
В 1880-х годах он был предшественником процесса производства высокотемпературного дикислорода, известного как «процесс Брина», основанного на исследованиях Тенара и Жана-Батиста Буссинго . Сегодня этот оксид используется для осушки газов и растворителей . Он также используется в качестве добавки в специальные стекла, такие как краун- барий и кремневый барий .
Опасность
Оксид бария токсичен, вызывает коррозию и растворяется в воде, поэтому с ним следует обращаться с большой осторожностью. На кожу и слизистые оболочки это соединение может оказывать едкое действие.
Примечания и ссылки
- ↑ а б в г д и е Лист Сигма-Олдрича составного оксида бария , консультированный 31 августа 2013 г.
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ↑ a b и c (en) Лист Acros Organics, посвященный составу оксида бария , по состоянию на 31 августа 2013 г.

- ↑ а б гр и д листа INRS Барий соединения и н о 125, 2012, доступ к которым 31 августа 2013
- ↑ Адольф Лежаль, Алюминий, марганец, барий, стронций, кальций и магний , Париж, Ж.-Б. Байер,, 357
- ↑ Бариевый порошок является пирофорным , легковоспламеняющимся и взрывоопасным материалом при контакте с кислородом или влагой воздуха и теплом.
- ↑ Поль Пуаре, « Научный разговор. », Учебное обозрение , т. 18,, стр. 549-560 (education.persee.fr/doc/revpe_2021-4111_1891_num_18_1_3248).

- ↑ Доктор Тисон, » Scientific Chronicle «, Revue du monde catholique , III, vol. 16, п о 92, первые две недели августа, 1882 г., стр. 266–281
Статьи по Теме
- Список осушителей
- Оптическое стекло
Соединения бария | |
|---|---|
| BaB 6 · Ba (BO 2 ) 2 и β-Ba (BO 2 ) 2 · BaBr 2 · Ba (CH 3 CO 2 ) 2 · Ba (C 5 H 7 O 2 ) 2 · Ba (ClO) 2 · Ba ( ClO 2 ) 2 · BaCO 3 · BaC 2 O 4 · Ba (ClO 3 ) 2 · Ba (ClO 4 ) 2 · Ba (CN) 2 · BaCl 2 · BaCrO 4 · BaF 2 · BaFeO 4 · BaFe 2 O 4 · Bai 2 · Ba (IO |
Оксиды | |
|---|---|
| Различные состояния | Четырехокись сурьмы ( Sb 2 O 4 ) · Оксид серебра (I, III) ( Ag O) · Оксид кобальта (II, III) ( Co 3 O 4 ) · Оксид железа (II, III) ( Fe 3 O 4 ) Трехводородный монооксид (H 3 O) · Оксид марганца (II, III) ( Mn 3 O 4 ) · Оксид свинца (II, IV) ( Pb 3 O 4 ) |
| Степень окисления +1 | Оксид серебра ( Ag 2 O) · оксид дикарбона ( C 2 O) · оксид меди (I) ( Cu 2 O) · оксид хлора ( Cl 2 O) · оксид лития ( Li 2 O) · оксид калия ( K 2 O) · Оксид натрия ( Na 2 O) · оксид рубидия ( Rb 2 O) · оксид таллия (I) ( Tl 2 O) · вода ( H 2 O) и другие оксиды водорода |
| Степень окисления +2 | Оксид алюминия (II) ( Al O) · оксид бария ( Ba O) · оксид бериллия ( Be O) · оксид кадмия ( Cd O) · оксид кальция ( Ca O) · оксид углерода ( C O) · оксиды кобальта (II ) ( Co O) · оксиды хрома (II) ( Cr O) · оксид меди (II) ( Cu O) · оксид германия ( Ge O) · оксид железа (II) ( Fe O) · оксид иридия ( Ir O) · Оксид магния ( Mg O) · оксид ртути (II) ( Hg O) · оксид никеля (II) ( Ni O) · оксид азота ( N O) · оксид палладия (II) ( Pd O) · оксид свинца (II) ( Pb O) · оксид стронция ( Sr O) · оксид серы ( S O) · диоксид серы ( S |
| Степень окисления +3 | Полуторный оксид актиния ( Ac 2 O 3 ) · оксид алюминия ( Al 2 O 3 ) · триоксид сурьмы ( Sb 2 O 3 ) · триоксид мышьяка ( As 2 O 3 ) · оксид висмута (III) ( Bi 2 O 3 ) · триоксид бора ( B 2 O 3 ) · оксид хрома (III) ( Cr 2 O 3 ) · оксиды кюрия (III) (Cm 2 O 3)) · Триоксид диазота ( N 2 O 3 ) · оксид эрбия (III) ( Er 2 O 3 ) · Оксиды европия (III) ( Eu 2 O 3 ) · оксид железа (III) ( Fe 2 O 3 ) · оксид гадолиния (III) ( Gd 2 O 3 ) · оксид галлия (III) ( Ga 2 O 3 ) · оксид, гольмий (III) ( Ho 2 O 3 ) · оксид индия (III) ( в 2 O 3 ) · оксид иридий (III) ( Ir 2 O 3 ) · оксид лантана ( La 2 O 3 ) · оксиды лютеция (III) ( Lu 2 O 3 ) · оксид неодима (III) ( Nd 2 O 3 ) · оксид никеля (III) ( Ni 2 O 3 ) · триоксид фосфора ( P 4 O 6 ) · оксид прометия (III) ( Pm 2 O 3 ) · оксид празеодима (III) ( Pr 2 O 3 ) · оксид родия (III) ( Rh 2 O 3 ) · Оксиды самария (III) ( Sm 2 O 3 ) · Оксид скандия ( Sc 2 O 3 ) · Оксид тербия (III) ( Tb 2 O 3 ) · Оксид таллия (III) ( Tl 2 O 3 ) · Оксид тулия (III) ( Tm |
| Степень окисления +4 | Диоксид углерода ( C O 2 ) · триоксид углерода ( C O 3 ) · оксид церия (IV) ( это O 2 ) · диоксид хлора ( Cl O 2 ) · диоксид хрома ( Cr O 2 ) · оксид кюрия (IV) (CmO 2) · Пероксид азота ( N 2 O 4 ) · диоксид германия ( Ge O 2 ) · оксид гафния (IV) ( Hf O 2 ) · оксид иридия (IV) ( Ir O 2 ) · диоксид свинца ( Pb O 2 ) · марганец диоксид ( Mn O 2 ) · диоксид азота ( N O 2 ) · оксиды нептуния (IV) ( Np O 2 ) · оксиды протактиния (IV) ( Pa O 2 ) · диоксид плутония ( Pu O 2 ) · оксид рения (IV) ( Re O 2 ) · оксид родия (IV) ( Rh O 2 ) · диоксид рутения ( Ru O 2 ) · диоксид селена ( If O 2 ) · диоксид кремния ( If O 2 ) · диоксид серы ( S O 2 ) · Диоксид олова ( Sn O 2 ) · диоксид теллура ( Te O 2 ) · диоксид тория ( Th O 2 ) · диоксид титана ( Ti O 2 ) · оксид вольфрама (IV) ( W O 2 ) · диоксид урана ( U O 2 ) · оксид ванадия (IV) ( V O 2 ) · диоксид циркония ( Zr O 2 ) |
| Степень окисления +5 | Пятиокись сурьмы ( Sb 2 O 5 ) · пятиокись мышьяка ( As 2 O 5 ) · пятиокись азота ( N 2 O 5 ) · пятиокись ниобия ( Nb 2 O |
| Степень окисления +6 | Триоксид хрома ( Cr O 3 ) · триоксид иридия ( Ir O 3 ) · триоксид молибдена ( Mo O 3 ) · триоксид рения ( Re O 3 ) · триоксид селена ( As O 3 ) · триоксид серы ( S O 3 ) · теллур триоксид ( Te O 3 ) · триоксид вольфрама ( W O 3 ) · триоксид урана ( U O 3 ) · триоксид ксенона ( Xe O 3 ) |
| Степень окисления +7 | Гептоксид хлора ( Cl 2 O 7 ) · гептоксид марганца ( Mn 2 O 7 ) · оксид рения (VII) ( Re 2 O 7 ) · оксиды технеция (VII) ( Tc 2 O 7 ) |
| Степень окисления +8 | Четырехокись осмия ( Os O 4 ) · четырехокись рутения ( Ru O 4 ) · четырехокись ксенона ( Xe O 4 ) · оксид иридия (VIII) ( Ir O 4 ) · четырехокись гассия ( Hs O 4 ) |
| похожие темы | Окись углерода · Двуокись хлора · Оксид · оксокислота · озонид |
<img src=»//fr.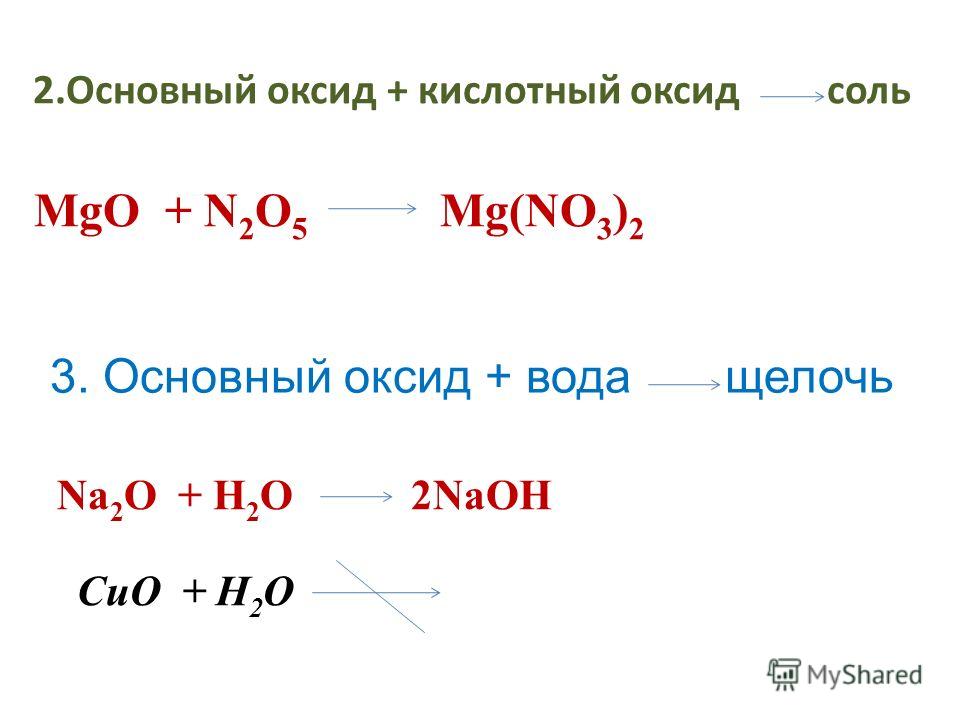 wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
оксид бария, оксид серы (vi), оксид алюминия и оксидом калия, гидроксидом калия, хлороводородом, оксидом
Химия, 24.08.2019 04:20, khokhlovakater
Ответ разместил: ДианаЧуклина
Bao + so3 -> baso4 bao + 2hcl -> bacl2 + h3o bao + h3o -> ba(oh)2 3so3 + al2o3 -> al2(so4)3 so3 + k2o -> k2so4 so3 +2 koh -> k2so4 + h3o so3 + h3o -> h3so4 al2o3 + 2koh -> 2kalo2 + h3o al2o3 + 6hcl -> 2alcl3 + 3h3o al2o3 + 3h3o -> 2al(oh)3 k2o + 2hcl -> 2kcl + h3o k2o + h3o -> 2koh
Спасибо
Ответ разместил: Гость
62,4 г х г
bacl2 + h3so4 = baso4 (осадок) + 2hcl
208 г/моль 233 г/моль
х = 62,4*233/208 = 69,9 г
ответ: образовалось 69,9 г baso4
Ответ разместил: Гость
а)
n(na2so3) = m(na2so3)/m(na2so3) = 6,3/126 = 0,05 моль
б)
n(ca3(po4)2) = m(ca3(po4)2)/m(ca3(po4)2) = 6,2/310 = 0,02 моль
в)
n(ag) = n(ag)/na = 3*10^23/6,02*1023 = 0,5 моль.
Другие вопросы по: Химия
Сколько различных пятизначных чисел можно получить из цифр 2,2,3,7,8 взятых без повторения…
Опубликовано: 27.02.2019 05:50
Ответов: 1
.(Cколькими способами 10 футбольных команд могут разыграть между собой золотые, бронзовые, серебряные медали (с решением))….
Опубликовано: 27.02.2019 06:50
Ответов: 2
Определить объем выделенного газа полученного при взаимодействии 250 грамм известняка содержащего 20% примесей с соляной кислотой…
Опубликовано: 27.02.2019 08:20
Ответов: 2
.(Вкуске 150 м ткани. и первый день истратили часть ткани, во второй -ещё 20м. после этого в куске осталось в 5 раз больше, чем истратили. сколько метров ткани истратили в первый д…
Опубликовано: 28. 02.2019 00:10
02.2019 00:10
Ответов: 3
Сумма длины и ширины прямоугольника равна 14 см. длина больше ширины на 4 см. чему равна площадь прямоугольника?…
Опубликовано: 28.02.2019 05:30
Ответов: 1
.(В16ч 40мин от пристани отошла моторная лодка. в 18ч 40мин в этом же направлении отчалил теплоход. через какое время теплоход догонит лодку, если её скорость 15км/ч, а скорость те…
Опубликовано: 28.02.2019 23:20
Ответов: 1
Знаешь правильный ответ?
Написать все возможные реакции между: оксид бария, оксид серы (vi), оксид алюминия и оксидом калия,…
Популярные вопросы
Уплощині ху знайдіть точку d (x; y; 0), рівновіддалену від трьох даних точок : а (0; 1; -1), b (-1; 0; 1), с (0; -1; 0)…
Опубликовано: 28.02.2019 16:30
Ответов: 1
На сколько частей делят плоскость две прямые, если они пересекаются. ..
..
Опубликовано: 01.03.2019 03:20
Ответов: 3
Лучи оа, ов, и ос попарно перпендикулярны. найдите периметр треугольника авс, если /оа/=/ов/=/ос/=5см….
Опубликовано: 02.03.2019 04:50
Ответов: 3
Здвох міст, відстань між якими 1800км, одночасно назустріч один одному вилетіли 2 вертоліти. швидкість першого вертольота 200км\год, а швидкість другого складає 4\5 швидкості першо…
Опубликовано: 02.03.2019 04:50
Ответов: 3
Основания трапеции равны 4 и 10, а её боковые стороны 3корня из 13 и 15. найдите косинус наименьшего угла этой трапеции….
Опубликовано: 02.03.2019 07:30
Ответов: 3
Шарик массой 150 г начинает падать с высоты 20 м из состояния покоя. какова его кинетическая енергия в момент перед падением на землю , если сопротивление воздуха пренебрежимо мало. ..
..
Опубликовано: 02.03.2019 15:30
Ответов: 2
Площадь поля 16 км в квадрате. пшеницей засеяли 11 км в квадрате, рожью-5 км в квадрате. какая часть поля засеяна пшеницей и какая рожью?…
Опубликовано: 02.03.2019 19:10
Ответов: 1
Мне нужно сочинение на одну из тем : травки как митраша попал в беду? или же в чём смысм названия повести? по рассказу м. пришвина «кладовая солнца» , буду )…
Опубликовано: 03.03.2019 04:50
Ответов: 2
Длина прямоугольника 1 4/20 метров, а ширина на 3/20 метров меньше длины. найдите периметр прямоугольника…
Опубликовано: 03.03.2019 09:00
Ответов: 2
Какая ничтожная малость может иногда перестроить жизнь всего человека…
Опубликовано: 04. 03.2019 03:20
03.2019 03:20
Ответов: 1
Больше вопросов по предмету: Химия Случайные вопросы
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.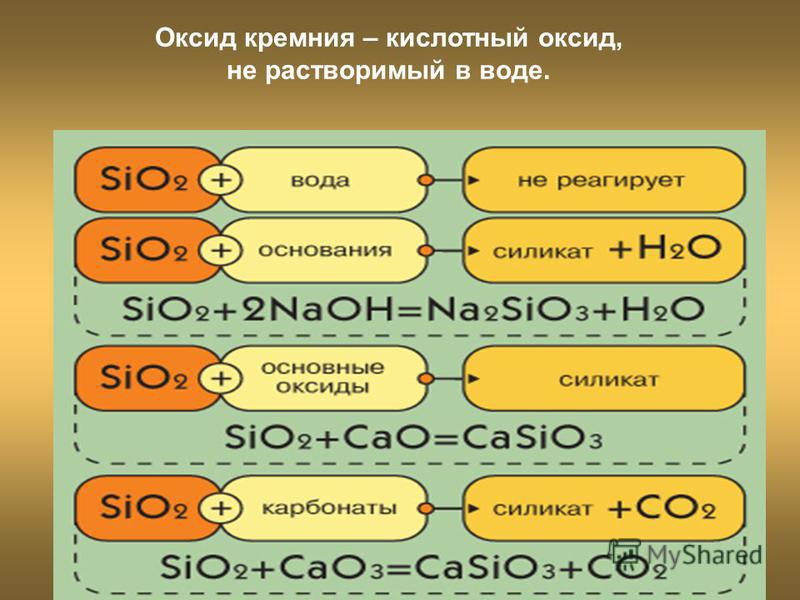
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Влияние модификации сульфатом бария на устойчивость к SO2 катализатора V2O5/TiO2 для реакции Nh4-SCR
. 2017 июль; 57: 110-117.
doi: 10.1016/j.jes.2016.12.001. Epub 2016 6 декабря.
Тэнфэй Сюй 1 , Сяодун Ву 2 , Лю Сюэсун 3 , Ли Цао 4 , Цивэй Линь 5 , Дуань Вэн 4
Принадлежности
- 1 Ключевая лаборатория перспективных материалов Министерства образования, Школа материаловедения и инженерии, Университет Цинхуа, Пекин 100084, Китай.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 2 Ключевая лаборатория передовых материалов Министерства образования, Школа материаловедения и инженерии, Университет Цинхуа, Пекин 100084, Китай; Институт региона дельты Янцзы Университета Цинхуа, Цзясин 314006, Китай. Электронный адрес: [email protected].
- 3 Колледж химии и химической инженерии, Шаосинский университет, Шаосин 312000, Китай.
- 4 Ключевая лаборатория передовых материалов Министерства образования, Школа материаловедения и инженерии, Университет Цинхуа, Пекин 100084, Китай.
- 5 Инновационный институт Redbud, Луньян, Фуцзянь 364000, Китай.
- PMID: 28647230
- DOI:
10.
 1016/j.jes.2016.12.001
1016/j.jes.2016.12.001
Тэнфэй Сюй и др. J Environ Sci (Китай). 2017 9 июля0003
. 2017 июль; 57: 110-117.
doi: 10.1016/j.jes.2016.12.001. Epub 2016 6 декабря.
Авторы
Тэнфэй Сюй 1 , Сяодун Ву 2 , Лю Сюэсун 3 , Ли Цао 4 , Цивэй Линь 5 , Дуань Вэн 4
Принадлежности
- 1 Ключевая лаборатория перспективных материалов Министерства образования, Школа материаловедения и инженерии, Университет Цинхуа, Пекин 100084, Китай.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 2 Ключевая лаборатория передовых материалов Министерства образования, Школа материаловедения и инженерии, Университет Цинхуа, Пекин 100084, Китай; Институт региона дельты Янцзы Университета Цинхуа, Цзясин 314006, Китай. Электронный адрес: [email protected].
- 3 Колледж химии и химической инженерии, Шаосинский университет, Шаосин 312000, Китай.
- 4 Ключевая лаборатория передовых материалов Министерства образования, Школа материаловедения и инженерии, Университет Цинхуа, Пекин 100084, Китай.
- 5 Инновационный институт Redbud, Луньян, Фуцзянь 364000, Китай.
- PMID: 28647230
- DOI:
10.
 1016/j.jes.2016.12.001
1016/j.jes.2016.12.001
Абстрактный
Отравление серой V 2 O 5 /BaSO 4 -TiO 2 (VBT), V 2 O 5 /WO 3 -1TiO 2 (VWT) и V 2 O 5 /BaSO 4 -WO 3 -TiO 2 (VBWT) проводили во влажном воздухе при восстановление NO x с NH 3 оценивали для 200-500°C. Катализатор VBT показал более высокую конверсию NO x после отравления серой, чем два других катализатора. Введение сульфата бария способствовало образованию сильных кислотных центров исходного катализатора и в некоторой степени устраняло окислительно-восстановительный цикл активного оксида ванадия, что приводило к некоторой потере активности. На VBT-S вместо неактивных сульфатов на VWT-S образовались легкоразлагаемые сульфаты. Эти разлагаемые сульфаты значительно увеличили количество сильнокислотных центров. Некоторые виды сульфатов ускользали при приготовлении катализатора, а сульфат бария воспроизводился при отравлении серой, что в значительной степени защищает ванадий от присоединения оксида серы. Следовательно, катализатор ВБТ показал наилучшую стойкость к отравлению серой.
Некоторые виды сульфатов ускользали при приготовлении катализатора, а сульфат бария воспроизводился при отравлении серой, что в значительной степени защищает ванадий от присоединения оксида серы. Следовательно, катализатор ВБТ показал наилучшую стойкость к отравлению серой.
Ключевые слова: сульфат бария; Разлагаемый сульфат; катализатор СКВ; Отравление серой.
Copyright © 2016. Опубликовано Elsevier B.V.
Похожие статьи
Стойкие к щелочам и сере катализаторы на основе вольфрама для контроля выбросов NOx.
Хуан З., Ли Х., Гао Дж., Гу С., Чжэн Л., Ху П., Синь И., Чен Дж., Чен И., Чжан З., Чен Дж., Тан Х. Хуан Цзи и др. Технологии экологических наук. 2015 15 декабря; 49(24):14460-5. doi: 10.1021/acs.est.5b03972. Epub 2015 4 декабря. Технологии экологических наук.
 2015.
PMID: 26587749
2015.
PMID: 26587749Гибридное селективное некаталитическое восстановление (СНКВ)/селективное каталитическое восстановление (СКВ) для удаления NOx с использованием низкотемпературной СКВ с катализатором Mn-V2O5/TiO2.
Choi SW, Choi SK, Bae HK. Чой С.В. и соавт. J Air Waste Manag Assoc. 2015 Апрель; 65 (4): 485-91. дои: 10.1080/10962247.2014.1002584. J Air Waste Manag Assoc. 2015. PMID: 25947218
Влияние легирования церием носителя TiO2 на активность Nh4-SCR на катализаторе V2O5-WO3/CeO2-TiO2.
Ченг К., Лю Дж., Чжан Т., Ли Дж., Чжао З., Вэй И., Цзян Г., Дуань А. Ченг К. и др. J Environ Sci (Китай). 2014 1 октября; 26 (10): 2106-13. doi: 10.1016/j.jes.2014.08.010. Epub 2014 11 августа. J Environ Sci (Китай).
 2014.
PMID: 25288555
2014.
PMID: 25288555Что нового в области химии поверхности объемных и поддерживаемых SCR-катализаторов на основе ванадия: улучшение их устойчивости к отравлению и термическому спеканию.
Грейнджер П., Сиака Х.В., Умбаркар С.Б. Грейнджер П. и др. Рек. хим. 2019 сен;19(9):1813-1828. doi: 10.1002/tcr.201800092. Epub 2018 18 октября. Рек. хим. 2019. PMID: 30335224 Обзор.
Механизм, с помощью которого оксид вольфрама способствует активности нанесенного V 2 O 5 /TiO 2 Катализаторы NO X Борьба с выбросами: структурные эффекты, выявленные с помощью 51 V MAS ЯМР-спектроскопии.
Jaegers NR, Lai JK, He Y, Walter E, Dixon DA, Vasiliu M, Chen Y, Wang C, Hu MY, Mueller KT, Wachs IE, Wang Y, Hu JZ.
 Джагерс Н.Р. и др.
Angew Chem Int Ed Engl. 2019 сен 2; 58 (36): 12609-12616. doi: 10.1002/anie.2013. Epub 2019 1 августа.
Angew Chem Int Ed Engl. 2019.
PMID: 31283870
Обзор.
Джагерс Н.Р. и др.
Angew Chem Int Ed Engl. 2019 сен 2; 58 (36): 12609-12616. doi: 10.1002/anie.2013. Epub 2019 1 августа.
Angew Chem Int Ed Engl. 2019.
PMID: 31283870
Обзор.
Посмотреть все похожие статьи
Цитируется
Улучшение SO 2 Устойчивость низкотемпературных катализаторов денитрации на основе Mn легированием Fe.
Ван Дж., Не З., Ан З., Бай Х., Ван Ф., Чжан С., Ли И., Ван С. Ван Дж. и др. АСУ Омега. 20 февраля 2019 г.; 4(2):3755-3760. doi: 10.1021/acsomega.9b00002. Электронная коллекция 2019 28 февраля. АСУ Омега. 2019. PMID: 31459588 Бесплатная статья ЧВК.
термины MeSH
вещества
Химия кислорода и серы
Химия кислорода и сера
| Химия Кислород | Химия Озон | Кислород в качестве Окислитель |
| Пероксиды | Способы приготовления О 2 | Химия Сера |
| Эффект Различия в силе связей X-X и X=X | Эффект Различия в электроотрицательности серы и Кислород | Эффект Различия в способности серы и кислорода к Расширить их валентную оболочку |
Химия Кислород
Кислород — самый распространенный элемент на этой планете. земная кора состоит из 46,6 % кислорода по массе, океаны – из 86 %
кислорода по весу, а атмосфера состоит из 21% кислорода по объему.
название кислород происходит от греческих основ оксис ,
«кислота» и gennan , «для образования или
генерировать». Таким образом, кислород буквально означает «кислотный
бывшее». Это название было введено Лавуазье, заметившим
соединения, богатые кислородом, такие как SO 2 и P 4 O 10 ,
растворяются в воде с образованием кислот.
земная кора состоит из 46,6 % кислорода по массе, океаны – из 86 %
кислорода по весу, а атмосфера состоит из 21% кислорода по объему.
название кислород происходит от греческих основ оксис ,
«кислота» и gennan , «для образования или
генерировать». Таким образом, кислород буквально означает «кислотный
бывшее». Это название было введено Лавуазье, заметившим
соединения, богатые кислородом, такие как SO 2 и P 4 O 10 ,
растворяются в воде с образованием кислот.
Электронная конфигурация атома кислорода [He] 2 s 2 2 p 4 предполагает, что нейтральные атомы кислорода могут получить октет валентных электронов, разделив две пары электроны с образованием двойной связи O=O, как показано на рисунке ниже.
Согласно этой структуре Льюиса, все электроны в
Молекулы O 2 спарены. Поэтому соединение должно
быть диамагнетиком он должен отталкиваться
магнитное поле. Экспериментально установлено, что O 2 является парамагнитным .
это
притягивается магнитным полем. Это можно объяснить, предположив
два неспаренных электрона в * разрыхляющей
молекулярные орбитали O 2 молекула.
Экспериментально установлено, что O 2 является парамагнитным .
это
притягивается магнитным полем. Это можно объяснить, предположив
два неспаренных электрона в * разрыхляющей
молекулярные орбитали O 2 молекула.
| На этой фотографии видно, что жидкость O 2 настолько сильно притягивается к магнитному полю, что замкните зазор между полюсами подковообразного магнита. |
При температуре ниже -183 o C, O 2 конденсируется с образованием жидкости характерного голубого цвета
происходит в результате поглощения света с длиной волны
630 нм. Это поглощение не наблюдается в газовой фазе и
относительно слаб даже в жидкости, потому что это требует, чтобы три
тела
два О 2 Молекулы и фотон сталкиваются
одновременно, что является очень редким явлением даже в
жидкая фаза.
Химия Озон
Молекула O 2 не единственная элементарная форма кислород. При наличии молнии или другого источника искра, молекулы O 2 диссоциируют с образованием атомов кислорода.
| искра | |||
| О 2 ( г ) | 2 О( г ) |
Эти атомы O могут реагировать с молекулами O 2 с образованием озон, O 3 ,
| О 2 ( г ) | + | О( г ) | О 3 ( г ) |
, структура Льюиса которого показана на рисунке. ниже.
ниже.
Кислород (O 2 ) и озон (O 3 ) являются примерами из аллотропов (от греческого значения «в другим способом»). По определению, аллотропы различны формы элемента. Так как они имеют разную структуру, аллотропы обладают различными химическими и физическими свойствами (см. Таблица ниже).
Свойства аллотропов кислорода
| Кислород (O 2 ) | Озон (О 3 ) | |||
| Точка плавления | -218.75 или С | -192,5 или С | ||
| Температура кипения | -182.96 или С | -110. 5 или С 5 или С | ||
| Плотность (при 20 o C) | 1,331 г/л | 1,998 г/л | ||
| О-О облигация приказ | 2 | 1,5 | ||
| Длина связи O-O | 0,1207 нм | 0,1278 нм |
Озон представляет собой нестабильное соединение с резким резким запахом, медленно разлагается до кислорода.
| 3 O 3 ( г ) | 3 O 2 ( г ) |
При низких концентрациях озон может быть относительно приятным. (
Характерный чистый запах, связанный с летними грозами,
из-за образования небольших количеств O 3 . )
)
Воздействие O 3 в более высоких концентрациях приводит к кашель, учащенное сердцебиение, боль в груди и общее телесная боль. При концентрациях выше 1 ppm озон токсичен.
Одним из характерных свойств озона является его способность поглощать излучение в ультрафиолетовой части спектра ( > 300 нм), обеспечивая тем самым фильтр, защищающий нас от воздействие высокоэнергетического ультрафиолетового излучения, испускаемого солнцем. Мы можем понять важность этого фильтра, если подумаем о что происходит, когда солнечное излучение поглощается нашей кожей.
Электромагнитное излучение в инфракрасном, видимом и
низкоэнергетические участки ультрафиолетового спектра (<300 нм)
несет достаточно энергии, чтобы возбудить электрон в молекуле в
орбитали с более высокой энергией. Этот электрон в конце концов возвращается в
орбиталь, с которой он был возбужден, и энергия отдается
окружающих тканей в виде тепла. Любой, у кого есть
пострадавшие от солнечных ожогов могут оценить болезненные последствия
чрезмерного количества этого излучения.
Излучение в высокоэнергетической части ультрафиолета Спектр (300 нм) имеет другой эффект при поглощении. Это излучение несет достаточно энергии для ионизации атомов или молекулы. Ионы, образующиеся в этих реакциях, имеют нечетное число электронов и чрезвычайно реакционноспособны. Они могут вызывать постоянные повреждение клеточной ткани и вызвать процессы, которые в конечном итоге привести к раку кожи. Относительно небольшое количество этого излучения поэтому может оказывать сильное воздействие на живую ткань.
В 1974 году Молина и Роуленд указали, что
хлорфторуглероды, такие как CFCl 3 и CF 2 Cl 2 ,
которые использовались в качестве хладагентов и пропеллентов в аэрозолях
банки, начали накапливаться в атмосфере. в
стратосфере, на высоте от 10 до 50 км над земной
поверхности хлорфторуглероды разлагаются с образованием атомов Cl и
оксиды хлора, такие как ClO, когда они поглощают солнечный свет. Атомы Cl
и молекулы ClO имеют нечетное число электронов, как показано на
рисунок ниже.
В результате эти вещества необычайно реактивны. в атмосферу, они реагируют с озоном или атомами кислорода, необходимы для образования озона.
| Класс | + | О 3 | ClO | + | О 2 | |
| ClO | + | О | Кл | + | О 2 |
Молина и Роуленд постулировали, что эти вещества
в конечном итоге истощит озоновый щит в стратосфере,
опасные последствия для биологических систем, которые
подвержены воздействию повышенного уровня высокоэнергетического ультрафиолетового излучения.
Кислород как Окислитель
Фтор — единственный элемент, который более электроотрицательный, чем кислород. В результате кислород получает электроны практически во всех своих химические реакции. Каждая молекула O 2 должна получить четыре электроны, чтобы удовлетворить октеты двух атомов кислорода без обмен электронами, как показано на рисунке ниже.
Таким образом, кислород окисляет металлы с образованием солей, в которых атомы кислорода формально присутствуют как O 2- ионов. Ржавчина образуется, например, при взаимодействии железа с кислородом в присутствии воды, чтобы получить соль, формально содержащую Fe 3+ и O 2- ионов, в среднем три молекулы воды каждому иону Fe 3+ в этом твердом теле.
| Н 2 О | |||||
| 4 Fe( с ) | + | 3 O 2 ( г ) | 2 Fe 2 O 3 ( s ) 3 H 2 O |
Кислород также окисляет неметаллы, такие как углерод, с образованием
ковалентные соединения, в которых кислород формально имеет окисление
число -2.
| С( с ) | + | О 2 ( г ) | CO 2 ( г ) |
Кислород является прекрасным примером окислителя потому что он увеличивает степень окисления практически любого вещества с которым он реагирует. В ходе своих реакций кислород уменьшенный. Таким образом, вещества, с которыми он реагирует, равны сокращение агенты .
Пероксиды
Для восстановления молекулы O 2 требуется четыре электрона пара ионов O 2-. Если реакция прекращается после O 2 молекула получила только два электрона, O 2 2- ион, показанный на рисунке ниже.
Этот ион имеет на два электрона больше, чем нейтральный O 2 молекула, а это означает, что атомы кислорода должны иметь только
одна пара связывающих электронов для достижения октета валентности
электроны. Ион O 2 2- называется перекисью .
ион, потому что соединения, содержащие этот ион, необычайно богаты
кислород. Это не просто оксиды, это (гипер)пероксиды.
Ион O 2 2- называется перекисью .
ион, потому что соединения, содержащие этот ион, необычайно богаты
кислород. Это не просто оксиды, это (гипер)пероксиды.
Самый простой способ получения пероксида – это реакция натрия или металлический барий с кислородом.
| 2 На( с ) | + | О 2 ( г ) | На 2 О 2 ( с ) | ||
| Ба( с ) | + | О 2 ( г ) | БаО 2 ( с ) |
Когда эти пероксиды вступают в реакцию с сильной кислотой, перекись водорода (H 2 O 2 ).
| BaO 2 ( с ) | + | 2 ч + ( водный ) | Ва 2+ ( водный ) | + | H 2 O 2 ( водный ) |
Структура Льюиса перекиси водорода содержит O-O
одинарной связи, как показано на рисунке ниже.
Теория VSEPR предсказывает, что геометрия вокруг каждого кислорода атом в H 2 O 2 должен быть согнут. Но это Теория не может предсказать, должны ли четыре атома лежать в той же плоскости или молекула должна визуализироваться как лежащая в двух пересекающихся плоскостях. Экспериментально определенный структура H 2 O 2 показан на рисунке ниже.
Валентный угол H-O-O в этой молекуле лишь немного больше чем угол между парой соседних 2 p атомных орбиталей атома кислорода, а угол между плоскостями которые образуют молекулу, немного больше, чем тетраэдрический угол.
Степень окисления атомов кислорода в перекиси водорода равно -1. Таким образом, H 2 O 2 может действовать как окислителя и захватывают еще два электрона, образуя пару гидроксид-ионы, в которых кислород имеет степень окисления -2.
| Н 2 О 2 | + | 2 е — | 2 ОХ — |
Или он может действовать как восстановитель и терять пару
электроны с образованием молекулы O 2 .
| Н 2 О 2 | О 2 | + | 2 часа + | + | 2 е — |
Реакции, в которых соединение одновременно подвергается обоим окисление и восстановление называются диспропорционированием реакции . Продукты диспропорционирования H 2 O 2 являются кислород и вода.
| 2 Н 2 О 2 ( водный ) | О 2 ( г ) | + | 2 Н 2 О( л ) |
Диспропорционирование H 2 O 2 является экзотермическая реакция.
| 2 H 2 O 2 ( водный ) | О 2 ( г ) | + | 2 Н 2 О( л ) | H o = -94,6 кДж/моль H 2 O |
Эта реакция протекает относительно медленно, однако в отсутствие
катализатора, например пыль или металлическая поверхность. Основные виды использования
Н 2 O 2 связаны с его окислительной способностью.
Применяется в разбавленных (3%) растворах как дезинфицирующее средство. В большем
концентрированные растворы (30%), используется как отбеливатель для
волосы, мех, кожа или древесная масса, используемая для изготовления бумаги. В очень
концентрированные растворы, H 2 O 2 был использован
как ракетное топливо из-за легкости его разложения до
дать O 2 .
Основные виды использования
Н 2 O 2 связаны с его окислительной способностью.
Применяется в разбавленных (3%) растворах как дезинфицирующее средство. В большем
концентрированные растворы (30%), используется как отбеливатель для
волосы, мех, кожа или древесная масса, используемая для изготовления бумаги. В очень
концентрированные растворы, H 2 O 2 был использован
как ракетное топливо из-за легкости его разложения до
дать O 2 .
Методы Подготовка O 2
Небольшие количества газа O 2 можно приготовить в количество способов.
1. Разложением разбавленного раствора перекиси водорода с пыль или металлическая поверхность в качестве катализатора.
| 2 H 2 O 2 ( водный ) | О 2 ( г ) | + | 2 Н 2 О( л ) |
2. При взаимодействии перекиси водорода с сильным окислителем
агент, такой как ион перманганата, MnO 4 — .
При взаимодействии перекиси водорода с сильным окислителем
агент, такой как ион перманганата, MnO 4 — .
| 5 H 2 O 2 ( водный ) | + | 2 MnO 4 — ( водный ) | + | 6 ч + ( водный ) | 2 Mn 2+ ( водный ) | + | 5 O 2 ( г ) | + | 8 Н 2 О( л ) |
3. Путем пропускания электрического тока через воду.
| электролиз | ||||
| 2 Н 2 О( л ) | 2 H 2 ( г ) | + | О 2 ( г ) |
4. Путем нагревания хлората калия (KClO 3 ) в
присутствии катализатора до его разложения.
Путем нагревания хлората калия (KClO 3 ) в
присутствии катализатора до его разложения.
| MnO 2 | ||||
| 2 KClO 3 ( с ) | 2 KCl( с ) | + | 3 O 2 ( г ) |
Химия Сера
Поскольку сера находится непосредственно под кислородом в периодической таблице,
эти элементы имеют сходные электронные конфигурации. Как результат,
сера образует множество соединений, являющихся аналогами соединений кислорода,
как показано в таблице ниже. Примеры в этой таблице показывают, как
префикс тио — может использоваться для обозначения соединений, в которых
сера заменяет атом кислорода. Тиоцианат (SCN —)
ион, например, является серосодержащим аналогом цианата
(OCN — ) ион.
Тиоцианат (SCN —)
ион, например, является серосодержащим аналогом цианата
(OCN — ) ион.
Соединения кислорода и их аналоги серы
| Соединения кислорода | Соединения серы | |
| Na 2 O (оксид натрия) | Na 2 S (сульфид натрия) | |
| H 2 O (вода) | H 2 S (сероводород) | |
| О 3 (озон) | SO 2 (двуокись серы) | |
| CO 2 (двуокись углерода) | CS 2 (сероуглерод) | |
| OCN — (цианат) | SCN — (тиоцианат) | |
| OC(NH 2 ) 2 (мочевина) | SC(NH 2 ) 2 (тиомочевина) |
Существует четыре основных различия между химическим составом
сера и кислород.
1. Двойные связи O=O намного прочнее, чем двойные связи S=S.
2. Одинарные связи S-S почти в два раза прочнее, чем одинарные связи O-O облигации.
3. Сера ( EN = 2,58) гораздо менее электроотрицательна чем кислород ( EN = 3,44).
4. Сера может расширять свою валентную оболочку, чтобы удерживать более восьми электроны, а кислород не может.
Эти, казалось бы, незначительные отличия имеют важные последствия по химии этих элементов.
Влияние Различия в прочности связей X-X и X=X
Радиус атома серы примерно на 60% больше, чем у атом кислорода.
В результате атомам серы труднее приблизиться достаточно вместе, чтобы образовать связи. Таким образом, двойные связи S=S намного слабее, чем двойные связи О=О.
Двойные связи между серой и кислородом или атомами углерода могут быть
обнаружены в таких соединениях, как SO 2 и CS 2 (см. рисунок ниже). Но эти двойные связи намного слабее, чем
эквивалентные двойные связи с атомами кислорода в O 3 или CO 2 .
Энтальпия диссоциации двойной связи C=S равна 477.
кДж/моль, например, тогда как энтальпия диссоциации связи для
Двойная связь C=O 745 кДж/моль.
рисунок ниже). Но эти двойные связи намного слабее, чем
эквивалентные двойные связи с атомами кислорода в O 3 или CO 2 .
Энтальпия диссоциации двойной связи C=S равна 477.
кДж/моль, например, тогда как энтальпия диссоциации связи для
Двойная связь C=O 745 кДж/моль.
Элементарный кислород состоит из молекул O 2 , в которых каждый атом завершает свой октет валентных электронов, разделяя два пары электронов с одним соседним атомом. Потому что сера не образует прочных двойных связей S=S, обычно элементарная сера состоит из циклических молекул S 8 , в которых каждый атом завершает свой октет, образуя одинарные связи с двумя соседними атомов, как показано на рисунке ниже.
S 8 молекулы могут упаковываться, образуя более одной
кристалл. Наиболее стабильная форма серы состоит из орторомбический кристаллы молекул S 8 , которые часто встречаются вблизи
вулканы. Если эти кристаллы нагреть до тех пор, пока они не расплавятся и
затем расплавленную серу охлаждают, получая аллотропную смесь серы, состоящую моноклинных кристаллов S 8 молекул составляет
сформировался. Эти моноклинные кристаллы медленно трансформируются
в более устойчивую орторомбическую структуру за период
время.
Если эти кристаллы нагреть до тех пор, пока они не расплавятся и
затем расплавленную серу охлаждают, получая аллотропную смесь серы, состоящую моноклинных кристаллов S 8 молекул составляет
сформировался. Эти моноклинные кристаллы медленно трансформируются
в более устойчивую орторомбическую структуру за период
время.
Склонность элемента образовывать связи с самим собой называется цепочка (от латинского catena , «цепь»). Потому что сера образует необычно прочные одинарные связи S-S, она лучше при катенация, чем любой элемент, кроме углерода. В результате ромбическая и моноклинная формы серы не являются единственными аллотропы элемента. Также существуют аллотропы серы, которые различаются размерами молекул, образующих кристалл. Циклический молекулы, содержащие 6, 7, 8, 10 и 12 атомов серы, известен.
Сера плавится при 119,25 o C с образованием желтой жидкости
которая менее вязкая, чем вода. Если эту жидкость нагреть до 159 o С,
превращается в темно-красную жидкость, которую невозможно вылить из
контейнер. Вязкость этой темно-красной жидкости в 2000 раз больше.
больше, чем у расплавленной серы, потому что циклическая S 8 молекулы открываются и соединяются вместе, образуя длинные цепочки
до 100 000 атомов серы.
Вязкость этой темно-красной жидкости в 2000 раз больше.
больше, чем у расплавленной серы, потому что циклическая S 8 молекулы открываются и соединяются вместе, образуя длинные цепочки
до 100 000 атомов серы.
Когда сера реагирует с активным металлом, она может образовывать сульфид-ион, S 2-.
| 16 К( с ) | + | С 8 ( с ) | 8 К 2 С( с ) |
Однако это не единственный продукт, который можно получить. А могут быть получены различные полисульфид-ионы с зарядом -2. которые различаются числом атомов серы в цепи.
Влияние Различия в электроотрицательности серы и кислорода
Поскольку сера гораздо менее электроотрицательна, чем кислород, она
с большей вероятностью образует соединения, в которых он имеет положительное
степень окисления (см. таблицу ниже).
таблицу ниже).
Общие числа окисления для серы
| Окисление Номер | Примеры | |
| -2 | Na 2 S, H 2 S | |
| -1 | Na 2 S 2 , H 2 S 2 | |
| 0 | С 8 | |
| +1 | S 2 Класс 2 | |
| +2 | С 2 О 3 2- | |
| +2 1 / 2 | С 4 О 6 2- | |
| +3 | С 2 О 4 2- | |
| +4 | СФ 4 , ТАК 2 , Н 2 ТАК 3 , СО 3 2- | |
| +5 | С 2 О 6 2- | |
| +6 | СФ 6 , ТАК 3 , Н 2 ТАК 4 , СО 4 2- |
Теоретически сера может реагировать с кислородом с образованием SO 2 или SO 3 , структуры Льюиса которых представлены на рисунке
ниже.
| СО 2 | |
| СО 3 |
На практике сжигание соединений серы дает SO 2 , независимо от того, сжигается ли сера или соединение серы.
| С 8 ( с ) | + | 8 О 2 ( г ) | 8 СО 2 ( г ) | |||
| CS 2 ( л ) | + | 3 O 2 ( г ) | CO 2 ( г ) | + | 2 SO 2 ( г ) | |
| 3 FeS 2 ( с ) | + | 8 О 2 ( г ) | Fe 3 O 4 ( с ) | + | 6 SO 2 ( г ) |
Хотя образующийся в этих реакциях SO 2 должен
реагирует с O 2 с образованием SO 3 , скорость этого
реакция очень медленная. Скорость конверсии SO 2 в SO 3 можно значительно увеличить, добавив
соответствующий катализатор.
Скорость конверсии SO 2 в SO 3 можно значительно увеличить, добавив
соответствующий катализатор.
| В 2 О 5 /К 2 О | ||
| 2 SO 2 ( г ) | 2 SO 3 ( г ) |
Огромное количество SO 2 производится промышленностью каждый год, а затем преобразуется в SO 3 , который можно использовать для производства серной кислоты, H 2 SO 4 . Теоретически, серную кислоту можно получить растворением газа SO 3 в вода.
| SO 3 ( г ) | + | Н 2 О( л ) | H 2 SO 4 ( водный ) |
На практике это не удобно. Вместо этого SO 3 поглощается 98% H 2 SO 4 , где вступает в реакцию
с водой с образованием дополнительного H 2 SO 4 молекулы. Затем добавляют воду по мере необходимости, чтобы сохранить
концентрация этого раствора от 96% до 98% H 2 SO 4 по весу.
Вместо этого SO 3 поглощается 98% H 2 SO 4 , где вступает в реакцию
с водой с образованием дополнительного H 2 SO 4 молекулы. Затем добавляют воду по мере необходимости, чтобы сохранить
концентрация этого раствора от 96% до 98% H 2 SO 4 по весу.
Серная кислота на сегодняшний день является самым важным промышленным
хим. Утверждалось даже, что существует прямое
зависимость между количеством серной кислоты в стране
потребление и его уровень жизни. Более 50% из
Серная кислота, производимая каждый год, используется для производства удобрений.
остальное используется для изготовления бумаги, синтетических волокон и текстиля,
инсектициды, моющие средства, кормовые добавки, красители, препараты,
антифриз, краски и эмали, линолеум, синтетический каучук,
печатные краски, целлофан, фотопленка, взрывчатые вещества,
автомобильные аккумуляторы и металлы, такие как магний, алюминий,
железо и сталь.
Серная кислота диссоциирует в воде с образованием HSO 4 — ион, известный как гидросульфатный или бисульфатный ион.
| H 2 SO 4 ( водный ) | Х + ( водный ) | + | HSO 4 — ( водный номер ) |
10% этих ионов гидросульфата далее диссоциируют с образованием ТАК 4 2-, или сульфат, ион.
| HSO 4 — ( aq ) | Х + ( водный ) | + | SO 4 2- ( водный номер ) |
При замене H + можно получить множество солей.
ионов в серной кислоте с положительно заряженными ионами, такими как
На + или К + ионы.
| NaHSO 4 | = | гидросульфат натрия |
| Нет данных 2 SO 4 | = | сульфат натрия |
Диоксид серы растворяется в воде с образованием сернистой кислоты.
| СО 2 ( г ) | + | Н 2 О( л ) | H 2 SO 3 ( водный ) |
Сернистая кислота не диссоциирует в воде в такой степени как серная кислота, но еще можно заменить Н + ионов в H 2 SO 3 с положительными ионами с образованием соли.
| NaHSO 3 | = | гидросульфит натрия |
| Нет данных 2 SO 3 | = | сульфит натрия |
Серная кислота и серная кислота являются примерами класса
соединений, известных как оксикислоты , потому что они
буквально кислоты, которые содержат кислород. Потому что они отрицательные
ионы (или анионы), содержащие кислород, SO 3 2- и SO 4 2- известны как оксианионы .
Структуры Льюиса некоторых образующихся оксидов серы
оксикислоты или оксианионы приведены в таблице ниже.
Потому что они отрицательные
ионы (или анионы), содержащие кислород, SO 3 2- и SO 4 2- известны как оксианионы .
Структуры Льюиса некоторых образующихся оксидов серы
оксикислоты или оксианионы приведены в таблице ниже.
| ОКСИАКИСТЫ | ОКСИАНИОНЫ |
Один из этих оксианионов заслуживает особого упоминания. Этот ион,
который известен как ион тиосульфата, образуется в результате реакции
между серой и сульфитным (SO 3 2-) ионом.
| 8 СО 3 2- ( ) | + | С 8 ( с ) | 8 S 2 O 3 2- ( aq ) | |
Влияние Различия в способности серы и кислорода расширять свои Валанс Шелл
Электронные конфигурации кислорода и серы обычно написано следующим образом.
| О | = | [He] 2 с 2 2 р 4 | |
| С | = | [Ne] 3 с 2 3 р 4 |
Хотя это обозначение показывает сходство между
конфигурации двух элементов, он скрывает важную
разница, которая позволяет сере расширять свою валентную оболочку, чтобы удерживать
более восьми электронов.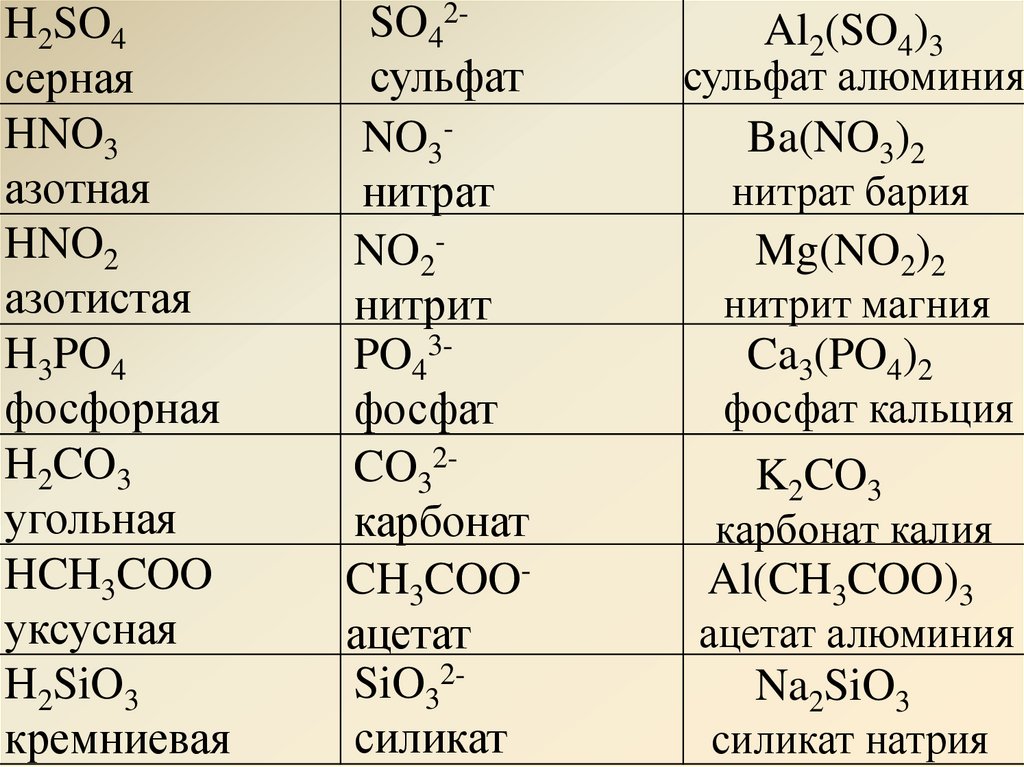
Кислород реагирует с фтором с образованием OF 2 .
| О 2 ( г ) | + | 2 Ф 2 ( г ) | 2 из 2 ( г ) |
В этот момент реакция останавливается, потому что кислород может удерживать только восемь электронов в его валентной оболочке, как показано на рисунке ниже.
Сера реагирует с фтором с образованием SF 4 и SF 6 , показано на рисунке ниже, потому что сера может расширять свою валентность оболочка, содержащая 10 или даже 12 электронов.
| С 8 ( с ) | + | 16 F 2 ( г ) | 8 SF 4 ( г ) | |
| С 8 ( с ) | + | 24 F 2 ( г ) | 8 СФ 6 ( г ) |
диоксид серы в предложении
Эти примеры взяты из корпусов и из источников в Интернете. Любые мнения в примерах не отражают мнение редакторов Кембриджского словаря, издательства Кембриджского университета или его лицензиаров.
Любые мнения в примерах не отражают мнение редакторов Кембриджского словаря, издательства Кембриджского университета или его лицензиаров.
В 1979 году был установлен стандарт качества воздуха для серы диоксида .
Из Кембриджского корпуса английского языка
На рис. 1а показано, что зависимость между концентрациями серы диоксида и свободами почти линейна.
Из Кембриджского корпуса английского языка
На их долю приходится 16 процентов всего загрязнения твердыми частицами и 43 процента всего серы диоксида .
Из Кембриджского корпуса английского языка
В 1993 году были ужесточены экологические стандарты для некоторых загрязнителей воздуха, таких как сера двуокись и окись углерода.
Из Кембриджского корпуса английского языка
Во-вторых, уровни загрязнения отрицательно коррелируют со свободой за одним небольшим исключением: концентрации серы двуокиси примерно одинаковы для стран с низкими и средними политическими свободами.
Из Кембриджского корпуса английского языка
Главный результат заключается в том, что затраты на сокращение серы диоксида , а также, возможно, пыли, вероятно, будут значительно ниже в странах с переходной экономикой, чем на западе.
Из Кембриджского корпуса английского языка
Мы обнаружили, что свободы статистически значимы для показателей загрязнения, которые непосредственно влияют на здоровье человека: концентрации сера диоксид , дым, тяжелые частицы и фекальные колиформы.
Из Кембриджского корпуса английского языка
Природная и обычно нечистая киноварь химически разделяется на ртуть и серу диоксид и затем повторно синтезируется для транспортировки или получения чистой киновари для использования в качестве пигмента.
Из Кембриджского корпуса английского языка
Сера диоксид , хотя и безвреден для здоровых людей, может вызвать астму при вдыхании или проглатывании чувствительными людьми.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Скорость движения выпуклости, выбросы серы диоксида и показания температуры грунта не выявили каких-либо изменений, указывающих на катастрофическое извержение.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Таким образом, концентрация свободной серы диоксида значительно снижается к моменту употребления пива или вина.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Выделяет серу диоксид и оксиды азота при нагревании до разложения.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Добавление серы диоксида может помочь улучшить сохранение цвета и аромата при длительном хранении.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Эти материалы включают силикаты (например, ортопироксен), серу и серу диоксид .
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Сера диоксид может быть опасен для детей и пожилых людей, вызывая серьезное повреждение легочной ткани.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Старые грязные угольные печи были заменены, что снизило выбросы серы двуокиси в город.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Одними из наиболее опасных токсинов в воздухе, выбрасываемых угольной электростанцией, являются сера диоксид , оксид азота, твердые частицы и ртуть.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
В процессе расходуется дитионит и конечным продуктом всех реакций является 2 серы диоксида анионов.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Воздух содержал высокие концентрации серы диоксида , поскольку производство энергии в основном основывалось на сжигании топлива с высоким содержанием серы.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Сера диоксид для этой цели производится, когда сера соединяется с кислородом.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Симптомы чувствительности к сульфитирующим агентам, включая серу диоксид , проявляются как потенциально опасные для жизни проблемы с дыханием в течение нескольких минут после приема внутрь.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Продукты разложения могут включать серу, серу диоксид , сероводород, полисульфаны, серная кислота и политионаты, в зависимости от конкретных условий реакции.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
При высокой температуре или в присутствии катализаторов сера диоксид может реагировать с сероводородом с образованием элементарной серы и воды.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
При нагревании этого раствора можно обратить реакцию с образованием серы диоксида и раствора сульфита натрия.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Такая бумага сохраняет свою прочность от 300 до 800 лет, несмотря на серу диоксид и другие загрязнители воздуха.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
По некоторым оценкам, 1 процент глобальных выбросов серы диоксида исходит оттуда.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Тетраэдрический промежуточный продукт разрушается с потерей серы диоксида и хлорид-иона с образованием протонированного хлорангидрида 4.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Оксиды железа снимают или сливают с верхней части меди, а газообразный сера диоксид выходит из печи через систему отходящих газов.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Другой способ его получения — тлеющий разряд в сере 9.0262 диоксид .
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Вулканы влияют на выбросы метана в атмосферу, когда они извергаются, выбрасывая в воздух пепел и серу диоксид .
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Свидетельства, опубликованные в начале 1980-х годов, показали, что облака состоят в основном из серы двуокиси и капель серной кислоты.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
сера диоксид пропускают через раствор карбоната калия до тех пор, пока не перестанет выделяться диоксид углерода.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Ровер обнаружил воду, двуокись углерода, кислород, серу, двуокись и сероводород.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Сера Диоксид также может быть удален путем сухой десульфурации путем введения известняковой суспензии в дымовой газ перед фильтрацией частиц.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Рассеивание кислотных аэрозолей и газообразных серы диоксида представляет дополнительную опасность возгорания с участием серной кислоты.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Сульфинатная соль (4) самопроизвольно удаляет серу диоксид и бензотиазолон лития (5) с образованием желаемого алкена (6).
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Сера Диоксид Выбросы увеличивались до 2006 года, после чего они начали снижаться.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Из-за серы двуокиси , образующейся в процессе плавления серы, изготовление инкрустации серы вскоре было прекращено.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Горячие источники тесно связаны с фумаролами, которые представляют собой жерла в активной вулканической области, выпускающие пар и горячие газы, такие как сера диоксид .
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Чаще встречается на предприятиях, где сера диоксид либо используется в небольших количествах, либо не используется вовсе.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Локально сера диоксид газ может привести к кислотным дождям и загрязнению воздуха с подветренной стороны от вулкана.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Вулканические газы, представляющие наибольшую потенциальную опасность для людей, животных, сельского хозяйства и имущества, — это сера двуокись , двуокись углерода и фтористый водород.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
В присутствии серы вероятные продукты включают серу диоксид , сероводород и серную кислоту.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Основными загрязнителями на объекте были серная кислота, сероводород, сера диоксид и тяжелые металлы.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Кислотность в значительной степени образуется в результате окисления серы диоксида , наиболее распространенного подкисляющего газа, в сульфат-ионы.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Кислотные дожди вызываются выбросами серы диоксида и оксида азота, которые реагируют с молекулами воды в атмосфере с образованием кислот.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Другой способ его получения — электролиз фтористого водорода с раствором сера диоксид , который также производил дифторид кислорода и сульфурилфторид.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
В виноделии бисульфит натрия выделяет серу диоксид газ при добавлении в воду или продукты, содержащие воду.
От
Википедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.
Диоксид азота гидратируется для получения азотистой кислоты, которая затем окисляет серу диоксид до серной кислоты и оксида азота.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Руда была обожжена для удаления серы диоксида .
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Во время обжига сульфид превращается в оксид, и сера выделяется в виде серы диоксида , газа.
От
Википедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.
Обжиг окисляет серу с образованием серы диоксида , который либо улетучивается в атмосферу, либо может быть вымыт.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
В печи для обжига медный концентрат частично окисляется с образованием кальцина и серы диоксида газа.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Другие внешние преимущества включают улучшение качества воздуха за счет снижения расхода топлива (ограничение выбросов закиси азота, серы диоксида , метан и другие газы, загрязняющие воздух).
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Он также опубликовал работы по ионизации водорода, двуокиси углерода, закиси азота, двуокиси азота, водяного пара, серы двуокиси и сероуглерода.
От
Википедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.
Эти опасные загрязнители известны как загрязнители критерия и включают озон, твердые частицы, серу двуокись , двуокись азота, окись углерода и свинец.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Атмосферные загрязнители (например, сера диоксид , оксиды азота, углеводороды и т. д.) в сочетании с солнечным излучением также могут вызывать серьезные повреждения.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Внешний ореол состоял из сера диоксид газ и мелкие пылинки размером 0,5-10 нанометров.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Очень раздражающие пары образуются из горячего материала, который может образовывать фосген, хлористый водород и серу диоксид .
От
Википедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.
Основными газами, выделяемыми во время вулканической деятельности, являются вода, двуокись углерода, сера двуокись , водород, сероводород, окись углерода и хлористый водород.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Лимоны, которые не годились для продажи, были переработаны в пектин или лимонную кислоту с использованием серы диоксида в качестве консерванта.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Некоторые атмосферные следовые газы, такие как озон, сера диоксид и оксиды азота являются антропогенными, химически активными факторами качества воздуха на региональном уровне.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Атомная генерация не производит непосредственно серы диоксида , оксидов азота, ртути или других загрязняющих веществ, связанных со сжиганием ископаемого топлива.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Большое количество серы двуокиси также может быть выброшено в атмосферу в результате извержений вулканов.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Дайверс продемонстрировал, что вместо этого тионилхлорид был получен в результате вторичной реакции между серой диоксидом и пентахлоридом фосфора.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Реакция второго порядка по сере диоксид , потому что другая молекула серы диоксида , вероятно, связывается с переходным состоянием, помогая стабилизировать его.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Одним из способов производства йода является смешивание серы диоксида с нитратными рудами, которые содержат некоторое количество йодатов.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Большая часть серы диоксида производится при сжигании элементарной серы.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Кроме того, концентрация серы диоксида в атмосфере может влиять на пригодность среды обитания для растительных сообществ, а также для жизни животных.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Однако дождь соединяется с серой двуокисью , выделяемой вулканическими жерлами, и образует кислотный дождь.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Роль серы диоксида в биологии млекопитающих еще недостаточно изучена.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Как правило, около 1% серы диоксида преобразуется в.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Это контрольное оборудование значительно сократило выбросы серы диоксида по сравнению с требуемыми нормами.
От
Википедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.
Только после того, как они узнали, что могут перерабатывать серу диоксид для производства удобрений, они, наконец, согласились со стандартами выбросов.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Например, сера образует токсичные серу диоксид и триоксид серы.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
При сжигании морского угля в атмосферу выбрасывается серы диоксида , диоксида углерода, оксида азота, сажи и твердых частиц органических веществ.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
В большинстве случаев эти области представляют собой яркие ландшафты, состоящие из серных двуокиси морозно-ледяных полей, предполагая, что они холоднее, чем их окружение.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
В 2009 году была введена в действие система мокрой десульфурации дымовых газов для снижения выбросов серы диоксида и тяжелых металлов.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Другими распространенными хладагентами, используемыми в различных приложениях, являются аммиак, сера диоксид и негалогенированные углеводороды, такие как пропан.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Твердые и газообразные загрязнители, такие как сажа, озон, сера диоксид , оксиды азота, могут вызывать пыль, загрязнение и необратимое молекулярное повреждение материалов.
От
Википедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.
Побочным продуктом обжига является сера диоксид , который далее перерабатывается в серную кислоту, товар.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Получают восстановлением дифениларсоновой кислоты серой диоксидом .
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Кроме того, обследование показало, что завод выпустил в общей сложности 61000 тонн серы двуокиси и 11 миллионов тонн двуокиси углерода в год.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
В результате извержений в атмосферу попало значительное количество серы диоксида и твердых частиц.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Он может быть образован действием серы диоксида на оксид или гидроксид бария.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Вторым этапом является согласованная потеря молекулы серы диоксида и ее замена хлоридом, присоединенным к сульфитной группе.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Присутствие сульфата и сульфида также вероятно, поскольку были обнаружены сера диоксид и сероводород.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Оксиды азота также могут образовываться естественным образом в результате ударов молнии, а сера диоксид образуется в результате извержений вулканов.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Сера диоксид — бесцветный газ, который может нанести вред здоровью человека и охладить климат Земли.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Известняк вступает в реакцию с серой диоксидом , выделяющимся при сжигании угля, удаляя это загрязняющее вещество из выбросов завода.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Уголь и нефть часто содержат соединения серы, и при их сгорании образуется сера диоксид .
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Соединения серы затемняют бензин, придают ему неприятный запах и повышают токсичность сера диоксид выбросы двигателя.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Анализ вин на серу диоксид требует йода в качестве окислителя.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Смог также возникает в результате сжигания большого количества угля, при котором образуется смесь дыма и серы диоксида .
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Вентури также используются для контроля выбросов летучей золы и серы диоксида из промышленных и коммунальных котлов.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.
Во избежание этого вино должно быть либо стерильно разлито в бутылки, либо содержать достаточное количество серы диоксида для подавления роста бактерий.
From
Wikipedia
Этот пример взят из Википедии и может быть повторно использован под лицензией CC BY-SA.




 Электронный адрес:
Электронный адрес:  1016/j.jes.2016.12.001
1016/j.jes.2016.12.001 Электронный адрес:
Электронный адрес:  1016/j.jes.2016.12.001
1016/j.jes.2016.12.001 2015.
PMID: 26587749
2015.
PMID: 26587749 2014.
PMID: 25288555
2014.
PMID: 25288555 Джагерс Н.Р. и др.
Angew Chem Int Ed Engl. 2019 сен 2; 58 (36): 12609-12616. doi: 10.1002/anie.2013. Epub 2019 1 августа.
Angew Chem Int Ed Engl. 2019.
PMID: 31283870
Обзор.
Джагерс Н.Р. и др.
Angew Chem Int Ed Engl. 2019 сен 2; 58 (36): 12609-12616. doi: 10.1002/anie.2013. Epub 2019 1 августа.
Angew Chem Int Ed Engl. 2019.
PMID: 31283870
Обзор.