Структура, свойства, номенклатура и применение пероксида бария (BaO2) / химия | Thpanorama
перекись бария представляет собой ионное и неорганическое соединение, химическая формула которого BaO2. Будучи ионным соединением, он состоит из ионов Ba2+ и O22-; последний то, что известно как анион перекиси, и из-за этого BaO2 приобретает его имя В таком случае, БаО2 Это неорганическая перекись.
Заряды его ионов показывают, как это соединение образуется из элементов. Металлический барий группы 2 дает два электрона молекуле кислорода, ИЛИ2, чьи атомы не используют их для восстановления до оксидных анионов, ИЛИ2-, но чтобы остаться объединенным простой связью, [O-O]2-.
Перекись бария представляет собой гранулированное твердое вещество при комнатной температуре, белое с легкими сероватыми тонами (верхнее изображение). Как и почти все пероксиды, с ним следует обращаться и хранить с осторожностью, так как он может ускорить окисление определенных веществ. .
.
Из всех пероксидов, образованных металлами группы 2 (г-н Бекамбара), BaO2 он термодинамически наиболее стабилен перед лицом своего термического разложения. При нагревании он выделяет кислород и образует оксид бария BaO. BaO может реагировать с кислородом из окружающей среды при высоких давлениях, чтобы снова образовать BaO2.
индекс
- 1 структура
- 1.1 Энергия кристаллической решетки
- 1.2 Гидраты
- 2 Подготовка или синтез
- 3 свойства
- 3.1 Внешний вид
- 3.2 Молекулярная масса
- 3.3 Плотность
- 3.4 Точка плавления
- 3.5 Точка кипения
- 3.6 Растворимость в воде
- 3.7 Термическое разложение
- 4 Номенклатура
- 5 использует
- 5.1 Производитель кислорода
- 5.2 Производитель пероксида водорода
- 6 Ссылки
Тетрагональная ячейка пероксида бария показана на верхнем изображении. Внутри него можно увидеть катионы2+ (белые сферы) и анионы O22- (красные сферы). Обратите внимание, что красные сферы связаны одинарной связью, поэтому они представляют линейную геометрию [O-O]2-.
Обратите внимание, что красные сферы связаны одинарной связью, поэтому они представляют линейную геометрию [O-O]2-.
Из этой унитарной ячейки вы можете построить кристаллы BaO2. Если наблюдается, анион O22- видно, что он окружен шестью ба2+, получить октаэдр, вершины которого белые.
С другой стороны, еще более очевидно, каждый Ба2+ окружен десятью22- (белая центральная сфера). Весь кристалл состоит из этого постоянного порядка в короткой и длинной дистанции.
Энергия кристаллической решеткиЕсли, кроме того, наблюдаются красно-белые сферы, то следует отметить, что они не сильно отличаются по своим размерам или ионным радиусам. Это потому, что катион Ba2+ Это очень объемный, и его взаимодействия с анионом О22- лучше стабилизировать ретикулярную энергию кристалла по сравнению с тем, как бы они, например, катионы Ca2+ и Mg2+.
Это также объясняет, почему BaO является наиболее нестабильным оксидом щелочноземельного металла: ионы Ba2+ и O2- Они значительно различаются по размеру, дестабилизируя свои кристаллы.
Поскольку это более нестабильно, тенденция BaO меньше2 разложить с образованием BaO; в отличие от пероксидов SrO2, CaO2 и MgO2, чьи оксиды являются более стабильными.
гидратыБаО2 можно найти в форме гидратов, из которых BaO2H 8H2Или это самый стабильный из всех; и на самом деле, это тот, который продается, а не безводный пероксид бария. Для получения безводного BaO необходимо высушить при 350 ° С2H 8H2Или с целью устранения воды.
Его кристаллическая структура также тетрагональна, но с восемью молекулами Н2Или взаимодействуя с O22- через водородные связи, и с Ba2+ через диполь-ионные взаимодействия.
Другие гидраты, о структуре которых не так много информации, это: BaO2H 10H2О, БаО2H 7H2О и БаО2∙ H2О.
Подготовка или синтезНепосредственное получение пероксида бария заключается в окислении его оксида. Это можно использовать из минерального барита или из соли нитрата бария, Ba (NO3)2; оба подвергаются нагреву в атмосфере воздуха или обогащаются кислородом.
Другой метод заключается в реакции Ba (NO) в холодной водной среде.3)2 с перекисью натрия:
Ба (НЕТ3)2 + не доступно2О2 + хн2O => BaO2∙ хН2O + 2NaNO3
Тогда гидрат BaO2∙ хН2Или он подвергается нагреву, его фильтруют и сушат в вакууме..
свойстваВнешний видЭто белое твердое вещество, которое может стать сероватым, если в нем присутствуют примеси (BaO, Ba (OH)2, или другие химические виды). Если его нагреть до очень высокой температуры, он испустит зеленоватое пламя из-за электронных переходов катионов Ва.2+.
Если его нагреть до очень высокой температуры, он испустит зеленоватое пламя из-за электронных переходов катионов Ва.2+.
169,33 г / моль.
плотность5,68 г / мл.
Точка плавления450 ° C.
Точка кипения800 ° С Это значение согласуется с тем, что следует ожидать от ионного соединения; и даже больше, из более стабильного пероксида щелочноземельного металла. Тем не менее, BaO на самом деле не кипятить2, но газообразный кислород выделяется в результате его термического разложения.
Растворимость в водеНеразрешимой. Однако он может медленно подвергаться гидролизу с образованием перекиси водорода, H2О2; и, кроме того, его растворимость в водной среде увеличивается, если добавить разбавленную кислоту.
Термическое разложениеСледующее химическое уравнение показывает реакцию термического разложения, испытываемого BaO2:
2BaO2 2BaO + O2
Реакция односторонняя, только если температура выше 800 ° С.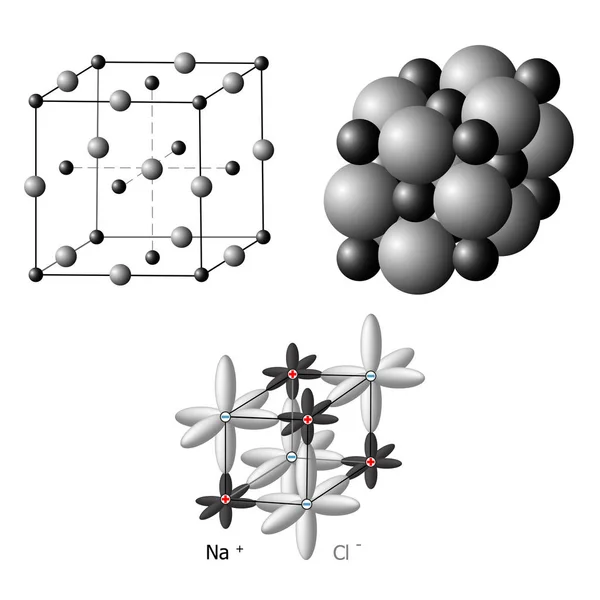 Если немедленно увеличить давление и снизить температуру, весь BaO будет преобразован обратно в BaO2.
Если немедленно увеличить давление и снизить температуру, весь BaO будет преобразован обратно в BaO2.
Еще один способ назвать БаО2 это перекись бария, согласно традиционной номенклатуре; поскольку барий может иметь только валентность +2 в его соединениях.
Неправильно, систематическая номенклатура используется для обозначения его как диоксид бария (бинооксид), считая его оксидом, а не пероксидом..
приложенийПроизводитель кислородаИспользуя минеральный барит (BaO), он нагревается сквозняками для устранения содержания кислорода при температуре около 700 ° C..
Если полученный пероксид подвергается слабому нагреву в вакууме, кислород регенерирует быстрее, и барит может быть повторно использован неопределенно долго для хранения и производства кислорода..
Этот процесс был коммерчески разработан Л. Д. Брином, в настоящее время устаревшим.
Производитель пероксида водородаПерекись бария реагирует с серной кислотой с образованием перекиси водорода:
BaO2 + H2SW4 => H2О2 + BaSO4
Поэтому является источником H2О2, манипулировали прежде всего с его гидратом BaO2H 8H2О.
В соответствии с этими двумя упомянутыми видами использования БаО2 позволяет развитие O2 и H2О2, как окислители, в органическом синтезе, так и в процессах отбеливания в текстильной и красильной промышленности. Это также хороший дезинфицирующий агент.
Кроме того, из БаО2 Другие пероксиды могут быть синтезированы, такие как натрий, Na2О2, и другие соли бария.
ссылки- S.C. Абрахамс, J Калнайс. (1954). Кристаллическая структура пероксида бария. Лаборатория исследований изоляции, Массачусетский технологический институт, Кембридж, Массачусетс, США..
- Wikipedia. (2018). Перекись бария. Получено с: en.wikipedia.org
- Дрожь и Аткинс. (2008). Неорганическая химия (Четвертое издание). Mc Graw Hill.
- Atomistry. (2012). Перекись бария. Получено с: barium.atomistry.com
- Хохар и соавт. (2011). Исследование подготовки лабораторных весов и разработка процесса для перекиси бария.
 Получено из: academia.edu
Получено из: academia.edu - PubChem. (2019). Перекись бария. Получено из: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Приготовление перекиси бария. Получено с: prepchem.com
Сборка тестов по химии по теме «Строение вещества»
6 Июн
Posted on Author admin 0
Чтобы поделиться, нажимайте
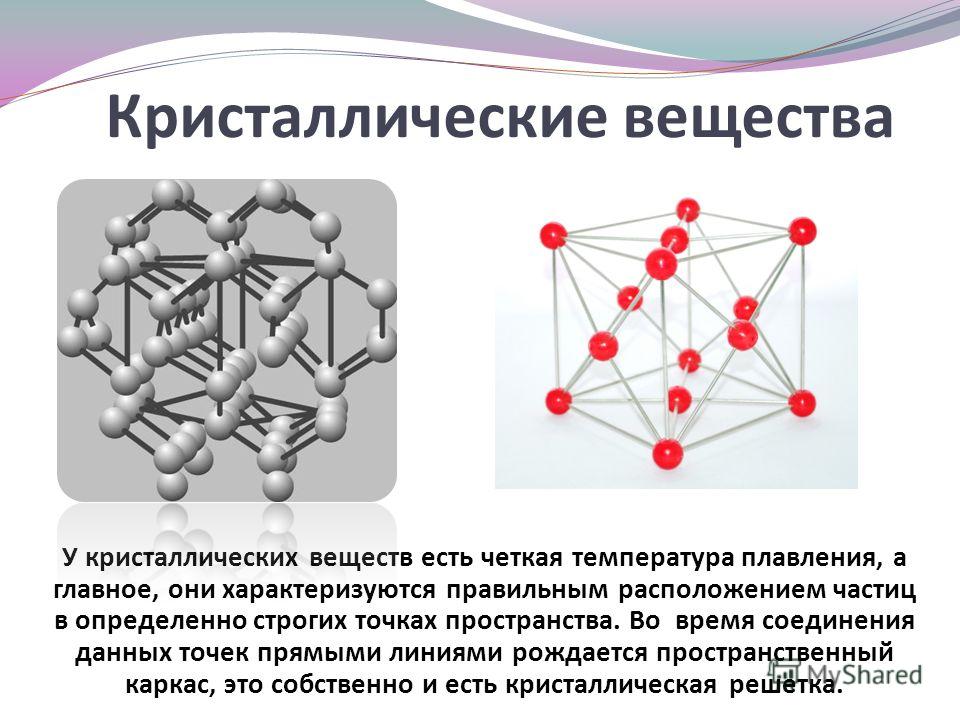
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Также вы можете ознакомиться со всеми тестами ЦТ по химии перейдя по ссылке http://www.yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
- Немолекулярное строение имеет: 1) фуллерен, 2) алмаз, 3) вода, 4) углекислый газ.
- Немолекулярное строение имеет: 1) железо, 2) водород, 3) кислород, 4) угарный газ.

- Ионную кристаллическую решетку имеет: 1) бромид калия, 2) бром, 3) калий, 4) бромоводород.
- Молекулярную кристаллическую решетку имеет: 1) литий, 2) оксид натрия, 3) красный фосфор, 4) белый фосфор.
- Молекулярную кристаллическую решетку имеет: 1) фторид серы (VI), 2) сульфид натрия, 3) графит, 4) натрий.
- Молекулярное строение имеет: 1) йод, 2) йодид калия, 3) гидроксид калия, 4) гидроксид алюминия.
- Немолекулярное строение имеет: 1) йод, 2) хлорид йода, 3) гидроксид калия, 4) уксусная кислота.

- Немолекулярное строение имеет: 1) цинк, 2) муравьиная кислота, 3) фтороводород, 4) кислород.
- Молекулярную кристаллическую решетку в твердом состоянии имеет: 1) иодид бария, 2) гидроксид бария, 3) барий, 4) йод.
- Ионную кристаллическую решетку имеет: 1) фтор, 2) фтороводород, 3) гидрид натрия, 4) хлорид титана(IV).
- Молекулярное строение имеет: 1) оксид кремния(IV), 2) нитрат бария, 3) хлорид натрия, 4) оксид углерода(II).

- Молекулярную кристаллическую решетку имеют: 1) H2O, CuO, 2) CuO, K2S, 3) K2S, H2SO4, 4) H2SO4, O2.
- Атомную кристаллическую решетку имеет: 1) графит, 2) железо, 3) карбонат кальция, 4) азотная кислота.
- Ионную кристаллическую решетку имеет: 1) фторид кальция, 2) оксид кремния, 3) алмаз, 4) медь.
- Вещество, имеющее низкую температуру плавления, возгоняющееся при нагревании, неэлектропроводное – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.

- Твердое, хрупкое вещество, расплав которого проводит электрический ток – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную
- Вещество, имеющее высокую электропроводность, ковкое, пластичное, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.
- Тугоплавкое хрупкое вещество, нерастворимое в воде, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную
- Атом является структурной единицей в кристаллической решетке: 1) фосфорной кислоты, 2) белого фосфора, 3) кремнезема, 4) хлорида аммония.
- В кристалле вольфрама частицы связаны металлической связью, поэтому вольфрам: 1) тугоплавок, 2) химически стоек, 3) электропроводен, 4) имеет высокую плотность.

- Ионный тип кристаллической решетки характерен для: 1) кислот, 2) металлов, 3) неметаллов, 4) солей.
- Из молекул состоит каждое из веществ: 1) поваренная соль и кислород, 2) оксид магния и хлороводород, 3) вода и хлор, 4) алмаз и сода.
- Атомную кристаллическую решетку имеет каждое из веществ: 1) алмаз и графит, 2) аммиак и йод, 3) озон и кислород, 4) вода и мел.
- Ионную кристаллическую решетку имеет каждое из веществ: 1) серная кислота и оксид углерода(IV), 2) гидроксид натрия и хлорид калия, 3) карбонат кальция и хлороводород, 4) оксид кремния и гидроксид меди(II).
- Верны ли следующие суждения о типах кристаллических решеток веществ в твердом состоянии? А) этанол имеет ионную кристаллическую решетку.

- Какие свойства характерны для вещества с атомной кристаллической решеткой? 1) нерастворимость в воде и тугоплавкость, 2) хрупкость и легкоплавкость, 3) растворимость в воде и летучесть, 4) хорошая тепло- и электропроводность.
- В твердых веществах молекулярного строения химическая связь: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная
- В твердых веществах атомного строения химическая связь между атомами: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная
- Некоторое вещество тугоплавко и не проводит электрический ток ни в твердом виде, ни в расплаве.
 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. - Некоторое вещество тугоплавко и не проводит электрический ток в твердом виде, но его водный раствор обладает электрической проводимостью. Какую кристаллическую решетку имеет это вещество? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Выберите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку: 1) С (графит), 2) SiO2, 3) SiC, 4) CO2
- Выберите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) SiO2, 2) SiH4, 3) O2, 4) Na.
- Выберите вещество, которое в твердом состоянии имеет ионную кристаллическую решетку: 1) N2O5, 2) HNO3, 3) NH4NO3, 4) NH3.

- Какое свойство характерно для веществ с атомной кристаллической решеткой? 1) высокая плотность, 2) тугоплавкость, 3) хорошая растворимость в воде, 4) электропроводность.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) хлор и водород, 2) вода и алюминий, 3) поваренная соль и серная кислота, 4) кремнезем и гидроксид натрия.
- Запахом обладают вещества, имеющие кристаллическую решетку: 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Молекулярную решетку в кристаллическом состоянии имеет: 1) хлорид натрия, 2) хлор, 3) натрий, 4) гидроксид натрия.
- Хлорид-ионы отсутствую в кристаллах: 1) хлорида натрия, 2) хлорида кальция, 3) хлорида фосфора(V), 4) хлорида цезия.

- Ионную кристаллическую решетку в кристаллическом состоянии имеет: 1) бром, 2) вода, 3) серная кислота, 4) карбонат натрия.
- Металлическую кристаллическую решетку имеет: 1) NH3, 2) AlCl3, 3) Cu3Al, 4) CuO.
- Один и тот же тип решетки в кристаллическом состоянии имеют вода и: 1) железо, 2) углекислый газ, 3) поваренная соль, 4) алмаз.
- Легкоплавкое кристаллическое вещество хорошо растворимо в этаноле и не проводит электрический ток ни в расплаве, ни в растворе. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Тугоплавкое кристаллическое вещество нерастворимо в воде и хорошо проводит теплоту и электрический ток.
 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. - Тот же тип кристаллической решетки, что и у сульфата натрия, имеет: 1) красный фосфор, 2) хлороводород, 3) серная кислота, 4) сульфид бария.
- Тот же тип кристаллической решетки, что и у натрия, имеет: 1) хлорид цинка, 2) сульфат натрия, 3) карбонат натрия, 4) золото.
- Тот же тип кристаллической решетки, что и у кислорода, имеет: 1) бром, 2) оксид натрия, 3) поваренная соль, 4) калий.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) фтор и фторид натрия, 2) хлор и хлорид калия, 3) хлорид натрия и гидроксид калия, 4) оксид хлора(VII) и гидроксид калия.

- Оксид алюминия в кристаллическом состоянии имеет тот же тип кристаллической решетки, что и: 1) алюминий, 2) кислород, 3) фтор, 4) фторид алюминия.
- Ванилин представляет собой легкоплавкое кристаллическое вещество с характерным запахом. Какой тип кристаллической решетки он имеет? 1) атомный, 2) молекулярный, 3) ионный, 4) металлический.
- Атомную решетку в кристаллическом состоянии имеет: 1) азот, 2) аммиак, 3) карбид кремния, 4) платина.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) натрий и хлорид натрия, 2) сульфат бария и барий, 3) сульфат бария и серная кислота, 4) серная кислота и оксид серы(VI).

- Для твердых веществ с молекулярной кристаллической решеткой характерна высокая: 1) плотность, 2) температура плавления, 3) летучесть, 4) энергия связи между молекулами.
- Для твердых веществ с металлической кристаллической решеткой характерна низкая: 1) теплопроводность, 2) плотность, 3) летучесть при комнатной температуре, 4) электропроводность.
- Для твердых веществ с ионной кристаллической решеткой характерна низкая: 1) температура плавления, 2) энергия связи между ионами, 3) растворимость в воде, 4) летучесть.
- Твердое вещество с ионной кристаллической решеткой расплавили.
 Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток.
Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток. - Атомную кристаллическую решетку не образует: 1) кремний, 2) германий, 3) алюминий, 4) углерод.
- Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, не электропроводно, то его кристаллическая решетка: 1) молекулярная, 2) атомная, 3) ионная, 4) металлическая.
- Понятие «молекула» не применимо по отношению к структурной единице вещества: 1) хлороформа, 2) кислорода, 3) алмаза, 4) озона.

- Атомная кристаллическая решетка характерна для: 1) алюминия и карбида алюминия, 2) серы и йода, 3) оксида кремния и хлорида натрия, 4) алмаза и бора.
- Вещества, имеющие молекулярную кристаллическую решетку, как правило: 1) тугоплавкие и хорошо растворимые в воде, 2) легкоплавкие и летучие, 3) твердые и электропроводные, 4) теплопроводные и пластичные.
Ответы приведены в конце страницы.
А вот некоторые задания ЦТ и ЕГЭ с видео-объяснением:
А18 ЦТ 2010. Укажите названия веществ, в молекулах которых содержатся кратные связи и все атомы лежат в одной плоскости: а) стирол; б) фенилацетилен; в) сероводород; г) бутин-1:
- б, г
- а, г
- а, б
- б, в
А19 ЦТ 2010. Укажите название вещества, которое в твёрдом состоянии имеет атомную кристаллическую решётку:
- серная кислота
- оксид кремния (IV)
- алюминий
- водород
Досрочный ЕГЭ 2018. Из предложенного перечня веществ выберите два вещества, в которых присутствует ковалентная неполярная химическая связь.
1) этан;
2) азотная кислота;
3) гидроксид бария;
4) хлор;
5) аммиак;
Запишите в поле ответа номера выбранных веществ.
Также вы можете ознакомиться со всеми тестами ЦТ по химии перейдя по ссылке http://www. yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
Ответы:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 2 | 1 | 1 | 4 | 1 | 1 | 3 | 1 | 4 | 3 | 4 | 4 | 1 | 1 | 3 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 1 | 2 | 4 | 3 | 3 | 4 | 3 | 1 | 2 | 2 | 1 | 4 | 1 | 1 | 3 |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 |
| 4 | 1 | 3 | 2 | 1 | 2 | 2 | 3 | 4 | 3 | 2 | 2 | 4 | 4 | 4 |
| 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| 1 | 3 | 4 | 2 | 3 | 4 | 3 | 3 | 4 | 4 | 3 | 3 | 3 | 4 | 2 |
А также вы можете проделать большое число заданий на эту тему с подробными видео-объяснениями в отдельном разделе «Химическая связь и строение вещества»
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
____________________________________________________________________________
__________________________________________________________________________________________________________________________________________
Оксид бария
Кристалл: BaO
Состав: NaCl
_____________________________________________________________________
Параметр решетки: | 2,76 Å |
Плотность: | г/см 3 |
Константы жесткости
: в 10 11 дин/см 2 , при комнатной температуре
c 11 : См. ссылку. 1, 2
ссылку. 1, 2
с 12 :
в 44 :
Сжимаемость (в 10 11 дин/см 2 ):
Коэффициент Пуассона:
Температура Дебая: 272 К
Температура плавления: 1380 С (возгон) 1928 или 1917
Фононный спектр обсуждался: см. J. Phys. хим. соц. июль/август. 1975
Поперечный оптический фонон T0 (k=0): Parodi цитирует 189 см -1 ИК абс.
Долгота оптического фонона L0 (k=0): см -1
Постоянная Грюнайсена:
Отношение е*/е:
Фотоупругие константы:
р 11 :
р 12 :
р 44 :
- Электронные свойства:
Ширина запрещенной зоны: прямая: 4,0 или 4,8 эВ (Henderson & Hughes) или 3,95 (Бессент)
Первый экситон: 4,06 эВ. (Код 3)
(Код 3)
Ширина валентной зоны: 8,4 эВ
(Mott-Gurney, «Электронные процессы в ионных кристаллах», 2-е издание (1950 г.))
Структура группы обсуждалась:
Статическая диэлектрическая проницаемость: 34 (НЕ 14,4)
Оптическая диэлектрическая проницаемость: 3,83
Подвижность электронов:
Мобильность отверстия:
Полярная константа связи:
a = (для m*=1)
Эффективная масса:
диапазон проводимости:
валентная зона:
Сродство к электрону: (в эВ, от дна зоны проводимости в вакууме)
0,5 (Ссылка 4) или 0,57 (Ссылка 5)
Спин-орбитальное взаимодействие: (валентная зона)
Катионная поляризация: 1,550 Å -3
Анионная поляризация: 3,050 Å -3
____________________________________________________________________________
Каталожные номера:
1. Веттер В.Х., Шахин Р.А. Bartels Упругие константы монокристалла BaO и их температурная зависимость, J. Phys. Хим.Сол. 34 , 1448 (1973)
Веттер В.Х., Шахин Р.А. Bartels Упругие константы монокристалла BaO и их температурная зависимость, J. Phys. Хим.Сол. 34 , 1448 (1973)
2. З. Чанг, Э.К. Graham Упругие свойства оксидов в структуре NaCl, J. Phys. хим. соц. 38 , 1355 (1977)
3. Б. Ульрици, В. Ульрици, Н.Н. Ковалев Оптическое поглощение в монокристаллах SrO, Сов. физ. Сол. ул. 17 , 2305 (1976)
4. С. 60, 13 (1948)
5. К.Ю. Цоу и Э.Б. Hensley Электронное сродство халькогенидов щелочноземельных металлов, J. Appl. физ. 45 , 47 (1974)
_____________________________________________________________________
Новый анализ объясняет роль дефектов в оксидах металлов | MIT News
Иногда технические дефекты, такие как несовершенства кристаллической решетки материала, могут на самом деле вызывать изменения свойств, которые открывают новые виды полезных приложений. Новое исследование, проведенное группой из Массачусетского технологического института, показывает, что такие недостатки в семействе материалов, известных как изолирующие оксиды металлов, могут быть ключом к их эффективности для различных высокотехнологичных приложений, таких как микросхемы энергонезависимой памяти и технологии преобразования энергии.
Новое исследование, проведенное группой из Массачусетского технологического института, показывает, что такие недостатки в семействе материалов, известных как изолирующие оксиды металлов, могут быть ключом к их эффективности для различных высокотехнологичных приложений, таких как микросхемы энергонезависимой памяти и технологии преобразования энергии.
Результаты исследования опубликованы на этой неделе в журнале Physical Review Letters , в статье доцента Массачусетского технологического института Бильге Йилдиз, профессора и младшего проректора Кристин Ван Влит и бывшего постдока Мостафы Юссефа.
Эти оксидно-металлические материалы исследовались многими исследователями, говорит Йилдиз, и «их свойства во многом зависят от количества и типа присутствующих дефектов». По ее словам, при воздействии сильных движущих сил, таких как сильные электрические поля, «поведение таких дефектов не было хорошо изучено».
У исследователей есть хорошо зарекомендовавшее себя теоретическое понимание того, как прекрасно структурированные версии этих изолирующих оксидов металлов функционируют в различных условиях, например, в сильных электрических полях, но такой теории для описания материалов, когда они содержат общие типы, не существовало. дефектов, по словам Йылдыза. Количественное понимание этих эффектов важно для разработки этого многообещающего семейства материалов для потенциальных приложений, включая новые типы низкоэнергетической компьютерной памяти и устройств обработки, электрическое охлаждение и электрокаталитические устройства преобразования энергии, такие как топливные элементы.
дефектов, по словам Йылдыза. Количественное понимание этих эффектов важно для разработки этого многообещающего семейства материалов для потенциальных приложений, включая новые типы низкоэнергетической компьютерной памяти и устройств обработки, электрическое охлаждение и электрокаталитические устройства преобразования энергии, такие как топливные элементы.
Команда продемонстрировала теоретическую основу и показала, как стабильность и структура точечного дефекта изменяются под действием сильных электрических полей. Они взяли общий дефект, называемый нейтральной кислородной вакансией — место, где в решетке должен появиться атом кислорода, но вместо этого захвачены два электрона. Их результаты позволили количественно оценить поляризационное поведение материала с этим дефектом в электрическом поле.
«Кислородные вакансии особенно важны в электронных и электрохимических приложениях», — говорит Йилдиз, который занимает совместные должности в отделах ядерной науки и инженерии, а также материаловедения и инженерии.
Во многих из этих приложений, говорит она, может быть внутренний градиент напряжения, созданный внутри тонкопленочного материала, и этот градиент «электрического потенциала» вызывает сильные электрические поля. Понимание эффектов этих полей необходимо для разработки некоторых новых устройств.
«Большая часть работ в этой области носит экспериментальный характер, — говорит Йылдыз. «Вы берете тонкую пленку, помещаете ее в электрическое поле и проводите измерения». Но в таких экспериментах эффекты локального электрического потенциала и электрического поля запутаны, что очень затрудняет понимание результатов. «Невозможно отделить их друг от друга, поэтому вам нужна теория», чтобы объяснить эффекты, добавляет она.
Исследователи разработали новую теоретическую основу, которая позволяет им отделить эффект электрического поля от эффекта электрического потенциала и количественно оценить их независимо друг от друга. По словам Йылдыза, это позволило им сделать очень конкретные предсказания, отличные от предсказаний классической теории, и должно позволить экспериментально проверить новую модель в течение года.
Результаты должны помочь в разработке некоторых важных потенциальных приложений, говорит она. Одним из них является новый тип компьютерного запоминающего устройства, известного как память с резистивным переключением, которая обеспечивает высокую скорость переключения при очень небольшом потреблении энергии. Эти устройства памяти полагаются на наличие дефектов.
«То, как они переключают свое состояние сопротивления [для записи данных], зависит от типа дефекта, содержания и распространения», — говорит она. «Чтобы смоделировать поведение устройства, вы должны иметь возможность моделировать, как приложенные сильные электрические поля изменяют структуру, концентрацию и распределение дефектов». Вот что позволяет эта новая работа: «Если вы знаете количественные эффекты как потенциала, так и поля, то вы можете спроектировать свои рабочие условия, чтобы извлечь выгоду из этих эффектов».
Понимание этих эффектов также важно для других приложений, таких как расщепление молекул воды для получения водорода на границах раздела твердое тело-жидкость, электронных устройств, которые основаны на границах раздела оксид-оксид, или других электрохимических процессов с использованием этих материалов в качестве катализаторов, где дефекты служат местами. которые обеспечивают взаимодействие.
которые обеспечивают взаимодействие.
Материалы, которые изучала команда, принадлежат к классу, известному как бинарные оксиды щелочноземельных металлов, компоненты которых являются «одними из самых распространенных классов материалов на Земле», — говорит Йилдиз. «[Этот класс] дешев, распространен и обладает настраиваемыми свойствами», что делает его многообещающим для многих приложений. Но она добавляет, что теоретический подход, который они избрали, теперь будет применяться гораздо шире, ко многим другим типам оксидных материалов и к другим типам дефектов в них, помимо нейтральных кислородных вакансий.
«Эта работа устанавливает новую парадигму изучения дефектов в полупроводниках путем создания необходимой математики для расчета энергии образования дефектов в электрически стимулированных дефектных кристаллах», — говорит Чезаре Франчини, доцент кафедры физики вычислительных материалов в Венский университет, который не участвовал в этой работе. «Эта работа расширяет существующие теории, которые связывают термодинамику с электрической поляризацией, и будет полезна практически для всех приложений, в которых дефекты (и их возможность настройки с помощью электрических стимулов) являются преимуществом, включая катализ, электронику и электрокалорические устройства».

 Получено из: academia.edu
Получено из: academia.edu




 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.

 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.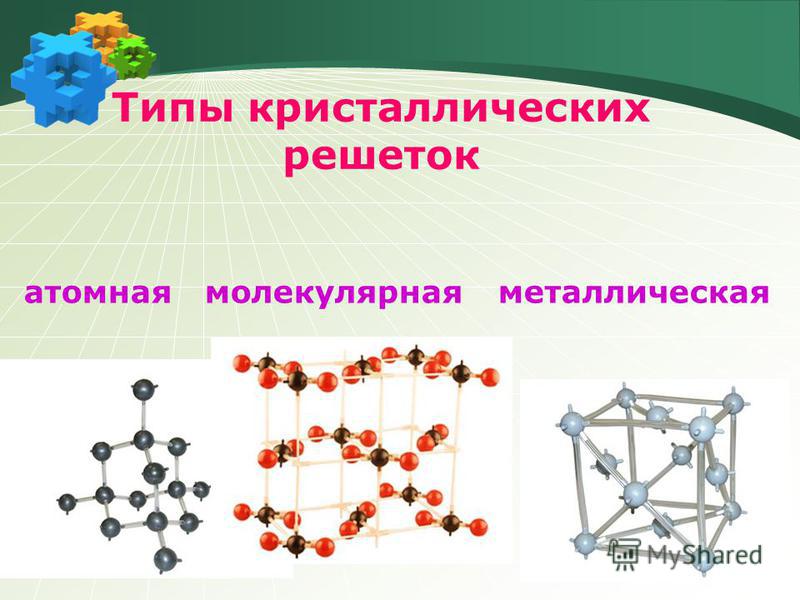

 Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток.
Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток.