Тест ЕГЭ на тему «Химическая связь и строение вещества».
Тест ЕГЭ на тему «Химическая связь и строение вещества».
№3
1. Ковалентные неполярные связи имеются в молекуле
1) HCl 2) Br2 3) H2O 4) CO2
2. В ряду СН3—СН3—СН2=СН2—СН=СН(последняя тройная связь)
1) уменьшаются углы между связями
2) уменьшается кратность связи
3) уменьшается прочность связи
4) уменьшается длина связи
3. Только ковалентные связи имеются в соединении:
1) гидроксид бария 3) оксид кальция
2) серная кислота 4) хлорид аммония
4. Только ковалентные связи имеются в соединении:
1) гидроксид калия 3) оксид калия
2) сернистая кислота 4) хлорид аммония
5. Связь, осуществленная за сет общей пары электронов, называется
Связь, осуществленная за сет общей пары электронов, называется
1) ионной 2) водородной 3) ковалентной 4) металлической
6. Ковалентная химическая связь всегда реализуется между:
1) атомами металлов и неметаллов 3) атомами металлов
2) атомами неметаллов 4) молекулами
7. Кратные связи отсутствуют в молекуле
1) бериллий 2) азот 3) литий 4) бор
8. Способность к образованию водородной связи возрастает в ряду:
1) HF—HCl—HBr—HI 3) NH3—PH3—AsH3—SbH3
2) H2Te—H2Se—H2S—H2O 4)HF—H2O—NH3—CH4
9. Между атомами элементов с порядковыми номерами 1 и 8 химическая связь
1) ионная 3) ковалентная полярная
2) водородная 4) ковалентная неполярная
10. Водородная связь образуется между молекулами
Водородная связь образуется между молекулами
1) иода 2) водорода 3) воды 4) фтора
11. Образование молекулы водорода из двух атомов можно отнести
1) к донорно — акцепторному механизму образования ковалентной неполярной связи
2) к обменному механизму образования ковалентной неполярной связи
3) к донорно — акцепторному механизму образования ковалентной полярной связи
4) к обменному механизму образования ковалентной полярной связи
12. Длина связи элемент – кислород в ряду TeO2—SO2—SeO2
1) Уменьшается 3) не изменяется
2) увеличивается 4) нет чёткой зависимости
13. Соединения, в котором имеются одновременно и ковалентные, и ионные связи:
1) нитрат бария 2) диоксид азота 3) 1-фторпропан 4) 2-фторпропан
14. Между молекулами воды реализуется связь
1) ионная 3) водородная
2) ковалентная полярная 4) ковалентная неполярная
15. Ионные связи имеются в веществе
Ионные связи имеются в веществе
1) гидроксид бария 3) серная кислота
2) озон 4) диоксид азота
16. Между атомами элементов с порядковыми номерами 1 и 7 химическая связь
1) ковалентная полярная 3) ковалентная неполярная
2) водородная 4) ионная
17. Водородная связь образуется между молекулами
1) фтороводорода 2)водорода 3) сероводорода 4) фтора
18. Не может образовывать водородные связи в водном растворе
1) HF 2)H2O 3) NH3 4)CH4
19. Соединения, в котором осуществляется ионная связь:
1) оксид углерода(II) 3) метан
2) бромид калия 4) кислород
20. Набор веществ, в которых имеются только ковалентные связи:
1) гидроксид кальция, кислород
2) угольная кислота, оксид натрия
3) диоксид серы, пероксид водорода
4) нитрат аммония, дихромат натрия
21. Между атомами элементов с порядковыми номерами 11 и 17 химическая связь
Между атомами элементов с порядковыми номерами 11 и 17 химическая связь
1) ионная 3) ковалентная полярная
2) металлическая 4) ковалентная неполярная
22. Ковалентная полярная связь имеется в веществе
1) хлороводород 3) хлорид натрия
2) бром 4) углерод
23. Вещество, в котором есть как ионные, так и ковалентные полярные связи:
1) Na2SO4 2) NaCl 3) BCl3 4) O3
24. Только ионная химическая связь присутствует в
1) карбонате калия 3) хлориде бария
2) гидросульфиде натрия 4) нитрате бария
25. Полярность связи в ряду HF—HCl—HBr—HI
1) уменьшается 3) не изменяется
2) возрастает 4) не подчиняется чёткой зависимости
26. И ионная, и ковалентная полярная химическая связь реализуется в веществе
1) гидроксид бария 2) серная кислота 3) кислород 4) аммиак
27. Не только ковалентные химические связи имеются в соединении
Не только ковалентные химические связи имеются в соединении
1) вода 2) хлорид аммония 3) аммиак 4) метан
28. Между молекулами воды реализуется химическая связь
1) ионная 3) водородная
2) ковалентная полярная 4) ковалентная неполярная
29. Между атомами элементов с порядковыми номерами 1 и 7 химическая связь
1) ковалентная полярная 3) ионная
2) ковалентная неполярная 4) металлическая
30. Полярность связи Э—F уменьшается в ряду
1) дифторид кислорода, трифторид брома
2) тетрафторид селена, трифторид азота
3) трифторид азота, тетрафторид углерода
4) фторид водорода, трифторид алюминия
31. Ионы являются структурными единицами каждого вещества в паре
1) фосфин и кислород
2) азот и азотная кислота
3) сульфид калия и иодид кальция
4) гидроксид бария и пентахлорид фосфора
32. Ионы являются структурными единицами каждого вещества в паре
Ионы являются структурными единицами каждого вещества в паре
1) вода и диоксид серы
2) хлорид аммония и хлорат калия
3) гидрат аммония и гидроксид натрия
4) сульфид бария и хлорноватистая кислота
33. В ряду H2O —H2S— H2Se происходит увеличение
1) полярности связи 3) основных свойств
2) угла связи между связями 4) длины связи
34. Ионы являются структурными единицами каждого вещества в паре
1) гидроксид бария и нитрат серебра 3) серная кислота и оксид бария
2) серная кислота и хлорид магния 4) бром и бромоводородная кислота
35. Между атомами элементов с порядковыми номерами 1 и 16 химическая связь
1) ковалентная полярная 3) ионная
2) ковалентная неполярная 4) металлическая
36. Между атомами элементов с порядковыми номерами 19 и 17 химическая связь
1) ковалентная полярная 3) ионная
2) ковалентная неполярная 4) металлическая
37. Между атомами элементов с порядковыми номерами 16 и 8 химическая связь
Между атомами элементов с порядковыми номерами 16 и 8 химическая связь
1) ковалентная полярная 3) ионная
2) ковалентная неполярная 4) металлическая
38. Ковалентная химическая связь имеется в веществе
1) хлорид бария 3) фторид натрия
2) дисульфид углерода 4) серебро
39. Соединения, в котором присутствуют одновременно и ковалентная, и ионная химическая связь:
1) нитрат аммония 2) уксусная кислота 3) серная кислота 4) азот
40. К соединениям с ковалентной полярной химической связью относится
1) хлор 2) иодид лития 3) аммиак 4) фосфор
41. Наибольшей является прочность в молекуле
1) селеноводорода 2)воды 3) фтороводорода 4) сероводорода
42. Соединения, в котором присутствуют одновременно и ковалентные, и ионные химические связи – это
1) ацетат калия 2) хлорид бериллия 3) нитрид бора 4) сероводород
43. Верны ли следующие утверждения для галогенов?
Верны ли следующие утверждения для галогенов?
А) С увеличением порядкового номера галогенов от хлора к иоду изменяется агрегатное состояние простых веществ при нормальных условиях.
Б) От фтора к брому увеличивается сила водородных кислот.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
44. Верны ли следующие утверждения о металлах?
А) в узлах кристаллической решетки металлов находятся положительно заряженные ионы
Б) Металлы обладают электропроводностью
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
45. Только ковалентные химические связи имеются в соединениях
1) диоксид азота и нитрат серебра 3) сульфат лития и диоксид углерода
2) хлорид бериллия и азот 4) метан и формиат натрия
46. Соединениями только с ковалентными химическими связями являются
Соединениями только с ковалентными химическими связями являются
1) серная кислота и кислород 3) вода и гидроксид калия
2) соляная кислота и хлорид бария 4) хлор и перхлоратаммония
47. Ковалентная неполярная связь имеется в веществе
1) хлороводород 2) бром 3) вода 4) диоксид углерода
48. Полярность связи наименьшая в соединении:
1) сероводород 2) фтороводород 3) водород 4) оксид углерода
49. Полярность связи увеличивается в ряду
1) HCl, HBr, HI 3) HI, HBr, HCl
2) HBr, HCl, HI 4) HCl, HI, HBr
50. Наиболее полярной является связь в молекуле
1) фтороводорода 2) фосфина 3) аммиака 4) хлороводорода
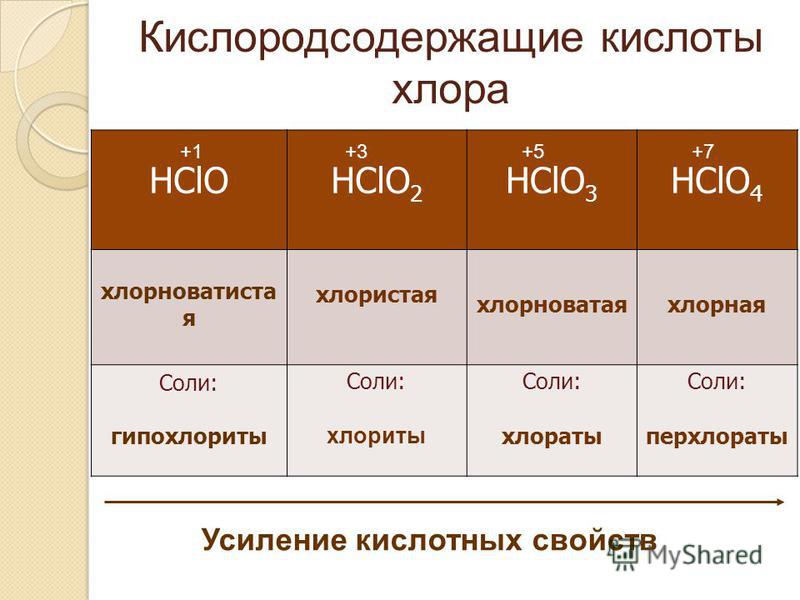
Химия в действии, Ч.2
Химия в действии, Ч.2
Оглавление11. ПЕРИОДИЧЕСКИЙ ЗАКОН ПЕРИОДИЧЕСКИЙ ЗАКОН11.1 Периодичность СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ПЕРИОДИЧНОСТЬ ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 12. ВОДОРОД И ВОДА 12.1. ВОДОРОД ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА 12.2 Вода ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ КАЧЕСТВО ВОДЫ ЗАГРЯЗНЕНИЕ ВОДЫ ОЧИСТКА И ПОДГОТОВКА ВОДЫ ОКЕАНЫ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 13. s-Металлы 13.1 Структура и свойства s-металлов СТРУКТУРА ФИЗИЧЕСКИЕ СВОЙСТВА РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ 13.2 Соединения, образуемые s-металлами ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ ГИДРОКСИДЫ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ 13.  3. Распространенность в природе, получение и применение 3. Распространенность в природе, получение и применениеПОЛУЧЕНИЕ S-МЕТАЛЛОВ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 14. d-ЭЛЕМЕНТЫ 14.1. Структура и свойства d-элементов d-ЭЛЕМЕНТЫ ФИЗИЧЕСКИЕ СВОЙСТВА ХИМИЧЕСКИЕ СВОЙСТВА 14.2 Химия семи d-элементов МАРГАНЕЦ ЖЕЛЕЗО КОБАЛЬТ НИКЕЛЬ МЕДЬ ЦИНК 14.3. Распространенность в природе, получение и применения ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 15. ЭЛЕМЕНТЫ III-VI ГРУПП 15.1. Алюминий и другие элементы III группы БОР ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ 15.2. IV группа периодической системы СОЕДИНЕНИЯ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД ПРИМЕНЕНИЯ УГЛЕРОДА ПРИМЕНЕНИЯ КРЕМНИЯ ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА 15.  3. Элементы V группы 3. Элементы V группыРАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА СОЕДИНЕНИЯ АЗОТА СОЕДИНЕНИЯ ФОСФОРА 15.4. Элементы VI группы. Кислород и сера КИСЛОРОД СОЕДИНЕНИЯ КИСЛОРОДА СЕРА СОЕДИНЕНИЯ СЕРЫ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ 16.1. Галогены ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ 16.2. Соединения галогенов ГАЛОГЕНОВОДОРОДЫ КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ 16.3. Распространенность, получение и применение галогенов и их соединений ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ 7.1.  Органическая химия Органическая химияНОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ УГЛЕВОДОРОДЫ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 17.2. Молекулярная структура органических соединений КОНФОРМАЦИИ СТЕРЕОИЗОМЕРИЯ 17.3. Механизмы органических реакций ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 18. УГЛЕВОДОРОДЫ 18.1. Алифатические углеводороды АЛКАНЫ АЛКЕНЫ АЛКИНЫ 18.2. Арены БЕНЗОЛ МЕТИЛБЕНЗОЛ 18.3. Природные источники, получение и применения ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ ПЕРЕРАБОТКА НЕФТИ ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ 19.1. Органические галогенсодержащие соединения ГАЛОГЕНОАЛКЕНЫ ГАЛОГЕНОАРЕНЫ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ 19.  2. Спирты, фенолы и эфиры 2. Спирты, фенолы и эфирыФЕНОЛЫ ПРОСТЫЕ ЭФИРЫ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ 19.3. Карбонильная группа ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ КАРБОНОВЫЕ КИСЛОТЫ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ АМИДЫ РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ 19.4 Амины и родственные соединения СОЛИ ДИАЗОНИЯ ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ВОПРОСЫ ДЛЯ ПРОВЕРКИ 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ АМИНОКИСЛОТЫ ПЕПТИДЫ БЕЛКИ 20.2. Углеводы и нуклеиновые кислоты НУКЛЕИНОВЫЕ КИСЛОТЫ 20.3. Жиры, масла и другие природные соединения ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ ВОСКИ ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ ВИТАМИНЫ АЛКАЛОИДЫ 20.4. Полимеры ПОЛИМЕРИЗАЦИЯ НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО ВОПРОСЫ ДЛЯ ПРОВЕРКИ ПРИЛОЖЕНИЯ |
Связи $BaO$ ковалентные или ионные?
Последняя обновленная дата: 16 января 2023 г.
•
Общее представление: 147,9K
•
Просмотр сегодня: 4.44K
Ответ
Проверено
147,9K+ просмот этот вопрос, сначала мы должны знать разницу между ионной и ковалентной связью. Кроме того, мы должны знать, что данная молекула представляет собой оксид бария и состоит из бария и кислорода.
Полный пошаговый ответ:
Давайте полностью поймем ответ на этот вопрос.
Во-первых, мы поймем разницу между ионными и ковалентными связями. Есть много типов химических связей, которые связывают молекулы вместе. Наиболее важными типами связи являются ионная и ковалентная связи. При ионной связи происходит перенос электронов, тогда как при ковалентной связи происходит совместное использование электронов.
Нам нужен один донор электронов и один акцептор электронов в случае ионной связи, но в случае ковалентных связей атомы с одинаковой электроотрицательностью делят электроны. Кроме того, ионные связи образуются между металлом и неметаллом, а ковалентные связи образуются между двумя неметаллами.
В этом вопросе нам нужно определить, является ли $BaO$ ковалентным или ионным. Вот в данном случае барий — металл, а кислород — неметалл. Ионные связи обычно возникают между металлическими элементами и неметаллическими элементами. Следовательно, между металлом и неметаллом существует связь, поэтому образующаяся связь будет ионной.
Следовательно, $BaO$ имеет ионную связь.
Примечание:
Следует отметить, что ионные связи образуются за счет электростатических сил притяжения между металлами и неметаллами, а ковалентные связи образуются за счет совместного использования электронов между двумя неметаллами и могут быть одинарными, двойными и тройной связи, и это зависит от числа валентных электронов.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
фосфин получается из следующей руды A Calcium Class 12 Chemistry Jee_main
Трендовые сомнения
Оксид бария (BAO).
 также называется «Бария». Остановимся на свойствах оксида бария.
также называется «Бария». Остановимся на свойствах оксида бария.Оксид бария является негорючим соединением. При контакте с окружающей средой поглощает воду. Большое количество оксида бария вызывает раздражение, а чрезмерное количество может привести к смерти. Его получают путем термического разложения нитрата бария.
Оксид бария используется в качестве катализатора во многих реакциях. Давайте предскажем имя IUPAC, номер CAS, идентификатор ChemSpider и другие подобные факты в этой статье.
Оксид бария Название IUPACНазвание IUPAC Оксид бария — это барий, монооксид или оксобарий.
Химическая формула оксида барияОксид бария имеет химическую формулу BaO. Этот барий содержит 2 электрона и кислород 6 электронов. Барий отдает два электрона кислороду и получает Ba 2+ и кислород O 2- состояние.
Оксид бария Номер CAS Предполагаемый номер CAS для оксида бария 1304-28-5 .
ChemSpider ID для оксида бария: 56180 .
Химическая классификация оксида бария- Оксид бария представляет собой ионное соединение.
- Оксид бария представляет собой комбинацию бария, катиона металла, и кислорода, аниона неметалла, образующего оксид металла.
- Оксид бария можно записать следующим образом.
Установлено, что молярная масса оксида бария составляет 153,33 г/моль.
Цвет оксида барияЦвет оксида бария варьируется от белого до желтого.
Молярная плотность оксида бария Молярная плотность оксида бария составляет 5,72 г/см3.
Температура плавления оксида бария наблюдалась при 1923 0 C (3493 0 F, 2196 K).
Температура кипения оксида барияОксид бария кипит при ~ 2000 0 C (3630 0 F, 2270 K).
Состояние оксида бария при комнатной температуреОксид бария находится в твердом состоянии при комнатной температуре.
Ионная связь оксида барияУстановлено, что связь в оксиде бария является ионной, где происходит перенос электронов от бария к кислороду.
Оксид бария ионный радиусв оксиде бария, ионный радиус BA 2+ — 1,34 A 0 , а ионный радиус O 2-— 1,32 A .
Электронные конфигурации оксида бария Электроны располагаются в особой оболочке вокруг ядра; это называется электронной конфигурацией. Давайте посмотрим на электронную конфигурацию оксида бария.
Давайте посмотрим на электронную конфигурацию оксида бария.
Электронная конфигурация бария и кислорода в оксиде бария приведена ниже.
Ba → [Xe] 6s 2
O → 1s 2 2s 2 2p 4 Оксид бария имеет степень окисления +2 для бария и степень окисления -2 для кислорода. Оксид бария имеет щелочную природу. Как мы знаем, барий является металлом, когда он реагирует с водой, давая основной оксид . Оксид бария представляет собой порошок без запаха. Наличие неспаренных электронов указывает на парамагнитные свойства, а наличие спаренных электронов указывает на диамагнетизм. Оксид бария диамагнитен по своей природе, так как содержит O 2-, не имеющий неспаренных электронов. Оксид бария реагирует с водой и дает гидроксид бария, который также называют гидратами оксида бария. BaO+H 2 O → Ba (OH 2 ) Кристаллическая структура оксида бария предсказана как кубическая CF8. 81
Степень окисления оксида бария  Посмотрим, является ли BaO парамагнитным или диамагнитным.
Посмотрим, является ли BaO парамагнитным или диамагнитным.
Таблица, представляющая кристаллическую структуру оксида бария Crystal family Centering type Atom in conventional unit cell cubic all faces centered number C F 8
 Значение полярности связи для оксида бария составляет 2,5, что рассчитывается по разнице электроотрицательностей между атомами.
Значение полярности связи для оксида бария составляет 2,5, что рассчитывается по разнице электроотрицательностей между атомами. BaO(т) + H 2 SO 4 (л) → BaSO 4 (т) +H 2 O (л)
Bail + 9H0076 BaSO0295 2 +H 2 O
Реакция оксида бария с основаниемОксид бария не реагирует с основанием, так как это оксид основного металла.
Реакция оксида бария с оксидом Реакция между диоксидом углерода и оксидом бария дает карбонат бария.

 Химия в действии. В 2-х ч. Ч. 2: Пер. с англ. — М.: Мир, 1998 — 620 с.
Химия в действии. В 2-х ч. Ч. 2: Пер. с англ. — М.: Мир, 1998 — 620 с.