Ba(OH)2 + SO2 = ? уравнение реакции
В результате пропускания сернистого газа через водный раствор гидроксида бария (Ba(OH)2 + SO2 = ?) происходит образование средней соли сульфита бария и воды. Молекулярное уравнение реакции имеет вид:
Сернистый газ (оксид серы (IV), диоксид серы) в обычных условиях представляет собой бесцветный газ с характерным резким запахом (температура плавления равна (), кипения – (). Растворимость оксида серы (IV) в воде весьма велика (при обычных условиях около 40 объемов на один объем воды). Водный раствор диоксида серы называется сернистой кислотой.
Сернистый газ химически активен; в растворе медленно окисляется. Типичный восстановитель, слабый окислитель. В жидком состоянии — неводный растворитель для азота, хлоридов металлов, галогенидов фосфора.
В промышленности оксид серы (IV) получают обжигом сульфида железа:
В лабораторных условиях этот газ получается при действии сильных кислот на сульфиты или гидросульфиты, а также при растворении меди в концентрированной серной кислоте.
ru.solverbook.com
BaO + SO2 = ? уравнение реакции
В результате взаимодействия оксидов бария и серы (IV) (BaO + SO2 = ?) происходит образование средней соли – сульфита бария (соединение). Молекулярное уравнение имеет следующий вид:
Данная реакция возможна, поскольку оксид бария проявляет типичные основные, а диоксид серы – кислотные свойства.
Диоксид серы – сернистый газ – синтезируют сжиганием серы на воздухе или окислением сульфидов:
а также действием 70%-ной серной кислоты на сульфиты металлов:
Диоксид серы – бесцветный тяжелый токсичный газ с удушливым запахом. При температуре он сжижается. Жидкий сернистый ангидрид – бесцветная подвижная жидкость, хорошо растворяющая серу, йод, жиры.
Угловое строение и локализация электронной пары на атоме серы объясняют полярность молекулы и её высокую реакционную активность.
Для диоксида серы характерна окислительно-восстановительная двойственность. Так, сернистый газ обесцвечивает воду:
и раствор перманганата калия:
ru.solverbook.com
основных, амфотерных, кислотных – HIMI4KA

Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O + HCl →
Б) Na2O + CO2 →
В) Na2O + O2 →
ПРОДУКТЫ РЕАКЦИИ
1) Na2CO3
2) NaCl + H2
3) NaCl + H2O
4) NaO3
5) Na2O2
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2O + H2SO4 (изб.) →
Б) Na2O + Al2O3 →
В) Na2O + P2O5 →
ПРОДУКТЫ РЕАКЦИИ
1) NaHSO4
2) NaHSO4 + H2O
3) NaAlO2
4) Na3PO4
5) Na2SO4 + H2O
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + H3PO4 (изб.) →
Б) CaO + H2O →
В) CaO + CO2 →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(H2PO4)2 + H2O
2) CaCO3
3) Ca(OH)2
4) CaCO2
5) Ca3(PO4)2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(H2PO4)2 + H2O
2) Ca3(PO4)2 + H2O
3) CaCl2 + H2O
4) CaSiO3 5) Ca(OCl)2
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯H2O→
В) ZnO + Na2O ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) ZnCl2 + H2O
2) ZnCl2
3) Na2[Zn(OH)4]
4) Na2ZnO2 + H2O
5) Na2ZnO2
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
ПРОДУКТЫ РЕАКЦИИ
1) Na2[Zn(OH)4] + H2
2) Na2ZnO2
3) Zn(H2PO4)2 + H2O
4) Zn + CO
5) Zn3(PO4)2 + H2O
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P2O5 + H2O →
Б) P2O5 + Ca(OH)2 ⎯⎯сплавление→
В) P2O5 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Ca3(PO4)2 + H2O
2) CaHPO4
3) Na3PO4 + H2O
4) Na3PO4
5) H3PO4
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P2O5 + H2O →
Б) P2O5 + Na2O →
В) P2O5 + HNO3 →
ПРОДУКТЫ РЕАКЦИИ
1) H3PO4 + HNO2
2) H3PO4
3) Na3PO4
4) H3PO3
5) HPO3 + N2O5
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + Ca(OH)2 (изб.) →
Б) SO2 + Na2O →
В) SO2 + O2 →
ПРОДУКТЫ РЕАКЦИИ
1) CaSO3 + H2O
2) SO3
3) Ca(HSO3)2
4) Na2SO4
5) Na2SO3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
ПРОДУКТЫ РЕАКЦИИ
1) Na2SO4 + H2O
2) Na2SO3 + H2O
3) NaHSO3
4) S + H2O
5) NaHSO4
31. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Ответы
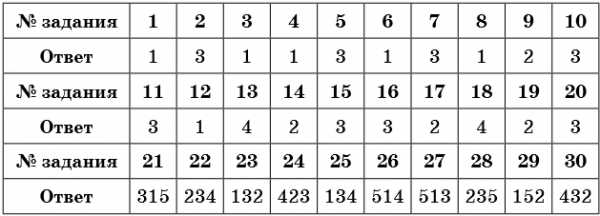
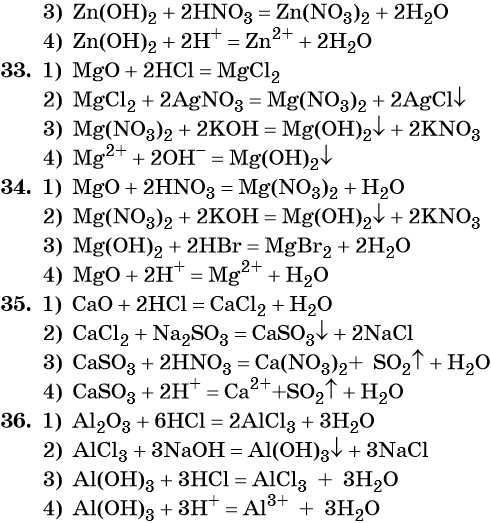
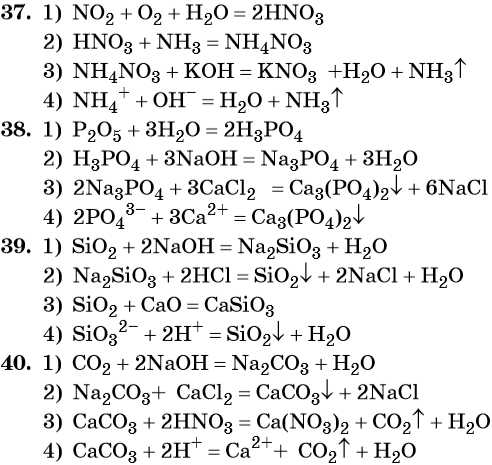
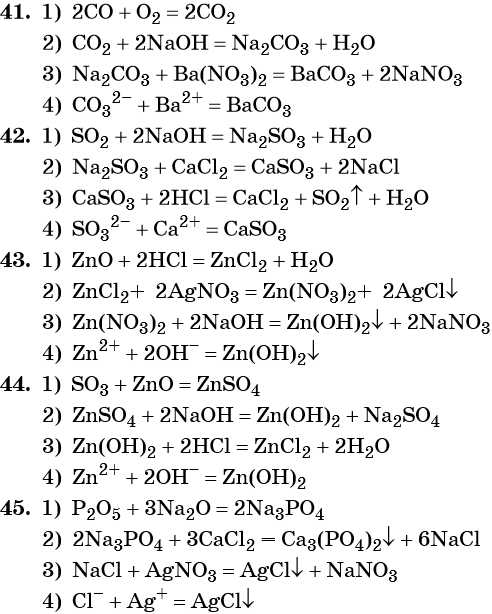
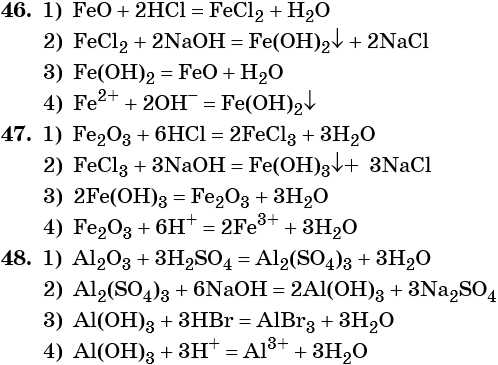

himi4ka.ru
Похожие работы | оксида бария и оксида серы(VI) 4) оксида бария и серной кислоты — страница №1/1 Задания А 23 (ЕГЭ 2013 г) Реакции ионного обмена
1) гидроксида натрия и соляной кислоты 2) серной кислоты и гидроксида бария 3) карбоната натрия и азотной кислоты 4) хлорида железа(II) и гидроксида калия
1) КОН(р-р) и H3PO4 2) HNO3(р-р) и СuO 3) HCl(р-р) и Mg(NO3)2(р-р) 4) Сa(OH)2(р-р) и СО2
1) H2SO4 с NaOH 2) Cu(OH)2 с HCl 3) H2SiO3 с KOH 4) HCl с HNO3
1) Fe(NO3)3 и KOH 2) FeSO4 и LiOH 3) Cu(OH)2 и Fe(NO3)3 4) Ba(OH)2 и FeCl3
1) нитрата бария и серной кислоты 2) гидроксида бария и оксида серы(VI) 3) оксида бария и оксида серы(VI) 4) оксида бария и серной кислоты.
1) гидроксида калия и хлорида алюминия 2) сульфата меди(II) и сульфида калия 3) серной кислоты и гидроксида лития 4) карбоната натрия и хлороводородной кислоты
1) FeCl2 и NaOH 2) Fe2O3 и NaOH 3) FeCl3 и NaOH 4) Fe и NaOH
1) Fe3+, K+, Cl—, 2) Fe3+, Na+, , 3) Ca2+, Li+, , Cl— 4) Ba2+, Cu2+, OH—, F—
1) и , 2) и Cl—, 3) и 4) и Br─
1) ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl 2) H2SO4 + Cu(OH)2 = CuSO4 + 2H2O 2) NaOH + HNO3 = NaNO3 + H2O 4) H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
Н+ + ОН─ → Н2О 1) ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl 2) H2SO4 + Cu(OH)2 = CuSO4 + 2H2O 3) NaOH + HNO3 = NaNO3 + H2O 4) H2SO4 + Ba(OH)2 = BaSO4 + 2H2O
3) Cu2+, , ОН─, Na+ 4) Н+ , , , K+
|
rita.netnado.ru

