Барий и его соединения незаменимы в промышленности и медицине
Барий — серебристый мягкий и хрупкий металл, простой элемент таблицы Менделеева. Металл очень активный, поэтому в чистом виде не встречается, только в составе минералов. Промышленной добыче подлежат барит и витерит. Относится к группе щелочноземельных, химически активных металлов. Легко взаимодействует с неконцентрированными кислотами, галогенами, водородом, аммиаком, фосфором. Горюч на воздухе при небольшом нагревании. Чистое вещество можно хранить, только изолировав от воздуха, например, под слоем керосина или парафина.
Растворимые соединения бария (хлорид, перхлорат, нитрид, нитрат, хлорат) очень ядовиты, вызывают тяжелые отравления и смерть, если не оказана своевременная помощь. В качестве антидота используют сульфаты магния или натрия в растворах (для промывания желудка, питье, внутривенно), которые переводят токсичные соли в безопасные нерастворимые.
Это интересно
Советская станция «Луна-1» в 1959-м году распылила пары бария, которые были ионизированы солнцем и превратились в плазменное облако, имитирующее комету. Зарубежные ученые распыляли мелкодисперсный порошок бария для изучения магнитного поля земли и уникального явления — полярного сияния.
Зарубежные ученые распыляли мелкодисперсный порошок бария для изучения магнитного поля земли и уникального явления — полярного сияния.
Применение
— Сплав бария с алюминием используется для поглощения газов в вакуумных электронных приборах. Никелевый сплав используется в радиолампах, в свечах зажигания карбюраторов. При выплавке свинца и меди добавка Ba помогает связать примеси. Добавление бария в типографские свинцовые сплавы увеличивает их твердость. Ввод реактива в металлические теплоносители позволяет уменьшить их коррозионное воздействие на трубопроводы.
— Гидроокись бария используется для определения в растворе углекислого газа, ионов сульфатов и карбонатов. В промышленности используется для очистки сахара, пищевых жиров и технических масел от сульфат-ионов, получения гидроокиси цезия и рубидия. Реактив востребован как присадка к маслам, при вулканизации резины, как катализатор в синтезе формальдегида.
— Барий сернокислый (сульфат бария) входит в состав белой краски, как наполнитель резин, керамики, лаков и красок; применяется при изготовлении дорогой плотной бумаги, буровых растворов, свинцово-кислотных аккумуляторов.
— Титанат бария — сегнетоэлектрик, применяемый в производстве пьезоизлучателей, пьезомикрофонов, керамических конденсаторов.
— Оксид бария необходим для емких аккумуляторов, катодов в лучевых мониторах, телевизорах. В атомной энергетике входит в состав стекла, которым покрывают урановые стержни.
— Карбонат применяется при выплавке стекол, в составе эмалей и глазурей, как яд для грызунов.
— Сульфид используется при дублении шкур, в производстве сероводорода, как составная часть люминофоров, белой краски.
— Пероксид, хлорат, нитрат применяются в пиротехнике. Хлорат и нитрат дают так называемый «зеленый огонь» фейерверков. Пероксид входит в состав сверхпроводящей керамики, запальных свечей в алюмотермии, дезинфицирующих веществ.
 Используется в химической индустрии для получения пероксида водорода, в текстильной промышленности для отбеливания натуральных тканей. Азотнокислый барий — составная часть красок, эмалей, глазурей.
Используется в химической индустрии для получения пероксида водорода, в текстильной промышленности для отбеливания натуральных тканей. Азотнокислый барий — составная часть красок, эмалей, глазурей.— Хлористый барий применяют для получения сверхчистых алюминия и магния; пигментов и красителей; керамики; для закалки стали; для травли грызунов; в кожевенной индустрии. С помощью хромата бария химическим методом получают O2 и h3; на его основе изготавливают желтые красители и пигменты.
— Фторид бария входит в состав электролита фторионных аккумуляторов; из его монокристаллов изготавливают оптические призмы и линзы.
— Тетрацианоплатинат применяется для покрытия светящихся экранов при работе с радиоактивным излучением (реактив флюоресцирует под воздействием радиации).
— Перхлорат бария — популярный осушитель.
— Соединения бария используются при получении радия из урановой руды.
В магазине химических реактивов и оборудования «ПраймКемикалсГрупп» можно с доставкой и по выгодным ценам купить сернокислый, хлористый, азотнокислый барий и гидроокись бария. В продаже широко представлены различные реактивы и лабораторная посуда.
В продаже широко представлены различные реактивы и лабораторная посуда.
Изометилтетрагидрофталевый ангидрид — важный реактив в электротехнической и строительной индустрии Хлорид цинка — вещество с широким спектром применения
Оксид бария
Наиболее распространенное применение вещества «оксид бария» основано на его свойстве гигроскопичности — умении вбирать в себя воду. Именно поэтому непосредственно в химическом производстве оно используется как компонент для получения пероксида бария. В промышленности оксид незаменим при производстве керамических магнитов. Кроме того, в современных условиях оксид бария, формула которого BaO, нашел огромное применение в микроэлектронике и электротехнике. Для производства магнитокерамики используют феррат бария, который получают путем соединения в мощном магнитном поле под прессом смеси порошков оксидов бария и железа.
Однако главным направлением применения является производство термоэмиссионных катодов. Еще в начале прошлого века ученый из Германии Венельт занимался изучением закона испускания электронов, который был совсем недавно открыт английским исследователем Ричардсоном. Для опытов Венельт использовал куски проволоки из платины. Первые опытные результаты полностью подтверждали выводы, сделанные впоследствии английским физиком. Но потом опыт не удался, и Венельт предположил, что поток электронов намного превышает норму потому, что на поверхности рабочего вещества – платины – могли появиться какие-либо примеси. Проверив свое предположение, Венельт установил, что источником отклонения величины потока электронов является оксид бария, попавший на поверхность платины в составе смазки технических устройств, используемых в эксперименте. Выводы Венельта долгое время оставались непризнанными, потому что ученое сообщество не могло экспериментально воспроизвести его опыт. Понадобилось почти сто лет для того, чтобы английский физик Колер доказал правоту Венельта. Колер на основании многократных опытов доказал, что если оксид бария подвергнуть постепенному подогреву при низком давлении, то интенсивность термоэлектронной эмиссии стремительно возрастает.
Еще в начале прошлого века ученый из Германии Венельт занимался изучением закона испускания электронов, который был совсем недавно открыт английским исследователем Ричардсоном. Для опытов Венельт использовал куски проволоки из платины. Первые опытные результаты полностью подтверждали выводы, сделанные впоследствии английским физиком. Но потом опыт не удался, и Венельт предположил, что поток электронов намного превышает норму потому, что на поверхности рабочего вещества – платины – могли появиться какие-либо примеси. Проверив свое предположение, Венельт установил, что источником отклонения величины потока электронов является оксид бария, попавший на поверхность платины в составе смазки технических устройств, используемых в эксперименте. Выводы Венельта долгое время оставались непризнанными, потому что ученое сообщество не могло экспериментально воспроизвести его опыт. Понадобилось почти сто лет для того, чтобы английский физик Колер доказал правоту Венельта. Колер на основании многократных опытов доказал, что если оксид бария подвергнуть постепенному подогреву при низком давлении, то интенсивность термоэлектронной эмиссии стремительно возрастает.
Только в тридцатые годы прошлого века немецкий ученый-химик Поль высказал предположение, состоящее в том, что электроны активизируются именно из-за наличия примеси бария в оксиде. В ходе реакции, которая проводится при низком давлении, часть кислорода улетучивается из оксида. Остающийся при этом барий ионизируется и тем самым способствует появлению свободных электронов. Эти электроны и были теми, которые покидали кристаллическую структуру при нагревании и которые когда-то наблюдал Венельт.
И лишь в начале второй половины прошлого века была окончательно доказана справедливость данной гипотезы. Химики А. Бундель и П. Ковтун (СССР) смогли не только численно установить величину концентрации примесей бария в оксиде, но и экспериментальным путем сопоставить ее значение с величиной потока термоэмиссии. Именно поэтому оксид бария используется в качестве активного вещества при изготовлении термоэмиссионных катодов. В качестве примера можно привести пучок электронов, с помощью которого создается изображение на экране простого телевизора или монитора компьютера. В качества источника потока здесь выступает оксид бария.
В качества источника потока здесь выступает оксид бария.
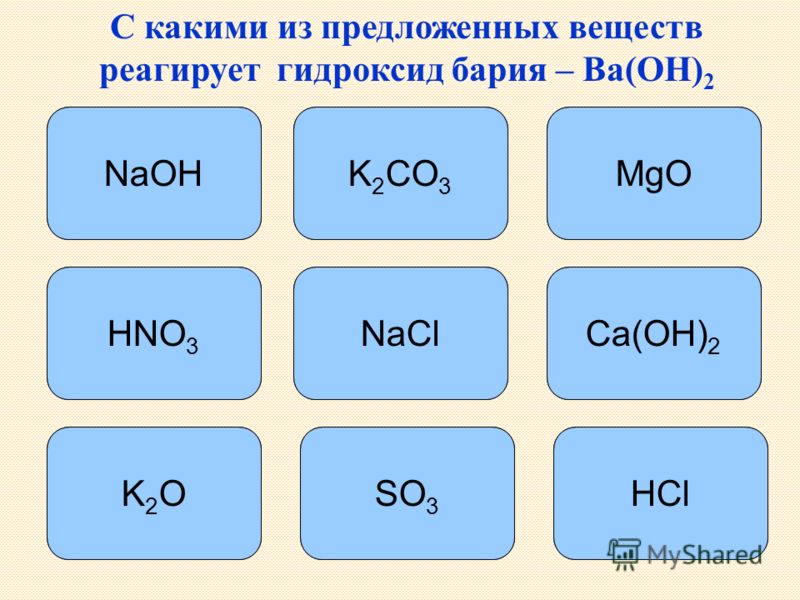
Если это вещество попытаться растворить в воде, то обнаруживается, что оксид бария реагирует с водой при нагревании раствора. При этом получается вещество гидроксид бария — белый порошок с температурой плавления всего 78°C. Это соединение отлично взаимодействует с углекислым газом, а потому водный раствор, часто называемый «баритовой водой», широко применяется в качестве реактива для углекислого газа.
В качестве исходного и необходимого компонента соединение входит в состав различных красящих материалов, смазок и масел. Такое использование оксида бария предсказывал еще Д.И. Менделеев.
Бром — Sciencemadness Wiki
Бром — химический элемент, третий по легкости галоген в периодической таблице и единственный неметалл, который находится в жидком состоянии при комнатной температуре. Он имеет химический символ Br и атомный номер 35. Эта темно-красно-коричневая жидкость пользуется большим спросом в качестве реагента и коллекционного образца, хотя она очень опасна и сложна в обращении и хранении.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химические
Бромные свойства представляют собой смесь хлора и йода, как и следовало ожидать. Менее окисляя, чем хлор и фтор, и в большей степени, чем йод, бром только вытеснит йод из йодистых солей.
Бром весьма реактивен по отношению ко многим элементам, бурно реагируя с большинством металлов. Он также способен реагировать со многими неметаллами и металлоидами, такими как твердые халькогены, пниктогены, а также при высоких температурах кремний и германий.
Классическая реакция – поместить небольшое количество алюминиевой фольги в жидкий бром. После значительной задержки (часто около 30 секунд) из-за оксидного слоя алюминий плавится и загорается. Это выбрасывает белые искры с большими облаками оранжевого брома и белых паров бромида алюминия. Сделано намеренно в контролируемой среде, это создает захватывающее зрелище. Однако, если сделать это случайно и без предосторожности, эта реакция будет губительной.
После значительной задержки (часто около 30 секунд) из-за оксидного слоя алюминий плавится и загорается. Это выбрасывает белые искры с большими облаками оранжевого брома и белых паров бромида алюминия. Сделано намеренно в контролируемой среде, это создает захватывающее зрелище. Однако, если сделать это случайно и без предосторожности, эта реакция будет губительной.
Бром находит множество важных применений в органической химии, прежде всего для введения атомов брома в соединение. Бром довольно легко реагирует с алкенами, алкинами и многими ароматическими соединениями. В сочетании с каталитическими количествами фосфора он также способен к α-хлорированию карбоновых кислот и является предпочтительным реагентом для бромирования чувствительных спиртов. Обе эти реакции происходят через трибромид фосфора; в качестве альтернативы вместо него можно использовать непосредственно трибромид фосфора.
Физический
Подобно хлориду, бромид-ион обычно не влияет на цвет соединения, но сам элемент имеет очень яркий оранжевый/красный цвет как в виде жидкости, так и в виде газа, подобно диоксиду азота. Его можно легко наливать, так как он не очень вязкий и смачивает стекло, когда в нем есть вода, но полностью не высыхает. Таким образом, желательно полностью высушить образцы брома перед их ампулированием.
Его можно легко наливать, так как он не очень вязкий и смачивает стекло, когда в нем есть вода, но полностью не высыхает. Таким образом, желательно полностью высушить образцы брома перед их ампулированием.
Запах брома довольно трудно описать, иногда его называют чем-то средним между хлором и йодом, но все же очень отчетливым. Дышать неприятно, не говоря уже о том, что это опасно.
Бром умеренно растворим в воде и легко растворим в растворах бромида. Окисляя бромиды, получают концентрированные растворы брома в бромиде (они обычно красного цвета и дымят бромным газом, но в отличие от брома заметно прозрачны), которые требуют перегонки для получения чистого элемента.
Доступность
Бром в ампулах доступен химическим компаниям и учреждениям, но обычно недоступен для частных лиц из-за ограничений на доставку и проблем со здоровьем и безопасностью для такого опасного химического вещества.
Соли бромида можно найти в Интернете относительно дешево и без ограничений по доставке. Бромиды иногда также можно найти в магазинах для бассейнов в качестве замены традиционным средствам для ухода за бассейнами с хлором.
Бромиды иногда также можно найти в магазинах для бассейнов в качестве замены традиционным средствам для ухода за бассейнами с хлором.
Подготовка
Существует несколько методов получения элементарного брома, ни один из которых не следует воспринимать легкомысленно.
В зависимости от имеющихся химикатов и требуемой степени чистоты существуют различные методы. Вероятно, самый популярный метод включает окисление брома в бромат посредством электролиза. Другие методы включают замещение хлором, но это приводит к межгалогенным соединениям и может быть довольно трудным.
Высокопродуктивный синтез с относительной легкостью включает окисление бромида натрия или калия перманганатом калия и избытком серной кислоты с последующей осторожной перегонкой в вытяжном шкафу или на открытом воздухе. В этом процессе перманганат калия добавляют к насыщенному раствору соли бромида, и смесь переносят в кипящую колбу простой дистилляционной установки. Серная кислота добавляется по каплям с использованием капельной воронки на протяжении всей перегонки, поскольку добавление является очень экзотермическим и может вызвать очень разрушительную неуправляемую реакцию, если ее добавлять неосторожно.
Проекты
- Производство трибромида фосфора
- Броморганические соединения
- Приготовление бромной воды
- Межгалогенбромсодержащие соединения
- Получение серной кислоты с помощью электробромного процесса
Обращение
Безопасность
Тот, кто намеревается производить или использовать бром, должен тщательно изучить риски, соображения безопасности и опасности, связанные с этим элементом. От повреждения, которое вызывает коррозия брома при контакте с кожей, до токсического воздействия густых паров на легочную ткань и до бурной реакции брома с восстановителями (особенно с алюминием), бром рассматривается многими, кто его изготовил. «злой элемент». Хотя его свойства очень интригуют, это определенно химическое вещество для более опытных химиков.
От повреждения, которое вызывает коррозия брома при контакте с кожей, до токсического воздействия густых паров на легочную ткань и до бурной реакции брома с восстановителями (особенно с алюминием), бром рассматривается многими, кто его изготовил. «злой элемент». Хотя его свойства очень интригуют, это определенно химическое вещество для более опытных химиков.
Жидкий бром чрезвычайно едкий, токсичный и окисляющий. Он очень легко дымит даже при низких температурах, а реакции с восстановителями часто нагревают его, создавая большое количество густых, токсичных оранжевых паров брома, которые небезопасны для дыхания.
Контакта с кожей с этим элементом следует избегать любой ценой. Было показано, что вдыхание паров брома и/или бромидов вызывает временную эректильную дисфункцию.
Растворы гидроксида натрия и сульфита/бисульфита/метабисульфита натрия или тиосульфатов должны быть в резерве, чтобы нейтрализовать любое рассеяние брома до безвредных солей брома.
Хранение
Бром известен тем, что убегает из контейнеров. Единственное надежное решение — правильно запечатать его в стеклянной ампуле. Стеклянные бутылки с крышкой из ПТФЭ можно использовать в течение умеренного времени, хотя бром следует держать подальше от стальных предметов, так как пары вызывают их быструю ржавчину. Обычно, если она хранится в стеклянной таре, бутылка хранится в специальном шкафу, а крышка заклеивается парафильмовой лентой. Парафиновую ленту периодически меняют, особенно когда она начинает темнеть. В качестве альтернативы хранение брома в лабораторном морозильнике значительно снижает летучесть и, следовательно, облегчает хранение.
Единственное надежное решение — правильно запечатать его в стеклянной ампуле. Стеклянные бутылки с крышкой из ПТФЭ можно использовать в течение умеренного времени, хотя бром следует держать подальше от стальных предметов, так как пары вызывают их быструю ржавчину. Обычно, если она хранится в стеклянной таре, бутылка хранится в специальном шкафу, а крышка заклеивается парафильмовой лентой. Парафиновую ленту периодически меняют, особенно когда она начинает темнеть. В качестве альтернативы хранение брома в лабораторном морозильнике значительно снижает летучесть и, следовательно, облегчает хранение.
Утилизация
Бром можно нейтрализовать восстановителями, такими как тиосульфат натрия и метабисульфит натрия, которые восстанавливают его до безвредных ионов бромида.
Ссылки
Соответствующие темы Sciencemadness
- что вы используете для хранения йода/брома
Оксид, гидроксид и пероксид бария | OEC
О
#постоянная ссылка на раздел Обзор Эта страница содержит последние торговые данные о оксиде, гидроксиде и пероксиде бария. В 2020 году Оксид, гидроксид и пероксид бария занял 4390-е место в мире по объемам продаж с общим объемом продаж 37,8 млн долларов. В период с 2019 по 2020 год экспорт оксида, гидроксида и пероксида бария сократился на -24,6%, с 50,1 млн долларов до 37,8 млн долларов. Торговля товаром Оксид, гидроксид и пероксид бария составляет 0,00023% от общего объема мировой торговли.
В 2020 году Оксид, гидроксид и пероксид бария занял 4390-е место в мире по объемам продаж с общим объемом продаж 37,8 млн долларов. В период с 2019 по 2020 год экспорт оксида, гидроксида и пероксида бария сократился на -24,6%, с 50,1 млн долларов до 37,8 млн долларов. Торговля товаром Оксид, гидроксид и пероксид бария составляет 0,00023% от общего объема мировой торговли.
Оксид, гидроксид и пероксид бария входят в состав Гидроксида и пероксида магния.
Экспорт В 2020 году крупнейшими экспортерами оксида, гидроксида и пероксида бария были Китай (25,4 млн долларов США), Германия (4,41 млн долларов США), Южная Африка (2,22 млн долларов США), США (1,71 млн долларов США) и Япония ( 1,17 млн долларов).
Импорт В 2020 году основными импортерами оксида, гидроксида и пероксида бария были США (7,33 млн долларов), Южная Корея (7,18 млн долларов), Япония (6,32 млн долларов), Китай (2,78 млн долларов), и Китайский Тайбэй (1,54 миллиона долларов).
Тарифы В 2018 году средний тариф на Оксид, гидроксид и пероксид бария составлял 0,1%, что делает его 6472-м самым низким тарифом с использованием классификации продуктов HS6.
Рейтинг Оксид, гидроксид и пероксид бария занимает 1479-е место в индексе сложности продукта (PCI).
Последние тенденции
#постоянная ссылка на разделПоследние данные
#постоянная ссылка на разделПросмотр
Поток
ШКАЛА ПО ОСИ Y
Valuecaret-downTrade ValueIndexIndex (YoY)GrowthGrowth (YoY)
Следующая визуализация показывает последние тенденции в отношении оксида, гидроксида и пероксида бария. Страны показаны на основе наличия данных.
Для получения полной информации о структуре торговли посетите обозреватель тенденций или продукт в профиле страны.
* С использованием обменных курсов на январь 2020 г. , если торговые данные представлены в местной валюте.
, если торговые данные представлены в местной валюте.
Ознакомьтесь с последними тенденциями
Historical Data
#permalink to sectionExporters and Importers
#permalink to sectionTrade By Country
Yearcaret-down2020201920182017201620152014201320122011201020092008200720062005200420032002200120001999199819971996
Barium oxide, hydroxide and peroxide are the world’s 4390th most traded product .
В 2020 году ведущие экспортеры Оксид, гидроксид и пероксид бария : Китай (25,4 млн долларов), Германия (4,41 млн долларов), Южная Африка (2,22 млн долларов), США (1,71 млн долларов) и Япония (1,17 млн долларов).
В 2020 году крупнейшими импортерами оксида, гидроксида и пероксида бария были США (7,33 млн долларов), Южная Корея (7,18 млн долларов), Япония (6,32 млн долларов), Китай (2,78 млн долларов) и Китайский Тайбэй ( 1,54 миллиона долларов).
Изучение визуализаций
Динамика рынка
#постоянная ссылка на разделТорговля по странам
Startingcaret-down20192018201720162015201420132012201120102009200820072006200520042003200220012000199919981997Endingcaret-down202020192018201720162015201420132012201120102009200820072006200520042003200220012000199919981997
Value
Between 2019 and 2020, the exports of Barium oxide, hydroxide and peroxide grew the fastest in South Africa ($2.21M), Germany ($540k), Japan ($255k), United Королевство (143 тысячи долларов) и Израиль (86,4 тысячи долларов).
В период с 2019 по 2020 год самые быстрорастущие импортеры Оксид, гидроксид и пероксид бария были из Китая (414 тыс. долл. США), Бельгии (168 тыс. долл. США), Греции (76 тыс. долл. США), России (73,8 тыс. долл. США) и Швейцарии (62,5 тыс. долл. США).
Исследовать визуализации
Концентрация рынка
#permalink to sectionСовокупная доля рынка
Стоимость
На этой диаграмме показано изменение концентрации рынка экспорта Бария оксид, гидроксид и пероксид.
В 2020 году концентрация рынка, измеренная с помощью энтропии Шеннона, составила 1,9.2. Это означает, что большая часть экспорта Оксид, гидроксид и пероксид бария приходится на 3 страны.
Explore Visualizations
Net Trade
#permalink to sectionYearcaret-down202020192018201720162015201420132012201120102009200820072006200520042003200220012000199919981997
This map shows which countries export or import more of Barium oxide, hydroxide and peroxide . Каждая страна окрашена в зависимости от разницы в экспорте и импорте Оксид, гидроксид и пероксид бария в течение 2020 года.
В 2020 году странами, которые имели наибольшую торговую стоимость в экспорте, чем в импорте Оксид, гидроксид и пероксид бария , были Китай (22,6 млн долларов США), Германия (3,87 млн долларов), Южной Африке (1,83 млн долларов), Франции (215 тыс. долларов) и Болгарии (39,4 тыс. долларов).
долларов) и Болгарии (39,4 тыс. долларов).
В 2020 году странами с наибольшей стоимостью импорта по сравнению с экспортом Оксид, гидроксид и пероксид бария были Южная Корея (7,11 млн долларов США), США (5,62 млн долларов США), Япония (5,15 млн долларов США), Китайский Тайбэй (1,45 млн долларов) и Италия (1,12 млн долларов).
Сравнение страны
#permalink в разделContinentscaret Downallafricaantarcticaasiaeuropenorth Americaoceaniasout America
Flow
Измерение
Ranking
. Этот визуализация. Соответствует страну. . Можно выбрать основные страны, экспортирующие или импортирующие Оксид, гидроксид и пероксид бария в мире или по континентам, а также выбрать интересующую меру.
Сложность продукта
#постоянная ссылка на разделГраница диверсификации
#постоянная ссылка на разделСпециализация
На диаграмме сложность-связь сравниваются риск и стратегическая ценность потенциальных экспортных возможностей продукта.
