Как из оксида алюминия получить алюминий? Химические формулы
Алюминий обладает свойствами, которые применимы во многих промышленностях: военном деле, строительстве, питании, транспорте и др. Он пластичный, легкий и широко распространен в природе. Многие люди даже не подозревают того, как широко можно использовать алюминий.
Многие сайты и книги описывают этот чудесный металл и его свойства. Информация находится в свободном доступе.
В лаборатории можно производить любые соединения алюминия, но в малых количествах и по высоким ценам.
История добычи элемента
Вплоть до середины девятнадцатого века ни об алюминии, ни о восстановлении его оксида речи не шло. Первая попытка получения алюминия была предпринята химиком Х. К. Эрстедом и закончилась успешно. Чтобы восстановить металл из его оксида, он использовал амальгамированный калий. Но никто не понял, что получилось в итоге.
Прошло несколько лет, и алюминий снова был получен химиком Велером, который нагрел безводный хлорид алюминия с калием. Ученый упорно трудился 20 лет и, наконец, сумел создать гранулированный металл. По цвету он напоминал серебро, но был легче него в несколько раз. Длительное время до начала двадцатого века алюминий ценился больше золота и выставлялся в музеях как экспонат.
Где-то в начале XIX века английский химик Дэви провел электролиз оксида алюминия и получил металл, названный «алюмиум» или «алюминум», что можно переводить как «квасцы».
Алюминий очень трудно отделить от других веществ — это одна из причин его дороговизны в то время. Ученое собрание и промышленники быстро узнали о потрясающих свойствах нового металла и продолжили попытки его добычи.
В больших количествах алюминий стали получать уже в конце того же девятнадцатого века. Ученый Ч. М. Холлом предложил растворять оксид алюминия в расплаве криолита и пропускать эту смесь через электрический ток. Через какое-то время в сосуде появлялся чистый алюминий. В промышленности и сейчас производят металл этим методом, но об этом позже
Для производств нужна прочность, которой, как выяснилось чуть позднее, у алюминия не было. Тогда металл стали сплавлять с иными элементами: магнием, кремнием и т. д. Сплавы были намного прочнее обычного алюминия — именно из них стали выплавлять самолеты и военную технику. А придумали слить алюминий и другие металлы в единое целое в Германии. Там же, в Дюрене, сплав, названный дюралюминием, поставили на производство.
Как из оксида алюминия получить алюминий
В рамках школьной программы по химии проходят тему «Как из оксида металла получить чистый металл».
К этому методу мы можем отнести и наш вопрос, как из оксида алюминия получить алюминий.
Чтобы образовать металл из его оксида, нужно добавить восстановитель — водород. Пойдет реакция замещения с образованием воды и металла: МеО + Н2 = Ме + Н2О (где Ме — металл, а Н2 — водород).
Пример с алюминием: Al2О3 + 3Н2 = 2Al + 3Н2О
На практике такой прием позволяет получать чистые активные металлы, которые не восстанавливаются оксидом углерода. Метод подходит для очистки небольшого количества алюминия и довольно-таки дорого стоит.
Как получить алюминий из оксида алюминия через добавление более электроотрицательного металла
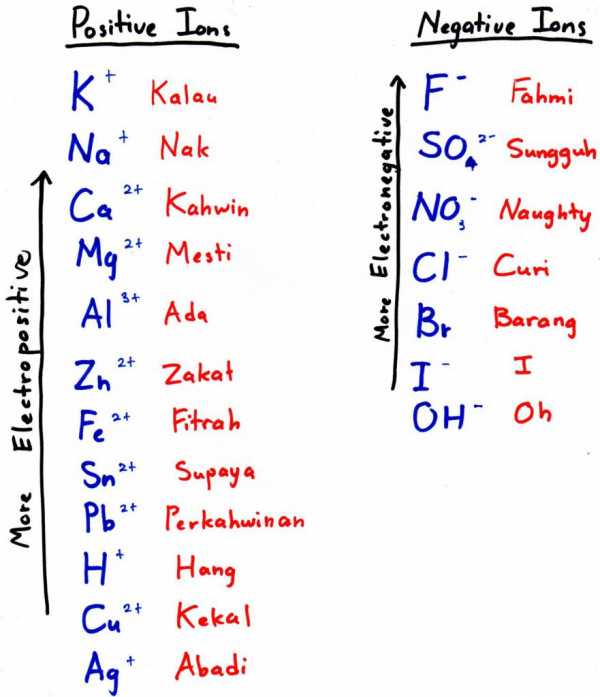
Чтобы получить алюминий этим способом, нужно подобрать более электроотрицательный металл и добавить его к оксиду — он вытеснит наш элемент из кислородного соединения. Более электроотрицательный металл — это тот, что стоит левее в электрохимическом ряду (на фото к подзаголовку — выше).
Примеры: 3Mg + Al2О3 = 2Al + 3MgO
6К + Al2О3 = 2Al + 3К2О
6Li + Al2О3 = 2Al + 3Li2О
Но как получить алюминий из оксида алюминия в условиях широкой промышленности?
Промышленный способ

Большинство производств для добычи элемента используют руды, которые называют бокситами. Сначала из них выделяют оксид, потом растворяют его в расплаве криолита, а затем получают чистый алюминий путем электрохимической реакции.
Это обходится дешевле всего и не требует дополнительных операций.
Кроме того, можно получить хлорид алюминия из оксида алюминия. Как это сделать?
Получение хлорида алюминия
Хлоридом алюминия называют среднюю (нормальную) соль из соляной кислоты и алюминия. Формула: AlCl3.
Для получения нужно добавить кислоту.
Уравнение реакции выглядит следующим образом — Al2О3 + 6HCl = 2AlCl3 + 3Н2О.
Как получить хлорид алюминия из оксида алюминия, не добавляя кислот?
Для этого надо прокалить спрессованную смесь оксида алюминия и углерода (сажа) в токе хлора при 600-800 гр. Хлорид должен отогнаться.
Эту соль применяют в качестве катализатора многих реакций. Ее главная роль — образование продуктов присоединения с разными веществами. Хлоридом алюминия протравливают шерсть, и его добавляют в антиперспиранты. Также соединение играет не последнюю роль в переработке нефти.
Получение гидроксоалюмината натрия

Как из оксида алюминия получить гидроксоалюминат натрия?
Чтобы получить это сложное вещество, можно продолжить цепочку превращений и сначала получить из оксида хлорид, а потом добавить гидроксид натрия.
Хлорид алюминия — AlCl3, гидроксид натрия — NaOH.
Al2O3 → AlCl3 → Na[Al(OH)4]
Al2О3 + 6HCl = 2AlCl3 + 3Н2О
AlCl3 + 4NaOH (концентрированный) = Na[Al(OH)4] + 3NaCl5
Но как из оксида алюминия получить тетрагидроксоалюминат натрия, избегая превращения в хлорид?
Чтобы из оксида алюминия получить алюминат натрия, нужно создать гидроксид алюминия и добавить к нему щелочь.
Следует напомнить, что щелочь — это основание, растворимое в воде. Сюда относят гидроксиды щелочных и щелочноземельных металлов (I и II группа таблицы Менделеева).
Al→ Al(ОН)3 → Na[Al(OH)4]
Из оксидов металлов средней активности, к которым относится алюминий, нельзя получать гидроксиды. Поэтому сначала мы восстановим чистый металл, например, через водород:
Al2О3 + 3Н2 = 2Al + 3Н2О.
А потом получим гидроксид.
Чтобы получить гидроксид, надо растворить алюминий в кислоте (для примера, во фтороводородной): 2Al + 6HF = 2AlF3 + 3Н2. А затем прогидролизовать полученную соль с добавлением равного количества щелочи в разбавленном растворе: AlF3 +3NaOH = Al(ОН)3 + 3NaF.
И дальше: Al(ОН)3 + NaOH = Na[Al(ОН)4]
(Al(ОН)3 — амфотерное соединение, которое может взаимодействовать и с кислотами, и с щелочами).
Тетрагидроксоалюминат натрия отлично растворяется в воде, а еще это вещество широко применяют в оформлении и добавляют в бетон, чтобы ускорить отвердевание.
Про метаалюминаты

Начинающие производители глинозема, наверное, задавались вопросом: «Как из оксида алюминия получить метаалюминат натрия?»
Алюминаты используются в широком производстве для ускорения некоторых реакций, окрашивания тканей и получения глинозема.
Лирическое отступление: глинозем — это, по сути, и есть оксид алюминия Al2О3.
Обычно оксид добывают из метаалюминатов, но здесь будет рассмотрен «обратный» способ.
Итак, чтобы получить наш алюминат, нужно просто смешать оксид натрия с оксидом алюминия при очень высокой температуре.
Случится реакция соединения — Al2О3 + Na2О = 2NaAlO2
Для нормального протекания требуется температура в 1200°C.
Можно проследить за изменением энергии Гиббса в реакции:
Na2O(к.)+ Al2O3(к.)= 2NaAlO2(к.), ΔG0298= -175 кДж.
Еще одно лирическое отступление:
Энергия Гиббса (или «свободная энергия Гиббса») — это зависимость, которая существует между энтальпией (энергией, доступной для преобразований) и энтропией (мерой «хаоса», беспорядка в системе). Абсолютное значение измерить невозможно, поэтому измеряются изменения во время протекания процесса. Формула: G (энергия Гиббса) = Н (изменение энтальпии между продуктами и исходными веществами реакции) — Т (температура) * S (изменение энтропии между продуктами и исходниками). Измеряется в Джоулях.
Как из оксида алюминия получить алюминат?
Для этого подойдет и тот способ, который был рассмотрен выше — с глиноземом и натрием.
Оксид алюминия, смешанный с оксидом другого металла при высоких температурах, и дает метаалюминат.
Но еще можно сплавить гидроксид алюминия со щелочью в присутствии оксида углерода СО:
Al(ОН)3 + NaOH = NaAlO2 + 2Н2О.
Примеры:
- Al2О3 + 2КОН = 2KAlO2 + Н2О (здесь глинозем растворяется в едкой щелочи калия) — алюминат калия;
- Al2О3 + Li2О = 2LiAlO2 — алюминат лития;
- Al2О3 + СаО = СаО × Al2О3 — сплавление оксида кальция с окисью алюминия.
Получение сульфата алюминия

Как получить сульфат алюминия из оксида алюминия?
Способ включен в школьную программу восьмых и девятых классов.
Сульфат алюминия — это соль вида Al2(SO4)3. Представлена может быть в виде пластинок или порошка.
Это вещество может разлагаться на оксиды алюминия и серы при температуре от 580 градусов. Сульфат используется для очистки воды от мельчайших частиц, очень полезен в пищевой, бумажной, тканевой и других отраслях производства. Он широко доступен благодаря своей низкой цене. Очистка воды происходит из-за некоторых особенностей сульфата.
Дело в том, что загрязняющие частицы имеют вокруг себя двойной электрический слой, а рассматриваемый реагент является коагулянтом, который, при проникновении в электрическое поле частиц, вызывает сжатие слоев и нейтрализует заряд частиц.
Теперь о самом методе. Чтобы получить сульфат, нужно смешать оксид и серную (не сернистую) кислоту.
Выходит реакция взаимодействия глинозема с кислотой:
Al2O3+3H2SO4=Al2(SO4)3+H2O
Вместо оксида можно добавить сам алюминий или его гидроксид.
В промышленности для получения сульфата используют уже известную из третьей части этой статьи руду — боксит. Ее обрабатывают серной кислотой и получают «загрязненный» сульфат алюминия. В боксите содержится гидроксид, а реакция в упрощенном виде выглядит так:
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
Бокситы
Боксит — это руда, состоящая сразу из нескольких минералов: железа, бемита, гиббсита и диаспора. Является главным источником добычи алюминия, образуется путем выветривания. Крупнейшие месторождения бокситов находятся в России (на Урале), США, Венесуэле (река Ориноко, штат Боливар), Австралии, Гвинее и Казахстане. Эти руды бывают моногидратными, тригидратными и смешанными.
Получение оксида алюминия
Про глинозем выше сказано много, но до сих пор не описано, как получить оксид алюминия. Формула — Al2О3.
А нужно всего-навсего сжечь алюминий в кислороде. Горение — процесс взаимодействия О2 и другого вещества.
Простейшее уравнение реакции выглядит следующим образом:
4Al + 3О2 = 2Al2О3
Оксид не растворяется в воде, но он хорошо растворим в криолите при высокой температуре.
Свои химические свойства оксид проявляет при температуре от 1000°С. Именно тогда он начинает взаимодействовать с кислотами и щелочами.
В естественных условиях корунд является единственный устойчивой вариацией вещества. Корунд очень твердый, с плотностью примерно 4000 г/м3. Твердость этого минерала по шкале Мооса — 9.

Оксид алюминия — амфотерный оксид. Легко преобразовывается в гидроксид (см. выше), а превратившись, сохраняет все свойства своей группы с преобладанием основных.
Амфотерные оксиды — это оксиды, которые могут проявлять как основные (свойства оксидов металлов), так и кислотные (оксидов неметаллов) свойства в зависимости от условий.
К амфотерным оксидам, исключая оксид алюминия, относятся: оксид цинка (ZnO), оксид бериллия (ВеО), оксид свинца (PbO), оксид олова (SnO), оксид хрома (Cr2О3), оксид железа (Fe2О3) и оксид ванадия (V2О5).
Соли: комплексные и не очень
Бывают средние (нормальные), кислые, основные и комплексные.
Средние соли состоят из самого металла и кислотного остатка и имеют вид AlCl3 (хлорид алюминия), Na2SO4 (сульфат натрия), Al(NO3)3 (нитрат алюминия) или MgPO4.
Кислые соли — это соли из металла, водорода и кислотного остатка. Их примеры: NaHSO4, CaHPO4.
Основные соли так же, как и кислые, состоят из кислотного остатка и металла, но вместо Н там ОН. Примеры: (FeOH)2SO4, Ca(OH)Cl.
И, наконец, комплексные соли — это вещества из ионов разных металлов и кислотного остатка многоосновной кислоты (соли, содержащие сложный ион): Na3[Co(NO2)6], Zn[(UO2)3(CH3COO)8].
Речь пойдет о том, как из оксида алюминия получить комплексную соль.
Условием превращения оксида в это вещество является его амфотерность. Глинозем отлично подходит для метода. Чтобы получить комплексную соль из оксида алюминия, нужно смешать этот оксид с раствором щелочи:
2NaOH + Al2O3 + H2O → Na2[Al(ОН)4]
Этот род веществ также образуется при воздействии растворов щелочей на амфотерные гидроксиды.
Раствор гидроксида калия взаимодействует с основанием цинка с получением тетрагидроксоцинката калия:
2KOH + Zn(OH)2 → K2[Zn(OH)4]
Раствор щелочи натрия реагирует, например, с гидроксидом берилия с образованием тетрагидроксобериллата натрия:
NaOH + Be(OH)2 → Na2[Be(OH)4]
Использование солей
Комплексные соли алюминия часто используют в фармацевтике, производстве витаминов и биологически активных веществ. Препараты, созданные на основе этих веществ, помогают в борьбе с похмельем, улучшают состояние желудка и общее самочувствие организма человека. Очень полезные соединения, как можно заметить.
Реактивы дешевле покупать в интернет-магазинах. Там большой выбор веществ, но сайты лучше выбирать надежные и проверенные временем. Если покупать что-то на «однодневках», то риск потерять деньги увеличивается.
При работе с химическими элементами нужно соблюдать правила безопасности: обязательно наличие перчаток, защитного стекла, специализированной посуды и приборов.
Эпилог
Химия – несомненно, сложная для понимания наука, но иногда полезно в ней разобраться. Проще всего это сделать через интересные статьи, простой слог и понятные примеры. Не лишним будет прочитать пару книг по теме и освежить в памяти курс школьной программы по химии.
Здесь было разобрано большинство тем химии, связанных с преобразованиями алюминия и его оксидов, в том числе, как из оксида алюминия получить тетрагидроксоалюминат, и еще множество интересных фактов. Оказалось, что у алюминия есть много самых необычных сфер применения в производстве и в быту, да и история получения металла весьма незаурядна. Химические формулы соединений алюминия тоже заслуживают внимания и подробного разбора, что и было освящено в этой статье.
fb.ru
Алюминий, производство алюминия: технология, процесс и описание
Алюминий обладает массой свойств, которые делают его одним из самых используемых материалов в мире. Он широко распространен в природе, занимая среди металлов первое место. Казалось бы, и трудностей с его производством быть не должно. Но высокая химическая активность металла приводит к тому, что в чистом виде его не встретить, а производить – сложно, энергоемко и затратно.
Сырье для производства
Из какого сырья получают алюминий? Производство алюминия из всех минералов, его содержащих, дорого и нерентабельно. Добывают его из бокситов, которые содержат до 50% оксидов алюминия и залегают прямо на поверхности земли значительными массами.

Эти алюминиевые руды имеют достаточно сложный химический состав. Они содержат глиноземы в количестве 30-70% от общей массы, кремнеземы, которых может быть до 20%,окись железа в пределах от 2 до 50%, титан (до 10%).
Глиноземы, а это окись алюминия и есть, состоят из гидроокисей, корунда и каолинита.
В последнее время окиси алюминия стали получать из нефелинов, которые содержат еще и окиси натрия, калия, кремния, и алунитов.
Для производства 1 т чистого алюминия нужно около двух тонн глинозема, который, в свою очередь, получают из примерно 4,5 т боксита.
Месторождения бокситов
Запасы бокситов в мире ограничены. На всем земном шаре всего семь районов с его богатыми залежами. Это Гвинея в Африке, Бразилия, Венесуэла и Суринам в Южной Америке, Ямайка в Карибском регионе, Австралия, Индия, Китай, Греция и Турция в Средиземноморье и Россия.
В странах, где есть богатые месторождения бокситов, может быть развито и производство алюминия. Россия добывает бокситы на Урале, в Алтайском и Красноярском краях, в одном из районов Ленинградской области, нефелин — на Кольском полуострове.
Самые богатые месторождения принадлежат именно российской объединенной компании UC RUSAL. За ней идут гиганты Rio Tinto (Англия-Австралия), объединившийся с канадской Alcan и CVRD. На четвертом месте находится компания Chalco из Китая, затем американо-австралийская корпорация Alcoa, которые являются и крупными производителями алюминия.
Зарождение производства
Датский физик Эрстед выделил первым алюминий в свободном виде в 1825 году. Химическая реакция проходила с хлоридом алюминия и амальгамой калия, вместо которой спустя два года немецкий химик Велер использовал металлический калий.
Калий – материал достаточно дорогой, поэтому в промышленном производстве алюминия француз Сент-Клер Девиль вместо калия в 1854 году использовал натрий, элемент значительно более дешевый, и стойкий двойной хлорид алюминия и натрия.
Русский ученый Н. Н. Бекетов смог вытеснить алюминий из расплавленного криолита магнием. В конце восьмидесятых годов того же века эту химическую реакцию использовали немцы на первом алюминиевом заводе. Во второй половине XVIII века было получено около химическими способами 20 т чистого металла. Это был очень дорогой алюминий.
Производство алюминия с помощью электролиза зародилось в 1886 году, когда одновременно были поданы практически одинаковые патентные заявки основоположниками этого способа американским ученым Холлом и французом Эру. Они предложили растворять глинозем в расплавленном криолите, а затем электролизом получать алюминий.
С этого и началась алюминиевая промышленность, ставшая за более чем вековую историю одной из самых крупных отраслей металлургии.
Основные этапы технологии производства
В общих чертах технология производства алюминия не изменилась с момента создания.
Процесс состоит из трех стадий. На первой из алюминиевых руд, будь это бокситы или нефелины, получают глинозем – окись алюминия Al2O3 .
Затем из окиси выделяют промышленный алюминий со степенью очистки 99,5 % , которой для некоторых целей бывает недостаточно.

Поэтому на последней стадии рафинируют алюминий. Производство алюминия завершается его очисткой до 99,99 %.
Получение глинозема
Существует три способа получения окиси алюминия из руд:
— кислотный;
— электролитический;
— щелочной.
Последний способ — наиболее распространенный, разработанный еще в том же XVIII веке, но с тех пор неоднократно доработанный и существенно улучшенный, применяется для переработки бокситов высоких сортов. Так получают около 85 % глиноземов.
Сущность щелочного способа заключается в том, что алюминиевые растворы с большой скоростью разлагаются, когда в них вводится гидроокись алюминия. Оставшийся после реакции раствор выпаривается при высокой температуре около 170° С и опять используется для растворения глинозема;
Сначала боксит дробится и измельчается в мельницах с едкой щелочью и известью, затем в автоклавах при температурах до 250°С происходит его химическое разложение и образовывается алюминат натрия, который разбавляют щелочным раствором уже при более низкой температуре – всего 100° С. Алюминатный раствор промывается в специальных сгустителях, отделяется от шлама. Затем происходит его разложение. Через фильтры раствор перекачивают в емкости с мешалками для постоянного перемешивания состава, в который для затравки добавлена твердая гидроокись алюминия.
В гидроциклонах и вакуум-фильтрах выделяется гидроокись алюминия, часть которой возвращается в качестве затравочного материала, а часть идет на кальцинацию. Фильтрат, оставшийся после отделения гидроокиси, тоже возвращается в оборот для выщелачивания следующей партии бокситов.

Процесс кальцинации (обезвоживания) гидроокиси во вращающихся печах происходит при температурах до 1300° С.
Для получения двух тонн окиси алюминия расходуется 8,4 кВт*ч электроэнергии.
Прочное химическое соединение, температура плавления которого 2050° С, это еще не алюминий. Производство алюминия впереди.
Электролиз окиси алюминия
Основным оборудованием для электролиза является специальная ванна, футерованная углеродистыми блоками. К ней подводят электрический ток. В ванну погружаются угольные аноды, сгорающие при выделении из окиси чистого кислорода и образующие окись и двуокись улглерода. Ванны, или электрилизеры, как их называют специалисты, включаются в электрическую цепь последовательно, образуя серию. Сила тока при этом составляет 150 тысяч ампер.
Аноды могут быть двух типов: обожженные из больших угольных блоков, масса которых может быть больше тонны и самообжигающиеся, состоящие из угольных брикетов в алюминиевой оболочке, которые спекаются в процессе электролиза под действием высоких температур.

Рабочее напряжение на ванне обычно составляет около 5 вольт. Оно учитывает и напряжение, необходимое для разложения окиси, и неизбежные потери в разветвленной сети.
Из растворенной в расплаве на основе криолита окиси алюминия жидкий металл, который тяжелее солей электролита, оседает на угольном основании ванны. Его периодически откачивают.

Процесс производства алюминия требует больших затрат электроэнергии. Чтобы получить одну тонну алюминия из глинозема, нужно израсходовать около 13,5 тысяч кВт*ч электроэнергии постоянного тока. Поэтому еще одним условием создания крупных производственных центров является работающая рядом мощная электростанция.
Рафинация алюминия
Наиболее известный метод – это трехслойный электролиз. Он также проходит в электролизных ваннах с угольными подинами, футерованных магнезитом. Анодом в процессе служит сам расплавленный металл, который подвергается очистке. Он располагается в нижнем слое на токопроводящей подине. Чистый алюминий, который из электролита растворяется в анодном слое, понимается вверх и служит катодом. Ток к нему подводится с помощью графитового электрода.
Электролит в промежуточном слое – это фториды алюминия или чистые или с добавлением натрия и хлорида бария. Нагревается он до температуры 800°С.
Расход электроэнергии при трехслойном рафинировании составляет 20 кВт*ч на один кг металла, то есть на одну тонну нужно 20 тысяч кВт*ч. Вот почему, как ни одно производство металлов, алюминий требует наличия не просто источника электроэнергии, а крупной электростанции в непосредственной близости.
В рафинированном алюминии в очень малых количествах содержатся железо, кремний, медь, цинк, титан и магний.
После рафинирования алюминий перерабатывается в товарную продукцию. Это и слитки, и проволока, и лист, и чушки.

Продукты сегрегации, полученные в результате рафинирования, частично, в виде твердого осадка, используются для раскисления, а частично отходят в виде щелочного раствора.
Абсолютно чистый алюминий получают при последующей зонной плавке металла в инертном газе или вакууме. Примечательной его характеристикой является высокая электропроводность при криогенных температурах.
Переработка вторичного сырья
Четверть общей потребности в алюминии удовлетворяется вторичной переработкой сырья. Из продуктов вторичной переработке льется фасонное литье.
Предварительно отсортированное сырье переплавляется в пороговой печи. В ней остаются металлы, имеющие более высокую температуру плавления, чем алюминий, например, никель и железо. Из расплавленного алюминия продувкой хлором или азотом удаляются различные неметаллические включения.
Более легкоплавкие металлические примеси удаляются присадками магния, цинка или ртути и вакуумированием. Магний удаляется из расплава хлором.
Заданный литейный сплав получают, введя добавки, которые определяются составом расплавленного алюминия.
Центры производства алюминия
По объемам потребления алюминия КНР занимает первое место, оставляя далеко позади находящиеся на втором месте США и обладательницу третьего места Германию.
Китай – это и страна производства алюминия, с огромным отрывом лидирующая в этой области.
В десятку лучших, кроме КНР, входят Россия, Канада, ОАЭ, Индия, США, Австралия, Норвегия, Бразилия и Бахрейн.
В России монополистом в производстве глинозема и алюминия является объединенная компания RUSAL. Она производит до 4 млн т алюминия в год и экспортирует продукцию в семьдесят стран, а присутствует на пяти континентах в семнадцати странах.
Американской компании Alcoa в России принадлежат два металлургических завода.
Крупнейший производитель алюминия в Китае – компания Chalco. В отличие от зарубежных конкурентов, все ее активы сосредоточены в родной стране.

Подразделение Hydro Aluminium норвежской компании Norsk Hydro владеет алюминиевыми заводами в Норвегии, Германии, Словакии, Канаде, и Австралии.
Австралийская BHP Billiton владеет производством алюминия в Австралии, Южной Африке и Южной Америке.
В Бахрейне находится Alba (Aluminium Bahrain B. S. C.) – едва ли не самое крупное производство. Алюминий этого производителя занимает более 2 % общего объема «крылатого» металла, выпускаемого в мире.
Итак, подводя итоги, можно сказать, что главными производителями алюминия являются международные компании, владеющие запасами бокситов. А сам исключительно энергоемкий процесс состоит из получения глинозема из алюминиевых руд, производства фтористых солей, к которым относится криолит, углеродистой анодной массы и угольных анодных, катодных, футеровочных материалов, и собственно электролитического производства чистого металла, которое является главной составляющей металлургии алюминия.
fb.ru
Оксидная керамика — оксид алюминия
Изделия из оксида алюминия (глинозема, корунда) востребованы больше, чем любой другой керамический материал высокого качества.
Основные свойства оксида алюминия (Al2O3):
-Высокая твердость
-Хорошая теплопроводность
-Отличная коррозионная стойкость
-Низкая плотность
-Сохранение прочности при высоких температурах
-Электроизоляционные свойства
-Невысокая стоимость относительно других керамических материалов
Все эти сочетания делают материал незаменимым при изготовлении коррозионностойких, износостойких, электроизоляционных и термостойких изделий для самых различных отраслей промышленности.
Основные области применения изделий из корунда (оксида алюминия):
-Футеровка изнашиваемого оборудования
-Кольца торцовых уплотнений
-Фильеры, проводки, направляющие
-Подшипники
-Мелящие тела
-Горелки
-Тигли
-Элементы клапанов и запорной арматуры
-Электроизоляторы
Существует несколько модификаций оксида алюминия в зависимости от содержания основной фазы и примесей, которые отличаются прочностью и химической стойкостью.
|
Состав |
Al2O3 95-97% |
Al2O3 94-96% |
Al2O3 98-99,6% |
Al2O3 98-99% |
|
Плотность, г/см3 |
3,65-3,75 |
3,6-3,7 |
3,8-3,9 |
3,8-3,85 |
|
Открытая пористость, % |
0 |
0 |
0 |
0 |
|
Твердость, ГПа |
13-14 |
12-13 |
15-17 |
15-16 |
|
Прочность при изгибе, МПа |
|
300-330 |
350-400 |
330-380 |
|
Прочность при сжатии, МПа |
2000-2300 |
2000-2200 |
2000-2400 |
2000-2400 |
|
Теплопроводность при 20-100°С, Вт/мК |
22-25 |
20-25 |
28-33 |
27-34 |
|
Коэффициент линейного термического расширения при 20-1000°С, 10-6К-1 |
7,0-8,0 |
7,0-8,0 |
7,0-8,0 |
7,0-8,0 |
|
Максимальная температура эксплуатации |
1500 |
1500 |
1700 |
1800 |
Изготавливаем изделия из оксидной керамики различных типоразмеров по индивидуальным заявкам Заказчика.
rm.gkmp32.com
Способ получения алюминия из его оксида
Изобретение относится к металлургии, в частности к получению алюминия из его оксида в виде сплава алюминия с кремнием и может быть использовано для производства силикоалюминия (силумина).
Известна реакция восстановления оксида алюминия углеродом Al2O3 + 3C —> 2Al + 3CO. (1) Изменение термодинамического потенциала реакции, рассчитанное по данным [1] и [2], составляет G 0T = 321519-139,81T кал, отсюда G0T1 при T>2299 K (2026oC). Теоретически восстановление оксида алюминия углеродом начинается при температуре свыше 2299 K (2026oC), но получение чистого алюминия электротермическим путем считается невозможным из-за образования карбида алюминия Al4C (при температурах 1500-2000 K) и оксикарбидов алюминия: Al4O4C (образуется при 1873 K) и Al2OC (образуется при 2273 K). Известен электротермический способ получения алюминия в виде его сплава с железом (ферроалюминия) путем восстановления оксида алюминия углеродом в присутствии железа [3]. В известном способе шихта для получения ферроалюминия состоит из оксида алюминия в виде электрокорунда (91-96% Al2O3; 1-3% SiO2; 1-2% TiO2; ~0,5% MgO; 0,8-3% CaO), коксика (13% золы) и стальной стружки. Восстановление оксида алюминия углеродом коксика осуществляют при температурах 1600-2000Формула изобретения
1. Способ получения алюминия из его оксида, включающий формирование реакционного объема расплава на основе фторидов металлов, наложение на расплав электрического тока, загрузку шихты, содержащей оксид алюминия, восстановление алюминия и его удаление из реакционного объема, отличающийся тем, что на расплав накладывают переменный электрический ток, алюминий восстанавливают при температуре 1000 — 1100oC, а восстановителем служит углерод графитовых электродов. 2. Способ по п. 1, отличающийся тем, что в качестве фторидов металлов используют криолит.findpatent.ru
Производство активного оксида алюминия | Полезное
Активный оксид алюминия (Al2O3) используется в химической промышленности как носитель катализаторов (каталитического риформинга), катализатор и осушитель, и в качестве производного для смешанных катализаторов. Будучи аморфным веществом, Al2O3 имеет пористую консистенцию, что делает его качественным гидрофильным сорбентом, близким по свойствам мелкопористому силикагелю. Производство активного оксида алюминия необходимо для осушки различных жидкостей (нефти, бензина, гексана), газов (воздуха, природного газа, сжиженного углеводородного газа, углекислого газа), очистки технических масел от продуктов окисления, в хроматографии, для статической осушки при консервации оборудования, а также для других работ газо- и нефтеперерабатывающей промышленности.
Активный оксид алюминия: производство и стандартизация
Производство активного оксида алюминия строго контролируется на соответствие стандартам технологического регламента. Al2O3имеет вид белых цилиндрических гранул или шариков диаметром 5 мм. Иногда гранулы имеют кремовый оттенок, что также допускается. В зависимости от производимой марки вещество имеет следующие формулы: АОА-1, АОА-2 и АОА-3. Активный оксид алюминия не имеет огне- и взрывоопасных свойств, но при работе с ним обязательно использование средств индивидуальной защиты, т.к. вещество имеет свойство раздражать слизистые глаз, рта и носа, а также накапливаться в легких, вызывая затемнение на рентгеновском снимке. В соответствии госстандартов, в помещении, где происходит работа с веществом или производство активного оксида алюминия, должна присутствовать приточно-вытяжная вентиляция, не допускающая превышения допустимой концентрации вещества в воздухе.
Производство активного оксида алюминия
1. Получение осадка из кислого раствора сульфата (Al2(SO4)3) или нитрата (Al(NO3)3) алюминия с применением растворов оснований.
2. Получение осадка из щелочного раствора алюминия (алюмината) с использованием серной, азотной или соляной кислоты, а также кислых растворов алюминиевых солей.
Активный оксид алюминия, производство которого основывается на технологии двухпоточного осаждения, в начальной стадии получения получают в виде двух составляющих гидроксида алюминия. После получения осадочной массы обе модификации смешиваются, фильтруются, промываются, и формируется в т.н. лепешку. Сушка гранул оксида алюминия происходит в потоке воздуха при нагреве до 110-120° С. После просушки гранулы прокаливаются нагревом до 550°С.
Производство активного оксида алюминия продолжается на шнековых экструдерах, где материал равномерно размешивается и одновременно подвергается тепловой обработке, а также воздействию азотной кислоты. После размешивания в экструдере происходит просушка оксида алюминия на ленточных сушилках. Прием активного оксида алюминия осуществляется партиями.
microintech.ru
Активный оксид алюминия
Основные области применения активного оксида алюминия:
- Адсорбционная осушка газов. Высокая активность оксида алюминия при взаимодействии с полярными адсорбтивами (прежде всего, парами воды) обеспечивает глубокую осушку газов до точки росы минус 60°С и ниже. Он интенсифицирует полимеризацию непредельных углеводородов, образующихся при крекинге в стадии высокотемпературной десорбции. Однако возможность многократной температурной регенерации путем выжига коксовых отложений обеспечивает долголетнюю работу адсорбента как осушителя олефинсодержащих потоков. Важной положительной способностью оксида алюминия являетсяего водостойкость. Именно этот показатель часто определяет выбор оксида алюминия в качестве адсорбента для осушки и переработки сред, в которых присутствует капельная влага.
- Адсорбционная очистка масел (прежде всего трансформаторных). Амфотерный характер оксида алюминия делает его эффективным адсорбентом кислот – продуктов окисления масел, накопление которых снижает диэлектрические свойства масел.
- Применение в статических адсорбционных системах. Активный оксид алюминия находит применение как эффективный осушитель при консервации приборов и оборудования, а также для таких систем, как дыхательные клапаны цистерн, трансформаторы и т. д.
- Адсорбционная очистка газовых и жидкостных потоков от соединений, содержащих фтор-ионы. Способность оксида алюминия хемосорбировать фтор-ионы используется для очиcтки вод с повышенным содержанием фтора, улавливания паров HF из газов суперфосфатных и электролизных производств. См. также как избежать дополнительных финансовых затрат из-за плохой работы пневмосистемы
Рост потребности в активном оксиде алюминия обусловлен развитием таких процессов нефтепереработки, как риформинг, гидроочистка, гидрокрекинг (в которых используются катализаторы, содержащие 80-90% оксида алюминия), а также широким применением его в процессах адсорбции.
Вы можете купить оксид алюминия дешево, однако низкая стоимость не гарантирует качество товара. SORBIS GROUP предлагает Вам сорбенты только высшего качества по умеренным ценам. Будьте внимательны и остерегайтесь подделок!
АOA (черенок) – цилиндрической формы диаметром 3,0-3,5 мм.
АОА для адсорбционных осушителей воздуха с диаметром гранул: 4 – 11 мм.
АOA (шарик) – круглой или овальной формы диаметром 1,6 мм – 8 мм.
Активированный оксид алюминия широко используется в качестве осушителя природного газа. Промышленностью выпускается Окись алюминия нескольких марок и разной формы: гранулированный, цилиндрический и шариковый.
Преимуществом же оксида алюминия является стойкость по отношению к капельной влаге и обеспечение глубокой степени осушки – до точки росы -60°С в области высокого влагосодержания осушаемого газа.
При наличии в осушаемом газе капельной воды в целях предотвращения растрескивания основного слоя осушителя – силикагеля можно рекомендовать засыпать небольшой слой оксида алюминия на входе газа в колонну.
sorbis-group.com
Как из оксида алюминия получить алюминий
Алюминий на сегодняшний день является наиболее распространенным металлом. Его используют в самых разных отраслях промышленности, медицине, строительстве, пищевой отрасли и т.д.

Для его получения используют активный оксид алюминия, который добывают из руды. Данный метод требует больших энергетических затрат, поэтому наибольшее он распространение получил лишь в ХХ веке.
Промышленный способ
В промышленных условиях чаще всего используют электрохимический способ получения алюминия. Основным сырьем являются горные породы – бокситы, имеющие красно-бурую окраску. Они могут содержать до 80 % оксида алюминия. Процесс делится на несколько этапов:
- Выделение из руды оксида алюминия.
- Растворение оксида алюминия в криолитовом расплаве.
- Выделение чистого алюминия путем электрохимической реакции.
Недостатком данного способа является большое потребление энергоресурсов. Поэтому ученые постоянно ищут другие варианты.
На сегодняшний день основную конкуренцию электрохимическому способу составляет производство алюминия в рудотермических печах. Этот способ имеет большую производительность, но алюминий получается не чистый. Он образует сплав с кремнием.
В лабораторных условиях возможно получение алюминия, свободного от примесей. Для этого проводят восстановление оксида алюминия водородом. Используя этот способ, возможно восстанавливать и другие металлы.

Особенности производства
Выделение алюминия происходит в электролизерах. Это огромные емкости, содержащие расплавленный криолит, двойной фторид натрия и алюминий. В электролит вводится глинозем, он плавает в ванне на подушке из жидкого алюминия.
Электроды, используемые при получении алюминия, изготавливают из углеродистых материалов. Анод быстро сгорает в выделяемых парах кислорода и оксидов углерода.
Жидкий алюминий оседает на углеродистых подинах, потому что он тяжелее электролитического расплава. Оттуда его периодически откачивают.
Полученный алюминий в жидком состоянии подают в литейный цех. Он располагается в непосредственной близости от электрохимического производства.
Использование специальных транспортных печей позволяет начинать процесс изготовления продукции из алюминия непосредственно после его получения.
Также алюминий может быть доставлен и на другие предприятия в форме небольших прямоугольных чушек, где его повторно расплавляют и обогащают дополнительными компонентами. Таким образом производят различные сплавы на основе алюминия – силумин, фехраль и другие.
Промышленное получение алюминия из оксида алюминия — в этом видео:
Понравилась запись? Поделись с друзьями и поддержи сайт:
www.senao.org
