Карбонат калия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Тренажер задания 31 по химии алюминия
Тренажер задания 31 из ЕГЭ по химии алюминия, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии алюминия с текстовыми решениями и ответами.
1. В раствор, полученный при взаимодействии алюминия с разбавленной серной кислотой, по каплям добавили раствор гидроксида натрия до образования осадка. Выпавший осадок белого цвета отфильтровали и прокалили. Полученное вещество сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
2. К раствору сульфата алюминия добавили избыток гидроксида натрия. В полученный раствор небольшими порциями прибавили соляную кислоту, при этом наблюдали образование объемного осадка белого цвета, который растворился при дальнейшем прибавлении кислоты. В образовавшийся раствор прилили раствор карбоната натрия. Напишите уравнения описанных реакций.
3. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, пропустили через раствор тетрагидроксоалюмината натрия. Образовавшийся осадок отфильтровали, прокалили, и твердый остаток обработали соляной кислотой. Напишите уравнения описанных реакций.
4. Твердое вещество, образовавшееся при взаимодействии сернистого газа и сероводорода, при нагревании взаимодействует с алюминием. Продукт реакции растворили в разбавленной серной кислоте и в образовавшийся раствор добавили поташ. Напишите уравнения описанных реакций.
5. Продукт взаимодействия серы с алюминием (реакция протекает при нагревании) растворили в холодной разбавленной серной кислоте и в раствор добавили карбонат калия. Образовавшийся осадок отделили, смешали с едким натром и нагрели. Напишите уравнения описанных реакций.
6. К раствору кальцинированной соды добавили раствор хлорида алюминия, выделившееся вещество отделили и внесли в раствор едкого натра. В образовавшийся раствор по каплям прибавляли раствор хлороводородной кислоты до прекращения образования осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
В образовавшийся раствор по каплям прибавляли раствор хлороводородной кислоты до прекращения образования осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
7. Нитрат алюминия прокалили, продукт реакции смешали с кальцинированной содой и нагрели до плавления. Образовавшееся вещество растворили в азотной кислоте и полученный раствор нейтрализовали раствором аммиака, при этом наблюдали выделение объемного студенистого осадка. Напишите уравнения описанных реакций.
8. Осадок, полученный при добавлении в раствор сульфата алюминия каустической соды, отделили, прокалили, смешали с кальцинированной содой и нагрели до плавления. После обработки остатка серной кислотой была получена исходная соль алюминия. Напишите уравнения описанных реакций.
9. В раствор кристаллической соды добавили хлорид алюминия, выделившийся осадок отделили и обработали раствором едкого натра. Полученный раствор нейтрализовали азотной кислотой, выделившийся осадок отделили и прокалили. Напишите уравнения описанных реакций.
Полученный раствор нейтрализовали азотной кислотой, выделившийся осадок отделили и прокалили. Напишите уравнения описанных реакций.
10. Осадок, полученный при взаимодействии раствора соли алюминия и щелочи, прокали-ли. Продукт реакции растворили в концентрированном горячем растворе щелочи. Через полученный раствор пропустили углекислый газ, в результате чего образовался осадок. Напишите уравнения описанных реакций.
11. Вещество, которое образуется при электролизе расплава боксита в криолите, растворяется как в растворе соляной кислоты, так и в растворе щелочи с выделением одного и того же газа. При смешивании полученных растворов образуется объемный осадок белого цвета. Напишите уравнения описанных реакций.
12. Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили. Фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций
Выпавший осадок отфильтровали и прокалили. Фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций
13. Оксид алюминия сплавили с карбонатом натрия, полученное твердое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия. Напишите уравнения описанных реакций.
14. Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода. Напишите уравнения описанных реакций.
15. Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твердому веществу добавили избыток раствора соляной кислоты. Напишите уравнения описанных реакций.
Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твердому веществу добавили избыток раствора соляной кислоты. Напишите уравнения описанных реакций.
16. Газ, выделившийся при взаимодействии хлористого водорода с бертолетовой солью, внесли в реакцию с алюминием. Продукт реакции растворили в воде и добавили гидроксид натрия до прекращения выделения осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
17. Газ, выделившийся при нагревании раствора хлористого водорода с оксидом марганца (IV), внесли во взаимодействие с алюминием. Продукт реакции растворили в воде и добавили сначала избыток раствора гидроксида натрия, а затем соляную кислоту. Напишите уравнения описанных реакций.
18. Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили, и полученный продукт сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
19) Оксид алюминия сплавили с содой. Полученный продукт растворили в соляной кислоте и обработали избытком аммиачной воды. Выпавший осадок растворили в избытке раствора гидроксида калия. Напишите уравнения описанных реакций.
20) Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся среднюю соль прокалили. Напишите уравнения описанных реакций.
21) Порошок алюминия нагрели с порошком серы, полученное вещество обработали водой. выделившийся при этом осадок обработали избытком раствора гидроксида калия до его полного растворения. К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка. Напишите уравнения описанных реакций.
К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка. Напишите уравнения описанных реакций.
22) Осадок, полученный при взаимодействии растворов сульфата алюминия и нитрата бария, отфильтровали. Фильтрат обработали едким натром в мольном соотношении 1 : 3. Выпавший осадок отделили и прокалили. Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
23) При взаимодействии раствора сульфата алюминия с раствором сульфида калия выделился газ, который пропустили через раствор гексагидроксоалюмината калия. Образовавшийся осадок отфильтровали, промыли, просушили и нагрели. Твердый остаток сплавили с едким натром. Напишите уравнения описанных реакций.
24) Алюминиевый порошок смешали с серой и нагрели. Полученное вещество поместили в воду. Образовавшийся осадок разделили на две части. К одной части прилили соляную кислоту, а к другой – раствор гидроксида натрия. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
25) Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили и полученный продукт растворили в разбавленной серной кислоте. Напишите уравнения описанных реакций.
26) При взаимодействии оксида алюминия и азотной кислоты образовалась соль. Соль высушили и прокалили. Образовавшийся при прокаливании остаток подвергли электролизу в расплавленном криолите. Полученный металл нагрели с концентрированными гидроксида калия и нитрата калия. При этом выделился газ с резким запахом. Напишите уравнения описанных реакций.
27) К раствору гидроксида натрия добавили порошок алюминия. Через раствор полученного вещества пропустили избыток углекислого газа. Выпавший осадок отделили и про-калили. Полученный продукт сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
28) Порошок металлического алюминия смешали с твердым йодом, и добавили несколько капель воды. К полученной соли добавили раствор гидроксида натрия до выпадения осадка. Образовавшийся осадок растворили в соляной кислоте. При последующем добавлении раствора карбоната натрия вновь наблюдается выпадение осадка. Напишите уравнения описанных реакций.
29) Алюминий растворили в соляной кислоте. К полученному раствору добавили избыток раствора карбоната калия. Выпавший осадок растворили в избытке раствора едкого калия, а выделившийся газ пропустили над раскаленным углем. Напишите уравнения описанных реакций.
30) Алюминий растворили в водном растворе горячего гидроксида натрия. к полученному раствору добавили по каплям разбавленную соляную кислоту до прекращения выпадения осадка. Выделившийся в период реакции газ пропустили над раскаленным оксидом меди (II). Полученное простое вещество растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
31) Алюминий вступил в реакцию с железной окалиной. Полученную смесь веществ растворили в концентрированном растворе гидроксида натрия и отфильтровали. Твердое вещество сожгли в атмосфере хлора, а фильтрат обработали концентрированным раствором хлорида алюминия. Напишите уравнения описанных реакций.
Понравилось это:
Нравится Загрузка…
Где используются сложные соли алюминия?
В мире существует довольно много веществ, которые не могут существовать в нормальных условиях. Из-за высокой химической активности или других окружающих факторов они сразу же разлагаются на воздухе на составные части или же вступают в реакцию со всеми подряд элементами с образованием новых соединений.
Для хранения подобных веществ приходится обеспечивать им специальные условия, которые позволили бы материалу, находящемуся внутри, сохранять свое агрегатное состояние. Карбонат алюминия относится как раз к той группе веществ, которые не могут существовать при нормальных условиях. Для его хранения пришлось бы воссоздать очень сложную систему, которая бы оберегала вещество от доступа извне.
Для его хранения пришлось бы воссоздать очень сложную систему, которая бы оберегала вещество от доступа извне.
Но вопрос стоит в том, что в этом совершенно нет никакой необходимости. Соединение не несет в себе никакой прорывной научной ценности, так что держать его в таких сложных условиях и тратить на это огромные деньги совершенно ни к чему. Поэтому о данной соли алюминия можно найти совсем немного информации.
Как получают вещество?
Образование соединения алюминия с солью карбонатной кислоты получается в результате спекания алюминиевого основания с карбонатами щелочных металлов. В итоге можно получить нужное вещество, но оно сразу же разлагается из-за гидролиза карбоната алюминия.
Причина кроется в том, что слабая кислота в симбиозе со слабым основанием дают слабую соль, которая не может противостоять атмосферному воздействию. Подобные реакции проводятся только для наглядных опытов, потому что сами вещества не несут промышленной ценности, а затраты на их хранение были бы намного больше полезности.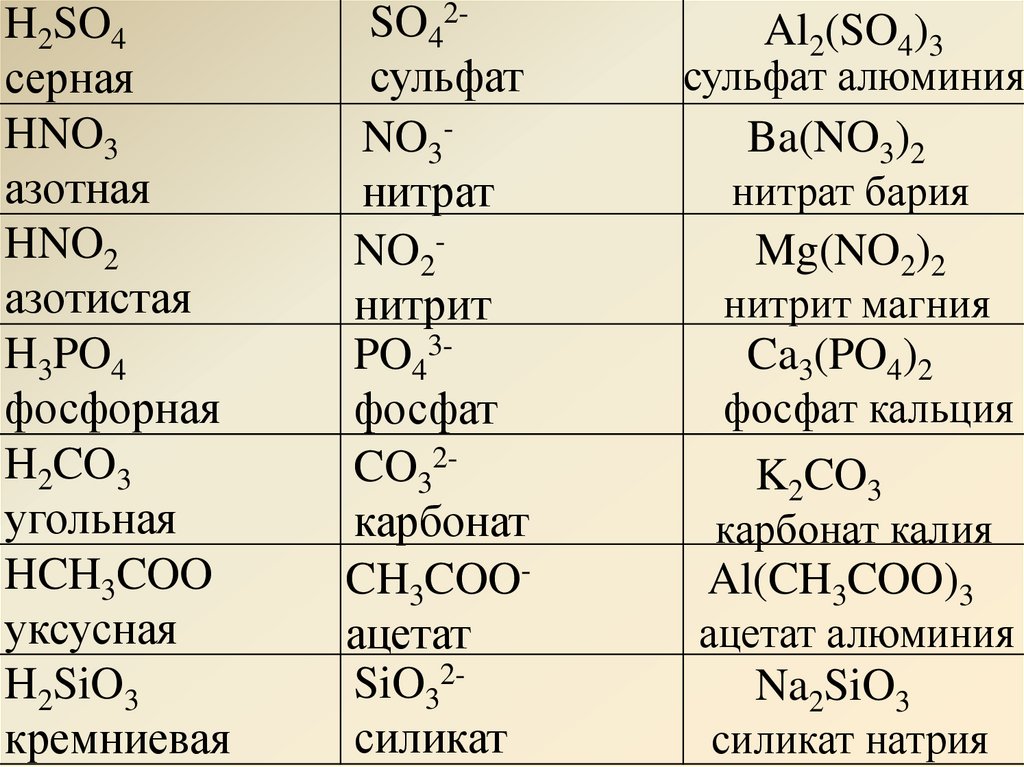
Также промежуточно можно получить соединение при реакциях:
- • карбонат калия+оксид алюминия;
- • хлорид алюминия+карбонат натрия;
- • сульфат алюминия+карбонат натрия;
- • оксид алюминия+карбонат натрия;
- • карбонат натрия нитрат алюминия;
- • хлорид алюминия+карбонат калия.
Есть еще большое количество реакций с карбонатами калия и натрия, которые вытесняют алюминий из его солей и промежуточно меняются местами. Но в итоге все равно получается алюминат калия или натрия, так что полученное соединение не сохраняется. Поэтому весьма проблематично изучить его свойства. Ни один справочник по химии не дает ответа на данный вопрос, так как он просто напросто не изучен.
Взаимодействие металлического алюминия с карбонатом натрия
Натрий является одним из самых активных металлов, так что используется для большого количества опытов, причем, как в чистом виде, так и в своих соединениях. Поэтому интересным вопросом выглядит реакция карбонат натрия→алюминий. Алюминий ни при каких условиях не вытесняет натрий из его солей, так что по-хорошему и никакой реакции быть не должно. Но при определенных условиях она происходит.
Поэтому интересным вопросом выглядит реакция карбонат натрия→алюминий. Алюминий ни при каких условиях не вытесняет натрий из его солей, так что по-хорошему и никакой реакции быть не должно. Но при определенных условиях она происходит.
Самое главное, что итог будет весьма странным: алюминий растворяется в концентрированном растворе карбоната натрия. В результате получается сложный окисел, в который входит сразу два металла. Такая реакция возможна благодаря амфотерности алюминия, проявляющего разные свойства в зависимости от условий среды реагирования. Ни с одним другим веществом повторить подобный опыт не получится из-за невозможности поставить металл на место неметалла в данной ситуации.
Оксид карбоната алюминия также не существует в природе по описанным причинам. Зато при помощи теплового сопровождения на уровне 1200 градусов по Цельсию, можно сплавить оксиды натрия и алюминия, чтобы получить алюминат. Этот материал является промежуточным и идет на нужды других отраслей промышленности, например, играет роль протравочного вещества перед покраской тканей в текстильном производстве.
Использование сложных солей алюминия на практике
Сложные многоатомные соединения часто используются в фармацевтике, так как там нужно применять нестандартные подходы для поиска оптимального состава лекарственных препаратов. Например, вещество алюминия гидроксид-магния карбонат магния-гидроксид представляет собой сложное многоатомное соединение, которое обладает большим набором полезных качеств.
Его свойства можно изложить списком:
- • Является сильнейшим атацидным средством, так что может быстро успокаивать желудок при ощущении в нем дискомфорта после острой или кислой пищи.
- • Нейтрализует среду желудка, забирая на себя избыточную соляную кислоту.
- • Возвращает в норму кислотно-щелочной баланс.
Алюминия гидроксида-магния карбоната гель-магния гидроксид прописывают пациентам при изжоге, повышенной кислотности желудка, хронических гастритах и язвенной болезни, грыже. Также он позволит снять негативное воздействие алкоголя на организм после его злоупотребления.
Также он позволит снять негативное воздействие алкоголя на организм после его злоупотребления.
При диетах или приеме других лекарств будет положительно влиять на желудок, так как избавит его от избыточной кислоты, которая всегда доставляет дискомфорт и приводит к болевым ощущениям и ухудшению самочувствия. Противопоказаниями к применению выступают только болезнь Альцгеймера и тяжелые нарушения функции почек, которые не позволяют им работать в полную силу.
Побочные эффекты проявляются крайне редко и могут иметь вид тошноты, незначительной диареи или изменения вкусовых ощущений. Также иногда пациенты чувствуют слабость быструю утомляемость или замедленную реакцию на окружающий мир. С другими лекарственными препаратами отмечается отличный уровень взаимодействия, но в любом случае нужно все делать только после консультации со своим лечащим врачом.

 ..]
..] ..]
ком ума с olu o d e carbonato de potssio, re col hidas n uma […]
..]
ком ума с olu o d e carbonato de potssio, re col hidas n uma […] ..]
..] ..]
..] europa.eu
europa.eu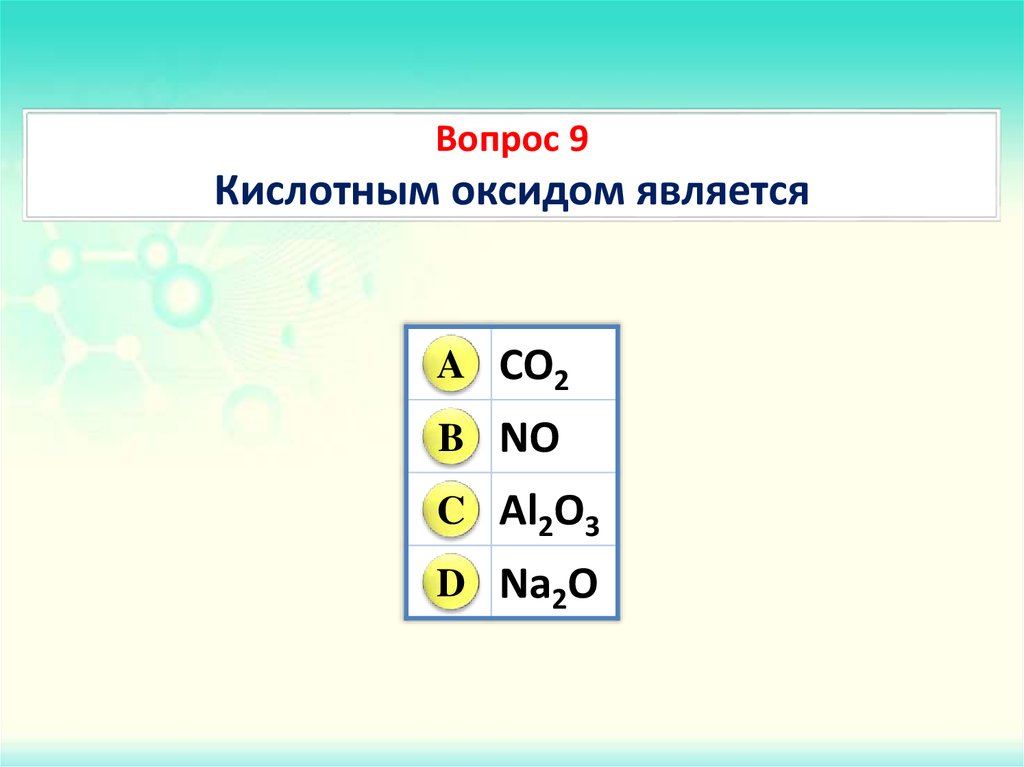 europa.eu
europa.eu europa.eu
europa.eu ..]
..] ..]
ферроцианид натрия a n d карбонат калия a t l ниже цены.
..]
ферроцианид натрия a n d карбонат калия a t l ниже цены.