Металлическая связь — Википедия
Материал из Википедии — свободной энциклопедии
Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их валентных электронов.
В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны проводимости, происходящие из атомов металлов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. В металлах в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Рис.1. Расположение ионов в кристалле щелочного металлаТак, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей — положительно заряженных ионов щелочного металла (рис.1). Кулоновское отталкивание одноимённо-заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра — квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной решётки
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляционной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щёлочный металл | Li | Na |
|---|
ru.wikipedia.org
Электроны в металлах
Электронная жидкость
Какие силы удерживают атомы в металле? В химических соединениях и в кристаллах, подобных хлористому натрию, атом металла отдает электрон атому другого вещества, который стремится его приобрести. Но куда могут переходить электроны, когда все атомы — это атомы металла?
Рассмотрим два атома натрия, находящихся на близком расстоянии друг от друга. При их сближении внешние, очень слабо связанные электроны каждого атома обнаруживают наличие другого атома и один электрон может даже «перескочить» с одного атома на другой. Тогда у одного атома оказываются два внешних электрона, а у другого — ни одного. Такая система отнюдь не устойчива, и один или даже оба электрона могут перескочить обратно к другому атому. В течение короткого промежутка времени, когда оба электрона находятся вблизи одного атома, его можно рассматривать как отрицательный ион натрия Na
Если к первым двум атомам натрия приблизить еще два, то уже четыре слабо связанных электрона будут «бродить» вокруг этих четырех атомов. Так как электроны отталкивают друг друга, они никогда не будут находиться у одного атома, в то время как остальные три атома будут лишены своих внешних электронов. Однако в течение коротких промежутков времени у одного атома могут быть два внешних электрона, он будет заряжен отрицательно и станет притягивать расположенные вблизи него ионы натрия, заряженные положительно. При добавлении других атомов к этой группе станет еще труднее установить, какому именно атому принадлежит определенный электрон. Может показаться, что в определенный период странствований электрон принадлежит какому-то одному атому (например, атому.
Электрон в своем движении редко приближается к центру атомов. Первоначально он находился на внешней орбите одного атома и изредка бывал достаточно близко от центральной части этого атома.
Электронная жидкость
Несмотря на то, что эти и другие электроны движутся в основном по траекториям, проходящим между атомами, они притягиваются находящимися поблизости положительными ионами натрия и в свою очередь сами притягивают их. Таким образом, внешние одиночные электроны каждого иона натрия образуют совместно своего рода жидкость из отрицательных зарядов, в которую погружены положительные ионы Na+. Эта «электрически отрицательная жидкость», притягивающая положительные ионы натрия, обусловливает целостность куска металла натрия.
Описанная «электронная жидкость» объясняет способность всех металлов легко проводить электрический ток. Если приложить к металлу электрическое поле, присоединив к куску металла полюса электрической батареи, то быстро движущиеся электроны начнут «дрейфовать» в металле в направлении, определяемом полярностью батареи. Электроны поступают в металл у одного полюса батареи и удаляются из него у другого. То, что металлы — хорошие проводники тепла, тоже связано с наличием в них этой «электронной жидкости», или «электронного газа», как ее называет большинство физиков.
Если нагревать с одного конца кусок металла, то электроны, составляющие «жидкость», будут двигаться несколько быстрее. Эти более быстрые электроны передают свою избыточную энергию — кинетическую энергию, обусловленную их скоростью, — другим частям куска металла, которые в результате этого нагреваются.
У этой «электронной жидкости», скрепляющей ионы металла, имеется еще одно интересное свойство. «Жидкость» связывает воедино ионы металла в жидком состоянии почти так же хорошо, как в твердом. Она действует как своеобразная жидкая среда, в которой ионы могут двигаться или образовывать правильную кристаллическую решетку при кристаллизации металла. Сравним электронные орбиты в кристаллическом натрии и кристалле алмаза. Натрий плавится при 97° С (чуть-чуть ниже температуры кипения воды при нормальном атмосферном давлении). Это — низкая температура по сравнению с точками плавления большинства веществ. Для разрушения кристаллов натрия и превращения их в жидкость требуется лишь немного тепла. Однако ионы не могут высвободиться из «электронной жидкости», если не подвести значительно большее количество тепла. Чтобы натрий начал испаряться, его нужно нагреть почти до 900° С.
Электроны и их поведение
В алмазе же электроны находятся во вполне определенных связях, и на них не отражаются никакие свойства «электронной жидкости», как, например, в натрии. Чтобы расплавить алмаз, нужно подвести достаточное количество тепла для ослабления существующих в нем межатомных связей. Эти связи настолько прочны, что для их разрушения кристалл приходится нагревать до температуры свыше 3500° С. Тогда атомы просто испаряются непосредственно из кристалла, минуя стадию образования жидкости. Широкий температурный интервал, в пределах которого сохраняется жидкое состояние, характерен для многих металлов. Почти каждый знаком с таким жидким металлом, как ртуть.
Другие металлы, как, например, железо, вольфрам и др., имеют более высокую точку плавления. В них целостность структуры обусловливается двумя разными способами связи — наличием «электронной жидкости», о которой мы только что говорили, и связями между отдельными атомами, как в кристаллической решетке алмаза. Эти металлы обладают, таким образом, прочностью, основанной на жестких связях и электрических свойствах, обусловленных «электронной жидкостью».
Все электроны ведут себя по-разному.
Электроны — удивительные частицы. Все они в известных конкретных условиях ведут себя по-разному. Правда, трудно отличить один электрон от другого по его массе и заряду. Однако вы никогда не сможете найти два электрона, которые одновременно находились бы в одном и том же месте и одинаково двигались в одном направлении.
Если два электрона находятся на близком расстоянии друг к другу, то они всегда движутся с различными скоростями или в разных направлениях. Если же скорость и направление движения обоих электронов одинаковы, то они могут перемещаться по орбитам вокруг различных атомов. (У двух электронов есть еще одна возможность вести себя по-разному: каждый электрон вращается вокруг своего центра, подобно крошечному волчку. Направление вращения такого волчка может быть различным у разных электронов).
all4study.ru
Металлическая связь Свойства металлов — Справочник химика 21
Медь, серебро и золото несколько выпадают из общей для переходных металлов закономерности по своему электронному строению с валентной конфигурацией Они характеризуются более низкими температурами плавления и кипения, чем предшествующие им переходные элементы, и являются довольно мягкими металлами. Проявление таких свойств соответствует закономерной тенденции к ослаблению металлических связей, обнаруживаемой начиная с группы У1Б(Сг-Мо- У). Эта тенденция объясняется постепенным уменьшением числа неспаренных -электронов у атомов металлов второй половины переходных рядов. Медь, серебро и золото обладают очень большой электро- и теплопроводностью, поскольку их электронное строение обусловливает высокую подвижность 5-электронов. Эти металлы ковки, пластичны и инертны и могут находиться в природе в металлическом состоянии. Они встречаются довольно редко и поэтому имеют высокую стоимость, но все же распространены значительно больше, чем платиновые металлы. Относительно большая распространенность и возможность существования этих металлов в природе в несвязанном виде послужили причиной того, что они явились первыми металлами, с которыми познакомился чёловск и кошрые иН научился обрабатывать. По-видимому, первым металлом, который стали восстанавливать из его руды, была медь. Металлургия началась с открытия того, что сплав меди с оловом (естественно встречающаяся примесь) дает намного более твердый материал — бронзу. Медные предметы были найденыМЕТАЛЛИЧЕСКАЯ СВЯЗЬ — один из видов химической связи — связь ионов металла со свободными обобществленными внешними электронами. М. с. обусловливает характерные свойства металлов блеск, пластичность, высокие электро- и теплопроводность, положительный температурный коэффициент электросопротивления, термоэлектронную эмиссию и др. [c.159]
Для твердых тел чаще более характерны смешанные виды связи. Известно, что ионная и ковалентная связи, а также ковалентная и металлическая не имеют резкого разграничения и может наблюдаться переход от одного вида связи к другому. Так, упрочнение металла в результате пластической деформации и легирования объясняется превращением металлической связи в ковалентную. При деформации в металлах появляются области высокой прочности и малой пластичности, приближающиеся по своим свойствам к типичным веществам, обладающим ковалентной связью (алмазу).
Металлическая связь. Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других простых или сложных веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло- и электропроводность. Эти особенности обязаны существованию в металлах особого вида связи — металлической связи. [c.65]
На симметрию кристаллической решетки -элементов их (п — 1) -электроны практически не влияют. Но если атом металла содержит неспаренные -электроны, то эти электроны могут взаимодействовать с -электронами соседних атомов металла и образовывать дополнительные ковалентные связи. Аналогичное взаимодействие возможно и для р-элементов. В этих металлах существуют металлическая и ковалентная связи одновременно. Ковалентная локализованная связь обладает свойством направленности, а металлическая — ненаправленная связь. Поэтому первый вид связи обуславливает более упорядоченное состояние, а второй — менее упорядоченное, т. е. с большей энтропией. При более высоких температурах на структуре кристаллической решетки и свойствах простого вещества сказывается, в основном, наличие металлической связи. Понижение температуры приводит к уменьшению отрицательного энтропийного (—Т Д5) вклада в изменение энергии Гиббса и начинает преобладать более упорядоченная локализованная ковалентная связь. Типичным примером является олово. Так, стабильной модификацией олова при i > 13,2 °С является мягкий металл ( белое олово), в то время как при более низких температурах устойчивее серое олово, представляющее собой твердый и хрупкий порошок с кристаллической решеткой типа алмаза — кристалла, с ковалентной связью [c.321]
В твердом состоянии металлы образуют особый тип связи — металлическую связь. Строение металлов обуславливает их особые физические свойства. Подробно о строении и физических свойсгвах металлов было рассказано в разделе 4 главы 2. [c.147]
По строению электронной оболочки атомов к металлам относят все s-элементы, кроме водорода и гелия, все d- и f-элементы и ряд р-элементов — алюминий, олово, свинец и др. Металлы в конденсированном (жидком или твердом) состоянии обладают способностью к отражению света, высокой тепло- и электропроводностью, пластичностью и текучестью. Они имеют сравнительно высокие температуры плавления и кипения. Эти специфические свойства металлов объясняются наличием у них особого типа химической связи, получившей название металлической связи. Атомы металлов содержат на внешнем энергетическом уровне небольшое количество электронов, которые достаточно слабо связаны со своим ядром, В то же время атомы металлов имеют много свободных валентных орбиталей. Эти орбитали отдельных атомов перекрываются друг с другом, обеспечивая электронам способность свободно перемещаться между ядрами во всем объеме металла. Следовательно, в кристаллической решетке металлов электроны обобществлены. Они непрерывно перемещаются между положительно заряженными ионами, которые расположены в узлах кристаллической решетки. При этом сравнительно небольшое число обобществленных электронов ( электронного газа ) связывает большое число ионов, [c.116]
Межкристаллитная коррозия характеризуется развитием коррозионного разрушения по границам зерен и ее дальнейшим быстрым проникновением в глубь металла. Коррозия, развиваясь по границам зерен металла и постепенно разобщая существующую между ними внутреннюю металлическую связь, ослабляет металл и понижает его механические свойства. [c.69]
Простая модель металлической связи, основанная на представлении об электронном газе , согласуется также с двумя другими характерными свойствами металлов их ковкостью и пластичностью. Ковкое вещество легко поддается расплющиванию молотом в тонкие листы пластичное вещество можно вытягивать в тонкую проволоку. Для того чтобы такая обработка металлов с изменением формы происходила без разрущения, атомные плоскости кристалла должны легко скользить одна по другой. Такое смещение атомов не вызывает появления больших сил отталкивания в металлах, потому что подвижный электронный газ постоянно смягчает перемещение положительных ионов, экранируя их друг от друга. Совсем [c.624]
Коррозия начинается с поверхности металла и при дальнейшем развитии этого процесса распространяется вглубь. Металл при этом может частично пли полностью растворяться (например, цинк в соляной кислоте) или же могут образоваться продукты коррозии в виде осадка на металле (например, ржавчина при коррозии железа во влажной атмосфере, гидрат окисла при коррозии цинка в воде). Иногда коррозионные процессы протекают с изменением физико-мехаиических свойств металлов и сплавов (потерей металлического звука, резким снижением механической прочности вследствие нарушения связи по границам кристаллитов). [c.5]
Таким образом, общие свойства металлов связаны с наличием у них свободных электронов. Чем значительнее концентрация последних, тем отчетливее выражены особенности металлического состояния. [c.10]
Вольфрам является самым тугоплавким из металлов. В ряду Сг—Мо—W наблюдается повышение температуры плавления и теплоты атомизации (возгонки), что объясняют усилением в металлическом кристалле ковалентной связи, возникающей за счет (-электронов. На свойства металлов в большой степени влияют примеси. Так, технический хром—один из самых твердых металлов, в то время как чистый хром пластичен. [c.549]
Все металлы представляют собой кристаллические тела, которым присущи особые металлические свойства электропроводность, теплопроводность и ковкость (пластичность). Эти свойства металлов обусловлены особенностями металлической связи. [c.100]
Порошкообразные V, Nb и Та адсорбируют значительные количества водорода, кислорода и азота, образуя твердые растворы внедрения. Неметаллы при этом переходят в атомарное состояние, и их электроны участвуют в образовании металлических связей в кристаллической решетке. При нагревании растворимость неметаллов возрастает, а характер связей между атомами металл — неметалл меняется. Изменяются и свойства соединений. Так, постепенное накопление кислорода в ниобии приводит к образованию нижеследующего ряда соединений [c.287]
До сих пор остается недостаточно ясным, почему существует такое большое различие в величине и природе металлического перенапряжения для нормальных и инертных металлов и с какими свойствами металлов (или растворов) оно связано. Была сделана попытка объяснить эти явления различным соотношением между прочностью связи ионов в растворе и в кристаллической решетке нормальных и инертных металлов. Подобное предположение эквивалентно допущению, что в разряде участвуют ионы в той форме, в какой они присутствуют в растворе, и что разряд переводит ион непосредственно в его конечное положение в решетке металла. [c.465]
Металлы отличаются от других твердых тел некоторыми особыми свойствами — высокой электрической проводимостью и теплопроводностью. Изучая эти свойства, а также зависимость от температуры, можно сделать ряд важных выводов о природе металлической связи. [c.138]
Однако применение законов кинетической теории газа к электронному газу приводит к значению а, отличающемуся от эксперимента. Делокализация валентных электронов-в кристаллической решетке металла, а следовательно, отсутствие в ней направленных валентных связей объясняет тот факт, что металлы имеют большое координационное число К, плотнейшую сферическую упаковку, а также чаще всего кубическую объемно-центрированную элементарную ячейку решетки. Некоторые металлы могут кристаллизоваться в различных типах решеток например, при температуре 906 °С устойчивым является немагнитное у-железо с /С=12. Впрочем, для некоторых тяжелых металлов наряду с металлической связью, образованной З -электронами, реализуются слабые ковалентные связи между атомами, в то время как 45-электроны образуют электронный газ. Для такой смешанной металлической и межатомной связи характерно образование пар электронов как с параллельными, так и с антипараллельными спинами (для марганца— антипараллельные, для железа — параллельные). Этим объясняется различие в магнитных свойствах металлов параллельные спины обусловливают ферромагнетизм, т. е. положительная магнитная восприимчивость на два или три порядка [c.138]
Для лучшего понимания свойств металлических сплавов и соединений с металлической связью напомним некоторые определения химии и физики металлов. Образование смешанных кристаллов происходит в том случае, если размеры атомов различных металлов близки между собой. При этом различают смешанные кристаллы замещения и внедрения. [c.143]
В табл. 21.1 перечислены некоторые отличительные свойства металлов и неметаллов. Металлы в конденсированном состоянии обладают характерным металлическим блеском. Ярко выраженные металлические элементы обладают хорошей электро- и теплопроводностью, а также ковкостью и пластичностью. В отличие от металлов неметаллические элементы не имеют блестящей поверхности и, как правило, являются плохими проводниками тепла и электричества. Семь неметаллических элементов существуют в виде двухатомных молекул. В это число входят пять газов (водород, азот, кислород, фтор и хлор), одна жидкость (бром) и одно летучее твердое вещество (иод). Остальные неметаллы при нормальных условиях существуют в кристаллической форме и могут быть твердыми, как, например, алмаз, или мягкими, как сера. Такое разнообразие свойств объясняется характером химической связи, присущим каждому элементу, как это изложено в разд. 8.7, ч. 1. [c.282]
Пластичность металлов также объясняется специфическими свойствами металлической связи. При механическом воздействии на твердое тело отдельные слои его кристаллической решетки смещаются относительно друг друга. В силу высшей степени делокализации электронов при смещении отдельных слоев кристаллической решетки происходит лишь некоторое перераспределение электронной плотности, связывающей друг с другом атомы металла, но разрыва химических связей не происходит — металл деформируется, не разрушаясь. [c.151]
Металлические решетки образуют простые вещества большинства элементов периодической системы — металлы. По прочности. металлические решетки находятся между атомными и молекулярными кристаллическими решетками. Это связано с тем, что металлической связи присущи и характерные черты ковалентной связи, и отдельные черты дальнодействующей связи. Металлические решетки бывают и малопрочные, например, ртуть — жидкая. Металлам свойственны непрозрачность, характерный металлический блеск, хорошая тепло- и электропроводность и другие характерные свойства. Упрощенно металлическая решетка представляется в виде положительно заряженных ионов, располагающихся в узлах ее, и электронов, двигающихся между ними. Атомы металлов, с характерным для них дефицитом валентных электронов, должны иметь как можно больше соседних атомов, чтобы этот дефицит компенсировать за счет электронов соседей. Поэтому координационное число здесь достигает больших значений (8—12). [c.161]
Пластичность металла определяется способностью металла не разрушаясь деформироваться так, что деформации остаются и после окончания действия нагрузки. Пластичность металлов имеет очень большое практическое значение. Благодаря этому свойству металлы поддаются ковке, прокатке, вытягиванию в проволоку (волочению), штамповке. Смещение заполненных атомами металла плоскостей в кристалле в определенных пределах не приводит к разрушению металлической связи. Механизм образования смещений связан с появлением и движением дислокаций. Хрупкими определенное время считались титан, вольфрам, хром, молибден, тантал, висмут, цирконий. Очищенные от примесей эти металлы — высокопластичные материалы, которые можно ковать, прессовать, прокатывать. В табл. 11.3 приведены значения относительного удлинения некоторых металлов, характеризующего их пластичность. [c.324]
Для металлов характерно образование сплавов (см. 1.7, 5.6), специфика которых обусловлена местом элементов в периодической системе. Для атомов.и /-элементов следует учитывать комплекс их особых свойств (см. 3.10, 4.3—4.5). При образовании сплавов металлов проявляется металлическая связь и происходит кристаллизация вещества. Фазы, из которых состоят сплавы, могут быть твердыми растворами, химическими соединениями и системами с образованием эвтектики (см. 1.7). [c.134]
Пластичность металлов также объясняется специфическими свойствами металлической связи. При мехаиическом воздействии на твердое тело отдельные слои его кристаллической решетки смещаются отиосительнс друг друга. В кристаллах с атомной структурой это приводит к разрыву ковалентных связей между атомами, принадлежащими различным слоям, и кристалл разрущается. В кристаллах с ионной структурой при взаимном смещении слоев неизбежно создается такое положение, при котором рядом оказы-вйются одноименно заряженные ионы при этом возникают силы Е ле.- лростатнческого отталкивания и кристалл также разрушается. В случае же металла при смещении отдельных с. юев его кристаллической решетки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы металла, но разрыва химических сг,язей не происходит—металл деформируется, пе разрушаясь. [c.534]
Электрофизические свойства металлов в свою очередь неразрьшно связаны с их строением. Все металлы и металлические сплавы — тела кристаллические, расположение атомов в которых имеет определенную закономерность. Реальные металлы представляют собой поликристаллические тела, состоящие из большого числа мелких (10″ — 10″ см) различно ориентированных по отношению друг к другу кристаллов. В процессе кристаллизации они приобретают неправильщто форму и называются зернами. [c.17]
Перспективы применения различных металлических материалов в современной технике оказались весьма заманчивыми, что и поставило перед химией задачу т.щательпого изучения свойств металлов и их сплавов, а также разработки экономичных методов их получе[(ия и рационального использоваиня. Современная химия металлов оказалась одной из самых разработанных областей науки и стала источником открытий и обобщений, способствующих иауч 10-техническому прогрессу. В связи с этим изучение химии конструкционных металлов в данном курсе начинается с рассмотрения физических и химических свойств металлов и их сплавов. [c.214]
Характерным механическим свойством металлов является их плис 1 ичлость (см. Г.1. VII, 3). Снособность металлов к пластической деформации обусловлена особенностью их кристаллической структуры, связанной с Ещлнчием свободно перемещающихся между узлами решетки электронов. Сментение заполненных ионами плоскостей в металлическом кристалле не приводит к его разрушению, если только расстояния между плоскостями изменяются в пределах, допускающих осуществление металлической связи. [c.217]
Металлические твердые растворы. Металлы характеризуются повышенной склонностью растворять металлы и в мень[пей степени неметаллы. Эта способность следствие предельной нелокализованности металлической связи. Вследствие дефицита электронов (см, рис, 64) валентная зона металлическ010 кристалла может принимать некоторое число добавочных электронов, не вызывая изменений структуры и металлических признаков кристалла. Образованию твердых растворов благоприятствует близость химических свойств, атомных радиусов и типов кристаллической структуры исходных вешеств (см. с. III). Несоблюдение одного из этих [c.205]
Структура и физические свойства жидкости зависят от химической индивидуальности образующих ее частиц, а также от характера и интенсивности сил, действующих между ними. Для воды, как мы видели, большую роль в ассоциации молекул в комплексы играют водородные связи. У неполярных молекул взаимодействие и взаимное расположение обусловливаются дисперсионными силами. Поскольку эти силы ненасыщаемы и ненаправлены, то и жидкости с неполярными молекулами характеризуются высокими координационными числами в комплексах. Высокие координационные числа достигаются и в жидких металлах, ибо металлическая связь тоже ненасыщаема и нена правлена. Иначе говоря, общие закономерности образования комплексов для жидких тел такие же, как и для твердых тел. Отличие заключается в отсутствии жесткости в структуре и дальнего порядка в расположении частиц. [c.152]
Сплавы представляют собой растворы, которые по своим свойствам очень близки к химическим соединениям. В некоторых сплавах при постепенном изменении состава иногда можно обнаружить несколько соединений одних и тех же металлов N34811, NaSп, N3803 и пр. Состав этих соединений не совпадает с обычными представлениями о валентности. В этих соединениях существенную роль играет металлическая связь, осуществляемая с помощью электронного 1 аза . В других случаях состав жидких и твердых сплавов может меняться непрерывно (например, А — Аи). При охлаждении сплавов образуются твердые растворы, которые совершенно однород- [c.30]
Общность ряда существенных физических свойств металлов, их резкое отличие от свойств типичных неметаллов в значительной мере обусловлены своеобразием внутреннего строения образуемых металлами кристаллических структур. В свою очередь поскольку силы, связывающие атомы металлов в кристаллическую решетку, определяются состоянием валентьых электронов свободных атомов, причины своеобразия физических свойств металлов следует искать в особенностях строения электронных оболочек и в природе металлической связи. Так как химические свойства свободных металлов и их соединений неразрывно связаны с физическими свойствами и также определяются строением электронных оболочек атомов и кристаллической структурой их соединений, следует кратко остановиться на этих важнейших характеристиках, определяющих совокупность физико-химических свойств металлов. [c.107]
Металлическая связь объясняет многие физические свойства металлов. Электроны, образующие металлическую связь, свободно перемещаются по кристаллу. Именно поэтому кристаллы с металлической связью пластичны, т. е. они изменяют форму при ударе, прокатываются в тонкие листы и вытягиваются в проволоку. Именно ггоэтому быстро выравнивается температура в пределах всего кристалла, что обуславливает хорошую теплопроводность. При приложении даже небольшой разности потенциалов электроны приобретают направленное движение от отрицательного полюса [c.55]
Металлическая связь ярко проявляется в щелочных и щелочноземельных металлах. В металлах переходных элементов образование энергетических зон и наличие металлической связи определяется перекрыванием 5-, и р-орбиталей. Но химическая связь в металлах й- и /-элементов не является только металлической связью их специфические свойства (высокие энергии связи атомов и энергии атомизации, высокие температуры плавления и кипения) не исключают возможного возникновения направленной связиспере-крьшанием -орбиталей. [c.123]
Из тех данных, с которыми мы познакомились при характеристике типов связи, следует, что специфика химической связи является важнейшим фактором, определяющим физико-химические свойства веществ (см. 5.10). Так, комплекс свойств металлических тел глубоко взаимосвязан с металлической связью. Многие свойства сплавов и соединений металлов d- и /-элементов (гидридов, бори-дов, карбидов, нитридов, оксидов и др.) не могут рассматриваться без учета возможной у них доли металлической связи. Сравнительно легко отличить свойства соединений с преобладанием ковалентной или ионной связи. К соединениям ковалентного типа относятся углеводороды, разнообразные другие органические вещества, СиО,, P I3, P I5 и т. п. Значительная доля ковалентной связи содержится в молекулах галогенидов, оксидах и сульфидах переходных металлов. [c.124]
Несмотря на явную сомнительность пренебрежения электронноионным взаимодействием, теория свободного электрона в состоянии объяснить многие свойства металлов. Так, ненаправленный характер связей ионов с электронным газом в металлических кристаллах объясняет их высокую ковкость и тягучесть. По этой же причине чистые металлы должны кристаллизоваться преимущественно в структурах плотнейших упаковок. И действительно, большая часть металлов имеет или гексагональную, или гранецентрированную кубическую плотнейшую упаковку, аналогичную приведенным на рис. 32. [c.80]
Сульфиды -металлов, лантаноидов и актиноидов имеют преимущественно переменный состав. Для них характерно наличие смешанных ионно-ковалентных или ковалентно-металлических связей. По мере усложнения состава возрастает доля ковалентной связи и появляются полупроводниковые свойства. У многих сульфидов лантаноидов и актиноидов обнаружены люминесцентные свойства. Сульфид церия Се28з исключительно стоек к действию расплавленных металлов в неокислительных средах и в вакууме, что позволяет использовать его для изготовления огнеупорных изделий. [c.241]
С особенностями металлической связи связаны такие свойства металлов, как хорошая электрическая проводимость, теплопр овод-ность, пластичность, ковкость и др. [c.147]
chem21.info
Химические связи • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Электроны в атоме занимают ряд вложенных слоев (см. Атом Бора), при этом воздействию другого атома могут подвергаться, как правило, только электроны, находящиеся во внешнем слое (он называется валентным слоем). Когда электроны в двух атомах выстраиваются так, что возникает сила, удерживающая вместе эти два атома, мы говорим, что образуется химическая связь. Различают несколько видов химической связи.
Ионная связь
Когда внешние электронные слои полностью заполнены, общая энергия атомов понижается. Например, атом натрия, имеющий на внешнем слое один электрон, охотно отдает этот электрон. И наоборот, атом хлора, которому не хватает одного электрона для заполнения внешнего слоя, стремится присоединить электрон для завершения уровня. Когда атомы натрия и хлора оказываются рядом, натрий отдает электрон, а хлор его принимает. При этом атом натрия, потеряв отрицательный заряд, становится положительно заряженным ионом натрия, а атом хлора, получив дополнительный электрон, становится отрицательно заряженным ионом хлора. По закону Кулона между двумя ионами возникает электростатическое притяжение, приводящее к образованию химической связи, которая и удерживает атомы вместе (см. также Правило октета).
С этой реакцией связано одно из чудес химии: бурно реагирующее вещество натрий и сильно ядовитый газ хлор, соединяясь, образуют обычную поваренную соль, широко применяемую в питании.
Ковалентная связь
Некоторые атомы, в основном это касается углерода, образуют связи по-другому. Когда два таких атома достаточно приближаются друг к другу, между ними возникает взаимодействие, которое можно рассматривать как длительный взаимный обмен электронами. Как будто атом бросает один из своих внешних электронов другому атому, затем ловит электрон другого атома и снова бросает его обратно в бесконечной игре в мяч. В соответствии с законами квантовой механики, такой обмен электронами вызывает силу притяжения, которая и удерживает атомы вместе.
Дело в том, что такой атом как углерод, имеющий четыре электрона во внешнем слое, может дополнить этот валентный слой до восьми электронов, образуя ковалентные связи с четырьмя другими атомами. Поэтому атомы углерода способны образовывать молекулы с длинными цепями, какие мы наблюдаем в биологических системах). Некоторые ученые (и я в том числе) даже утверждают, что вследствие этого свойства атома углерода вся жизнь во Вселенной, как и жизнь на Земле, должна быть углеродной.
Металлическая связь
В металлах образуется химическая связь еще одного вида. Каждый атом в металле отдает один или два подвижных электрона, как бы делясь этими электронами со всеми соседними атомами металла. Эти квазисвободные электроны образуют что-то вроде желе, в котором располагаются тяжелые положительные ионы металла. Все это напоминает трехмерную пространственную решетку из стеклянных шариков в вязкой патоке — если толкнуть один из таких шариков, он слегка сдвинется, но сохранит свое положение относительно других. Точно так же атомы металла, потревоженные внешним механическим воздействием, останутся связанными друг с другом благодаря «электронному желе» (или «электронному газу»). Вот почему, если ударить по металлу молотком, останется вмятина, но сам кусок металла, скорее всего, не разломится. Именно «электронное желе» делает металлы хорошими проводниками электричества (см. Электронная теория проводимости).
Водородная связь
Строго говоря, это не химическая связь в том смысле, в каком мы рассматривали предыдущие три типа связи. Это, скорее, притяжение между отдельными молекулами. Многие молекулы, хотя и являются в целом нейтральными (то есть имеют одинаковое количество отрицательных электронов и положительных протонов в своем ядре), оказываются поляризованными. Это значит, что некоторые части таких молекул имеют суммарный отрицательный заряд, в то время как другие части — положительный. Конечно, суммарный заряд молекулы нейтрален, но положительный и отрицательный заряды распределены неравномерно.
Представим, что полярная молекула, как ее называют, приближается своей отрицательной областью к молекуле-мишени. Электростатическая сила со стороны этой отрицательной области больше, чем со стороны положительной, т. к. положительная область расположена дальше. Эта электростатическая сила вызывает в молекуле-мишени передвижение электронов прочь от точки контакта, тем самым создавая в этом месте молекулы-мишени незначительный положительный заряд. В результате между двумя молекулами возникает сила притяжения и, следовательно, образуется связь.
Самая известная полярная молекула — это молекула воды. Отрицательный заряд собирается вокруг атома кислорода, приводя к образованию слабого положительного заряда около атомов водорода. Благодаря такой поляризации вода является хорошим растворителем. Ее молекулы способны создавать связи более прочные, чем те, которые удерживают молекулы-мишени вместе. Связи, создаваемые посредством положительно заряженных атомов водорода, называются водородными связями. Поскольку молекул водорода очень много в биологических молекулах, водородные связи в них образуются достаточно часто. В частности, именно водородные связи удерживают вместе две спирали молекулы ДНК.
См. также:
elementy.ru
ВВЕДЕНИЕ В СУЩНОСТЬ ЭЛЕКТРИЧЕСКОГО ЗАРЯДА
ВВЕДЕНИЕ В СУЩНОСТЬ ЭЛЕКТРИЧЕСКОГО ЗАРЯДАРАЗНОИМЁННЫЕ ЭЛЕКТРИЧЕСКИЕ ЗАРЯДЫ, КАК ПРОТИВОФАЗНЫЕ КВАНТОВЫЕ ПУЛЬСАЦИИ
Гришаев А.А.
Институт метрологии времени и пространства, ГП ВНИИФТРИ
141570 Московская обл., Менделеево
Введение.
По прошествии нескольких столетий активного изучения электрических явлений, официальная физика не может сказать о сущности электрического заряда ничего сверх того, что заряды бывают двух типов, причём разноимённые заряды притягиваются, а одноимённые – отталкиваются. Такой уровень понимания имелся уже в самом начале эпохи изучения электричества, и до сих пор серьёзного продвижения в этом вопросе не произошло.О каком-то важном изъяне в традиционном подходе к электричеству свидетельствует следующее противоречие с законом сохранения энергии [1]. Считается, что каждая пара элементарных зарядов, при отсутствии экрана между ними, испытывает электромагнитное взаимодействие. На ядерных масштабах энергия кулоновского взаимодействия такой пары сравнима с величиной mec2, где me — масса электрона, c — скорость света. Казалось бы, при аннигиляции электрон-позитронной пары эта энергия должна превращаться в другие формы. Однако, энергии гамма-квантов, являющихся продуктами аннигиляции, свидетельствуют: при таком превращении освобождается энергия 2mec2, т.е. сумма собственных энергий электрона и позитрона (см., например, [2]). Выходит, что сравнимая с этой величиной энергия кулоновского взаимодействия аннигилирующей пары исчезает бесследно.
Более того, по всем канонам электродинамики, как классической, так и квантовой, у каждой заряженной частицы имеется индивидуальная энергия, обусловленная наличием заряда: ведь считается, что этот заряд в частице как-то распределён, и его “кусочки” – хоть классически, хоть квантово – взаимодействуют друг с другом. Выходит, что и эта индивидуальная зарядовая энергия частиц (со всеми её недорезанными бесконечностями) бесследно исчезает при аннигиляции.
Вышеназванные, а также другие электрические парадоксы можно разрешить без противоречий с законом сохранения энергии – в предположении, что, в отличие от массы, электрический заряд не является энергетической характеристикой. В настоящей статье мы изложим представления об электрическом заряде, которые позволяют существенно прояснить картину электромагнитных взаимодействий.
Физический смысл электрического заряда.
Как мы отмечали в предыдущих работах, электрон является квантовым пульсатором [3]. Напомним, что квантовые пульсации представляют собой чередование всего двух состояний, поэтому временная развёртка квантовых пульсаций является не синусоидой, а меандром; можно сказать, что, на уровне “первокирпичиков” вещества, мир является не “аналоговым”, а “цифровым”. Частота f квантового пульсатора и его масса m связаны формулой де Бройля:hf=mc2, (1)
где
h — постоянная Планка. Ранее мы неявно использовали эту формулу без ссылки на де Бройля; о его авторстве узнали совсем недавно, из статьи [4]. Там говорится, что де Бройль много работал над тем, чтобы придать формуле (1) релятивистски инвариантный вид. Он полагал, что формула (1) справедлива лишь в системе покоя электрона – ведь считалось, что, по мере роста скорости, частота f должна была бы уменьшаться, а масса m, наоборот, возрастать. Но мы считаем, что формула (1) не нуждается в релятивистских коррекциях, поскольку ни f, ни m не испытывают релятивистских изменений, и обе они пропорциональны одной и той же величине – собственной энергии квантового пульсатора [3].Как мы отмечали в предыдущих работах
[5], частота свободного квантового пульсатора определяется только его местоположением на совокупности частотных склонов, ответственных за тяготение. Напомним, что заданное в некоторой области пространства распределение для собственной частоты квантового пульсатора — с градиентом, т.е. с частотным склоном – приводит к следующему. При перемещении квантового пульсатора в сторону понижения частоты, его собственная энергия убывает, причём разность превращается в кинетическую энергию, чем и обусловлено ускорение свободного падения [6]. Таким образом, частота пульсаций электрона, которую мы далее будем называть электронной частотой, равно как и масса электрона, зависят от гравитационного потенциала. Используя справочное значение массы электрона, которое соответствует потенциалу на поверхности Земли, мы получаем с помощью формулы (1) значение электронной частоты ~ 1.24× 1020 Гц.Уместен вопрос: имеет ли значение текущая фаза квантовых пульсаций на электронной частоте? Мы отвечаем на этот вопрос утвердительно: на наш взгляд, именно с этой текущей фазой связана сущность электрического заряда. Мы полагаем, что в каждой точке иерархии частотных склонов однозначно задана не только электронная частота, но и две противоположные фазы пульсаций на этой частоте, которые и ответственны за электрические заряды: меандры квантовых пульсаций положительного и отрицательного зарядов сдвинуты друг относительно друга на полпериода. Важно подчеркнуть, что все свободные заряды, находящиеся в одном и том же гравитационном потенциале, пульсируют синхронно: когда отрицательные заряды пребывают “на верхней полочке меандра”, то положительные – на его
“нижней полочке”, и наоборот.Итак, разгадка двуполярности электричества заключается, на наш взгляд, в противофазности квантовых пульсаций на электронной частоте. Электрический заряд, действительно, оказывается не энергетической характеристикой, т.к. он определяется не частотой, а фазой. Тем не менее, электрическая энергия является объективной реальностью, и следует остановиться на физическом смысле этой энергии.
Физический смысл электрической энергии.
Уточним, что под электрической энергией мы понимаем работу, которую требуется совершить для пространственного разделения разноимённых зарядов (заметим, что концентрация зарядов одного знака тоже представляет собой, в сущности, такое разделение). Попытаемся ответить на вопрос – почему для разделения противофазных квантовых пульсаторов требуется совершить работу.Рассмотрим уединённую пару элементарных разноимённых зарядов. Какие циклические процессы происходят в этой паре? Прежде всего, это две противофазные пульсации на электронной частоте, происходящие в местах локализации каждого из зарядов. Но, кроме этих пульсаций, здесь можно обнаружить ещё нечто, а именно: синхронные встречные перескоки состояний – верхней и нижней полочек меандра – из места локализации одного заряда в место локализации другого. Этот тип циклического движения можно рассматривать, как пространственные квантовые пульсации, которым – как и обычным, или временным, квантовым пульсациям – соответствует некоторая энергия. Чтобы получить для неё аналитическое выражение, обратим внимание на то, что энергия обычных квантовых пульсаций равна кванту действия h (с размерностью Дж× с), умноженному на частоту, или, что то же самое, делённому на дискрет пульсаций во времени. Рассуждая по аналогии, введём квант пространственного действия H, с размерностью Дж× м, чтобы, будучи поделённым на дискрет пульсаций в пространстве, т.е. на расстояние r между зарядами, он давал бы энергию пространственных квантовых пульсаций E. Тогда, в самом общем виде, можно записать
, (2)
причём здесь необходимы некоторые замечания. Двойка в знаменателе обусловлена тем, что за один цикл пространственных пульсаций происходит переброс состояний “туда-сюда”, т.е. на удвоенное расстояние между зарядами. Проблема сингулярности при
r® 0 устраняется следующим образом. Энергия пространственных пульсаций имеет физический смысл лишь когда рассматриваемые пульсаторы не перекрываются в пространстве – этим и обусловлено наличие нижнего ограничения на расстояние между зарядами в (2). Характерным размером re электрона является, на наш взгляд, не его удвоенный классический радиус, а его комптоновская длина волны. Будем считать, что при 0<r<2re энергия пространственных пульсаций равна нулю. Отсюда вытекает значение константы в (2), которое оказывается равно H/2re. Теперь, сравнивая размерности h и H, мы замечаем, что эти две константы связаны через множитель с размерностью скорости:H=hV, (3)
так что
. (4)
Соответственно, сила электрического притяжения, действующая между парой разноимённых зарядов, есть
. (5)
Что касается численного значения
V, то оно оказывается равно отнюдь не скорости света в вакууме, как это можно было ожидать. Для точного соответствия силы (5) силе кулоновского притяжения элементарных зарядов в вакууме, следует положить V=7× 105 м/с. Тогда, действительно, мы получаем две равные по величине и согласующиеся по размерности комбинации постоянных:e2/4p e 0= 2.3× 10-28 Кл2× м× Ф-1, hV/2= 2.3× 10-28 Дж× м,
где e — элементарный заряд, e 0 — диэлектрическая проницаемость вакуума.
Интересно отметить, что значение скорости V, равное 700 км/с, поразительным образом совпадает со значением, которое Козырев называл “скоростью перехода причины в следствие” или “ходом времени” [7]. К сожалению, оказались безуспешными все наши попытки разобраться с физическим смыслом этой скорости и понять, что же движется с этой скоростью. По-видимому, физический смысл имеет лишь произведение постоянной Планка на скорость Козырева, дающее введённый выше квант пространственного действия:
H=hV= 4.6× 10-28 Дж× м.
Подчеркнём, что, в согласии с вышеизложенным, электрическая энергия присуща парам элементарных зарядов лишь противоположного знака, порождая силу их притяжения (5). Пары одноимённых зарядов не имеют электрической энергии; соответственно, они не отталкиваются друг от друга. Видимое же их “отталкивание”, если оно имеет место, обусловлено, по-видимому, притяжением к противоположным зарядам. Вот лишь одно из следствий этой избирательности действия электрических сил: для обеспечения стабильности атомных ядер не требуется ядерных сил, чтобы сдерживать “кулоновское отталкивание” ядерных протонов.
Связанные электрические заряды.
При формировании устойчивых структур из элементарных частиц, характерной чертой является уменьшение собственной энергии этих частиц; так, даже атомарному электрону требуется сообщить энергию, чтобы он покинул атом. Таким образом, частоты связанных квантовых пульсаторов понижены по сравнению с частотами свободных квантовых пульсаторов, о которых говорилось выше.Логично допустить, что, для обеспечения этого понижения частот, в объёме атома задано соответствующее ямко-подобное распределение частот квантовых пульсаторов (“частотное гнездо”, по терминологии Николаевского
[8]). Для обобщения нашей модели электрического заряда на случай связанных квантовых пульсаторов, следует принять, что в объёме атома эта модель работает качественно так же, как и в случае свободных зарядов, а именно: для каждого пониженного значения электронной частоты заданы две противоположные фазы пульсаций, одна из которых обеспечивает наличие отрицательного заряда, а другая – положительного.Следует пояснить – согласованы ли эти фазы пульсаций у совокупности атомов. Ответ на этот вопрос неоднозначен. Если атомы слабо взаимодействуют друг с другом, так что каждый из них можно рассматривать как автономную крупицу вещества, то фазы квантовых пульсаций, задающие электрические заряды, могут “плавать” от атома к атому. Если же атомы взаимодействуют сильно, например, образуют структуру твёрдого тела, то эти фазы имеют тенденцию к синхронизации – что при определённых условиях и происходит, создавая условия для проявления экзотических эффектов, вроде сверхпроводимости (см. ниже).
Теперь заметим, что связанные заряженные частицы имеют такую же возможность электрически взаимодействовать друг с другом, как и свободные. Спрашивается: каким всё-таки образом обеспечивается устойчивость структуры атома – почему атомарный электрон, взаимодействуя с положительным зарядом в ядре, не падает на него? Как в классической, так и в квантовой физике считается, что силой, препятствующей этому падению, является центробежная сила, возникающая при орбитальном движении электрона. Однако, как мы отмечали в работе
[9], центробежная сила обусловлена радиальным градиентом скоростей у частиц вращающегося тела; эта сила может действовать лишь на структурное образование из элементарных частиц, но никак не на одиночную элементарную частицу.Мы полагаем, что падение атомарных электронов на ядро исключается благодаря особому режиму их пульсаций, при котором отсутствует электрическая энергия взаимодействия электронов с положительными зарядами ядра, а, значит, отсутствует и притяжение электронов к ядру. В самом деле, выше отмечалось, что притяжение возникает у
противофазных пульсаторов. Пока противоположные заряды имеют одинаковую электронную частоту, они пульсируют в противофазе и, соответственно, притягиваются. Теперь допустим, что частоты противоположных зарядов немного различаются. Тогда их разность фаз линейно растёт со временем, и притяжение возникает лишь тогда, когда эта разность фаз близка к нечётным числам p . Но можно регулярно переключать частоту электрона между двумя слабо разнесёнными значениями, при одном из которых рассматриваемая разность фаз линейно растёт, а при другом – линейно уменьшается. Тогда возможно удерживать разность фаз в коридоре ± p /2 и не давать ей приближаться к значению, при котором возникает притяжение. Таким образом, задача предотвращения падения атомарного электрона на ядро почти решена; остаётся лишь решить проблему – куда электрон будет отдавать часть своей энергии при переключении его частоты вниз, и откуда он будет получать её обратно при переключении частоты вверх. На наш взгляд, эта проблема решается организацией синхронных противоположных переключений у пар атомарных электронов, имеющих одинаковую среднюю энергию: электроны из такой пары просто по очереди передают разностную энергию друг другу. Из такой картины взаимодействия электронных пар, кстати, вытекают основные принципы, по которым происходит заполнение электронных оболочек в многоэлектронных атомах.Такая точка зрения позволяет просто и наглядно объяснить результаты атомной спектроскопии, которые традиционно интерпретируются, как следствие наличия у электрона такой характеристики, как спин. Если верно вышеизложенное, то “спином”, во-первых, обладают не свободные, но только связанные электроны, и, во-вторых, “спин” не имеет ничего общего ни с собственным механическим моментом количества движения электрона, ни с его собственным магнитным моментом.
Природа металлической проводимости.
Современные концепции металлической проводимости базируются на допущении о газе свободных электронов, движущихся в промежутках между атомами. При этом омическое сопротивление обусловлено, якобы, тем, что атомы мешают направленному движению этих электронов, если к проводнику приложена разность потенциалов: электроны соударяются с атомами и отдают им часть своей кинетической энергии.Чтобы оценить эту модель, достаточно поинтересоваться, с какой результирующей скоростью продвигаются электроны к положительному концу проводника. Например, Каганов [10] приводит следующие цифры: в типичном проводнике, при плотности тока 1А/см2, среднее значение искомой скорости составляет ~ 10-3 см/с. Эта цифра заставляет задуматься. В самом деле, тепловая скорость электрона при температуре 3000К есть ~ 107 см/с. Метаясь с такими скоростями между атомами, электроны должны находиться в тепловом равновесии с ними, ведь нагрев куска металла при этом не происходит. Стоит, однако, приложить к нему разность потенциалов, и коллективный дрейф электронов с ничтожной скоростью, от которого практически не изменяется распределение их скоростей, приводит к тому, что проводник начинает заметно греться. Это настолько странно, что наглядная модель омического сопротивления металлов – в рамках концепции газа свободных электронов – до сих пор отсутствует.
Мы полагаем, что сильные различия в электропроводности у металлов, полупроводников и диэлектриков проистекают отнюдь не из особенностей расположения разрешённых и запрещённых энергетических зон: зонная теория по существу ничего не объясняет, а лишь подгоняет расположение этих зон для согласия с экспериментальными фактами. Высокая электропроводность металлов обусловлена, на наш взгляд, самым малым числом электронов на внешних электронных оболочках, которое у атомов ярко выраженных металлов равно одному или двум. Этого числа внешних электронов, приходящихся на один атом, недостаточно для того, чтобы сформировать с их помощью структуру твёрдого тела – с учётом того, что часть этих электронов должна иметь возможность отрабатывать температурные возмущения. Поэтому внешние атомарные электроны в металлах, вообще говоря, не являются валентными, поскольку атомы в металлической структуре соединяются через взаимодействие не внешних электронных оболочек, а ближайших к ним внутренних – которые имеют существенно меньший радиус (этим, кстати, можно качественно объяснить более высокую плотность металлов по сравнению с неметаллами). Отсюда вытекает высокая мобильность внешних атомарных электронов в металлах: входя в состав некоторого атома, такой электрон зачастую находится ближе к ядру соседнего атома, чем своего, что способствует лёгкому “переключению” этого электрона в состав соседнего атома.
Этими переключениями электронов из атома в атом и обусловлена, на наш взгляд, металлическая проводимость – как это и представляли раньше [11], до принятия ведущей в тупик концепции газа свободных электронов. Важно подчеркнуть, что в режиме стационарного тока переключение электрона в соседний атом, который до этого отдал один из своих электронов, означает, что навстречу перескоку элементарного отрицательного заряда происходит встречный перескок элементарного положительного заряда. Таким образом, “квант электричества”, передаваемый в металле в режиме стационарного тока, равен удвоенному элементарному заряду даже при обычных температурах. Как можно видеть, для объяснения величины этого “кванта электричества” нам не требуются умозрительные теории, призванные описать надуманное объединение электронов в куперовские пары.
Что же касается омического сопротивления металлов, то его можно объяснить следующим образом. Как отмечалось выше, у связанных электронов попарно синхронизируются переключения собственных энергий. В условиях теплового разброса этих энергий, при продвижении по проводнику электроны многократно испытывают процедуру такой синхронизации. Её алгоритм заключается в том, что тот электрон из вновь формирующейся пары, чья энергия больше, избавляется от этого излишка, который переходит в другую форму – в джоулево тепло.
Чем выше температура, тем больше тепловой разброс собственных энергий электронов и, соответственно, тем больше потери на джоулево тепло, что интерпретируется, как рост сопротивления. Если учесть, что в различных металлах и сплавах внешние электроны имеют различные тепловые разбросы даже при одинаковой температуре, то естественное объяснение, по крайней мере, качественное, находят термоэлектрические явления – эффекты Пельтье, Зеебека, Томсона.
Соответственно, по мере понижения температуры становится всё меньше тепловой разброс собственных энергий электронов, и всё более благоприятными оказываются условия для “беспошлинного” продвижения электронов по проводнику. Переход в сверхпроводящее состояние происходит, если оказываются скоррелированными электронные частоты у достаточного количества внешних атомарных электронов в объёмах, соответствующих линиям тока.
Следует добавить, что самостоятельный незатухающий ток в кольцевом сверхпроводнике – это, на наш взгляд, предрассудок. Индуцированными токами сверхпроводник гасит внешние электромагнитные воздействия; если же нет внешних воздействий, то нет и “замороженных” токов в сверхпроводнике. Проблема в том, что сама процедура детектирования незатухающего тока, с помощью какого-либо магнитометра, индуцирует ток в сверхпроводнике; но есть ли в нём ток, когда магнитометр выключен – неизвестно. Мы полагаем, что при этом тока нет. Сверхпроводящие электромагниты, как известно, работают только с внешними источниками питания. Впрочем, взаимодействие незатухающих токов наблюдалось в опытах с парой сверхпроводящих колец [12]. Но эти незатухающие токи были обусловлены, по-видимому, тем, что ток в каждом из колец являлся внешним воздействием для другого кольца.
Магнитное взаимодействие свободных зарядов.
Магнитное взаимодействие – это привилегия движущихся зарядов: магнитно взаимодействуют только те заряды, локально-абсолютные скорости которых не равны нулю. Используя известные соотношения, получим аналитическое выражение для магнитной силы – в терминах нашей модели электрического заряда.Пусть два уединённых элементарных заряда одинакового знака имеют локально-абсолютные скорости v1 и v2. Сила Лорентца, действующая на заряд q2, в нерелятивистском приближении есть
F2=m 0 q2[v2H1], (6)
где m
0 – магнитная проницаемость вакуума, H1– напряжённость магнитного поля, создаваемого зарядом q1. Выражение для магнитного поля движущегося заряда имеет вид [13]:, (7)
где
r12 – радиус-вектор, проведённый от заряда q1 к заряду q2. Подставляя (7) в (6) и учитывая, что e2/4p e 0=hV/2, получаем:. (8)
При выводе этого выражения мы намеренно рассматривали случай взаимодействия одноимённых зарядов, и вот почему. Если электрические силы стремятся устранить неоднородности в статическом распределении заряда, то от магнитных сил можно было бы ожидать, что они стремятся устранить неоднородности в кинематике заряда. Иными словами, магнитное взаимодействие должно так поворачивать векторы скоростей свободных заряженных частиц, чтобы результирующая сумма электрических токов уменьшалась бы и в пределе стремилась к нулю. Однако, анализ математических выражений, описывающих действие магнитных сил, показывает, что эти силы уменьшают сумму токов при взаимодействии лишь одноимённых зарядов; в противоположном случае сумма токов не уменьшалась бы, а возрастала. Можно было бы разрешить этот парадокс радикальным образом – если допустить, что магнитно взаимодействуют только одноимённые заряды. Это допущение гармонично дополняло бы сделанный выше вывод о том, что электрически взаимодействуют только разноимённые заряды.
Как ни непривычны эти выводы, но они, по-видимому, не противоречат фактам, хотя иногда это не очевидно. Например, треки электрон-позитронных пар в камере Вильсона, казалось бы, свидетельствуют о том, что одно и то же “магнитное поле” искривляет траектории как электрона, так и позитрона. Но обратим внимание: сильные магнитные поля в лабораторных установках создаются с помощью токов в металлических проводниках. Как отмечалось выше, ток в металлах представляет собой встречное движение положительного и отрицательного электричества. Поэтому можно считать, что на электрон и позитрон в камере Вильсона действует не “одно и то же магнитное поле”: электрон
взаимодействует с током отрицательных зарядов, а позитрон – с током положительных. Этот же принцип – встречного движения отрицательного и положительного электричества – позволяет объяснить, почему пучок протонов управляется электромагнитами, а также почему постоянные магниты действуют на заряженные частицы обоих знаков. Ведь намагниченность вещества объясняется, на наш взгляд, не упорядочиванием орбитального движения электронов в атомах, и тем более не упорядочиванием спинов электронов, а замкнутыми токами по цепочкам из нескольких атомов. Коснёмся ещё одной ситуации, с магнитным полем Земли, которое, как мы полагаем, создаётся отрицательными зарядами [14]. Если верны наши представления, то магнитное поле Земли действует на отрицательно заряженные космические частицы, но не действует — на положительно заряженные. Так ли это? Считается, что в радиационных поясах Земли курсируют захваченные магнитным полем заряженные частицы обоих знаков – в частности, протоны. Наличие протонов в радиационных поясах подтверждается с помощью спутниковых избирательных детекторов – например, ядерно-эмульсионных и сцинтилляционных [15]. Но, даже если протоны попадают в радиационные пояса в основном из внешнего космоса, то где гарантия, что они захвачены именно магнитным полем, а не объёмным отрицательным зарядом, который создают захваченные электроны? Вторая их этих двух версий, кстати, лучше согласуется с феноменом космических лучей, более чем на 90% состоящих из протонов [16], которые бомбардируют Землю почти изотропно, словно её магнитное поле на них не действует.
Магнитное воздействие на быстро движущийся электрон.
Известно, что при увеличении скорости электрона до значений, сравнимых со скоростью света, эффективность магнитного воздействия на электрон уменьшается по релятивистскому закону. Многие поколения исследователей пытались объяснить этот феномен на основе допущений о релятивистских изменениях каких-либо физических характеристик, присущих самому электрону. Так, в теории относительности считается, что у электрона происходит релятивистский рост массы (что представляется нам абсурдом).Между тем, названный феномен возможно объяснить без привлечения каких-либо изменений характеристик электрона. Уменьшение эффективности магнитного воздействия на быстро движущийся электрон простейшим образом вытекает из единственной и, по-видимому, бесспорной предпосылки – о том, что локально-абсолютная скорость электрона не может превышать скорость света в вакууме. В самом деле, пусть электрон, движущийся со скоростью v, влетает в область магнитного воздействия, где он испытывает поперечное приращение скорости D v. С помощью теоремы Пифагора мы получаем, что максимальная величина D v, которую может приобрести электрон в данном случае, есть
, (9)
т.е. D
vmax равно произведению c – максимально возможному приращению скорости – на релятивистский радикал. Поделив обе части (9) на промежуток времени, в течение которого происходит поперечное приращение скорости, и устремив этот промежуток времени к нулю, мы сразу получаем выражение, связывающее максимальные поперечные ускорения для случаев быстро и медленно движущегося электрона:, (10)
где
a0 — максимальное поперечное ускорение медленно движущегося (v2/c2<<1) электрона при том же магнитном воздействии.Таким образом, “ослабление” магнитного воздействия на быстро движущийся электрон является, на наш взгляд, эффектом не энергетическим и не силовым: по мере приближения скорости электрона к скорости света, соответствующее уменьшение максимального поперечного приращения скорости обусловлено всего лишь запретом на преодоление электроном “светового барьера”.
Заключение.
Итак, традиционный подход к электричеству приводит к противоречиям с законом сохранения энергии. Эти противоречия устраняются в предположении, что физическим смыслом электрического заряда является определённость фазы квантовых пульсаций на электронной частоте.Тогда, как показано выше, естественно объясняется происхождение электрической энергии и электрических сил, а также проясняются некоторые вопросы устойчивости атомов, структуры твёрдого тела, металлической проводимости, магнитного взаимодействия. По-видимому, можно построить всю электродинамику, не используя таких мистических понятий, каковыми являются элементарный заряд (в традиционном понимании), напряжённости электрического и магнитного полей, диэлектрическая и магнитная проницаемости вакуума, и т.п. Ведь в полученные выше выражения (5) и (8) для электрических и магнитных сил входят, помимо постоянной Планка и скорости света, лишь скорость Козырева и метрические параметры.
С учётом вышеизложенного, мы можем говорить уже не о частотных склонах, а о частотно-фазовых, которыми тяготение и электромагнетизм “сцеплены” друг с другом.
Автор благодарит А.А.Гришаева (старшего) и А.Н.Малимона за весьма полезное обсуждение.
Ссылки.
Источник:
http://newfiz.narod.ruПоступило на сайт: 22 июля 2002.
newfiz.narod.ru
А. Ток в металлах — PhysBook
Электронная проводимость металлов
Электронная проводимость металлов была впервые экспериментально доказана немецким физиком Э.Рикке в 1901 г. Через три плотно прижатых друг к другу отполированных цилиндра — медный, алюминиевый и снова медный — длительное время (в течение года) пропускали электрический ток. Общий заряд, прошедший за это время, был равен 3.5·106 Кл. Поскольку массы атомов меди и алюминия существенно отличаются друг от друга, то массы цилиндров должны были бы заметно измениться, если бы носителями заряда были ионы. Результаты опытов показали, что масса каждого из цилиндров осталась неизменной. В соприкасающихся поверхностях были обнаружены лишь незначительные следы взаимного проникновения металлов, которые не превышали результатов обычной диффузии атомов в твердых телах. Следовательно, свободными носителями заряда в металлах являются не ионы, а такие частицы, которые одинаковы и в меди, и в алюминии. Такими частицами могли быть только электроны.
Прямое и убедительное доказательство справедливости этого предположения было получено в опытах, поставленных в 1913 г. Л. И. Мандельштамом и Н. Д. Папалекси и в 1916 г. Т. Стюартом и Р. Толменом.
На катушку наматывают проволоку, концы которой припаивают к двум металлическим дискам, изолированным друг от друга (рис. 1). К концам дисков с помощью скользящих контактов присоединяют гальванометр.
Рис. 1
Катушку приводят в быстрое вращение, а затем резко останавливают. После резкой остановки катушки свободные заряженные частицы будут некоторое время двигаться вдоль проводника по инерции, и, следовательно, в катушке возникнет электрический ток. Ток будет существовать короткое время, так как из-за сопротивления проводника заряженные частицы тормозятся и упорядоченное движение частиц прекращается.
Направление тока говорит о том, что он создается движением отрицательно заряженных частиц. Переносимый при этом заряд пропорционален отношению заряда частиц, создающих ток, к их массе, т.е. \(~\Delta q = \frac{q_0}{m}\). Поэтому, измеряя заряд, проходящий через гальванометр за все время существования тока в цепи, удалось определить отношение \(~\frac{q_0}{m}\). Оно оказалось равным 1,8·1011 Кл/кг. Эта величина совпадает с отношением заряда электрона к его массе, найденным ранее из других опытов.
Таким образом, электрический ток в металлах создается движением отрицательно заряженных частиц электронов. Согласно классической электронной теории проводимости металлов (П. Друде, 1900 г., Х.Лоренц, 1904 г.), металлический проводник можно рассматривать как физическую систему совокупности двух подсистем:
- свободных электронов с концентрацией ~ 1028 м-3 и
- положительно заряженных ионов, колеблющихся около положения равновесия.
Появление свободных электронов в кристалле можно объяснить следующим образом.
Рис. 2
При объединении атомов в металлический кристалл слабее всего связанные с ядром атома внешние электроны отрываются от атомов (рис. 2). Поэтому в узлах кристаллической решетки металла располагаются положительные ионы, а в пространстве между ними движутся электроны, не связанные с ядрами своих атомов. Эти электроны называются свободными или электронами проводимости. Они совершают хаотическое движение, подобное движению молекул газа. Поэтому совокупность свободных электронов в металлах называют электронным газом.
Если к проводнику приложено внешнее электрическое поле, то на беспорядочное хаотическое движение свободных электронов накладывается направленное движение под действием сил электрического поля, что и порождает электрический ток. Скорость движения самих электронов в проводнике — несколько долей миллиметра в секунду, однако возникающее в проводнике электрическое поле распространяется по всей длине проводника со скоростью, близкой к скорости света в вакууме (3·108 м/с).
Так как электрический ток в металлах образуют свободные электроны, то проводимость металлических проводников называется электронной проводимостью.
Электроны под влиянием постоянной силы, действующей со стороны электрического поля, приобретают определенную скорость упорядоченного движения (ее называют дрейфовой). Эта скорость не увеличивается в дальнейшем со временем, так как при столкновении с ионами кристаллической решетки электроны передают кинетическую энергию, приобретенную в электрическом поле, кристаллической решетке. В первом приближении можно считать, что на длине свободного пробега λ (это расстояние, которое электрон проходит между двумя последовательными столкновениями с ионами) электрон движется с ускорением \(~a = \frac{eE}{m}\) и его дрейфовая скорость линейно возрастает со временем\[~\upsilon = at = \frac{eEt}{m}\]. В момент столкновения электрон передает кинетическую энергию кристаллической решетке. Потом он опять ускоряется, и процесс повторяется. В результате средняя скорость упорядоченного движения электронов пропорциональна напряженности электрического поля в проводнике \(~\mathcal h \upsilon \mathcal i \sim E\) и, следовательно, разности потенциалов на концах проводника, так как \(~E = \frac Ul\), где l — длина проводника.
Известно, что сила тока в проводнике пропорциональна скорости упорядоченного движения частиц\[~I = en \mathcal h \upsilon \mathcal i S\], а значит, согласно предыдущему, сила тока пропорциональна разности потенциалов на концах проводника: I ~ U. В этом состоит качественное объяснение закона Ома на основе классической электронной теории проводимости металлов.
Однако в рамках этой теории возникли трудности. Из теории следовало, что удельное сопротивление должно быть пропорционально корню квадратному из температуры (\(~\rho \sim \sqrt T\)), между тем, согласно опыту, ρ ~ Т. Кроме того, теплоемкость металлов, согласно этой теории, должна быть значительно больше теплоемкости одноатомных кристаллов. В действительности теплоемкость металлов мало отличается от теплоемкости неметаллических кристаллов. Эти трудности были преодолены только в квантовой теории.
В 1911 г. голландский физик Г. Камерлинг-Оннес, изучая изменение электрического сопротивления ртути при низких температурах, обнаружил, что при температуре около 4 К (т.е. при -269 °С) удельное сопротивление скачком уменьшается (рис. 1) практически до нуля. Это явление обращения электрического сопротивления в нуль Г. Камерлинг-Оннес назвал сверхпроводимостью.
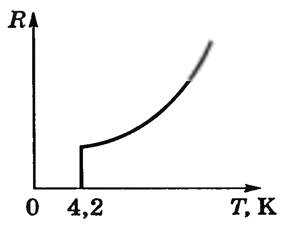
Рис. 1
В дальнейшем было выяснено, что более 25 химических элементов — металлов при очень низких температурах становятся сверхпроводниками. У каждого из них своя критическая температура перехода в состояние с нулевым сопротивлением. Самое низкое значение ее у вольфрама — 0,012 К, самое высокое у ниобия — 9 К.
Сверхпроводимость наблюдается не только у чистых металлов, но и у многих химических соединений и сплавов. При этом сами элементы, входящие в состав сверхпроводящего соединения, могут и не являться сверхпроводниками. Например, NiBi, Au2Bi, PdTe, PtSb и другие.
Вещества в сверхпроводящем состоянии обладают необычными свойствами:
- электрический ток в сверхпроводнике может существовать длительное время без источника тока;
- внутри вещества в сверхпроводящем состоянии нельзя создать магнитное поле:
- магнитное поле разрушает состояние сверхпроводимости. Сверхпроводимость — явление, объясняемое с точки зрения квантовой теории. Достаточно сложное его описание выходит за рамки школьного курса физики.
Широкому применению сверхпроводимости до недавнего времени препятствовали трудности, связанные с необходимостью охлаждения до сверхнизких температур, для чего использовался жидкий гелий. Тем не менее, несмотря на сложность оборудования, дефицитность и дороговизну гелия, с 60-х годов XX века создаются сверхпроводящие магниты без тепловых потерь в их обмотках, что сделало практически возможным получение сильных магнитных полей в сравнительно больших объемах. Именно такие магниты требуются для создания установок управляемого термоядерного синтеза с магнитным удержанием плазмы, для мощных ускорителей заряженных частиц. Сверхпроводники используются в различных измерительных приборах, прежде всего в приборах для измерения очень слабых магнитных полей с высочайшей точностью.
В настоящее время в линиях электропередачи на преодоление сопротивления проводов уходит 10 — 15 % энергии. Сверхпроводящие линии или хотя бы вводы в крупные города принесут громадную экономию. Другая область применения сверхпроводимости — транспорт.
На основе сверхпроводящих пленок создан ряд быстродействующих логических и запоминающих элементов для счетно-решающих устройств. При космических исследованиях перспективно использование сверхпроводящих соленоидов для радиационной защиты космонавтов, стыковки кораблей, их торможения и ориентации, для плазменных ракетных двигателей.
В настоящее время созданы керамические материалы, обладающие сверхпроводимостью при более высокой температуре — свыше 100 К, то есть при температуре выше температуры кипения азота. Возможность охлаждать сверхпроводники жидким азотом, который имеет на порядок более высокую теплоту парообразования, существенно упрощает и удешевляет все криогенное оборудование, обещает огромный экономический эффект.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 279-282.
www.physbook.ru
Поверхностная и внутренняя энергия металла
Металлические изделия формируют основную базу инфраструктурного обеспечения инженерных коммуникаций, выступают сырьем для машиностроительной промышленности и строительства. В каждой из указанных областей использование таких элементов сопрягается с высокой ответственностью. На монтажные и коммуникационные конструкции воздействуют и химические, и механические нагрузки, что обуславливает необходимость первичного анализа свойств материала. Для понимания эксплуатационных параметров используется такое понятие, как энергия металла, которая определяет поведение отдельного элемента или конструкции в тех или иных условиях эксплуатации.

Свободная энергия
Множество процессов в структуре металлических изделий определяется характеристиками свободной энергии. Наличие в материале ионов с таким потенциалом приводит к их перемещению в другие среды. Например, в ходе взаимодействия с растворами, содержащими аналогичные ионы, металлические элементы уходят в контактную смесь. Но это происходит в случаях, когда свободная энергия металлов превосходит аналогичные показатели в растворе. В результате может сформироваться положительная обкладка двойного электрического поля за счет свободных электронов, оставшихся вблизи металлической поверхности. Укрепление данного поля также выступает барьером для прохождения новых ионов – таким образом, создается граница раздела фаз, препятствующая переходам элементов. Процесс такого перемещения продолжается до того момента, пока в новообразованном поле не будет достигнута предельная разность потенциалов. Пиковая граница определяется балансом разностей потенциалов в растворе и металле.
Поверхностная энергия
При попадании новых молекул на металлическую поверхность происходит освоение свободных зон. В процессе перемещения молекулы занимают на поверхности микротрещины и участки раздела мелких зерен – это сегменты кристаллической решетки. По такой схеме происходит изменение свободной поверхностной энергии, которая понижается. В твердых телах также можно наблюдать процессы облегчения пластического течения на поверхностных участках. Соответственно, поверхностная энергия металлов обуславливается силами притяжения молекул. Здесь же стоит отметить величину поверхностного натяжения, которая зависит от нескольких факторов. В частности, ее определяет геометрия молекул, их силы и количество атомов в структуре. Также имеет значение и расположение молекул в поверхностном слое.
Поверхностное напряжение

Обычно процессы натяжения происходят в гетерогенных средах, которые отличаются поверхностью раздела несмешивающихся фаз. Но следует заметить, что наряду с натяжением проявляются и другие свойства поверхностей, обусловленные параметрами их взаимодействия с другими системами. Совокупность данных свойств определяет большинство технологических показателей металла. В свою очередь, энергия металла, с точки зрения поверхностного натяжения, может определять параметры коалесценции капель в сплавах. Технологи, таким образом, выявляют характеристики огнеупоров и флюсов, а также их взаимодействие с металлической средой. Помимо этого, поверхностные свойства оказывают влияние на скорость термотехнологических процессов, среди которых выделение газов и вспенивание металлов.
Зонирование энергии и свойства металла
Уже отмечалось, что конфигурация распределения молекул по структуре металлической поверхности может определять отдельные характеристики материала. В частности, специфический отблеск многих металлов, а также их непрозрачность обуславливаются распределением энергетических уровней. Скопление энергий в свободных и занятых уровнях способствует наделению любого кванта двумя энергетическими уровнями. Один из них будет находиться зоне валентности, а другой — в участках проводимости. При этом нельзя сказать, что распределение по энергиям электронов в металле является стационарным и не предполагает изменений. Элементы валентной зоны, к примеру, могут поглощать световые кванты, мигрируя в зону проводимости. В результате свет поглощается, а не отражается. По этой причине металлы имеют непрозрачную структуру. Что касается блеска, то его обуславливает процесс испускания света при возвращении активизированных излучением электронов на низкие уровни энергии.
Внутренняя энергия

Данный потенциал формируется энергией ионов, а также тепловым движением электронов проводимости. Косвенно эта величина характеризуется собственными зарядами металлических структур. В частности, для стали, которая пребывает в контакте с электролитами, автоматически устанавливается собственный потенциал. С изменениями внутренней энергии связаны многие неблагоприятные процессы. Например, по этому показателю можно определить коррозионные и деформационные явления. В таких случаях внутренняя энергия металла обуславливает наличие микро- и макронарушений в структуре. Более того, частичное рассеивание данной энергии под действием той же коррозии обеспечивает и потерю определенной доли потенциала. На практике эксплуатации металлических изделий негативные факторы изменения внутренней энергии могут проявляться в виде структурных разрушений и снижении пластичности.
Энергия электрона в металле
При описаниях совокупности частиц, которые взаимодействуют между собой в твердом теле, применяются квантово-механические представления об энергии электронов. Обычно используются дискретные значения, которые определяют характер распределения данных элементов по уровням энергии. В соответствии с требованиями квантовой теории, измерение энергии электронов производится в электрон-вольтах. Считается, что в металлах потенциал электронов на два порядка превышает энергию, которая рассчитывается по кинетической теории газов в условиях комнатной температуры. При этом энергия выхода электронов из металлов и, в частности, скорость движения элементов не зависит от температуры.
Энергия иона в металле
Расчет энергии ионов позволяет определять характеристики металла в процессах плавления, возгонки, деформации и т. д. В частности, технологи выявляют показатели прочности на разрыв и упругость. Для этого вводится и понятие кристаллической решетки, в узлах которой находятся ионы. Энергетический потенциал иона обычно рассчитывается с учетом его возможности разрушительного воздействия на кристаллическое вещество с образованием составных частиц. На состояние ионов может повлиять и кинетическая энергия электронов, выбиваемых из металлов в процессе столкновения. Поскольку в условиях повышения разности потенциалов в среде электродов до тысячи вольт скорость перемещения частиц значительно увеличивается, накапливаемого потенциала хватает для расщепления встречных молекул на ионы.
Энергия связи
Металлы характеризуются смешанными типами связи. Ковалентная и ионная связки не имеют резкого разграничения и зачастую перекликаются между собой. Так, процесс упрочнения металла под действием легирования и пластического деформирования объясняется как раз перетеканием металлической связки в ковалентное взаимодействие. Независимо от вида данных связей, все они определяются как химические процессы. При этом у каждой связи есть энергия. Например, ионное, электростатической и ковалентное взаимодействие может обеспечивать потенциал в 400 кДж. От конкретной величины будет зависеть и энергия металла при взаимодействии с разными средами и под механическими нагрузками. Металлические связки могут характеризоваться разными показателями прочности, но в любом проявлении они будут не сопоставимы с аналогичными свойствами в ковалентных и ионных средах.
Свойства металлических связей
Одним из первостепенных качеств, которые характеризуют энергию связей, является насыщаемость. Данное свойство определяет состояние молекул и, в частности, их структуру и состав. В металле частицы существуют в дискретном виде. Прежде для понимания эксплуатационных свойств комплексных соединений применялась теория валентных связей, однако в последние годы она утратила свое значение. При всех своих преимуществах данная концепция не объясняет ряд имеющих большое значение свойств. Среди них можно отметить спектры поглощения в соединениях, магнитные качества и другие характеристики. Зато при расчетах энергии поверхности в металлах можно выявить такое свойство, как воспламеняемость. Оно определяет способность металлических поверхностей возгораться без детонирующих активаторов.
Состояние металлов

Большинство металлов характеризуется валентной конфигурацией с электронным строением. В зависимости от свойств данной структуры, определяется и внутреннее состояние материала. На основе этих показателей и с учетом связей можно сделать выводы о значениях температуры плавления конкретного металла. К примеру, мягкие металлы, среди которых золото и медь, отличаются пониженной температурой плавления. Это объясняется уменьшением количества не спаренных электронов у атомов. С другой стороны, мягкие металлы имеют высокие показатели теплопроводности, что, в свою очередь, объясняется высокой подвижностью электронов. Кстати, металл, накапливающий энергию в условиях оптимальной проводимости ионов, обеспечивает высокую электропроводность за счет электронов. Это одна из важнейших эксплуатационных характеристик, которые определяются металлическим состоянием.
Заключение

Химические свойства металлов во многом определяют их технико-физические качества. Это позволяет специалистам ориентироваться на энергетические показатели материала, с точки зрения возможности его использования в тех или иных условиях. Кроме того, энергия металла не всегда может рассматриваться в качестве самостоятельной. То есть собственный потенциал может изменяться в зависимости от характера взаимодействия с другими средами. Наиболее выразительны связи металлических поверхностей с другими элементами на примере процессов миграции, когда происходит заполнение свободных энергетических уровней.
fb.ru
