Kлюч к тесту
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
б, в | г | б | б, в | а | б | г | б | б, в | б |
1. Натрий гидроксид
натрия сульфат
натрия нитрат
натрия азотная
кислота нитрат
натрия нитрит
натрия.
Натрий гидроксид
натрия сульфат
натрия нитрат
натрия азотная
кислота нитрат
натрия нитрит
натрия.
Решение
Запишем цепочку химических превращений, используя формулы веществ, и пронумеруем стрелки:
Составим уравнения реакций для каждого «шага» схемы.
1) 2Na + 2H2O = 2NaOH + H2;
2) 2NaOH + H2SO4 = Na2SO4 + 2H2O;
3) Na2SO4 + Ba(NO3)2 = BaSO4 + 2NaNO3;
4) NaNO3 + H2SO4 NaНSO4 + HNO3;
5) HNO3 + NaOH = NaNO3 + H2O;
6) 2NaNO3 2NaNO2 + O2.
2. Алюминий оксид алюминия алюминат натрия хлорид алюминия гидроксид алюминия сульфат алюминия гидроксид алюминия оксид алюминия алюминий.
3. Сера диоксид
серы сульфит
натрия сернистый
газ триоксид
серы серная
кислота сульфат
натрия.
4. Фосфор пентаоксид фосфора ортофосфорная кислота дигидрофосфат кальция ортофосфорная кислота гидрофосфат кальция.
5. Натрий гидроксид натрия гидрокарбонат натрия карбонат натрия сульфат натрия хлорид натрия натрий.
6. Цинк тетрагидроксоцинкат калия хлорид цинка гидроксид цинка оксид цинка цинкат натрия.
7. Железо хлорид железа(II) гидроксид железа(II) гидроксид железа(III) оксид железа(III) железо.
8. Хлор хлороводород поваренная соль хлор белильная известь.
9. Сера сульфид цинка сероводород сернистый газ сернистая кислота сульфит натрия.
10. Алюминий хлорид алюминия гексагидроксоалюминат натрия нитрат алюминия алюминий.
11. Углекислый газ карбонат кальция гидрокарбонат кальция карбонат кальция оксид углерода(IV) угарный газ углерод.
12. Цинк оксид
цинка сульфат
цинка хлорид
цинка нитрат
цинка сульфид
цинка оксид
цинка цинкат
калия.
13. Медь нитрат меди(II) гидроксид меди(II) сульфат меди(II) нитрат меди(II) оксид меди(II) гидроксид меди (II) оксид меди(II) медь.
14. Напишите уравнения реакций, протекающих без изменения степеней окисления элементов, по схеме: гидроксид карбонат сульфат хлорид нитрат (все вещества растворимы в воде).
15. Составьте уравнения реакций, протекающих без изменения степеней окисления элементов, по схеме: основание-1 основание-2 основание-3 соль-1 соль-2 соль-3 кислота-1 кислота-2 кислота-3.
16. Kальций негашеная известь гашеная известь нитрат кальция фосфат кальция.
17. Углерод углекислый газ угольная кислота карбонат натрия карбонат бария углекислый газ.
18. Kарбонат бария гидрокарбонат бария карбонат бария оксид бария барий.
19. Медь сульфат меди(II) гидроксид меди(II) оксид меди(II) медь хлорид меди(II).
20. Оксид
алюминия хлорид
алюминия гидроксохлорид
алюминия дигидроксохлорид
алюминия гидроксид
алюминия оксид
алюминия.
21. Фосфор пентаоксид фосфора ортофосфорная кислота дигидрофосфат кальция гидрофосфат кальция фосфат кальция.
22. Алюминий сульфат алюминия нитрат алюминия гидроксонитрат алюминия гидроксид алюминия.
Способ очистки от железа кислых растворов солей, содержащих нитрат алюминия
Изобретение относится к области химии и может быть использовано при переработке глиноземсодержащего сырья кислотными способами. Кислые растворы солей, содержащие нитрат алюминия, смешивают с основанием до нейтрализации свободной азотной кислоты и гидролиза нитрата железа до гидроксида железа. Полученный раствор выдерживают в течение 30-90 минут при температуре 90-160°C. Полученную пульпу при достижении pH 1,5-2,3 выгружают из реактора, охлаждают, смешивают с катионным полиэлектролитом. Железосодержащий осадок сгущают и отделяют от очищенного раствора солей. Регулирование соотношения раствора солей и основания и корректировку pH пульпы производят путем дополнительного введения раствора солей или основания непосредственно в пульпу.
Изобретение относится к области переработки глиноземсодержащего сырья кислотными способами, а именно к способам очистки от железа кислых растворов солей, содержащих нитраты алюминия, натрия, калия, железа и других элементов, и может быть использовано в технологии получения соединений алюминия.
Кислые растворы нитратных солей, содержащие нитрат алюминия, являются промежуточными продуктами в технологии получения глинозема, гидроксида и моногидрата оксида алюминия (бемита), коагулянтов и других продуктов на основе нитрата алюминия.
Концентрация нитрата железа в растворах солей в пересчете на оксид Fe
В связи с близостью свойств соединений алюминия и железа разделение нитратов алюминия и железа в кислых растворах является сложной задачей. Исходя из свойств системы Al(NO3)3-Fe(NO3)3-HNO3-H2O очистку кислых растворов нитратных солей от железа проводят кристаллизацией нитрата алюминия из упаренных алюминийсодержащих растворов в крепких растворах азотной кислоты при отношении кислоты к Al 2O3 от 10:1 до 18:1 [Комплексная переработка алюминийсодержащего сырья кислотными способами / Ю. А.Лайнер, М.: Наука, 1982, стр.128].
А.Лайнер, М.: Наука, 1982, стр.128].
Недостатки данного метода:
— низкая эффективность процесса вследствие изоморфизма соединений алюминия и железа;
— использование большого количества концентрированной азотной кислоты для кристаллизации и промывки кристаллов нитрата алюминия;
— сложность переработки маточных растворов азотной кислоты и выведения железа из технологического цикла.
Более эффективной является очистка кислых растворов нитратных солей от железа гидролизом нитрата железа. При отсутствии свободной азотной кислоты в растворе солей и недостатке кислоты для образования нитрата алюминия Al(NO3)3 образуются основные соли алюминия типа Al(OH) А.Лайнер, М.: Наука, 1982, стр.129-130].
А.Лайнер, М.: Наука, 1982, стр.129-130].
По изобретению SU №272182 [опубликовано: 26.05.1970 г.] выщелачивание глиноземистой руды, содержащей примеси железа, проводят азотной кислотой, взятой в количестве от 50 до 90% от стехиометрически необходимой, при 140-220°C и давлении 5,6-10,5 кг/см2 в автоклаве в течение 1-6 часов, реакционную массу из автоклава разбавляют, фильтруют, промывают нерастворенный материал, который затем выбрасывают, а фильтраты используют для получения окиси алюминия.
Известен способ обезжелезивания растворов азотнокислого алюминия [SU №489717, опубликовано: 30.10.1975 г.], включающий автоклавную обработку высококремнистого железистого сырья 30%-ной азотной кислотой при температуре 180°C в течение 2 часов, перемешивание пульпы после автоклавной обработки в течение 1-10 часов при температуре 18-100°C с последующей фильтрацией пульпы, при этом расход азотной кислоты составляет 90% от стехиометрической нормы на образование нормального нитрата алюминия, Al(NO3)3.
Известен способ очистки пульпы, содержащей азотнокислый алюминий, от соединений железа [SU №532571, опубликовано: 25.10.1976 г.] путем разбавления пульпы водой и перемешивания пульпы при 18-100°C в течение 10-24 часов, при этом вскрытие бокситов проводят 30%-ной азотной кислотой при температуре 180°C в течение 2 часов и расходе кислоты 80% стехиометрической нормы на образование нитрата алюминия, разбавление пульпы водой проводят в соотношении 1:1.
Недостатки названных известных способов:
— выщелачивание глиноземистого сырья азотной кислотой в автоклавах при высокой температуре усложняет аппаратурно-технологическую схему процесса;
— разбавление автоклавной пульпы водой и длительное перемешивание пульпы приводят к увеличению объемов оборудования и увеличению энергозатрат на упаривание разбавленных растворов солей;
— разложение глиноземистого сырья азотной кислотой с расходом менее 100%) от стехиометрически необходимого количества приводит к тому, что нерастворенный материал (кремнеземный осадок), загрязненный соединениями железа, выбрасывают;
— при сбросе кремнеземного осадка в отвал переработка высококремнистого глиноземного сырья становится не эффективной, так как диоксид кремния является основным компонентом сырья.
По патенту РФ №2202516 [опубликовано: 20.04.2003 г.] способ получения оксида алюминия из алюмосиликатного сырья включает очистку раствора азотнокислого алюминия от железа путем добавления к раствору двухосновного нитрата алюминия, Al(OH)2(NO3), до нейтрализации избытка кислоты и выделения осадка гидроксида железа, полученный осадок фильтруют.
Недостатками известного способа являются:
— использование для нейтрализации избытка кислоты и выделения осадка гидроксида железа труднодоступного реагента — двухосновного нитрата алюминия, Al(OH)2(NO3), который получают путем неполного термического гидролиза нитрата алюминия из предварительно упаренных растворов;
— необходимость приготовления суспензии двухосновного нитрата алюминия, Al(OH)2(NO3), и дробного дозирования этой суспензии в раствор азотнокислых солей, что не позволяет вести процесс осаждения железа в динамическом режиме.
Аналоги предлагаемого изобретения авторам неизвестны.
Задачей предлагаемого изобретения является извлечение 75-95% железа из кислых растворов нитратных солей, содержащих нитрат алюминия, при использовании доступных реагентов и выведение железа из технологического цикла без выделения алюминия в твердую фазу.
Поставленная задача достигается тем, что раствор солей смешивают с основанием в соотношении, обеспечивающем нейтрализацию свободной азотной кислоты и гидролиз нитрата железа до гидроксида железа, затем раствор выдерживают в течение 30-90 минут при температуре 90-160°C для коагуляции аквакомплексов гидроксида железа и осаждения соединений железа, при достижении pH 1,5-2,3 пульпу выгружают из реактора, охлаждают, смешивают с катионным полиэлектролитом, железосодержащий осадок сгущают и отделяют от очищенного раствора солей.
При получении пульпы с pH меньше 1,5 или больше 2,3 производят регулирование соотношения раствора солей и основания и корректировку pH путем дополнительного введения раствора солей или основания в пульпу.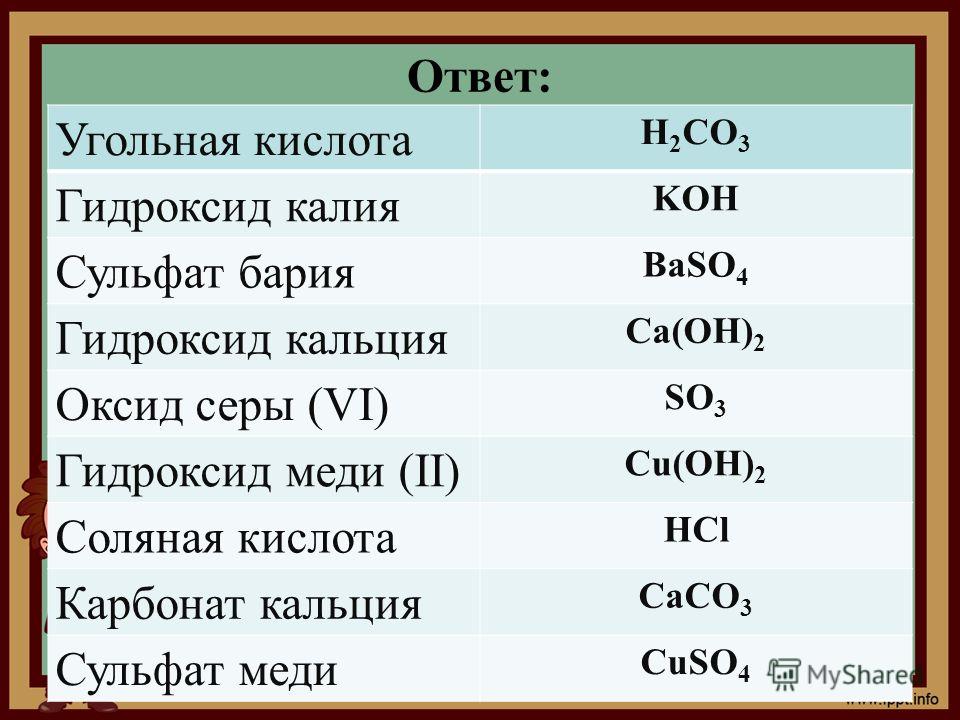
Сгущенный железосодержащий осадок отделяют методом отстаивания.
На очистку от железа поступают растворы солей, содержащие 0,5-5,0% свободной азотной кислоты, 15-35% нитратных солей Al, Na, K, Ca, Mg, Fe, в том числе, 12-25%) нитрата алюминия и 0,1-0,4% железа в пересчете на оксид Fe2O3.
В ходе осуществления очистки от железа кислые растворы солей смешивают с основаниями, которые обеспечивают нейтрализацию свободной азотной кислоты в растворе и гидролиз нитрата железа с образованием гидроксида железа по следующим схемам:
Fe3++3OH——-→Fe(OH)3
Fe3++3NH4OH——-→Fe(OH)3+3NH4 +
2Fe3++3Al(OH)3—-→2Fe(OH)3+3Al(OH)m(NO3)3-m, m=1;
2Fe3++6AlOOH+3H2O—-→2Fe(OH)3+3Al(OH)m(NO3)3-m, m=1.
В качестве оснований используют следующие реагенты:
— гидроксиды натрия или калия, или аммиак в виде водных растворов;
— гидроксид алюминия, осажденный гидроксидом натрия или аммиачной водой из раствора нитрата алюминия, в виде пульпы или осадка Al(ОН)3 с фильтра;
— моногидрат оксида алюминия (бемит, AlOOH), полученный в процессе полного термического гидролиза нитрата алюминия, в виде пульпы или осадка с фильтра.
Соли, которые образуются при нейтрализации свободной азотной кислоты указанными реагентами, не оказывают отрицательного влияния на дальнейшую переработку растворов, т.к. нитраты натрия и калия содержатся в исходном растворе солей, нитрат аммония разлагается на последующих стадиях процесса или используется в технологии производства удобрений, гидроксонитраты алюминия перерабатываются в общей схеме переработки нитрата алюминия.
Основной фактор, влияющий на степень удаления железа из раствора солей — это водородный показатель (или pH) пульпы, которая образуется в процессе выдержки раствора солей после нейтрализации свободной азотной кислоты и гидролиза нитрата железа.
pH начала образования гидроксида железа составляет 2, поэтому при повышении pH раствора солей до 1,5-2,3 нитрат железа подвергается гидролизу с образованием гидроксида железа, Fe(OH)3 или Fe2O3*nH2O, который в водном растворе существует в виде аквакомплексов.
pH начала образования гидроксида алюминия составляет 4, поэтому при pH 1,5-2,3 нитрат алюминия гидролизуется лишь частично с образованием основной соли алюминия, Al(OH)(NO3)2, которая является водорастворимым соединением.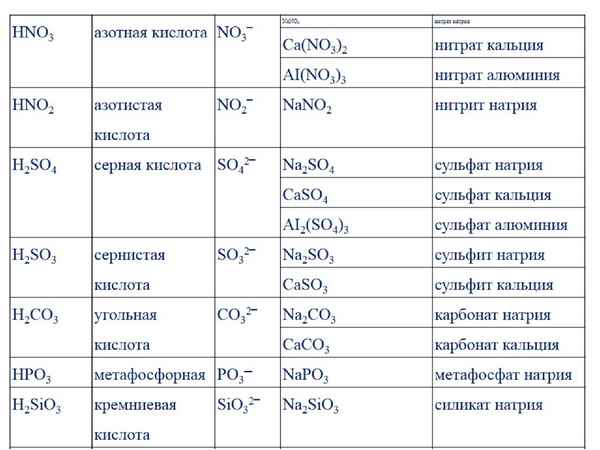 При pH 1,5-2,3 выделение алюминия в твердую фазу в виде гидроксида не происходит.
При pH 1,5-2,3 выделение алюминия в твердую фазу в виде гидроксида не происходит.
При осаждении железа в указанных условиях, сгущении твердой фазы и отделении осадка гравиметрическим методом степень извлечения железа из раствора составляет 75-95%. Содержание железа в пересчете на оксид Fe2O3 в растворах солей снижается с 0,1-0,4% до 0,005-0,07%.
При pH менее 1,5 степень гидролиза нитрата железа уменьшается, снижается полнота осаждения и степень извлечения железа из раствора. При pH более 2,3 соединения железа в растворе солей находятся в виде коллоидных частиц, которые не взаимодействуют с катионным полиэлектролитом и не осаждаются при отстаивании пульпы. Кроме того, при pH более 2,3 идет не только гидролиз нитрата железа с образованием гидроксида железа, но и первая ступень гидролиза нитрата алюминия, что приводит к повышенному расходу реагентов без изменения степени извлечения железа из раствора.
Гидроксид железа легко дает коллоидные растворы. Твердая фаза в них находится во взвешенном состоянии, не взаимодействует с полиэлектролитом, не осаждается вследствие малого размера частиц и высокого поверхностного заряда. Для получения легко осаждаемых частиц твердой фазы проводят выдержку раствора солей при температуре 90-160°C в течение 30-90 минут. В этих условиях происходит коагуляция аквакомплексов гидроксида железа и осаждение соединений железа: Fe2O3, δ-FeOOH, Fe5O7(OH)*4H2O, которые легко подвергаются агрегации при добавлении в полученную пульпу катионного полиэлектролита.
Твердая фаза в них находится во взвешенном состоянии, не взаимодействует с полиэлектролитом, не осаждается вследствие малого размера частиц и высокого поверхностного заряда. Для получения легко осаждаемых частиц твердой фазы проводят выдержку раствора солей при температуре 90-160°C в течение 30-90 минут. В этих условиях происходит коагуляция аквакомплексов гидроксида железа и осаждение соединений железа: Fe2O3, δ-FeOOH, Fe5O7(OH)*4H2O, которые легко подвергаются агрегации при добавлении в полученную пульпу катионного полиэлектролита.
Выбор указанного диапазона температур обусловлен тем, что при температуре ниже 90°C снижается скорость реакций, ухудшается коагуляция коллоидных частиц гидроксида железа и взаимодействие их с полиэлектролитом, снижается полнота удаления железа из раствора. Повышение температуры выше 160°C при проведении высокотемпературного гидролиза нитрата железа в автоклавных условиях не влияет на полноту удаления железа из раствора солей.
В диапазоне температур 90-109°C реакторное оборудование работает при атмосферном давлении, в диапазоне 110-160°C при повышенном давлении.
Для осуществления очистки раствора солей от железа смешивают одно из указанных оснований, раствор выдерживают в течение 30-90 минут при температуре 90-160°C до достижения pH пульпы 1,5-2,3, периодически осуществляют контроль pH. При отклонении pH производят корректировку pH пульпы и соотношения реагентов: раствора солей и основания. Для выведения железа из технологического цикла пульпу с pH в диапазоне 1,5-2,3 выгружают из реактора, охлаждают и смешивают с катионным полиэлектролитом.
Выбор катионного полиэлектролита обусловлен тем, что поверхность частиц твердой фазы в пульпе имеет отрицательный заряд. В качестве катионного полиэлектролита применяется, в частности, сополимер акриламида и метилхлорида в виде раствора с массовой долей сополимера 0,1-0,2%. Данный полиэлектролит является доступным и экономичным реагентом.
Сгущенный железосодержащий осадок выводят из отстойника-сгустителя на переработку. Объемная доля сгущенного осадка в среднем составляет 4-7% и не превышает 10% от объема пульпы.
Объемная доля сгущенного осадка в среднем составляет 4-7% и не превышает 10% от объема пульпы.
Железосодержащий осадок перерабатывают известными методами: фильтруют и/или центрифугируют, при необходимости осадок отмывают от водорастворимых соединений. Промытый железосодержащий осадок используют, в частности, в качестве пигментной добавки.
В технологии предусмотрено смешение жидкой фазы: фильтрата и фугата с очищенным раствором солей или возврат фильтрата и фугата, а также промывных вод с промывки осадка в исходный кислый раствор солей, что позволяет организовать безотходный процесс и исключить потери солей с осадком.
Очищенный раствор солей из отстойника-сгустителя направляют на последующие стадии процесса для получения соединений алюминия, натрия, калия или смешанных продуктов.
Новым и существенным в предлагаемом техническом решении является подбор доступных реагентов и определение условий осаждения железа из кислых растворов солей, содержащих нитрат алюминия, без перевода алюминия в осадок, извлечение 75-95% железа из технологического цикла при использовании простой аппаратурно-технологической схемы.
Испытания предлагаемого способа проведены с использованием кислых растворов солей, содержащих нитрат алюминия, полученных при азотнокислотной переработке щелочных алюмосиликатов, в частности нефелинового концентрата. Способ очистки растворов солей от железа в соответствии с предлагаемым изобретением иллюстрируют приведенные ниже примеры. Результаты опытов в соответствии с предлагаемым изобретением приведены в таблице 1.
Пример 1
Кислый раствор солей следующего состава: сумма солей — 24%, в том числе, нитрат алюминия — 17,6%, свободная азотная кислота — 1,65%, железо в пересчете на оксид железа (III), Fe2O3, — 0,23% смешивают в реакторе с 42%-ным раствором гидроксида натрия в соотношении 100:3 по массе и выдерживают 60 минут при температуре 97±2°C, полученную пульпу, имеющую pH 1,4, выгружают из реактора, охлаждают, добавляют полиэлектролит Nalco 9914, железосодержащий осадок сгущают и отделяют от очищенного раствора методом отстаивания.
Массовая доля соединений железа в пересчете на оксид Fe2O3 в очищенном растворе солей составляет 0,0730%), степень извлечения железа — 70%.
Примеры 2-11
Опыты 2-11 проводят аналогично опыту по примеру 1. Кислый раствор солей смешивают в определенном соотношении с 42%-ным раствором гидроксида натрия и выдерживают раствор 60 минут при температуре 97±2°C до достижения pH пульпы в диапазоне 1,5-2,3. В очищенном растворе солей после отделения железосодержащего осадка определяют остаточное содержание железа в пересчете на оксид Fe2O3 и рассчитывают степень извлечения железа из раствора.
Пример 12
Кислый раствор солей следующего состава: сумма солей — 30%, в том числе, нитрат алюминия — 22,64%, свободная азотная кислота — 1,97%, железо в пересчете на оксид железа (III), Fe2O3, — 0,24% смешивают в реакторе с 42%-ным раствором гидроксида натрия в соотношении 100:4 по массе и выдерживают 60 минут при температуре 90±2°C, полученную пульпу с pH 1,92 выгружают из реактора, охлаждают, добавляют полиэлектролит Nalco 9914, железосодержащий осадок сгущают и отделяют от очищенного раствора методом отстаивания.
Массовая доля соединений железа в пересчете на оксид Fe2O3 в очищенном растворе солей составляет 0,0312%, степень извлечения железа — 87%.
Пример 13
Опыт проводят аналогично опыту по примеру 12. Выдержку раствора производят в течение 60 минут при кипении раствора при температуре 108°C, полученную пульпу с pH 2,02 выгружают из реактора.
Массовая доля соединений железа в пересчете на оксид Fe2O3 в очищенном растворе солей составляет 0,0238%, степень извлечения железа — 90%.
Пример 14
Опыт проводят аналогично опыту по примеру 12. Выдержку раствора производят в течение 60 минут при температуре 155±5°C, полученную пульпу с pH 1,8 выгружают из реактора.
Массовая доля соединений железа в пересчете на оксид Fe2O3 в очищенном растворе солей составляет 0,02%, степень извлечения железа — 92%.
Пример 15
Кислый раствор солей следующего состава: сумма солей — 24%, в том числе, нитрат алюминия — 17,6%, свободная азотная кислота — 1,65%, железо в пересчете на оксид железа (III), Fe2O3 — 0,23% смешивают в реакторе с 42%-ным раствором гидроксида натрия в соотношении 100:3,7 по массе и выдерживают 30 минут при кипении раствора при температуре 106°C, полученную пульпу с pH 1,67 выгружают из реактора, охлаждают, добавляют полиэлектролит Nalco 9914, железосодержащий осадок сгущают и отделяют от очищенного раствора методом отстаивания.
Массовая доля соединений железа в пересчете на оксид Fe2O3 в очищенном растворе солей составляет 0,035%, степень извлечения железа — 85%.
Пример 16
Опыт проводят аналогично опыту по примеру 15. Раствор выдерживают 60 минут при кипении раствора при температуре 106°C.
Массовая доля соединений железа в пересчете на оксид Fe2O3 в очищенном растворе солей составляет 0,026%, степень извлечения железа — 92%.
Пример 17
Опыт проводят аналогично опыту по примеру 15. Раствор выдерживают 90 минут при кипении раствора при температуре 106°C.
Массовая доля соединений железа в пересчете на оксид Fe2O3 в очищенном растворе солей составляет 0,025%, степень извлечения железа — 89%.
| Таблица 1 | |||||
| Результаты очистки кислых растворов солей от железа | |||||
| Пример | pH | Температура выдержки | Время выдержки | Массовая доля Fe2O3 в очищенном растворе | Степень извлечения железа из раствора солей |
| °C | мин | % | % | ||
| 1 | 1,4 | 97±2 | 60 | 0,0730 | 70 |
| 2 | 1,5 | 97±2 | 60 | 0,0580 | 75 |
| 3 | 1,66 | 97±2 | 60 | 0,0496 | 78 |
| 4 | 1,74 | 97±2 | 60 | 0,0308 | 86 |
| 5 | 1,8 | 97±2 | 60 | 0,0290 | 87 |
| 6 | 1,84 | 97±2 | 60 | 0,0210 | 91 |
| 7 | 1,91 | 97±2 | 60 | 0,0184 | 92 |
| 8 | 2,06 | 97±2 | 60 | 0,0114 | 95 |
| 9 | 2,10 | 97±2 | 60 | 0,0140 | 94 |
| 10 | 2,13 | 97±2 | 60 | 0,0084 | 96 |
| 11 | 2,31 | 97±2 | 60 | 0,0087 | 96 |
| 12 | 1,92 | 90±2 | 60 | 0,0312 | 87 |
| 13 | 2,02 | 108 | 60 | 0,0238 | 90 |
| 14 | 1,8 | 155±2 | 60 | 0,0190 | 92 |
| 15 | 1,67 | 106 | 30 | 0,0350 | 85 |
| 16 | 1,7 | 106 | 60 | 0,0260 | 89 |
| 17 | 1,68 | 106 | 90 | 0,0250 | 89 |
1. Способ очистки от железа кислых растворов солей, содержащих нитрат алюминия, заключающийся в том, что раствор солей смешивают с основанием в соотношении, обеспечивающем нейтрализацию свободной азотной кислоты и гидролиз нитрата железа до гидроксида железа, затем раствор выдерживают в течение 30-90 мин при температуре 90-160°C для коагуляции аквакомплексов гидроксида железа и осаждения соединений железа, при достижении pH 1,5-2,3 пульпу выгружают из реактора, охлаждают, смешивают с катионным полиэлектролитом, железосодержащий осадок сгущают и отделяют от очищенного раствора солей.
Способ очистки от железа кислых растворов солей, содержащих нитрат алюминия, заключающийся в том, что раствор солей смешивают с основанием в соотношении, обеспечивающем нейтрализацию свободной азотной кислоты и гидролиз нитрата железа до гидроксида железа, затем раствор выдерживают в течение 30-90 мин при температуре 90-160°C для коагуляции аквакомплексов гидроксида железа и осаждения соединений железа, при достижении pH 1,5-2,3 пульпу выгружают из реактора, охлаждают, смешивают с катионным полиэлектролитом, железосодержащий осадок сгущают и отделяют от очищенного раствора солей.
2. Способ по п.1, отличающийся тем, что при получении пульпы с pH меньше 1,5 или больше 2,3 производят регулирование соотношения раствора солей и основания и корректировку pH путем дополнительного введения раствора солей или основания в пульпу.
3. Способ по п.1, отличающийся тем, что в диапазоне температур 90-109°C реакторное оборудование работает при атмосферном давлении, в диапазоне 110-160°C — при повышенном давлении.
4. Способ по п.1, отличающийся тем, что в качестве основания используют гидроксид натрия, или гидроксид калия, или водный раствор аммиака, или гидроксид алюминия, или моногидрат оксида алюминия (бемит, AlOOH).
5. Способ по п.1, отличающийся тем, что железосодержащий осадок отделяют от раствора солей методом отстаивания.
неорганическая химия – Реакция гидроксида алюминия и азотной кислоты
спросил
Изменено 4 года, 7 месяцев назад
Просмотрено 4к раз
$\begingroup$
В последнее время я много внимания уделяю гидроксиду алюминия или, в частности, разбивке его на основные компоненты. Я знаю, что при растворении гидроксида алюминия в азотной кислоте образуется нитрат алюминия ($\ce{Al(NO3)3}$), который при кипячении разлагается на алюминий и диоксид азота. Конечной целью этого процесса является извлечение алюминия из гидроксида алюминия, но это невозможно сделать, пока гидроксид алюминия не растворится в азотной кислоте. Я не знаю, легко ли гидроксид алюминия реагирует с азотной кислотой или нет. Может ли гидроксид алюминия легко реагировать с азотной кислотой? Или это нужно катализировать, или я должен использовать другую реакцию для выделения алюминия?
Конечной целью этого процесса является извлечение алюминия из гидроксида алюминия, но это невозможно сделать, пока гидроксид алюминия не растворится в азотной кислоте. Я не знаю, легко ли гидроксид алюминия реагирует с азотной кислотой или нет. Может ли гидроксид алюминия легко реагировать с азотной кислотой? Или это нужно катализировать, или я должен использовать другую реакцию для выделения алюминия?
- неорганическая химия
- кислотно-основная
- катализ
$\endgroup$
5
$\begingroup$
Оксид алюминия может быть продуктом плавления Al(NO3)3 при достаточно высокой температуре. Металлический алюминий не был бы продуктом ни в воде, ни в расплавленной соли.
2. Металлический алюминий плохо растворяется в азотной кислоте из-за образования пассивной оксидно-гидроксидной пленки.
 Атомная энергетика нуждалась в больших количествах азотнокислого алюминия, и его получали растворением металлического алюминия в соляной кислоте (очень быстро) и обработкой раствора азотной кислотой, выпаривая HCl.
Атомная энергетика нуждалась в больших количествах азотнокислого алюминия, и его получали растворением металлического алюминия в соляной кислоте (очень быстро) и обработкой раствора азотной кислотой, выпаривая HCl.- Металлический алюминий часто подготавливают к сварке путем удаления оксидной пленки разбавленной плавиковой кислотой. Алюминиевая поверхность остается голым металлом в течение, может быть, микросекунды, прежде чем снова окислиться до оксида. Но пленка оксида алюминия будет очень тонкой в течение нескольких часов и легко поддается сварке. Оксидная пленка становится толще на воздухе по мере старения. 9\circ C}$ делается не потому, что им нравится использовать высокие температуры, а потому, что нет других хороших способов сделать алюминий. Гидролиз водных растворов солей алюминия будет а не давать металлический алюминий.
Может ли $\ce{Al(OH)3}$ реагировать с $\ce{HNO3}$? Это действительно зависит. Свежий $\ce{Al(OH)3}$ растворяется в разбавленной $\ce{HNO3}$.
 Старый $\ce{Al(OH)3}$ стареет до $\ce{Al(OH)3}$ и гораздо менее реакционноспособен.
Старый $\ce{Al(OH)3}$ стареет до $\ce{Al(OH)3}$ и гораздо менее реакционноспособен.Электролиз водного раствора соли алюминия , а не дает металлический алюминий. Гидролиз $\ce{AlCl3}$ дает $\ce{h3 + O2/Cl2}$. $\ce{Al(NO3)3}$ будет восстановлен с образованием водорода, поэтому вы получите смесь продуктов: $\ce{NO2}$, $\ce{NO}$, $\ce{h3}$ , но не металлический алюминий. Если бы это было легко, промышленность не утруждала бы себя гидролизом расплавленного $\ce{AlF3/Al2O3}$.
$\endgroup$
2
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Напишите сбалансированное химическое уравнение для нитрата алюминия + гидроксида натрия, чтобы получить гидроксид алюминия и нитрат натрия?
Последняя обновленная дата: 25 января 2023
•
Общее количество просмотров: 190,2K
•
Просмотры сегодня: 5,84K
Ответ
Проверено
190,2K+ виды
HINT: Мы. когда число атомов на стороне реагента равно числу атомов на стороне продукта. Сбалансированное химическое уравнение подчиняется закону сохранения массы.
Закон сохранения гласит, что масса не может быть ни создана, ни уничтожена.Полный ответ:
Мы также помним, что сбалансировать химическое уравнение означает сделать атомы одинаковыми по обе стороны реакции.
Сначала мы преобразуем слово уравнение в символьное уравнение. Для этого мы написали формулу химического соединения.
Формула для нитрата алюминия: \[Al{\left( {N{O_3}} \right)_3}\]
Для гидроксида натрия: \[NaOH\]
Для гидроксида алюминия: \[Al{\left ( {ОН} \справа)_3}\]
Для нитрата натрия это \[NaN{O_3}\]
Запишите уравнение
\[Al{\left( {N{O_3}} \right)_{3\;}} + NaOH\; \to \;Al{\left({OH} \right)_3}\; + NaN{O_3}\]
Теперь подсчитайте количество атомов каждого типа на стороне реагента, исключая а затем на продукте
Для записи числа атомов в случае \[{\left( {N{O_3}} \right )_3}\] мы также должны учитывать нижний индекс, поэтому количество атомов азота на стороне реагента становится $3$, а количество кислорода становится $9$, тогда как $1$ атом присутствует в $NaOH$, который также добавляется. Со стороны продукта для кислорода это становится $3 + 3 = 6$ , $3$ из \[Al{\left( {OH} \right)_3}\] и $3$ \[NaN{O_3}\].
Таким образом, общее количество атомов на стороне реагента становится равным
Азот: $3$
Кислород: $9 + 1 = 10$
Водород: $1$
Алюминий: $1$
На стороне продукта оно становится равным
Азот: $1$
Кислород: $3 + 3 = 6$
Водород: 3$
Алюминий: 1$Атомы Номер слева Номер справа $Al$ $1$ $1$ $N$ $3$ $1$ $O$ $10$ $6$ $H$ $1$ $3$ $Na$ $1$ $1$ Теперь, чтобы сбалансировать количество атомов азота на R.
 H.S. умножаем на 3, получается
H.S. умножаем на 3, получается
\[Al{\left({N{O_3}} \right)_{3\;}} + NaOH \to Al{\left({OH} \right)_3} + 3NaN{ O_3}\]
Количество атомов становитсяАтомов Номер на левой стороне Номер на правой стороне $Al$ $1$ $1$ $N$ $3$ $3$ $O$ $10$ $12$ $ H$ $1$ $3$ $Na$ $1$ $3$ Теперь сбалансируем число атомов Na.S. путем умножения на 3
\[Al{\left( {N{O_3}} \right)_{3\;}} + 3NaOH \to Al{\left( {OH} \right)_3} + 3NaN{O_3} \]
Количество атомов становится следующим:Атомы Номер слева Номер справа $Al$ $1$ $1$ $N$ $3$ $3$ $O$ $12$ $12$ $ H$ $3$ $3$ $Na$ $3$ $3$ Количество атомов с обеих сторон одинаково, следовательно, уравнение сбалансировано.

- Металлический алюминий часто подготавливают к сварке путем удаления оксидной пленки разбавленной плавиковой кислотой. Алюминиевая поверхность остается голым металлом в течение, может быть, микросекунды, прежде чем снова окислиться до оксида. Но пленка оксида алюминия будет очень тонкой в течение нескольких часов и легко поддается сварке. Оксидная пленка становится толще на воздухе по мере старения. 9\circ C}$ делается не потому, что им нравится использовать высокие температуры, а потому, что нет других хороших способов сделать алюминий. Гидролиз водных растворов солей алюминия будет а не давать металлический алюминий.
