Формула Нитрата натрия структурная химическая
- Неорганическая соль
Структурная формула
Истинная, эмпирическая, или брутто-формула: NNaO3
Химический состав Нитрата натрия
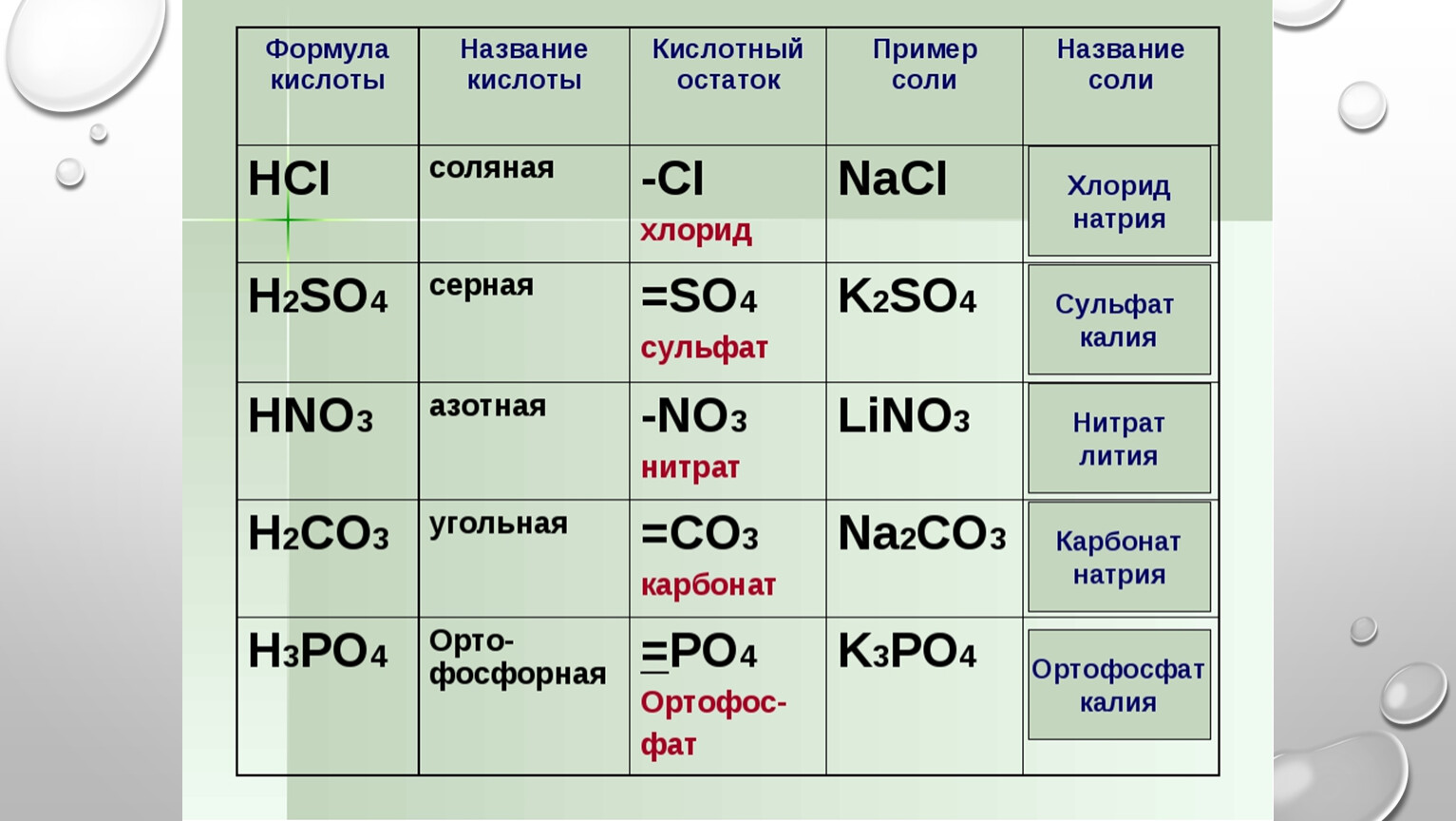
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| N | Азот | 14,007 | 1 | 16,5% |
| Na | Натрий | 22,99 | 1 | 27% |
| O | Кислород | 15,999 | 3 | 56,5% |
Молекулярная масса: 84,994
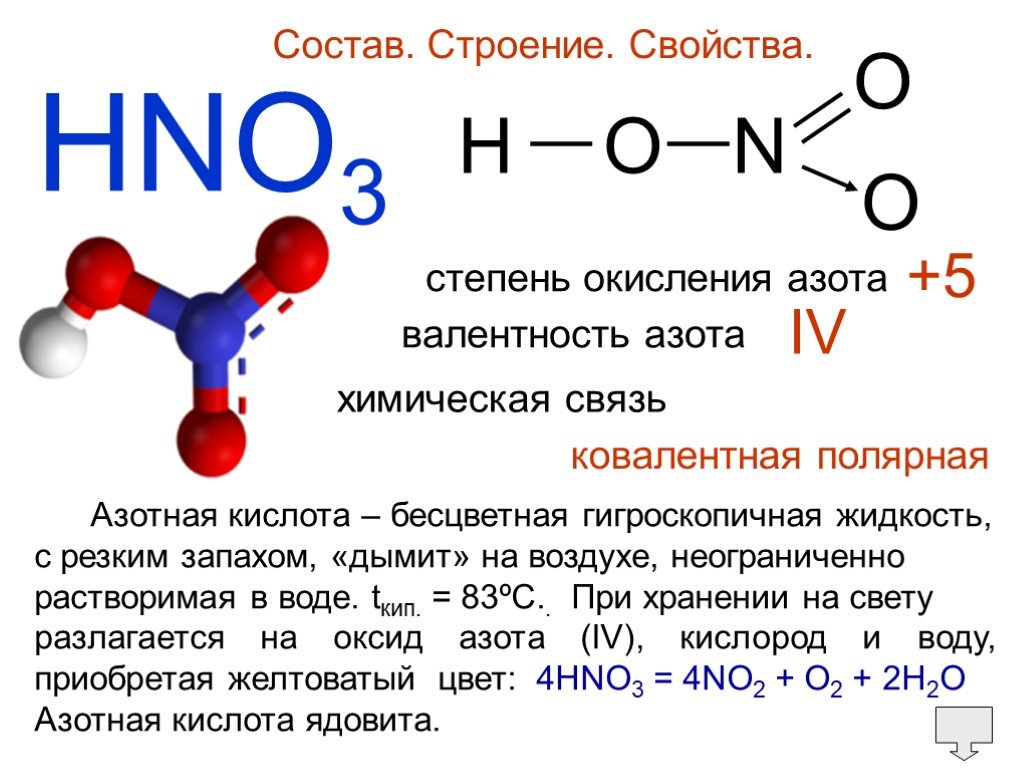
Нитрат натрия(азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Свойства
Физические свойства
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,7 (60°С), 176,0 (100°С)
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Натриевая селитра обладает высокой гигроскопичностью, что затрудняет использование этого вещества в пиротехнике.
Химические свойства
ри нагревании до 380°С разлагается с выделением кислорода и нитрита натрия:
2NaNO3 → 2NaNO2+O2
Может вступать в реакции обмена с солями щелочных металлов.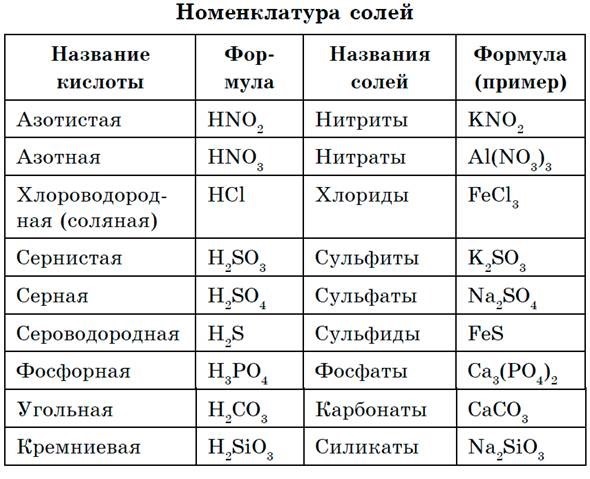 Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
NaNO3+KCl → KNO3+NaCl
NaNO3+RbI → RbNO3+NaI
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
2NaNO3+S → 2NaNO2
2NaNO3+C → 2NaNO2+CO2
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
21Na + 26HNO3 → 21NaNO3 + NO+N2O + N2 + 13H2O
Na2O + 2HNO3 → 2NaNO3 + H2O - Гидроксида натрия или кислых солей натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O
NaHCO3 + HNO3 → NaNO3 + CO2 +H2O
Также вместо азотной кислоты можно использовать нитрат аммония:
NaOH + NH4NO3 → NaNO3 + NH3 + H2O
NaHCO3 + NH4NO3 → NaNO3 + NH3 + CO2 + H2O - Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl-): AgNO3 + NaCl → NaNO3 + AgCl
Применение
Применяется как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
ICSC 0185 — НИТРАТ НАТРИЯ
ICSC 0185 — НИТРАТ НАТРИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| НИТРАТ НАТРИЯ | ICSC: 0185 (Октябрь 2001) |
| НАТРИЕВАЯ СЕЛИТРА ЧИЛИЙСКАЯ СЕЛИТРА |
|
| CAS #: 7631-99-4 |
| UN #: 1498 |
| EINECS #: 231-554-3 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск взрыва при контакте с восстановительными веществами. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск взрыва при контакте с восстановительными веществами. |
НЕ допускать контакта с горючими веществами или восстановителями. | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. | Защитные перчатки. | Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. |
| Глаза | Покраснение. Боль. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Боль в животе. Синие губы, ногти и кожа. Судороги. Диарея. Головокружение. Головная боль. Затрудненное дыхание. Помутнение сознания. Тошнота. Потеря сознания. | Не принимать пищу, напитки и не курить во время работы. Мыть руки перед едой. | Прополоскать рот. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Смести просыпанное вещество в пластиковые или стеклянные контейнеры. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от горючих веществ и восстановителей. Хранить сухим. | |
| УПАКОВКА | |
| НИТРАТ НАТРИЯ | ICSC: 0185 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид БЕСЦВЕТНЫЕ ГИГРОСКОПИЧНЫЕ КРИСТАЛЛЫ. 
Физические опасности
Химические опасности
|
Формула: NaNO3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Промойте загрязненную одежду большим количеством воды ввиду опасности возгорания В случае отравления этим веществом необходимо специфическое лечение; должны иметься в наличии соответствующие средства с инструкциями. 
|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
3.3: Формулы для ионных соединений
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16137
- Анонимный
- LibreTexts
Цели обучения
- Напишите химическую формулу простого ионного соединения.

- Распознавать многоатомные ионы в химических формулах.
Мы уже встречались с некоторыми химическими формулами для простых ионных соединений. Химическая формула представляет собой краткий список элементов в соединении и соотношения этих элементов. Чтобы лучше понять, что означает химическая формула, мы должны рассмотреть, как ионное соединение построено из его ионов.
Ионные соединения существуют в виде чередующихся положительных и отрицательных ионов в правильных трехмерных массивах, называемых кристаллами (рис. \(\PageIndex{1}\)). Как видите, в массиве нет отдельных \(\ce{NaCl}\) «частиц»; вместо этого существует непрерывная решетка чередующихся ионов натрия и хлорида. Однако мы можем использовать отношение ионов натрия к ионам хлорида, выраженное в наименьших возможных целых числах, как способ описания соединения. В случае хлорида натрия отношение ионов натрия к ионам хлорида, выраженное в наименьших целых числах, составляет 1:1, поэтому мы используем \(\ce{NaCl}\) (один \(\ce{Na}\) символ и один символ \(\ce{Cl}\)) для представления соединения. Таким образом, \(\ce{NaCl}\) — это химическая формула хлорида натрия, которая представляет собой краткий способ описания относительного количества различных ионов в соединении. Макроскопический образец состоит из множества пар NaCl; каждая отдельная пара называется формульная единица . Хотя удобно думать, что кристаллы \(\ce{NaCl}\) состоят из отдельных единиц \(\ce{NaCl}\), рисунок \(\PageIndex{1}\) показывает, что ни один ион не связан исключительно с с любым другим одиночным ионом. Каждый ион окружен ионами противоположного заряда.
Таким образом, \(\ce{NaCl}\) — это химическая формула хлорида натрия, которая представляет собой краткий способ описания относительного количества различных ионов в соединении. Макроскопический образец состоит из множества пар NaCl; каждая отдельная пара называется формульная единица . Хотя удобно думать, что кристаллы \(\ce{NaCl}\) состоят из отдельных единиц \(\ce{NaCl}\), рисунок \(\PageIndex{1}\) показывает, что ни один ион не связан исключительно с с любым другим одиночным ионом. Каждый ион окружен ионами противоположного заряда.
Формула ионного соединения соответствует нескольким соглашениям. Во-первых, катион записывается как перед анионом .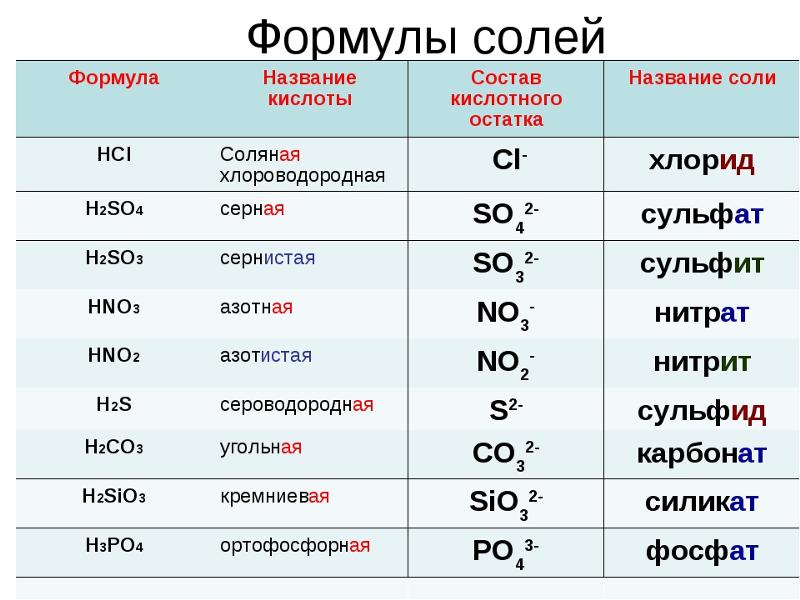 Поскольку большинство металлов образуют катионы, а большинство неметаллов образуют анионы, в формулах обычно сначала указывается металл, а затем неметалл. Во-вторых, заряда — это , а не записанное в формуле. Помните, что в ионном соединении компонентами являются ионы, а не нейтральные атомы, хотя формула не содержит зарядов. Наконец, правильная формула ионного соединения всегда имеет чистый нулевой заряд, означает, что общий положительный заряд должен равняться общему отрицательному заряду. Чтобы определить правильную формулу любой комбинации ионов, определите, сколько каждого иона необходимо, чтобы сбалансировать общие положительные и отрицательные заряды в соединении.
Поскольку большинство металлов образуют катионы, а большинство неметаллов образуют анионы, в формулах обычно сначала указывается металл, а затем неметалл. Во-вторых, заряда — это , а не записанное в формуле. Помните, что в ионном соединении компонентами являются ионы, а не нейтральные атомы, хотя формула не содержит зарядов. Наконец, правильная формула ионного соединения всегда имеет чистый нулевой заряд, означает, что общий положительный заряд должен равняться общему отрицательному заряду. Чтобы определить правильную формулу любой комбинации ионов, определите, сколько каждого иона необходимо, чтобы сбалансировать общие положительные и отрицательные заряды в соединении.
Это правило в конечном итоге основано на том факте, что материя в целом электрически нейтральна.
По соглашению предполагается, что имеется только один атом, если индекс отсутствует. Мы не используем 1 в качестве нижнего индекса.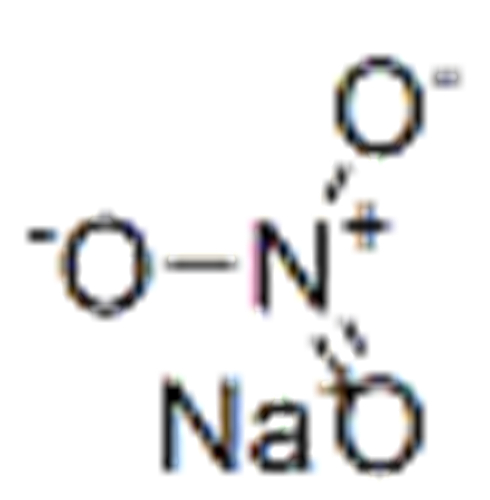
Если мы посмотрим на ионное соединение, состоящее из ионов лития и ионов брома, мы увидим, что ион лития имеет заряд 1+, а ион брома имеет заряд 1–. Только один ион каждого необходим, чтобы уравновесить эти заряды. Формула бромида лития: \(\ce{LiBr}\).
Когда ионное соединение образуется из магния и кислорода, ион магния имеет заряд 2+, а атом кислорода имеет заряд 2−. Хотя оба этих иона имеют более высокие заряды, чем ионы в бромиде лития, они все же уравновешивают друг друга в соотношении один к одному. Следовательно, правильная формула для этого ионного соединения: \(\ce{MgO}\). 9{−}} \номер \]
Теперь положительные и отрицательные заряды уравновешены. Мы могли бы записать химическую формулу этого ионного соединения как \(\ce{MgClCl}\), но принято использовать числовой индекс, когда имеется более одного иона данного типа — \(\ce{MgCl2}\ ). Эта химическая формула говорит, что в этой формуле есть один ион магния и два иона хлорида. (Не читайте часть формулы «Cl 2 » как молекулу двухатомного элементарного хлора. В этом соединении хлор не существует как двухатомный элемент. Скорее, он существует в виде двух отдельных ионов хлорида.) По соглашению, 9{2+}}\).
В этом соединении хлор не существует как двухатомный элемент. Скорее, он существует в виде двух отдельных ионов хлорида.) По соглашению, 9{2+}}\).
Для соединений, в которых соотношение ионов не столь очевидно, нижние индексы в формуле могут быть получены путем пересечения зарядов : используйте абсолютное значение заряда одного иона в качестве нижнего индекса для другого иона. Этот метод схематично показан на рис. 3.3.2.
На изображении показаны M с зарядом n+ и X с зарядом m-. Плата за M становится нижним индексом X, а заряд X становится нижним индексом M, что делает конечный продукт M индексом m X индексом n. На изображении предлагается написать формулу соединения, образованного алюминием и кислородом. Он показывает Al с зарядом 3+ и O с зарядом 2-. При скрещивании зарядов конечным результатом будет Al нижний индекс 2 O нижний индекс 3. Рисунок \(\PageIndex{2}\): Плата за проезд. Один из методов получения нижних индексов в эмпирической формуле — скрещивание зарядов.
При пересечении зарядов иногда необходимо сократить индексы до их простейшего отношения, чтобы записать эмпирическую формулу. Рассмотрим, например, соединение, образованное Pb 4 + и O 2− . Использование абсолютных значений зарядов ионов в качестве индексов дает формулу Pb 2 O 4 . Это упрощает его правильную эмпирическую формулу PbO 2 . Эмпирическая формула имеет один ион Pb 4 + и два O 2– ионов.
Пример \(\PageIndex{1}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион натрия и ион серы
- ион алюминия и ион фтора
- ион железа 3+ и ион кислорода
Решение
- Для получения октета валентной оболочки натрий образует ион с зарядом 1+, а ион серы имеет заряд 2−. Два иона натрия 1+ необходимы для уравновешивания заряда 2- иона серы.
 Вместо того, чтобы писать формулу как \(\ce{NaNaS}\), мы условно сокращаем ее до \(\ce{Na2S}\).
Вместо того, чтобы писать формулу как \(\ce{NaNaS}\), мы условно сокращаем ее до \(\ce{Na2S}\). - Ион алюминия имеет заряд 3+, а ион фтора, образованный фтором, имеет заряд 1–. Три иона фтора 1- необходимы, чтобы уравновесить заряд 3+ на ионе алюминия. Эта комбинация записывается как \(\ce{AlF3}\).
- Железо может образовывать два возможных иона, но здесь указан ион с зарядом 3+. Атом кислорода имеет заряд 2- как ион. Чтобы сбалансировать положительные и отрицательные заряды, мы обращаемся к наименьшему общему кратному — 6: два иона железа 3+ дадут 6+, а три иона кислорода 2- дадут 6-, тем самым уравновешивая общие положительные и отрицательные заряды. Таким образом, формула этого ионного соединения: \(\ce{Fe2O3}\). В качестве альтернативы используйте метод перекрестных сборов, показанный на рис. 3.3.2.
Упражнение \(\PageIndex{1}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион кальция и ион кислорода
- ион меди 2+ и ион серы
- ион меди 1+ и ион серы
- Ответ a:
СаО
- Ответ б:
CuS
- Ответ c:
Медь 2 С
Многоатомные ионы
Некоторые ионы состоят из групп атомов ковалентно связанных вместе и имеют общий электрический заряд . Поскольку эти ионы содержат более одного атома, их называют многоатомными ионами. Структуры Льюиса, названия и формулы некоторых многоатомных ионов приведены в таблице 3.3.1.
Поскольку эти ионы содержат более одного атома, их называют многоатомными ионами. Структуры Льюиса, названия и формулы некоторых многоатомных ионов приведены в таблице 3.3.1.
| Ион Имя | Ионная формула |
|---|---|
| ион аммония | NH 4 +1 |
| гидроксид-ион | ОХ −1 |
| цианид-ион | CN −1 |
| карбонат-ион | СО 3 −2 |
| бикарбонат или гидрокарбонат | ОХС 3 − |
| ацетат-ион | С 2 Н 3 O 2 −1 или CH 3 CO 2 −1 |
| нитрат-ион | НЕТ 3 −1 |
| нитрит-ион | НЕТ 2 −1 |
| сульфат-ион | СО 4 −2 |
| сульфит-ион | СО 3 −2 |
| ион фосфата | ЗП 4 −3 |
| фосфит-ион | ЗП 3 −3 |
Обратите внимание, что только один многоатомный ион в этой таблице, ион аммония (NH 4 +1) , является катионом. Этот многоатомный ион содержит один атом азота и четыре атома водорода, которые вместе несут заряд +1. Все остальные многоатомные ионы заряжены отрицательно и поэтому классифицируются как анионы. Однако только два из них, ион гидроксида и ион цианида, названы с использованием суффикса «-ид», который обычно указывает на отрицательно заряженные частицы. Остальные многоатомные анионы, которые все содержат кислород в сочетании с другим неметаллом, существуют как часть ряда, в котором количество атомов кислорода в многоатомной единице может варьироваться. Как неоднократно подчеркивалось в нескольких разделах этого текста, никакие две химические формулы не должны иметь общего химического названия. Одного суффикса «-ид» недостаточно для различения названий анионов в родственном многоатомном ряду. Поэтому используются суффиксы «-ate» и «-ite», чтобы обозначить, что соответствующие многоатомные ионы являются частью ряда. Кроме того, эти суффиксы также указывают относительное количество атомов кислорода, содержащихся в многоатомных ионах.
Этот многоатомный ион содержит один атом азота и четыре атома водорода, которые вместе несут заряд +1. Все остальные многоатомные ионы заряжены отрицательно и поэтому классифицируются как анионы. Однако только два из них, ион гидроксида и ион цианида, названы с использованием суффикса «-ид», который обычно указывает на отрицательно заряженные частицы. Остальные многоатомные анионы, которые все содержат кислород в сочетании с другим неметаллом, существуют как часть ряда, в котором количество атомов кислорода в многоатомной единице может варьироваться. Как неоднократно подчеркивалось в нескольких разделах этого текста, никакие две химические формулы не должны иметь общего химического названия. Одного суффикса «-ид» недостаточно для различения названий анионов в родственном многоатомном ряду. Поэтому используются суффиксы «-ate» и «-ite», чтобы обозначить, что соответствующие многоатомные ионы являются частью ряда. Кроме того, эти суффиксы также указывают относительное количество атомов кислорода, содержащихся в многоатомных ионах. Обратите внимание, что все многоатомные ионы, названия которых оканчиваются на «-ate», содержат на один кислород больше, чем те многоатомные анионы, названия которых заканчиваются на «-ite». К сожалению, как и в обычной системе обозначения переходных металлов, эти суффиксы обозначают только относительное число атомов кислорода, содержащихся в многоатомных ионах. Например, нитрат-ион, который обозначается как NO 3 -1 , содержит на один кислород больше, чем нитрит-ион, который обозначается как NO 2 -1 . Однако ион сульфата обозначается как SO 4 -2 . Хотя и нитрат-ион, и сульфат-ион имеют суффикс «-ate», первый содержит три атома кислорода, а второй — четыре. Кроме того, и нитрат-ион, и сульфит-ион содержат три атома кислорода, но эти многоатомные ионы не имеют общего суффикса. К сожалению, относительный характер этих суффиксов требует, чтобы комбинации формул ионов и названий ионов многоатомных ионов просто запоминались.
Обратите внимание, что все многоатомные ионы, названия которых оканчиваются на «-ate», содержат на один кислород больше, чем те многоатомные анионы, названия которых заканчиваются на «-ite». К сожалению, как и в обычной системе обозначения переходных металлов, эти суффиксы обозначают только относительное число атомов кислорода, содержащихся в многоатомных ионах. Например, нитрат-ион, который обозначается как NO 3 -1 , содержит на один кислород больше, чем нитрит-ион, который обозначается как NO 2 -1 . Однако ион сульфата обозначается как SO 4 -2 . Хотя и нитрат-ион, и сульфат-ион имеют суффикс «-ate», первый содержит три атома кислорода, а второй — четыре. Кроме того, и нитрат-ион, и сульфит-ион содержат три атома кислорода, но эти многоатомные ионы не имеют общего суффикса. К сожалению, относительный характер этих суффиксов требует, чтобы комбинации формул ионов и названий ионов многоатомных ионов просто запоминались.
Правило построения формул для ионных соединений, содержащих многоатомные ионы, такое же, как и для формул, содержащих одноатомные (одноатомные) ионы: положительный и отрицательный заряды должны уравновешиваться. Если для уравновешивания заряда требуется более одного конкретного многоатомного иона, вся формула для многоатомного иона должна быть заключена в круглые скобки, а числовой индекс помещается вне круглых скобок. Это должно показать, что нижний индекс относится ко всему многоатомному иону. Два примера показаны ниже:
Изображение задает вопрос, состоящий из двух частей: напишите формулу соединения, образованного (а) барием и нитратом и (б) аммонием и фосфатом. Для (а) Ba имеет заряд 2+, а NO 3 имеет заряд -1. При скрещивании зарядов получается формула Ba(NO 3 ) 2 . Для (b) NH 4 имеет заряд +1, а PO 4 имеет заряд 3-, поэтому при пересечении зарядов получается формула (NH 4 ) 3 PO 4 .
Пример \(\PageIndex{2}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион калия и ион сульфата
- ион кальция и ион нитрата
Раствор
- Ионы калия имеют заряд 1+, тогда как ионы сульфата имеют заряд 2−. Нам понадобятся два иона калия, чтобы сбалансировать заряд сульфат-иона, поэтому правильная химическая формула будет \(\ce{K_2SO_4}\).
- Ионы кальция имеют заряд 2+, в то время как ионы нитрата имеют заряд 1-. Нам понадобится два иона нитрата, чтобы сбалансировать заряд каждого иона кальция. Формула для нитрата должна быть заключена в круглые скобки. Таким образом, мы пишем \(\ce{Ca(NO3)2}\) как формулу этого ионного соединения.
Упражнение \(\PageIndex{2}\)
Напишите химическую формулу ионного соединения, состоящего из каждой пары ионов.
- ион магния и карбонат-ион
- ион алюминия и ацетат-ион
- Ответ a:
Mg 2 + и CO 3 2 — = MgCO 3
- Ответ б:
Al 3 + and C 2 H 3 O 2 — = Al(C 2 H 3 O 2 ) 3
Распознавание ионных соединений
Существует два способа распознавания ионных соединений. Во-первых, соединения между металлическими и неметаллическими элементами обычно являются ионными . Например, CaBr 2 содержит металлический элемент (кальций, металл группы 2А) и неметаллический элемент (бром, неметалл группы 7А). Следовательно, это, скорее всего, ионное соединение. (на самом деле это соответствует ионному.) Напротив, соединение NO 2 содержит два элемента, которые оба являются неметаллами (азот из группы 5А и кислород из группы 6А). Это не ионное соединение; он принадлежит к категории ковалентных соединений, обсуждаемых в другом месте. Также обратите внимание, что эта комбинация азота и кислорода не имеет определенного электрического заряда, поэтому это , а не ион нитрита.
Во-первых, соединения между металлическими и неметаллическими элементами обычно являются ионными . Например, CaBr 2 содержит металлический элемент (кальций, металл группы 2А) и неметаллический элемент (бром, неметалл группы 7А). Следовательно, это, скорее всего, ионное соединение. (на самом деле это соответствует ионному.) Напротив, соединение NO 2 содержит два элемента, которые оба являются неметаллами (азот из группы 5А и кислород из группы 6А). Это не ионное соединение; он принадлежит к категории ковалентных соединений, обсуждаемых в другом месте. Также обратите внимание, что эта комбинация азота и кислорода не имеет определенного электрического заряда, поэтому это , а не ион нитрита.
Во-вторых, если вы узнаете формулу многоатомного иона в соединении, соединение равно 9{2+}}\) ион, при этом заряд 2+ уравновешивает общий заряд 2- от двух нитрат-ионов. Таким образом, это соединение также является ионным.
Пример \(\PageIndex{3}\)
Идентифицируйте каждое соединение как ионное или неионное.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{Nh5Cl}\)
- \(\ce{OF2}\)
Раствор
- Натрий — металл, а кислород — неметалл; поэтому ожидается, что \(\ce{Na2O}\) будет ионным. 9{+}}\), что указывает на то, что это соединение является ионным.
- И кислород, и фтор являются неметаллами. Следовательно, \(\ce{OF2}\) не является ионным.
Упражнение \(\PageIndex{3}\)
Определите каждое соединение как ионное или неионное.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(Nh5)3PO4}\)
- \(\ce{SOCl2}\)
- Ответ a:
неионогенный
- Ответ б:
ионный
- Ответ c:
ионный
- Ответ д:
неионогенный
Взгляд ближе: кровь и морская вода
Науке давно известно, что кровь и морская вода имеют схожий состав. Ведь в обеих жидкостях растворены ионные соединения. Сходство может быть больше, чем простое совпадение; многие ученые считают, что первые формы жизни на Земле возникли в океанах. Однако при ближайшем рассмотрении видно, что кровь и морская вода совершенно разные. А 0,9% раствора хлорида натрия приблизительно соответствует концентрации солей в крови. Напротив, морская вода в основном представляет собой 3% раствор хлорида натрия, что более чем в три раза превышает его концентрацию в крови. Вот сравнение количества ионов в крови и морской воде:
Ведь в обеих жидкостях растворены ионные соединения. Сходство может быть больше, чем простое совпадение; многие ученые считают, что первые формы жизни на Земле возникли в океанах. Однако при ближайшем рассмотрении видно, что кровь и морская вода совершенно разные. А 0,9% раствора хлорида натрия приблизительно соответствует концентрации солей в крови. Напротив, морская вода в основном представляет собой 3% раствор хлорида натрия, что более чем в три раза превышает его концентрацию в крови. Вот сравнение количества ионов в крови и морской воде:

 Проглатывание может оказать воздействие на кровь. Может привести к образованию метгемоглобина. Эффект от воздействия может проявляться с задержкой. Необходимо медицинское обследование.
Проглатывание может оказать воздействие на кровь. Может привести к образованию метгемоглобина. Эффект от воздействия может проявляться с задержкой. Необходимо медицинское обследование.
 Вместо того, чтобы писать формулу как \(\ce{NaNaS}\), мы условно сокращаем ее до \(\ce{Na2S}\).
Вместо того, чтобы писать формулу как \(\ce{NaNaS}\), мы условно сокращаем ее до \(\ce{Na2S}\).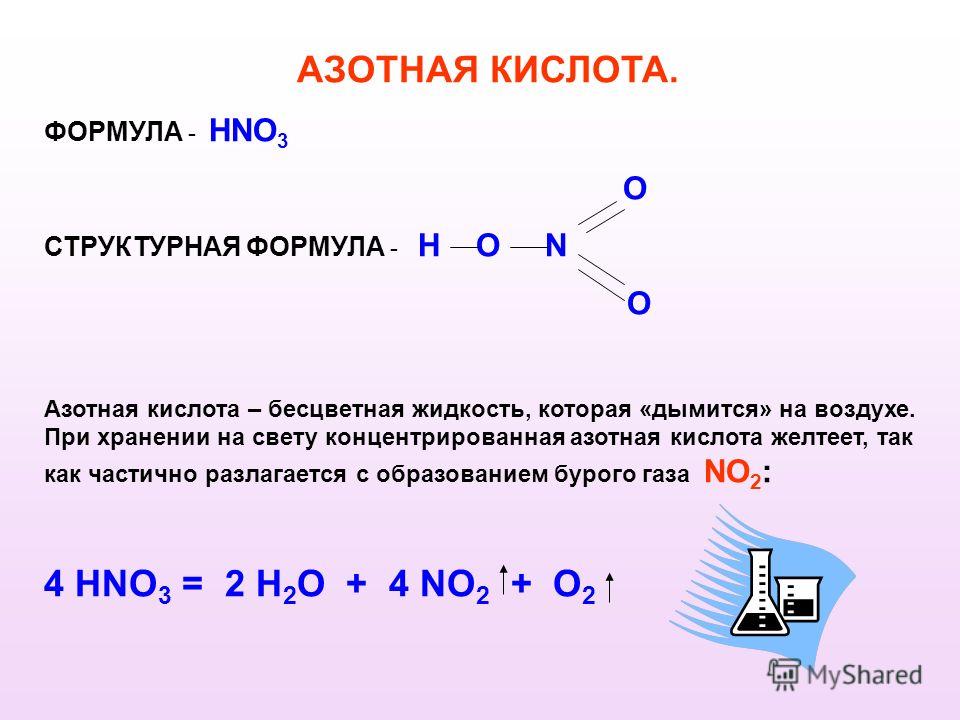
 Напишите химическую формулу ионного соединения, образованного каждой парой ионов.
Напишите химическую формулу ионного соединения, образованного каждой парой ионов. Напишите химическую формулу ионного соединения, образованного каждой парой ионов.
Напишите химическую формулу ионного соединения, образованного каждой парой ионов. Для каждой пары элементов определите заряд их ионов и напишите правильную формулу образовавшегося ионного соединения между ними.
Для каждой пары элементов определите заряд их ионов и напишите правильную формулу образовавшегося ионного соединения между ними. Соотношение каждого вида ионов в соединении
Соотношение каждого вида ионов в соединении



 К ним относятся соли щелочных металлов и щелочноземельных металлов.
К ним относятся соли щелочных металлов и щелочноземельных металлов. Почти все неорганические азотнокислые соли растворимы в воде при стандартных температуре и давлении. Типичным примером неорганической нитратной соли является нитрат калия (селитра). Нитратные соединения имеют широкий спектр применения, который зависит от их активности в качестве окислителей, наличия свободно доступного азота или их высокой растворимости. Нитрат калия и нитрат натрия широко используются в качестве сильных окислителей, особенно во взрывчатых веществах, где быстрое разложение нитрата на составляющие элементы высвобождает большие объемы реактивного кислорода. Нитраты широко используются в очень больших количествах в качестве удобрений в сельском хозяйстве из-за их способности разлагаться и высвобождать азот для роста растений, а также из-за их хорошей растворимости, обеспечивающей поглощение ионов нитратов корневыми волосками растений. Нитратные соединения широко используются в качестве промышленного сырья, где требуется окислитель или источник нитрат-иона.
Почти все неорганические азотнокислые соли растворимы в воде при стандартных температуре и давлении. Типичным примером неорганической нитратной соли является нитрат калия (селитра). Нитратные соединения имеют широкий спектр применения, который зависит от их активности в качестве окислителей, наличия свободно доступного азота или их высокой растворимости. Нитрат калия и нитрат натрия широко используются в качестве сильных окислителей, особенно во взрывчатых веществах, где быстрое разложение нитрата на составляющие элементы высвобождает большие объемы реактивного кислорода. Нитраты широко используются в очень больших количествах в качестве удобрений в сельском хозяйстве из-за их способности разлагаться и высвобождать азот для роста растений, а также из-за их хорошей растворимости, обеспечивающей поглощение ионов нитратов корневыми волосками растений. Нитратные соединения широко используются в качестве промышленного сырья, где требуется окислитель или источник нитрат-иона.