Реакции ионного обмена. Часть 1
Чтобы поделиться, нажимайте
Реакции ионного обмена. Часть 1
Предлагаем вам сборку заданий по теме Реакции ионного обмена. Ответы вы найдёте внизу страницы.
Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций. Дан следующий перечень веществ:
- Перманганат калия, аммиак, сульфат калия, сульфат железа(III), фосфат кальция. Допустимо использование водных растворов этих веществ.
- Фосфид кальция, перманганат натрия, оксид азота(IV), гидроксид меди(II), хлороводород. Допустимо использование водных растворов этих веществ.
- Нитрат кальция, гидрокарбонат натрия, медь, алюминий, серная кислота (конц.). Допустимо использование водных растворов этих веществ.
- Серная кислота, иодид калия, оксид марганца(IV), нитрат магния, гидроксид алюминия.
 Допустимо использование водных растворов этих веществ.
Допустимо использование водных растворов этих веществ. - Перманганат калия, нитрит калия, гидроксид калия, оксид меди(II), сульфат аммония. Допустимо использование водных растворов этих веществ.
- Перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
- Нитрат железа(II), концентрированная азотная кислота, оксид кремния(IV), углекислый газ, гидроксид алюминия. Допустимо использование водных растворов веществ.
- Cернистый газ, перманганат натрия, гидроксид натрия, углекислый газ, ортофосфорная кислота. Допустимо использование водных растворов этих веществ.
- Иодид калия, оксид кремния, гидроксид калия, углекислый газ, серная кислота. Допустимо использование водных растворов этих веществ.
- Иодид калия, сульфат натрия, гидроксид железа(II), иодоводородная кислота, гидроксид железа(III). Допустимо использование водных растворов этих веществ.

- Хлорид бария, сульфит натрия, фосфат кальция, сульфат бария, хлорид железа(III). Допустимо использование водных растворов этих веществ.
- Гипохлорит калия, сульфат калия, гидрофосфат калия, гидроксид калия, гидроксид хрома(III). Допустимо использование водных растворов этих веществ.
- Бром, сульфат калия, сульфит калия, нитрат натрия, соляная кислота. Допустимо использование водных растворов этих веществ.
- Иодид калия, нитрат бария, сульфат бария, карбонат натрия, пероксид водорода. Допустимо использование водных растворов этих веществ.
- Оксид меди(I), разбавленный раствор серной кислоты, перманганат калия, фторид натрия, азот. Допустимо использование водных растворов этих веществ.
- Сульфид меди(II), концентрированная азотная кислота, гидроксид алюминия, нитрат меди(II), сульфат хрома(III). Допустимо использование водных растворов этих веществ.
- Дихромат натрия, серная кислота, иодид натрия, силикат калия, нитрат магния.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. - Хлорат калия, серная кислота, аммиак, сульфат железа (II), хлорид калия. Допустимо использование водных растворов веществ.
- Перманганат калия, соляная кислота, аммиак, хлорид железа (II), сульфит бария. Допустимо использование водных растворов этих веществ.
- Оксид марганца (IV), серная кислота, сульфид меди (II), хлорид калия, гидрокарбонат калия. Допустимо использование водных растворов этих веществ.
- Азотная кислота (разбавленная), гидроксид железа (II), нитрат меди (II), карбонат кальция, хлорид лития. Допустимо использование водных растворов этих веществ.
- Дихромат калия, цинк, серная кислота (разбавленная), хлорид бария, ацетат аммония. Допустимо использование водных растворов этих веществ.
- Пероксид водорода, нитрат серебра, гидроксид натрия, оксид хрома (III), фторид аммония. Допустимо использование водных растворов этих веществ.

- Cерная кислота, сульфит натрия, дихромат натрия, оксид меди (II), нитрат калия. Допустимо использование водных растворов этих веществ.
- Марганцевая кислота, фторид натрия, сернистый газ, нитрат бария, пероксид водорода. Допустимо использование водных растворов этих веществ.
- Силикат натрия, серная кислота, углекислый газ, иодид калия, оксид марганца (IV). Допустимо использование водных растворов этих веществ.
- Нитрат натрия, медь, оксид фосфора (V), серная кислота (концентрированная), ацетат калия. Допустимо использование водных растворов этих веществ.
- Плавиковая кислота, хлорит калия, фосфин, гидроксид калия, нитрат серебра. Допустимо использование водных растворов этих веществ.
- Хлорид железа (II), хромит калия, аммиак, серная кислота (концентрированная), угарный газ. Допустимо использование водных растворов этих веществ.
- Гидроксид калия, хлорат калия, дигидрофосфат аммония, сульфат бария, фосфин.
 Допустимо использование водных растворов этих веществ.
Допустимо использование водных растворов этих веществ.
Возможные варианты ответа:
- Fe2(SO4)3 + 6NH3∙H2O = 2Fe(OH)3 + 3(NH4)2SO4
2Fe3+ + 3SO42ˉ + 6NH3∙H2O = 2Fe(OH)3 + 6NH4 + + 3SO42ˉ
Fe3+ + 3NH3∙H2O = Fe(OH)3 + 3NH4+
- Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl— = Cu2+ + 2Cl— + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
- 2NaHCO3 + H2SO4 = Na2SO4 + 2CO2 + 2H2O
2Na+ + 2HCO3— + 2H+ + SO42- = 2Na+ + SO42- + 2CO2 + 2H2O
HCO3ˉ + H+ = CO2 + H2O
- 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H
2Al(OH)3 + 6H+ + 3SO42ˉ = 2Al3+ + 3SO42- + 6H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
- 2KOH + (NH4)2SO4 = K2SO4 + 2NH3 + 2H2O
2K+ + 2OHˉ + 2NH4+ + SO42ˉ = 2K+ + SO42ˉ + 2NH3 + 2H2O
OHˉ + NH4+ = NH3 + H2O
- KHCO3 + KOH = K2CO3 + H2O
2K+ + HCO3— +OH— = 2K+ + CO32- + H2O
HCO3— +OH— = CO32- + H2O
- Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
Al(OH)3 + 3H+ + 3NO3ˉ = Al3+ + 3NO3ˉ + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
- H3PO4+ 3NaOH = Na3PO4 + 3H2O
H3PO4 + 3Na+ + 3OHˉ = 3Na+ + PO43ˉ + 3H2O
H3PO4 + 3OHˉ = PO43ˉ + 3H2O
- 2KOH + H2SO4= K2SO4 + 2H2O
2K+ + 2OHˉ + 2H+ + SO42ˉ = 2K+ + SO42ˉ + 2H2O
OHˉ + H+ = H2O
- Fe(OH)2+ 2HI = FeI2 + 2H2O
Fe(OH)2 + 2H+ + 2Iˉ = Fe2+ + 2Iˉ + 2H2O
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
- BaCl2+ Na2SO3 = BaSO3 + 2NaCl
Ba2+ + 2Clˉ + 2Na+ + SO32ˉ = BaSO3 + 2Na+ + 2Clˉ
Ba2+ + SO32ˉ = BaSO3
- K2HPO4+ KOH = K3PO4 + H2O
3K+ + HPO42ˉ + OHˉ = 3K+ + PO43ˉ + H2O
HPO42ˉ + OHˉ = PO43ˉ + H 2O
- K2SO3+ 2HCl = 2KCl + SO2 + H2O
2K+ + SO32ˉ + 2H+ + 2Clˉ = 2K+ + 2Clˉ + SO2 + H2O
SO32ˉ + 2H+ = SO2 + H2O
- Ba(NO3)2+ Na2CO3 = BaCO3 + 2NaNO3
Ba2+ + 2NO3ˉ + 2Na+ + CO32ˉ = BaCO3 + 2Na+ + 2NO3ˉ
Ba2+ + CO32ˉ = BaCO3
- 2NaF + H2SO4= Na2SO4 + 2HF
2Na+ + 2Fˉ + 2H+ + SO42ˉ = 2Na+ + SO4
Fˉ + H+ = HF
- Al(OH)3+ 3HNO3 = Al(NO3)3 + 3H2O
Al(OH)3 + 3H+ + 3NO3ˉ = Al3+ + 3NO3ˉ + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
- H2SO4 + K2SiO3 = H2SiO3 + K2SO4
2H+ + SO42- + 2K+ + SiO32- = H2SiO3 + 2K+ + SO42-
2H+ + SiO32- = H2SiO3
- FeSO4 + 2NH3∙H2O = Fe(OH)2 + (NH4)2SO4
Fe2+ + SO42ˉ + 2NH3∙H2O = Fe(OH)2 + 2NH4+ + SO42ˉ
Fe2+ + 2NH3∙H2O = Fe(OH)2 + 2NH4+
- 2HCl + BaSO3 = SO2 + H2O + BaCl2
2H+ + 2Cl— + BaSO3 = SO2 + H2O + Ba2+ + 2Cl—
2H+ + BaSO3 = SO2 + H2O + Ba2+
- 2KHCO3 + H2SO4 = 2CO2 + 2H2O + K2SO4
2K+ + 2HCO3— + 2H+ + SO42- = 2CO2 + 2H2O + 2K+ + SO42-
HCO3— + H+ = CO2 + H2O
- 2HNO3 + CaCO3 = CO2 + H2O + Ca(NO3)2
2H+ + 2NO3— + CaCO3 = CO2 + H2O + Ca2+ + 2NO3—
2H+ + CaCO3 = CO2 + H2O + Ca2+
- H2SO4 + BaCl2 = BaSO4 + 2HCl
2H+ + SO42- + Ba2+ 2Cl— = BaSO4 + 2H+ + 2Cl—
SO42- + Ba2+ = BaSO4
- 2NaOH + 2AgNO3 = 2NaNO3 + Ag2O + H2O
2Na+ + 2OH— + 2Ag+ + 2NO3— = 2Na+ + 2NO3— + Ag2O + H2O
2OH— + 2Ag+ = Ag2O + H2O
- H2SO4 + Na2SO3 = Na2SO4 + SO2 + H2O
2H+ + SO42- + 2Na+ + SO32- = 2Na+ + SO42- + SO2 + H2O
2H+ + SO32- = SO2 + H2O
- HMnO4 + NaF = NaMnO4 + HF
H+ + MnO4— + Na+ + F— = Na+ + MnO4— + HF
H+ + F— = HF
- H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4
2H+ + SO42- + 2Na+ + SiO32- = H2SiO3 + 2Na+ + SO42-
2H+ + SiO32- = H2SiO3
- 2CH3COOK + H2SO4 = K2SO4 + 2CH3COOH
2CH3COO— + 2K+ + 2H+ + SO42- = 2K+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
- KOH + HF = KF + H2O
K+ + OH— + HF = K+ + F— + H2O
OH— + HF = F— + H2O
- FeCl2 + 2NH3 + 2H2O = 2NH4Cl + Fe(OH)2
Fe2+ + 2Cl— + 2NH3 + 2H2O = 2NH4+ + 2Cl— + Fe(OH)2
Fe2+ + 2NH3 + 2H2O = 2NH4+ + Fe(OH)2
- NH4H2PO4 + 3KOH = K3PO4 + NH3 + 3H2O
NH4+ + H2PO4— + 3K+ + 3OH— = 3K+ + PO43- + NH3 + 3H2O
NH4+ + H2PO4— + 3OH— = PO43- + NH3 + 3H2O
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
ЕГЭ 2021 по химии. Теория и примеры заданий» src=»https://www.youtube.com/embed/videoseries?list=PLEL-sAdim5FaiqQVHd8oCDZ7GBW7e2sBQ» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
сульфат калия и нитрат бария, серная кислота и хлорид бария. Химия. 8 класс. Габриелян. ГДЗ. § 38. Глава 5. Вопрос 1. – Рамблер/класс
Суть реакций: сульфат калия и нитрат бария, серная кислота и хлорид бария. Химия. 8 класс. Габриелян. ГДЗ. § 38. Глава 5. Вопрос 1. – Рамблер/класс
8 класс. Габриелян. ГДЗ. § 38. Глава 5. Вопрос 1. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Помогите,записать молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, — между сульфатом калия и нитратом бария, между серной кислотой и хлоридом бария. В чём суть обеих реакций?
В чём суть обеих реакций?
ответы
Лови ответ.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Психология
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Влияние воздуха на горение свечи. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 2. Опыт 3.
Попробуйте провести следующий опыт. Влияние воздуха на горение свечи.
Вставьте стеклянную трубку с оттянутым концом в резиновую (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Это правда, что будут сокращать иностранные языки в школах?
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
9. Определите ряд, в котором в обоих словах пропущена одна и та же буква. ЕГЭ-2017 Русский язык Цыбулько И. П. ГДЗ. Вариант 12.
9.
Определите ряд, в котором в обоих словах пропущена одна и та же буква. Выпишите
эти слова, вставив пропущенную букву. (Подробнее…)
ГДЗРусский языкЕГЭЦыбулько И.П.
Нитрат бария и сульфат натрия
••• изображение фейерверка от BHughes Фотография с сайта Fotolia.com
Обновлено 25 апреля 2017 г.
Автор Винсент Саммерс , и нерастворимая соль, сульфат бария. Сульфат бария является одним из наиболее нерастворимых известных соединений. Хотя многие реакции обратимы при соответствующих условиях, поскольку один из продуктов этой реакции нерастворим в воде, обратимость реакции теряется.
Реакция
Химическая реакция может быть записана как Ba(NO3)2 + Na2SO4 —> 2 NaNO3 + BaSO4
Это говорит о том, что одна молекула нитрата бария реагирует с одной молекулой сульфата натрия с образованием двух молекул натрия нитрата плюс одна молекула сульфата бария. Оба продукта реакции полезны в коммерческом мире. Использование полученного нитрата натрия и сульфата бария значительно отличается друг от друга.
Использование нитрата натрия
Нитраты являются сильными окислителями, а нитрат натрия используется в пиротехнике и ракетном топливе. Кроме того, он является отличным источником азота в удобрениях и играет важную роль в различных рецептурах стекла и керамики. Нитрат натрия также используется в качестве противомикробного консерванта в пищевых продуктах.
Нитрат натрия также используется в качестве противомикробного консерванта в пищевых продуктах.
Медицинское использование сульфата бария
Хотя большинство источников бария крайне токсичны для человека, сульфат – если он чистый – не таков. Это связано с его высокой степенью нерастворимости. Сульфат бария используется в качестве контрастного вещества в рентгеновской медицинской технике. Его употребляют в виде еды или «молочного коктейля».
Другие применения сульфата бария
Существует множество второстепенных применений, в большинстве из которых соединение используется из-за физических свойств его частиц. Например, его можно использовать для покрытия форм, чтобы отлитый в них металл не прилипал. Хотя нитрат бария, один из исходных материалов, часто используется в пиротехнике, сульфат бария также используется в некоторых специальных фейерверках.
Рекомендации
Используйте защитное снаряжение. Паспорта безопасности материалов следует внимательно изучить, прежде чем незнакомый человек начнет использовать какое-либо из этих веществ, поскольку соединения бария очень ядовиты, а нитраты являются сильными окислителями.
Паспорта безопасности материалов следует внимательно изучить, прежде чем незнакомый человек начнет использовать какое-либо из этих веществ, поскольку соединения бария очень ядовиты, а нитраты являются сильными окислителями.
Статьи по теме
Ссылки
- NIH Medline Plus: сульфат бария
- Бесплатная информация о пиротехнике: бесплатная информация о пиротехнике продолжил свое образование в рамках программы Citizen Scholar Program Университета Вирджинии, пройдя множество курсов по органической и квантовой химии. Он пишет технические статьи с 2010 года.
Фото кредиты
изображение дисплея фейерверка от BHughes Фотография с сайта Fotolia.com
Ионные и чистые ионные уравнения
Главная > Высшая школа > Химия AP > Примечания > Ионные и чистые ионные уравнения
- В растворе будут участвовать некоторые ионы в химической реакции (например, с образованием осадка), в то время как другие останутся в растворе без изменений.
 Эти ионы, не изменяющиеся в реакции, называются ионами наблюдателей .
Эти ионы, не изменяющиеся в реакции, называются ионами наблюдателей . - Иногда бывает полезно удалить ионы-наблюдатели из химических уравнений и просто написать уравнения с веществами, которые действительно реагируют. Они называются чистыми ионными уравнениями.
- Пример: Реакция растворов нитрата бария и сульфата натрия с образованием осадка сульфата бария:
- Для реакции: Ba(NO 3 ) 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (т) + 2NaNO 3 (водн.)
- Полное ионное уравнение этой реакции показывает растворимые ионные соединения в виде отдельных ионов:
- Это полное ионное уравнение .
 Ионы бария и сульфата реагируют с образованием осадка сульфата бария, а ионы натрия и нитрата остаются неизменными — это ионы-спектаторы.
Ионы бария и сульфата реагируют с образованием осадка сульфата бария, а ионы натрия и нитрата остаются неизменными — это ионы-спектаторы. - , если мы удалим неизменные ионы с каждой стороны уравнения:
- SO 4 2- → BaSO 4 (с)
- Это суммарное ионное уравнение , показывающее только ионы, участвующие в реакции.
- Пример 1: Что такое ионы-спектаторы в реакции AgNO 3(водн.

Ba 2+ + 2 NO 3 — + 2 Na + + SO + + SO 80-9067 80-9067 4 90 BaSO 4 (s) + 2 Na + + 2 NO 3 —
BA 2+ +
2 NO 3 —+2 NA ++ SO 4 + SO 4 + SO 4 + SO 4 + + SO 4 + 4+. → BaSO 4 (s) +2 Na ++2 NO 3 — - В растворе будут участвовать некоторые ионы в химической реакции (например, с образованием осадка), в то время как другие останутся в растворе без изменений.

 Допустимо использование водных растворов этих веществ.
Допустимо использование водных растворов этих веществ.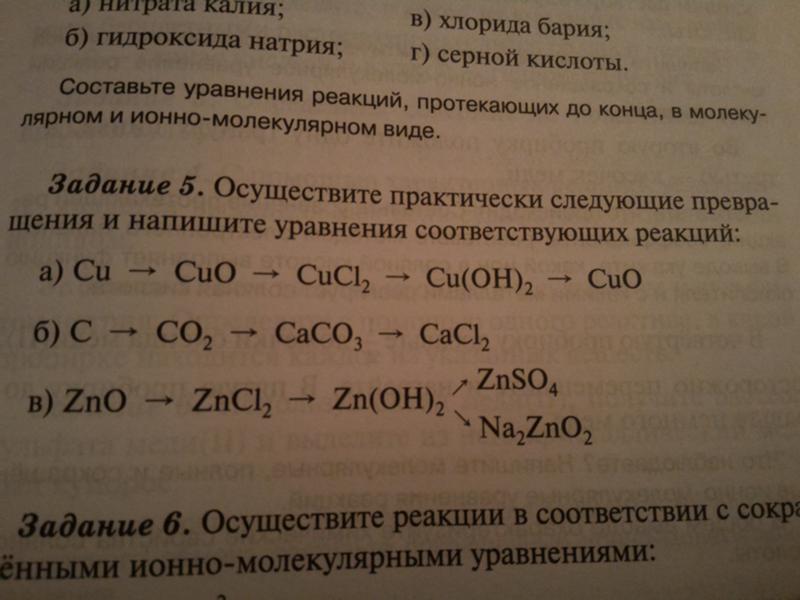
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
 Допустимо использование водных растворов этих веществ.
Допустимо использование водных растворов этих веществ. Эти ионы, не изменяющиеся в реакции, называются ионами наблюдателей .
Эти ионы, не изменяющиеся в реакции, называются ионами наблюдателей . Ионы бария и сульфата реагируют с образованием осадка сульфата бария, а ионы натрия и нитрата остаются неизменными — это ионы-спектаторы.
Ионы бария и сульфата реагируют с образованием осадка сульфата бария, а ионы натрия и нитрата остаются неизменными — это ионы-спектаторы.