Задание 30 из ЕГЭ по химии
Русский язык Математика (профильная) Обществознание Физика История Биология Химия Английский язык Информатика Литература
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
Бесплатный интенсив по химии
3 огненных вебинара, домашние задания, беседа курса, личный кабинет, связь с преподавателем и многое другое.

Курс стартует 27 марта.
Подробнее об интенсиве
За это задание вы можете получить 2 балла на ЕГЭ в 2023 годуРазбор сложных заданий в тг-канале:
Посмотреть
Задача 1
Для выполнения задания используйте следующий перечень веществ: хлорид серебра, оксид хрома(VI), серная кислота, вода, нитрат бария. Допустимо использование водных растворов веществ…
Задача 2
Для выполнения задания используйте следующий перечень веществ: сульфат железа(II), хлорат натрия, гидроксид натрия, медь, карбонат кальция. Допустимо использование водных растворов…
Задача 3
Для выполнения задания используйте следующий перечень веществ: пероксид водорода, нитрат калия, серная кислота, карбонат бария, хлорид натрия.
Задача 4
Для выполнения задания используйте следующий перечень веществ: пероксид водорода, перманганат калия, разбавленная серная кислота, гидроксид натрия, хлорид калия. Допустимо использо…
Задача 5
Для выполнения задания используйте следующий перечень веществ: пероксид водорода, бром, карбонат кальция, гидроксид натрия, хлорид меди(II). Допустимо использование водных растворо…
Задача 6
Для выполнения задания используйте следующий перечень веществ: аммиак, перманганат калия, гидроксид калия, хлорид железа(III), нитрат натрия. Допустимо использование водных раствор…
Задача 7
Для выполнения задания используйте следующий перечень веществ: сульфит калия, бихромат калия, серная кислота, хлорид калия, гидроксид меди(II). Допустимо использование водных раств…
Задача 8Для выполнения задания используйте следующий перечень веществ: сульфат железа(II), перманганат калия, серная кислота, гидроксид меди(II), гидроксид железа(III).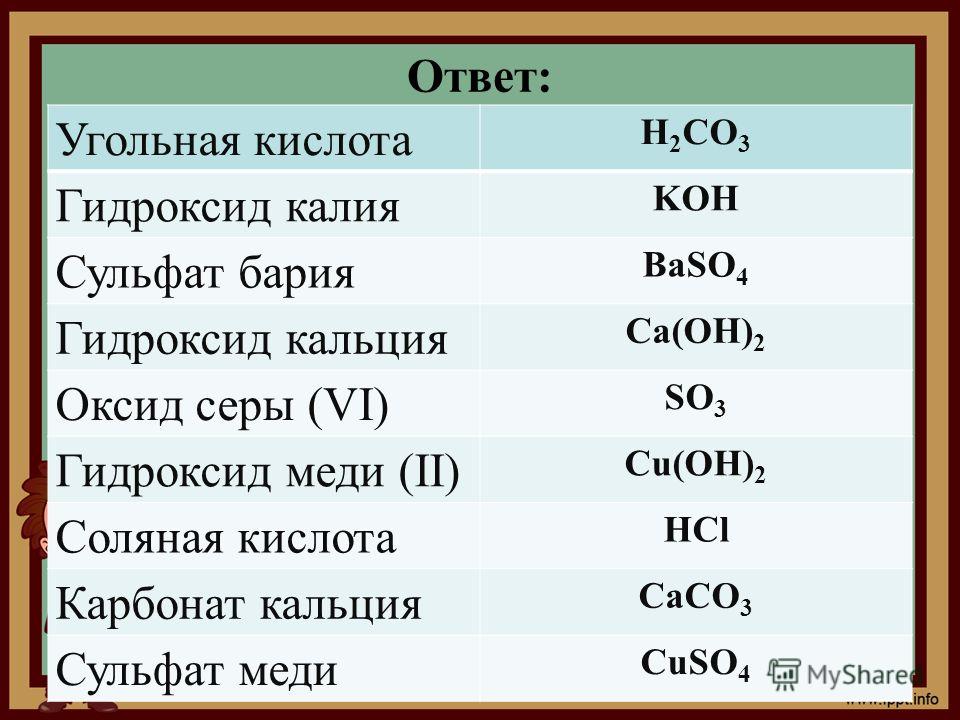 Допустимо использов…
Допустимо использов…
Задача 9
Для выполнения задания используйте следующий перечень веществ: бихромат калия, сульфид натрия, серная кислота, хлориды меди(II) и лития. Допустимо использование водных растворов ве…
Задача 10
Для выполнения задания используйте следующий перечень веществ: хлорид хрома(II), бихромат натрия, соляная кислота, карбонат магния, сульфат бария. Допустимо использование водных ра…
Задача 11
Для выполнения задания используйте следующий перечень веществ: оксид железа(III), гидроксид калия, нитрат натрия, сульфат меди(II), йодид свинца. Допустимо использование водных рас…
Задача 12
Для выполнения задания используйте следующий перечень веществ: йодид калия, йодат калия, серная кислота, гидросульфид калия, сульфат бария. Допустимо использование водных растворов…
Задача 13
Для выполнения задания используйте следующий перечень веществ: хлорид железа(II), концентрированная серная кислота, гидроксид натрия, йод, гидроксид железа(III).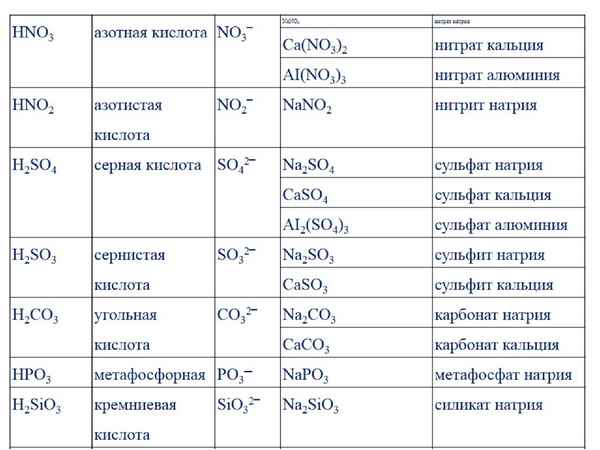 Допустимо использо…
Допустимо использо…
Задача 14
Для выполнения задания используйте следующий перечень веществ: нитрит калия, оксид хрома(VI), серная кислота, нитрат кальция, хлорид алюминия. Допустимо использование водных раство…
Задача 15
Для выполнения задания используйте следующий перечень веществ: сульфат железа(II), перманганат калия, серная кислота, хлорид меди(II), гидроксид железа(III). Допустимо использовани…
Задача 16
Для выполнения задания используйте следующий перечень веществ: аммиак, перманганат калия, гидроксид калия, хлорид железа(III), нитрат натрия. Допустимо использование водных раствор…
Задача 17
Для выполнения задания используйте следующий перечень веществ: оксид хрома(III), нитрат натрия, карбонат натрия, гидросульфат натрия, хлорид калия. Допустимо использование водных р…
Задача 18
Для выполнения задания используйте следующий перечень веществ: этанол, бихромат калия, серная кислота, хлорид калия, гидроксид меди(II). Допустимо использование водных растворов ве…
Допустимо использование водных растворов ве…
Задача 19
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, щавелевая кислота, серная кислота, нитрат бария, перманганат калия. Допустимо использование водных рас…
Задача 20
Для выполнения задания используйте следующий перечень веществ: нитрат натрия, гидроксид натрия, сульфид меди(II), оксид цинка, оксид хрома(III). Допустимо использование водных раст…
1 2 3 4
Тема для второго номера из второй части — «Реакция ионного обмена». Задание тридцать достаточно интересное для решения, к тому же оно оценивается в два балла.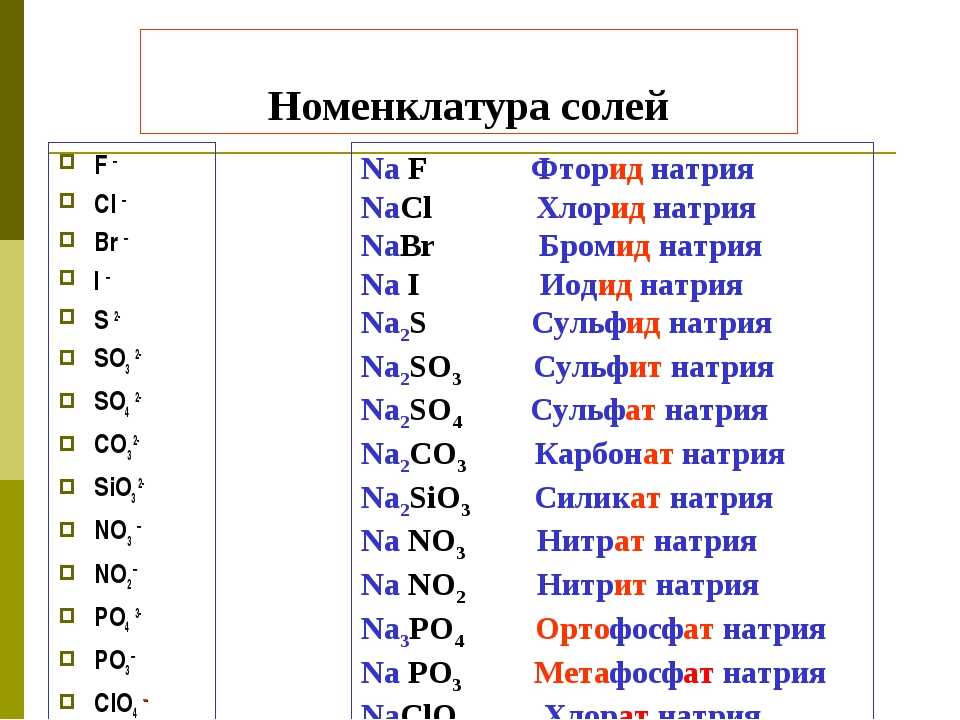 Так как требуется развернутый ответ, мы советуем изучить критерии, по которым ставится полный балл, чтобы избежать ненужных потерь. Задачка делается достаточно быстро, если у вас хватает теории и практики, поэтому во время подготовки уделяйте равномерно двум позициями внимание, чтобы на экзамене вы смогли быстро решить тридцатую.
Так как требуется развернутый ответ, мы советуем изучить критерии, по которым ставится полный балл, чтобы избежать ненужных потерь. Задачка делается достаточно быстро, если у вас хватает теории и практики, поэтому во время подготовки уделяйте равномерно двум позициями внимание, чтобы на экзамене вы смогли быстро решить тридцатую.
Формулировка везде похожая — вам будет дан список вещ-в. Потребуется найти те, между которыми может протекать реакция ионного обмена. После составители попросят вас написать как полное, так и сокращенное уравнение. Также вы должны будете написать молекулярное. Главное — правильное оформление как формульное, так и текстовое. Следуйте строго по шаблону, чтобы не потерять важные баллы по невнимательности.
Номер 30 — это легкая задача из второй части, за которую вы можете быстро получить оценку. При должной подготовке вам не составит труда быстро и правильно решить данное задание.
Теория к заданию 30 по химии: Реакция ионного обмена
<< Задание 29
Задание 31 >>
Популярные материалы
Задания – тренажёры по химии 11 класс по теме «Гидролиз»
Задания – тренажёры по химии 11 класс
по теме «Гидролиз»
1. Установите соответствие между названием соли и типом гидролиза
Установите соответствие между названием соли и типом гидролиза
1) хлорид цинка а) гидролизуется по катиону
2) сульфид калия б) гидролизуется по аниону
3) нитрат натрия в) гидролизуется и по катиону и по аниону
4) нитрат меди г) не гидролизуется
2. Установите соответствие между названием соли и средой её водного раствора
1) сульфид алюминия а) по катиону
2) сульфид натрия б) по аниону
3) нитрат магния в) по катиону и аниону
4) сульфит калия
3. Установите соответствие между формулой соли и средой её водного раствора
1) K2SO4 а) нейтральная
2) CrCl3 б) кислая
3) Li2CO3 в) щелочная
4) NH4Br
4. Установите соответствие между названием соли и средой её водного раствора
1) нитрат бария а) кислая
2) хлорид железа (III) б) нейтральная
3) сульфат аммония в) щелочная
4) ацетат калия
5. Установите соответствие между формулой соли и молекулярно-ионным уравнением гидролиза этой соли
Установите соответствие между формулой соли и молекулярно-ионным уравнением гидролиза этой соли
1) CuSO4 а) CH3COO– + H2O = CH3COOH + OH–
2) K2CO3 б) NH4+ + H2O = NH3H2O + H+
3) CH3COONa в) Сu2+ + H2O = Cu(OH)+ + H+
4) (NH4)2SO4 г) СO32– + H2O = HCO3– + OH–
д) Сu2+ + 2H2O = Cu(OH)2 + 2H+
6. Установите соответствие между названием соли и средой её водного раствора
1) ацетат калия а) кислая
2) сульфит натрия б) нейтральная
3) нитрат лития в) щелочная
4) хлорид цинка
7. Установите соответствие между названием соли и средой её водного раствора
1) формиат натрия а) кислая
2) хлорид бария б) нейтральная
3) нитрит калия в) щелочная
4) нитрат ртути(II)
8. Установите соответствие между названием соли и типом гидролиза
Установите соответствие между названием соли и типом гидролиза
1) пропионат аммония а) гидролиз по катиону
2) сульфид цезия б) гидролиз по аниону
3) сульфид алюминия в) гидролиз по катиону и аниону
4) карбонат натрия г) гидролизу не подвергается
9. Установите соответствие между названием соли и типом гидролиза
1) карбонат натрия а) гидролиз по катиону
2) хлорид аммония б) гидролиз по аниону
3) сульфат калия в) гидролиз по катиону и аниону
4) сульфид алюминия г) гидролизу не подвергается
10. Установите соответствие между формулой соли и молекулярно-ионным уравнением гидролиза этой соли
1) Na2SiO3 a) Na+ + H2O = NaOH + H+
2) Al(NO3)3 б) Al3+ + H2O = AlOH2+ + H+
3) CH3COONa в) NH4+ + H2O = NH3 + H3O+
4) NH4NO3 г) СН3СОО — + H2O = СН 3СОOH + H+
д) СН3СОО — + H2O = СН 3СОOH + OH —
е) СН3СООNa + H2O = СН 3СОOH + Na + OH —
ж) NO3— + H2O = HNO3 + OH —
з) SiO32- + H2O = HSiO3 — + OH —
11. Установите соответствие между названием соли и типом гидролиза
Установите соответствие между названием соли и типом гидролиза
1) хлорид аммония а) гидролизуется по аниону
2) сульфат калия б) гидролизуется по катиону
3) карбонат натрия в) гидролиз не происходит
4) сульфид алюминия г) необратимый гидролиз
12. Установите соответствие между формулой соли и её способностью к гидролизу
1) Сr2(S04)з а) гидролиз по катиону
2) Na 2SO4 б) гидролиз по аниону
3) ВаСl2 в) гидролиз по катиону и аниону
4) AI 2S3 г) гидролизу не подвергается
13 Установите соответствие между названием соли и отношением ее к гидролизу
1) хлорид цинка а) гидролизуется по катиону
2) сульфид калия б) гидролизуется по аниону
3) нитрат натрия в) гидролизуется по катиону и аниону
4) нитрат меди г) не гидролизуется
14. Установите соответствие между формулой соли и типом её гидролиза
1) BeSO4 а) по катиону
2) KNO2 б) по аниону
3) CuCl2 в) по катиону и по аниону
4) Pb (NO3)2 г) не гидролизуется
15. Установите соответствие между названием соли и её способностью к гидролизу
Установите соответствие между названием соли и её способностью к гидролизу
1) хлорид аммония а) гидролиз по катиону
2) сульфат калия б) гидролиз по аниону
3) карбонат натрия в) гидролиз не происходит
4) карбонат железа(III) г) необратимый гидролиз
Установите соответствие между названием соли и кислотностью среды в растворе этой соли
1) нитрит калия а) нейтральная
2) фенолят натрия б) кислая
3) хлорид аммония в) щелочная
4) сульфат калия
Установите соответствие между формулой соли и её способностью к гидролизу
1) FeCl3 а) по катиону
2) BaS б) по аниону
3) KF в) по катиону и по аниону
4) ZnSO4 г) не гидролизуется
18. Установите соответствие между формулой соли и окраской индикатора лакмуса в её водном растворе.
1) Cu (NO3)2 а) красная
2) Li2S б) синяя
3) Na2SO3 в) фиолетовая
4) CaCl2 г) не окрашен
19. Установите соответствие между названием соли и её способностью к гидролизу
Установите соответствие между названием соли и её способностью к гидролизу
1) нитрат железа(II) а) гидролиз по катиону
2) сульфат меди б) гидролиз по аниону
3) сульфид бария в) гидролиз не происходит
4) нитрат кальция г) гидролиз по катиону и аниону
20. Установите соответствие между формулой соли и окраской индикаторов в её водном растворе.
1) KF а) лакмус красный, фенолфталеин красный
2) Al2(S04)з б) лакмус красный, фенолфталеин бесцветный
3) KCl в) лакмус синий, фенолфталеин красный
4) Na 3PO4 г) лакмус синий, фенолфталеин бесцветный
д) лакмус фиолетовый, фенолфталеин красный
21. Установите соответствие между названиями веществ и продуктами их гидролиза
1) трипальмитин а) C15H31COOH и C3H5(OH)3
2) нитрид кальция б) ZnOHCl и HCl
3) хлорид цинка в)NH3 и Ca(OH)2
4) триацетат целлюлозы г) (C6H10O5)n и CH3COOH
д) Ca(NO3)2 и NH3
е) Zn(OH)2 и HCl
22. Установите соответствие между названием соли и цветом индикаторов в растворе этой соли.
Установите соответствие между названием соли и цветом индикаторов в растворе этой соли.
1) нитрат бария а) фенолфталеин красный, лакмус синий
2) хлорид железа(III) б) фенолфталеин бесцветный, лакмус красный
3) сульфат аммония в) фенолфталеин бесцветный, лакмус фиолетовый
4) ацетат калия г) фенолфталеин красный, лакмус красный
23. Установите соответствие между названием соли и средой её водного раствора
1) хлорид хрома(III) а) нейтральная
2) сульфат хрома (II) б) кислая
3) сульфид натрия в) щелочная
4) сульфат цезия
24. Установите соответствие между названием соли и её способностью к гидролизу
1) сульфат рубидия а) гидролизу не подвергается
2) сульфид аммония б) гидролизуется по катиону
3) фосфат калия в) гидролизуется по аниону
4) сульфид лития г) гидролизуется по катиону и по аниону
25. Установите соответствие между названием соли и её способностью к гидролизу
1) сульфид натрия а) гидролизу не подвергается
2) нитрат бария б) гидролизуется по катиону
3) сульфат калия в) гидролизуется по аниону
4) карбонат аммония г) гидролизуется по катиону и по аниону
26. Установите соответствие между названием соли и её способностью к гидролизу
Установите соответствие между названием соли и её способностью к гидролизу
1) стеарат аммония а) гидролизу не подвергается
2) пальмитат калия б) гидролизуется по катиону
3) перхлорат натрия в) гидролизуется по аниону
4) сульфат цезия г) гидролизуется по катиону и по аниону
27. Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое
1) сульфат натрия а) сульфид калия
2) хлорид алюминия б) сульфид аммония
3) ортофосфат цезия в) сульфат железа (II)
4) ацетат аммония г) нитрат бария
28. Установите соответствие между названиями веществ и рН их водного раствора
1) гидроксид лития, сульфид калия,
силикат натрия а) рН больше 7
2) хлорид бария, хромат калия, б) рН меньше 7
перманганат натрия в) рН равно 7
3) формиат натрия, нитрит калия, г) нет однозначного ответа
гипохлорит кальция
4) хлорид кадмия(II), сульфат хрома (III),
нитрат аммония
29. Установите соответствие между формулами веществ и рН среды, характерной для их водных растворов
Установите соответствие между формулами веществ и рН среды, характерной для их водных растворов
1) NH4Cl, FeBr3, CdSO4 а) рН больше 7
2) Na(HCOO), Cs2S, LiNO2 б) рН меньше 7
3) NaMnO4, KCLO4, K2Cr2O7 в) рН равно 7
4) (NH4)2Cr2O7, BeI2, ZnCl2 г) нет однозначного ответа
30. Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое
1) Fe2(CO3)3 а) K2S
2) NaCl б) (NH4)2SiO3
3) Cs3PO4 в) FeSO4
4) NH4NO3 д) Ba(NO3)2
Таблица правильных ответов:
1 | абга | 11 | бваг | 21 | авег |
2 | вбаб | 12 | аггв | 22 | вбба |
3 | абвб | 13 | абга | 23 | ббва |
4 | баав | 14 | абаа | 24 | агвв |
5 | вгаб | 15 | авбг | 25 | вааг |
6 | ввба | 16 | ввба | 26 | гваа |
7 | вбва | 17 | абба | 27 | гваб |
8 | вбвб | 18 | аббв | 28 | аваб |
9 | багв | 19 | аабв | 29 | бабв |
10 | збдв | 20 | вббв | 30 | бдав |
Будут ли сочетаться формы осадка растворов сульфата калия и нитрата бария?
Химические осадки Объединение
Морган М.
Будет ли сочетаться осадочная форма растворов сульфата калия и нитрата бария? Если да, напишите суммарное ионное уравнение реакции.
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Паскаль М. ответил 30.03.15
Репетитор
5,0 (84)
Высококвалифицированный преподаватель химии и всех уровней алгебры
Смотрите таких репетиторов
Посмотреть таких репетиторов
Morgan,
Чтобы ответить на такой вопрос, вам нужно иметь при себе правила растворимости… так что достаньте учебник и найдите там эту таблицу или список.
Теперь у вас есть ионное соединение + анионное соединение… это означает, что у вас будет двойная реакция замещения, в которой ионы будут менять партнеров.
сульфат калия + нитрат бария —> барий сульфат + калий нитрат
Основываясь на правилах растворимости в вашей книге, вы сможете определить, что
- все соли калия растворимы = (aq)
- все нитратные соли растворимы = (водн.)
- большинство сульфатных солей растворимы = (водн.), КРОМЕ Свинца, бария и т. д., тогда будет (s)
- нет правила относительно бария как такового… это только исключение из других правил.
На основании этого анализа состояния ваших соединений должны быть:
Сульфат калия + нитрат бария-> барий сульфат + нитрат калия
(aq) + (aq)-> (s) + (aq)
Итак, ваш осадок будет сульфатом бария, идущий из иона бария и сульфат-иона. .. и ваше суммарное ионное уравнение будет таким:
.. и ваше суммарное ионное уравнение будет таким:
ион бария (водный раствор) + ион сульфата (водный раствор) —> сульфат бария (s)
все, что вы нужно сделать сейчас это:
- напишите символы для ионов с соответствующими зарядами
- напишите правильную формулу для вашего твердого тела
- сбалансировать уравнение
Тада… готово!
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощь? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Образец 22,0 мл 1,88 М калия раствора сульфата смешивают с 14,0 мл 0,890 М раствор азотнокислого бария и этот осадок K2SO4(водн.)+Ba(NO3)2(водн.)?BaSO4(т)+2KNO3(водн.) Твердый BaSO4 собирают, сушат и обнаруживают, что он масса 2,54 г. Определить предельный реагент, теоретический выход и выход в процентах.
Вопрос
Пошаговые ответы
Образец 22,0 мл 1,88 М калия раствора сульфата смешивают с 14,0 мл 0,890 М раствор нитрата бария и этот осадок происходит реакция: K2SO4(aq)+Ba(N…
Образец 22,0 мл 1,88 М калия раствора сульфата смешивают с 14,0 мл 0,890 М раствор азотнокислого бария и этот осадок происходит реакция: K2SO4(водн.)+Ba(NO3)2(водн.)?BaSO4(т)+2KNO3(водн.) Твердый BaSO4 собирают, сушат и обнаруживают, что он масса 2,54 г. Определить предельный реагент, теоретический выход и выход в процентах.
Рекомендуемый AI ответ:
Реакция будет происходить между сульфатом калия и нитратом бария. Сульфат калия будет реагировать с нитратом бария с образованием калия
Сульфат калия будет реагировать с нитратом бария с образованием калия
Рекомендация видео с лучшим совпадением:
Решено проверенным экспертом
У нас нет заданного вами вопроса, но вот рекомендуемое видео, которое может помочь.
Вопрос о наилучшем совпадении:
Образец 22,0 мл 1,42 М калия раствора сульфата смешивают с 14,1 мл 0,870 М раствор азотнокислого бария и этот осадок происходит реакция: K2SO4(водн.)+Ba(NO3)2(водн.)→BaSO4(т)+2KNO3(водн.) Твердый BaSO4 собирают, сушат и обнаруживают, что он имеет масса 2,48 г. Определить предельный реагент, теоретический выход и выход в процентах. Определите предельный реагент. Определить теоретический выход. Определить процент выхода.
Рекомендуемые видеоролики
Стенограмма
Реакция осаждения дала 2,48 грамма, и мы хотим рассчитать пределы теоретического выхода реагента и процентного выхода. У нас есть начальные количества обоих реагентов. Мы можем рассчитать, сколько сульфата бария должен производить каждый из них, чтобы найти предельный прореагировавший и теоретический выход, если мы возьмем начальные количества. Всякий раз, когда у нас есть растворы, мне нравится начинать с концентрации раствора для моих расчетов и разбивать единицы на части, потому что молярность раствора выше лидеров. У нас есть моли на литр для обоих из них. У нас есть моли на литр. Способ, которым мы можем преобразовывать молекулы двух разных типов, например реагент в продукт, был одной из вещей, которыми интересовались кроты. Мы можем использовать приведенное сбалансированное уравнение и использовать коэффициенты в их молярных соотношениях. рацион, но для этого нам нужно получить в единицах только моли реагентов. Нам нужно избавиться от единицы объема внизу, потому что у нас есть объемы каждого из этих используемых решений, и поэтому мы можем избавиться от этой единицы объема здесь внизу. Нам нужно, чтобы это было в том же блоке, чтобы мы могли использовать одни и те же тома. Мы переведем выноски в миллиметры. Когда мы делим на объем для каждого решения, мы избавляемся от единицы объема, которая была 22,0 и 4. Как мы видим, лидеры сокращаются.
Всякий раз, когда у нас есть растворы, мне нравится начинать с концентрации раствора для моих расчетов и разбивать единицы на части, потому что молярность раствора выше лидеров. У нас есть моли на литр для обоих из них. У нас есть моли на литр. Способ, которым мы можем преобразовывать молекулы двух разных типов, например реагент в продукт, был одной из вещей, которыми интересовались кроты. Мы можем использовать приведенное сбалансированное уравнение и использовать коэффициенты в их молярных соотношениях. рацион, но для этого нам нужно получить в единицах только моли реагентов. Нам нужно избавиться от единицы объема внизу, потому что у нас есть объемы каждого из этих используемых решений, и поэтому мы можем избавиться от этой единицы объема здесь внизу. Нам нужно, чтобы это было в том же блоке, чтобы мы могли использовать одни и те же тома. Мы переведем выноски в миллиметры. Когда мы делим на объем для каждого решения, мы избавляемся от единицы объема, которая была 22,0 и 4. Как мы видим, лидеры сокращаются. Нам нужны моли продукта, но у нас есть моли нашего реагента. Мы можем видеть, что все они имеют коэффициенты 1, используя сбалансированное уравнение. Здесь будет преобразование 1 к 1. моли реагентов будут помещены в конец уравнения, чтобы сократить уравнение. Моль сульфата калия эквивалентен молю сульфата бария. Моль сульфата бария эквивалентна 1 молю нитрата бария, поэтому мы можем использовать молярную массу продукта, чтобы перевести это в граммы. Теоретический выход как для моля, так и для грамма составляет 233,38 грамма. Когда мы вставим это в наш калькулятор, мы получим цифру 7,29.граммов, которые можно использовать для получения бария. Поскольку барий естественным образом производит меньшее количество нитрата, мы можем произвести 2,86 грамма. Мы собираемся двигаться вперед с 1, потому что нитрат бария закончится первым. Это предельный реагент. Процентная доходность рассчитывается путем сопоставления фактической суммы сбора с теоретической суммой, поэтому мы хотим продолжить и рассчитать ее.
Нам нужны моли продукта, но у нас есть моли нашего реагента. Мы можем видеть, что все они имеют коэффициенты 1, используя сбалансированное уравнение. Здесь будет преобразование 1 к 1. моли реагентов будут помещены в конец уравнения, чтобы сократить уравнение. Моль сульфата калия эквивалентен молю сульфата бария. Моль сульфата бария эквивалентна 1 молю нитрата бария, поэтому мы можем использовать молярную массу продукта, чтобы перевести это в граммы. Теоретический выход как для моля, так и для грамма составляет 233,38 грамма. Когда мы вставим это в наш калькулятор, мы получим цифру 7,29.граммов, которые можно использовать для получения бария. Поскольку барий естественным образом производит меньшее количество нитрата, мы можем произвести 2,86 грамма. Мы собираемся двигаться вперед с 1, потому что нитрат бария закончится первым. Это предельный реагент. Процентная доходность рассчитывается путем сопоставления фактической суммы сбора с теоретической суммой, поэтому мы хотим продолжить и рассчитать ее.
