Китай нитрат бария 99% производителей, поставщиков и фабрики — Продукция
Категории Продуктов
Свяжитесь с нами
Главная > Продукты > Химические продукты > Нитрат бария
Yingfengyuan Industrial Group Limited является одним из ведущих китайских производителей и поставщиков нитрата бария 99%, оснащенных профессиональным заводом, мы можем предложить вам лучшие и дешевые продукты 99% нитрата бария. Технические характеристики Нитрат бария 99,3% мин. Внешний вид: белый кристалл CAS №: …
Отправить запрос
Теперь говорите
Yingfengyuan Industrial Group Limited является одним из ведущих китайских производителей и поставщиков нитрата бария 99%, оснащенных профессиональным заводом, мы можем предложить вам лучшие и дешевые продукты 99% нитрата бария.
Нитрат бария Химическое название: нитрат бария Порошок / Кристалл Другие названия: Молекулярная формула динитрата бария: Ba (NO3) 2 Молекула Вес: 261. 34 CAS NO .: 10022-31-8 EINECS №: 233-020-5 № ООН: 1446 Опасность Класс: 5.1 Внешний вид: белый сыпучий кристалл или порошок.
34 CAS NO .: 10022-31-8 EINECS №: 233-020-5 № ООН: 1446 Опасность Класс: 5.1 Внешний вид: белый сыпучий кристалл или порошок.
Детали упаковки: полиэтиленовый пакет 25 кг или большой мешок 1000 кг с поддонами. Oras согласно требованию покупателя GG.
Хранение и транспортировка: Хранить в сухом и проветриваемом помещении, хранить вдали от воды и влаги во время транспортировки, осторожно разгружать, чтобы не повредить сумки. Кроме того, его следует хранить отдельно от ядовитых веществ.
Технические характеристики:
Пункт | НИТРАТ БАРИЯ | |||
класс | Технический класс | Страна происхождения | Сделано в Китае | |
Пункт | стандарт | Результат испытаний | ||
Содержание нитрата бария | ≥ 99% | 99. | ||
(в сухом виде) | ||||
влажность | ≤ 0.05% | 0.045% | ||
Черная (Fe), | ≤ 0.003% | 0.003% | ||
Нерастворимое в воде вещество | ≤ 0.1% | 0.1% | ||
Значение рН | 5.0-8.0 | 6.5 | ||
горячая этикетка : нитрат бария 99%, Китай, производители, поставщики, фабрика, дешевые, лучшие, продукты
сопутствующие товары
-
Нитрат калия 99,4%
-
Октагидрат гидроксида бария
-
Нитрит натрия 99%
-
Нитрат бария для брикетов Древесный уголь
-
Нитрит натрия промышленный
-
Кристалл нитрита натрия
Формула Нитрата калия структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: KNO3
Химический состав Нитрата калия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| K | Калий | 39,102 | 1 | 38,7% |
| N | Азот | 14,007 | 1 | 13,9% |
| O | Кислород | 15,999 | 2 | 47,5% |
Молекулярная масса: 101,106
Нитра́т ка́лия, азотноки́слый ка́лий (ка́лиевая сели́тра, кали́йная селитра, индийская селитра и др.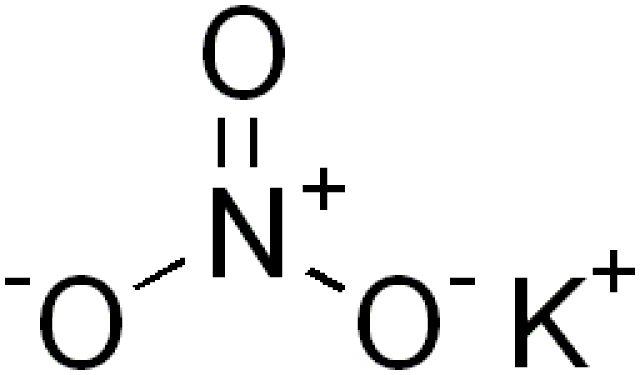 ) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой.
| Растворитель / Температура | 0 °С | 10 °С | 20 °С | 25 °С | 30 °С | 40 °С | 50 °С | 60 °С | 70 °С | 80 °С | 90 °С | 100 °С |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 | |||
| Жидкий аммиак | 10,52 | 10,4 | ||||||||||
| Гидразин | 14 | |||||||||||
| Диэтиловый эфир | ||||||||||||
| Этанол | ||||||||||||
| Метанол | ||||||||||||
| Глицерин |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная):
Zn + 2HCl → ZnCl2 + 2H0
KNO3 + 2H0 → KNO2 + H2O - Расплав нитрата калия может быть использован для получения калия электролизом, однако из-за высоких окислительных способностей нитрата калия в этом состоянии предпочтительнее гидроксид калия.

Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитря́ницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca (NO 3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу. Реакция поташа с кальциевой селитрой (нитратом кальция).
Ca(NO3)2 + K2CO3 → 2KNO3 + CaCO3
является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор.
Ca(NO3)2 + K2SO4 → KNO3 + CaSO4
Первый способ применялся до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия:
KCl + NaNO3 → KNO3 + NaCl
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
KCl + NH4NO3 → KNO3 + NH4Cl
KOH + HNO3 → KNO3 + H2O
21K + 26HNO3 → 21KNO3 + NO + N2O + N2+13H2 — тоже демонстративная реакция соответствующих кислоты и металла
K2O + 2HNO3 → 2KNO3 + H2O — демонстр.
 реакция соотв. щелочного оксида с соотв. кислотой
реакция соотв. щелочного оксида с соотв. кислотой2KOH + N2O5 → 2KNO3 + H2O
NH4NO3 + KOH → NH3 + KNO3 + H2O
K2CO3 + 2HNO3 → 2KNO3 + H2O + CO2
Природные источники и месторождения
В природе нитрат калия распространен в виде минерала нитрокалита. Крупнейшее его месторождение находится в Ост-Индии. Природный нитрат калия является результатом разложения азотистых веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом.
В очень малых количествах содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Незаменим он при изготовлении дымного пороха и некоторых других составов (например, карамельного ракетного топлива), которые почти полностью сейчас идут на производство пиротехники.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла.
Расплав часто используется в лабораториях и у любителей для получения элементарного калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет хорошо выраженного антибактериального воздействия, но его оказывает образующийся в мясных продуктах (где нитрат калия и находит наиболее широкое применение) нитрит калия.
Нитрат бария, формула, химические свойства, приготовление, применение
Нитрат бария
Нитрат бария представляет собой неорганическое соединение, представляющее собой комбинацию соли бария с азотной кислотой. Нитрат бария — бесцветное, водорастворимое и ядовитое вещество. Нитробарит — редкий минерал из группы соединений бария. Обычно он использовался в пиротехнике. Он может взорваться при правильных условиях, когда он реагирует на тепло. Это один из негорючих химических веществ. Систематическое название IUPAC известно как нитрат бария. Химическая или молекулярная формула нитрата бария: Ba(NO 3 ) 2 . Он также известен как соль бария или динитрит бария.
Нитрат бария — бесцветное, водорастворимое и ядовитое вещество. Нитробарит — редкий минерал из группы соединений бария. Обычно он использовался в пиротехнике. Он может взорваться при правильных условиях, когда он реагирует на тепло. Это один из негорючих химических веществ. Систематическое название IUPAC известно как нитрат бария. Химическая или молекулярная формула нитрата бария: Ba(NO 3 ) 2 . Он также известен как соль бария или динитрит бария.
Структурная формула
Это структурная формула нитрата бария:
Химическая формула
Химическая формула или молекулярная формула Ba(NO 3 ) 2 .
Способ получения
Нитрат бария можно получить двумя способами. В первом способе карбонат бария реагирует с азотной кислотой и осаждает примеси железа на поверхность. Затем с помощью методов фильтрации эти примеси удаляются. Затем оставшийся раствор подвергают процессу выпаривания. После завершения испарения он кристаллизуется с образованием нитрата бария. Во втором методе сульфид бария реагирует с азотной кислотой с получением нитрата бария. Но в этом методе нитрат бария разлагается и дает оксид бария, диоксид азота и кислород.
Во втором методе сульфид бария реагирует с азотной кислотой с получением нитрата бария. Но в этом методе нитрат бария разлагается и дает оксид бария, диоксид азота и кислород.
2Ba(NO 3 ) 2 → 2BaO + 4NO 2 + O 2
Физические свойства
| 4 Температура плавления | 592 С |
| Температура кипения | 83 С |
| Молекулярная масса | 261,337 г/моль |
| Плотность | 3,24 г/см 3 |
| Растворимость в воде | 0,00064 мг/л |
| Показатель преломления | 1,5659 |
| Кристаллическая структура | куб. |
| Магнитная восприимчивость | -66,5×10 -6 см 3 /моль |
| Внешний вид | Белые блестящие кристаллы |
| Запах | Без запаха |
| Растворимость | Растворим в ацетоне, этаноле |
Химические свойства
Нитрат бария представляет собой белые блестящие кристаллы, которые были получены в изобилии.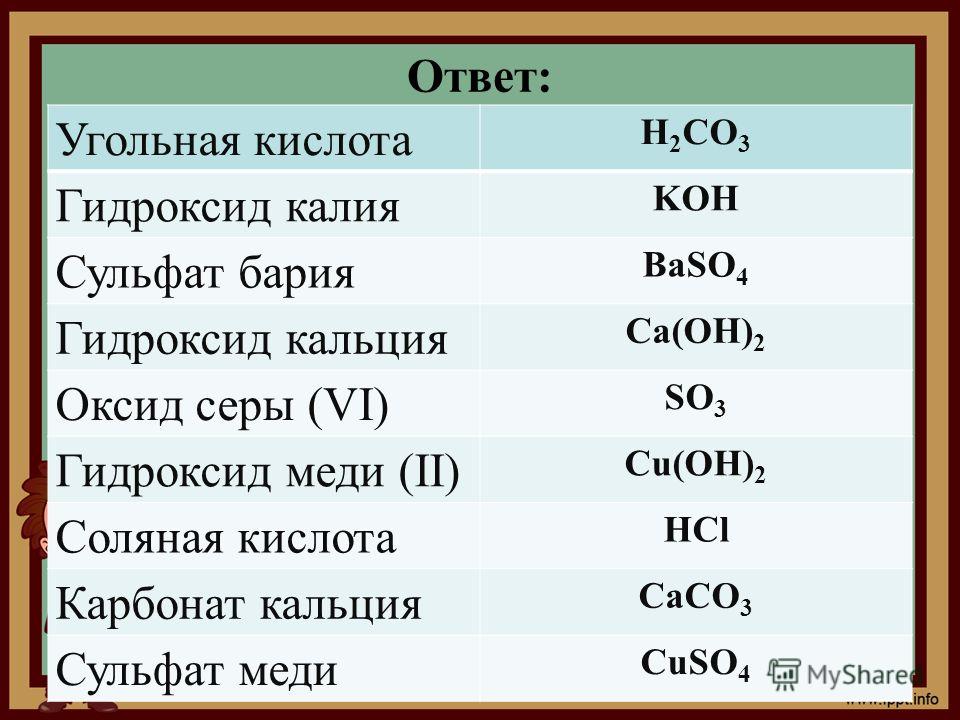 Он растворим в ацетоне и этаноле. Имеет кубическую структуру. Температура плавления выше температуры кипения. Он имеет умеренную молярную массу и низкую плотность.
Он растворим в ацетоне и этаноле. Имеет кубическую структуру. Температура плавления выше температуры кипения. Он имеет умеренную молярную массу и низкую плотность.
Применение
Нитрат бария используется в производстве оксида бария. Он также используется в производстве керамических глазурей. Это окислитель. Он широко используется для детонаторов. Он в основном используется для красок и изготовления взрывчатых веществ.
Предыдущая статьяОксид бария, формула, химические свойства, подготовка, применение
Следующая статьяЙодид бария, формула, химические свойства, подготовка, применение
Нитрат бария, 99,95% 10022-31-8 Индия
Код
: Б 1337
КАС
: 10022-31-8
Мол. Формула
: Ба(НО 3 ) 2
Мол. Масса
Масса
: 261,32
Описание
: Нитрат бария с химической формулой Ba(NO3)2 представляет собой соль, состоящую из бария и нитрат-иона.
Нитрат бария существует в виде белого твердого вещества при комнатной температуре. Растворим в воде
Приложения
: B 1337 (OTTO) Нитрат бария, 99,95% (мет.прим.) — используется в нефтяной и газовой промышленности для приготовления буровых растворов. Он используется для изготовления красок, кирпичей, плитки, стекла, резины и других соединений бария.
Недвижимость
Категории
: Неорганические химикаты, соединения бария
анализ
: 99,95%
Внешний вид (Форма)
: Порошок/кристаллический порошок
Внешний вид (Цвет)
: Белый
Температура плавления
: 592 °C (разл.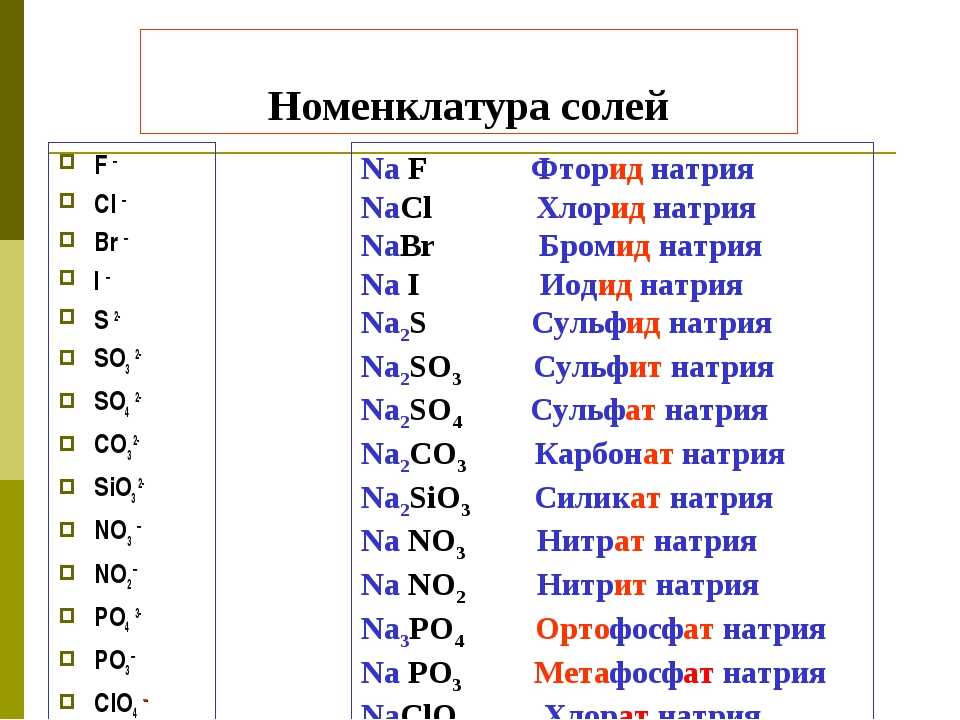 )(лит.)
)(лит.)
Растворимость
: Растворим в воде. Нерастворим в спирте.
Информация по технике безопасности
Символы опасности
Сигнальное слово Опасно
Краткая характеристика опасности h372-h402-h432
Предупреждения P220
Средства индивидуальной защиты Защитные очки, лицевые щитки, полнолицевой противоаэрозольный респиратор типа N100 (США), перчатки, респираторный картридж типа N100 (США), тип P1 (EN143 ) респиратор фильтр типа P3 (EN 143) респираторные картриджи
Коды опасности O,Xn
Заявления о рисках 8-20/22
Заявления о безопасности 28
RIDADR UN 1446 5.1/PG 2
WGK Германия 1
RTECS CQ9625000
| Уплотнения | Цена (INR) |
|---|---|
| 25 г | 3006.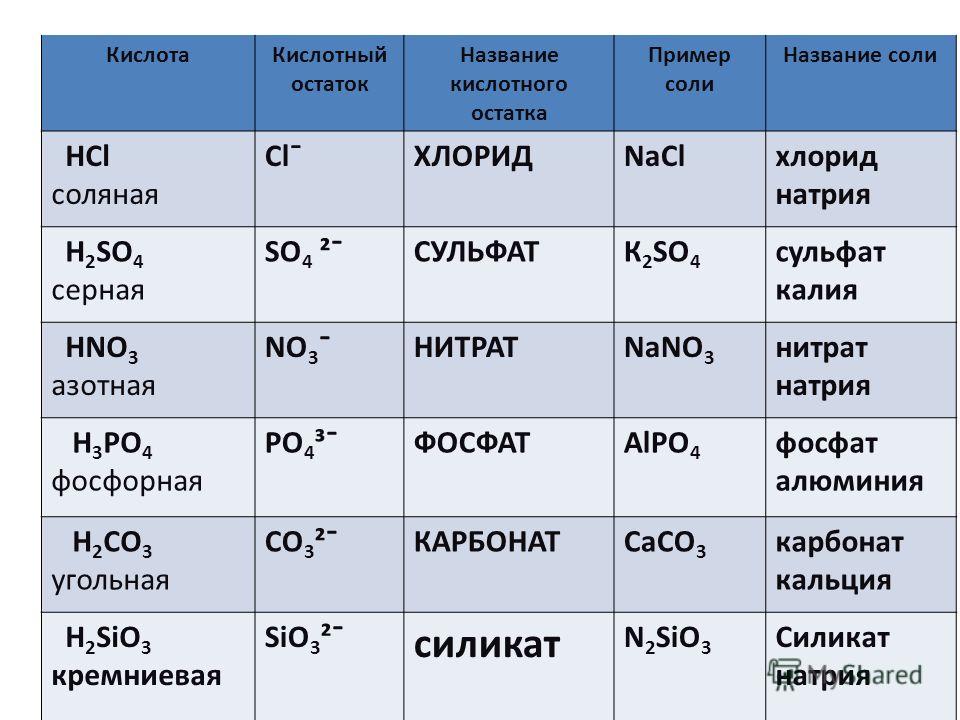 |

 05%
05%