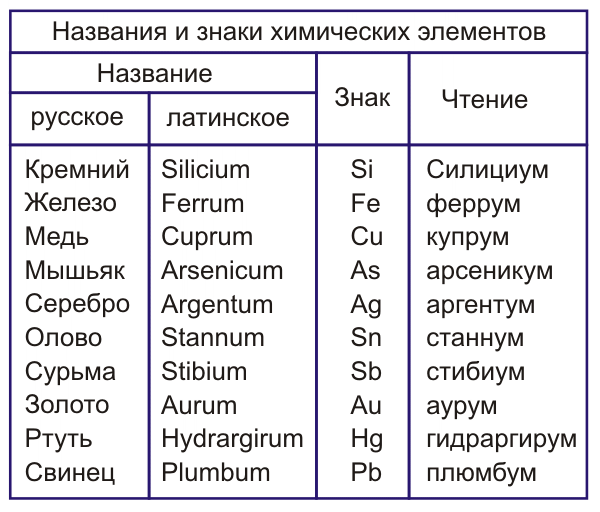
Тривиальные названия неорганических веществ. Номенклатура неорганических соединений. Тривиальные и систематические названия
В настоящее время химикам известно более 20 миллионов химических соединений. Очевидно, что запомнить названия десятков миллионов веществ не в состоянии ни один человек.
Именно поэтому Международным союзом теоретической и прикладной химии разработана систематическая номенклатура органических и неорганических соединений. Построена система правил, которая позволяет называть оксиды, кислоты, соли, комплексные соединения, органические вещества и т. д. Систематические названия имеют ясный, однозначный смысл. Например, оксид магния — это MgO, сульфат калия — CaSO4, хлорметан — CH3Cl и т. д.
Химик, открывший новое соединение, не сам выбирает ему название, а руководствуется четкими правилами ИЮПАК. Любой его коллега, работающий в любой стране мира, сможет по названию быстро построить формулу нового вещества.
Систематическая номенклатура удобна, рациональна и признана во всем мире. Существует, однако, небольшая группа соединений, для которых «правильная» номенклатура практически не применяется. Названия некоторых веществ используются химиками на протяжении десятилетий и даже столетий. Эти тривиальные названия более удобны, более привычны, и настолько прочно вошли в сознание, что практики не желают менять их на систематические. В действительности, даже правила ИЮПАК допускают использование тривиальных названий.
Ни один химик не назовет вещество CuSO4 • 5H2O пентагидратом сульфата меди (II). Гораздо проще использовать тривиальное название этой соли: медный купорос. Никто не будет спрашивать у коллеги: «Скажи, а у вас в лаборатории не осталось гексацианоферрата (III) калия?» Так ведь и язык сломать можно! Спросят иначе: «Красной кровяной соли не осталось?»
Коротко, удобно и привычно. К сожалению, тривиальные названия веществ не подчиняются никаким современным правилам. Их нужно просто запомнить. Да-да, химик должен помнить, что FeS2 — это пирит, а под привычным всем термином «мел» скрывается карбонат кальция.
Их нужно просто запомнить. Да-да, химик должен помнить, что FeS2 — это пирит, а под привычным всем термином «мел» скрывается карбонат кальция.
В приведенной ниже таблице перечислены некоторые наиболее часто встречающиеся тривиальные названия солей, оксидов, кислот, оснований и т. д. Обратите внимание: одно вещество может иметь несколько тривиальных названий. Например, хлорид натрия (NaCl) можно назвать галитом, а можно — каменной солью.
| Тривиальное название | Формула вещества | Систематическое название |
| алмаз | С | углерод |
| алюмокалиевые квасцы | KAl(SO4)2 • 12H2O | додекагидрат сульфата алюминия-калия |
| ангидрит | CaSO4 | сульфат кальция |
| барит | BaSO4 | сульфат бария |
| берлинская лазурь | Fe4[Fe(CN)6]3 | гексацианоферрат (II) железа (III) |
| бишофит | MgCl2 • 6H2O | гексагидрат хлорида магния |
| боразон | BN | нитрид бора |
| бура | Na2B4O7 • 10H2O | декагидрат тетрабората натрия |
| водяной газ | CO + H2 | водород + оксид углерода (II) |
| галенит | PbS | сульфид свинца (II) |
| галит | NaCl | хлорид натрия |
| гашеная известь | Ca(OH)2 | гидроксид кальция |
| гематит | Fe2O3 | оксид железа (III) |
| гипс | CaSO4 • 2H2O | дигидрат сульфата кальция |
| глинозем | Al2O3 | оксид алюминия |
| глауберова соль | Na2SO4 • 10H2O | декагидрат сульфата натрия |
| графит | С | углерод |
| едкий натр | NaOH | гидроксид натрия |
| едкое кали | KOH | гидроксид калия |
| железный колчедан | FeS2 | дисульфид железа |
| железный купорос | FeSO4 • 7H2O | гептагидрат сульфата железа (II) |
| желтая кровяная соль | K4[Fe(CN)6] | гексацианоферрат (II) калия |
| жидкое стекло | Na2SiO3 | силикат натрия |
| известковая вода | раствор Ca(OH)2 в воде | раствор гидроксида кальция в воде |
| известняк | CaCO3 | карбонат кальция |
| каломель | Hg2Cl2 | дихлорид диртути |
| каменная соль | NaCl | хлорид натрия |
| киноварь | HgS | сульфид ртути (II) |
| корунд | Al2O3 | оксид алюминия |
| красная кровяная соль | K3[Fe(CN)6] | гексацианоферрат (III) калия |
| красный железняк | Fe2O3 | оксид железа (III) |
| криолит | Na3[AlF6] | гексафтороалюминат натрия |
| ляпис | AgNO3 | нитрат серебра |
| магнезит | MgСO3 | карбонат магния |
| магнетит | Fe3O4 | оксид дижелеза (III) — железа (II) |
| магнитный железняк | Fe3O4 | оксид дижелеза (III) — железа (II) |
| малахит | Cu2(OH)2CO3 | карбонат гидроксомеди (II) |
| медный блеск | Cu2S | сульфид меди (I) |
| медный купорос | CuSO4 • 5H2O | пентагидрат сульфата меди (II) |
| мел | CaCO3 | карбонат кальция |
| мрамор | CaCO3 | карбонат кальция |
| нашатырный спирт | водный раствор NH3 | раствор аммиака в воде |
| нашатырь | NH4Cl | хлорид аммония |
| негашеная известь | CaO | оксид кальция |
| нитропруссид натрия | Na2[Fe(NO)(CN)5] | пенатцианонитрозилийферрат (II) натрия |
| олеум | раствор SO3 в H2SO4 | раствор оксида серы (VI) в конц.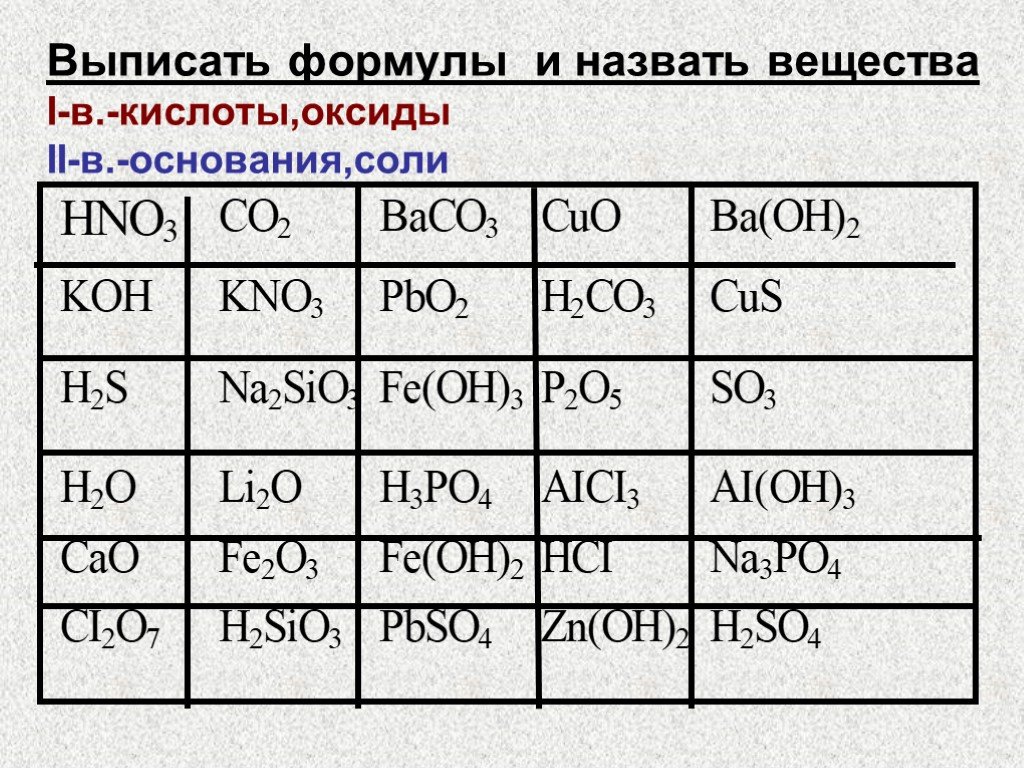 серной кислоте серной кислоте |
| перекись водорода | H2O2 | пероксид водорода |
| пирит | FeS2 | дисульфид железа |
| пиролюзит | MnO2 | диоксид марганца |
| плавиковая кислота | HF | фтороводородная кислота |
| поташ | K2СO3 | карбонат калия |
| реактив Несслера | K2[HgI4] | щелочной раствор тетраиодомеркурата (II) калия |
| родохрозит | MnCO3 | карбонат марганца (II) |
| рутил | TiO2 | диоксид титана |
| свинцовый блеск | PbS | сульфид свинца (II) |
| свинцовый сурик | Pb3O4 | оксид дисвинца (III) — свинца (II) |
| селитра аммонийная | NH4NO3 | нитрат аммония |
| селитра калийная | KNO3 | нитрат калия |
| селитра кальциевая | Ca(NO3)2 | нитрат кальция |
| селитра натронная | NaNO3 | нитрат натрия |
| селитра чилийская | NaNO3 | нитрат натрия |
| серный колчедан | FeS2 | дисульфид железа |
| сильвин | KCl | хлорид калия |
| сидерит | FeCO3 | карбонат железа (II) |
| смитсонит | ZnCO3 | карбонат цинка |
| сода кальцинированная | Na2CO3 | карбонат натрия |
| сода каустическая | NaOH | гидроксид натрия |
| сода питьевая | NaHCO3 | гидрокарбонат натрия |
| соль Мора | (NH4)2Fe(SO4)2 • 6H2O | гексагидрат сульфата аммония-железа (II) |
| сулема | HgCl2 | хлорид ртути (II) |
| сухой лед | CO2 (твердый) | диоксид углерода (твердый) |
| сфалерит | ZnS | сульфид цинка |
| угарный газ | CO | оксид углерода (II) |
| углекислый газ | CO2 | оксид углерода (IV) |
| флюорит | CaF2 | фторид кальция |
| халькозин | Cu2S | сульфид меди (I) |
| хлорная известь | смесь СаCl2, Ca(ClO)2 и Ca(OH)2 | смесь хлорида кальция, гипохлорита кальция и гидроксида кальция |
| хромомокалиевые квасцы | KCr(SO4)2 • 12H2O | додекагидрат сульфата хрома (III)-калия |
| царская водка | смесь HCl и HNO3 | смесь концентрированных растворов соляной и азотной кислот в объемном отношении 3:1 |
| цинковая обманка | ZnS | сульфид цинка |
| цинковый купорос | ZnSO4 • 7H2O | гептагидрат сульфата цинка |
Примечание: природные минералы состоят из нескольких веществ. Например, в составе свинцового блеска можно найти соединения серебра. В таблице, естественно, указывается только основное вещество.
Например, в составе свинцового блеска можно найти соединения серебра. В таблице, естественно, указывается только основное вещество.
Вещества вида Х • n H2O называют кристаллогидратами. В их состав входит т. н. «кристаллизационная» вода. Например, можно сказать, что сульфат меди (II) кристаллизуется из водных растворов с 5 молекулами воды. Получаем пентагидрат сульфата меди (II) (тривиальное название — медный купорос).
Если вас интересуют систематические названия, рекомендую обратиться к разделу «Названия неорганических кислот и солей».
Кислоты
3. КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С точки зрения теории электролитической диссоциации кислоты это электролиты, диссоциирующие в водных растворах на катионы только водорода Н+ и анионы кислотных остатков.
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO42 H+ + PO43
(третья
ступень).
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
Номенклатура кислот.
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс ист:
H2SO3 сернистая кислота,
H3AsO3 мышьяков истая кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO
хлорноватистая
кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета — мало воды,
орто — много воды.
Например:
P2O5 + H2O → 2HO3 метафосфорная кислота,
P2O5 + 3H2O → 2H3O4 ортофосфорная кислота.
1. Бескислородные кислоты.
Зная название кислоты, записываем сначала водород, а затем кислотообразующий элемент. Степень окисления водорода в кислотах всегда +1. Степень окисления элемента отрицательная. Она равна номеру группы ПСЭ (в которой находится элемент) минус восемь.
Например:
сероводородная
кислота
элемент сера,
расположен в
шестой
группе ПСЭ. 6 — 8 = -2.
Степень
окисления серы
2. Записываем
символы
водорода и
серы Н+S-2, т. к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например: метафосфорная кислота кислотообразующий элемент фосфор. Суффикс н показывает, что он имеет максимальную степень окисления, фосфор в пятой группе ПСЭ, следовательно, максимальная степень окисления +5, она сохраняется и в оксиде фосфора Р2+5О5-2. Приставка мета говорит о том, что воды в кислоте минимальное количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O →
H6P
Классификация кислот по следующим признакам:
По содержанию кислорода:
1. Кислородосодержащие 2. Бескислородные
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H 2S
По силе (по степени диссоциации)
1. Сильные (α =100 %)
2. Слабые (α < 100 %)
Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые 2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение соответствующего оксида в воде:
P2O5 + 3H2O →
2H3PO4.
3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na 2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4. Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4. Взаимодействие с солями:
а) менее летучие кислоты вытесняют более летучие из их солей:
H2SO4 + NaCI → NaHSO4 + HCI
конц. тверд.
тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл — ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
Активные | Средней активности | Малоактивные |
Li К Ca Мg Al | Ti Cr Zn Fe Ni Sn Pb | Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
Активные | Средней
актив. | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Al, Fe) | Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
S , H2S, SO2 | S , H2S, SO2 | SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Ti) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
NH3, NH4NO3 | N2 или N2O | NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Ti, Al, Cr, Fe) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт
№ 1. Взаимодействие
кислотного
оксида
Взаимодействие
кислотного
оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В
пробирку
внести 56
капель
концентрированного
раствора
силиката
натрия Na2SiO3 и постепенно
добавить 56
капель
соляной кислоты,
непрерывно
встряхивая
пробирку. Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в фарфоровую чашку 10 см3 2 моль/дм3 раствора гидроксида натрия. Добавить 12 капли фенолфталеина, чтобы окраска стала малиновой, что подтверждает наличие щелочи в растворе. Затем в пробирку по каплям добавлять раствор соляной кислоты, до обесцвечивания раствора. Выпарить содержимое чашки и убедиться, что образовалась соль. Написать уравнение реакции.
Силикат натрия CAS#: 1344-09-8
| Основная информация о силикате натрия |
| Название продукта: | Силикат натрия |
| Синонимы: | L96 (Salt); MetSo99; N38; n38 (SILICE); SILICEAIL); SILICEALAID); пирамида8;q70 |
| CAS: | 1344-09-8 |
| MF: | Na2O3Si | 91004 122. 06 06 |
| EINECS: | 215-687-4 |
| Категории продуктов: | UVCBS-inorganic; AAS; AAS CRMSALPHABETIC; AASSPECTROSCOPPECTPECTROSCOPPECTPECTROSCOPPECTPECTROSCOPPECTOCPECTY; ;Эталонные/калибровочные стандарты;Стандартные растворы;Химический синтез;Неорганические соли;Материаловедение;Наука о металлах и керамике;Соли;Натрий;Соли натрия;Синтетические реагенты |
| Мол.-8.моль | |
| Свойства натриевого силиката. | 2,33 г/мл при 25 °C (лит.) |
| темп. | -20°C |
| растворимость | H 2 O: soluble |
| form | powder |
| color | Colorless |
| Water Solubility | very slightly soluble cold h3O [MER06] |
| Merck | 13,8751 |
| Стабильность: | Стабильная. Несовместим с кислотами, большинством металлов, многими органическими материалами. Несовместим с кислотами, большинством металлов, многими органическими материалами. |
| ИНЧИКЕЙ | NTHWMYGWWRZVTN-UHFFFAOYSA-N |
| CAS DataBase Reference | 1344-09-8(CAS DataBase Reference) |
| Система регистрации веществ EPA | Силикат натрия (1344-09-8) | 1 |
| Информация о безопасности |
| Коды опасностей | F, XI, T, C |
| Риск. /37/38-35-20/21/22-37 | |
| Заявления о безопасности | 26-36/37-45-7/9-28-36/37/39-36-27 |
| RIDADR | UN 2922 8/PG 2 |
| WGK Germany | 2 |
| RTECS | VW0400000 |
| F | 34 |
| HazardClass | 8 |
| PackingGroup | II |
| HS Code | 28391910 |
| Hazardous Substances Data | 1344-09-8 (Данные по опасным веществам) |
| Токсичность | LD50 перорально у крыс: 1960 мг/кг |
| Информация о паспорте безопасности |
| Провайдер | Язык |
|---|---|
| Натриевая соль кремниевой кислоты | Английский |
| SigmaAldrich | Английский |
| АКРОС | Английский |
| АЛЬФА | Английский |
| Силикат натрия Использование и синтез |
| Описание | Силикат натрия, 2Na2OSiO2, является простейшей формой стекла. Встречается в виде комков зеленоватого стекла, растворимых в паре под давлением, белых порошков разной степени растворимости, мутных или прозрачных жидкостей. он негорючий; однако, когда порошкообразная форма взвешена в воздухе, это может вызвать взрыв пыли, если присутствует источник воспламенения. Вдыхание пыли также может вызвать проблемы со здоровьем. Стеклянная форма также может создать опасность для аварийно-спасательных служб в случае аварии. Он не указан как опасный материал в таблицах опасных материалов DOT. Основное применение — катализаторы, мыло, клеи, водоподготовка, отбеливание, гидроизоляция и антипирены. Встречается в виде комков зеленоватого стекла, растворимых в паре под давлением, белых порошков разной степени растворимости, мутных или прозрачных жидкостей. он негорючий; однако, когда порошкообразная форма взвешена в воздухе, это может вызвать взрыв пыли, если присутствует источник воспламенения. Вдыхание пыли также может вызвать проблемы со здоровьем. Стеклянная форма также может создать опасность для аварийно-спасательных служб в случае аварии. Он не указан как опасный материал в таблицах опасных материалов DOT. Основное применение — катализаторы, мыло, клеи, водоподготовка, отбеливание, гидроизоляция и антипирены. |
| Химические свойства | Силикат натрия, NA2SiO3, также известный как жидкое стекло, силикат натрия, метасиликат натрия и растворимое стекло, представляет собой серовато-белый кристаллический порошок с температурой плавления 1088 °C (1990 °F). ). Он растворим в воде и обладает сильными моющими и эмульгирующими свойствами. Силикат натрия используется для огнеупорного текстиля, изоляции электрических проводов, защиты дерева и пористого камня, жиронепроницаемой бумажной тары, а также в качестве катализатора при очистке высокооктанового бензина. Силикат натрия используется для огнеупорного текстиля, изоляции электрических проводов, защиты дерева и пористого камня, жиронепроницаемой бумажной тары, а также в качестве катализатора при очистке высокооктанового бензина. |
| Применение | Футеровка Бессемеровских преобразователей, концентраторов кислоты. производство точильных камней, абразивных кругов (только в качестве связующего). |
| Применение | Силикат натрия (Na2SiO3), более известный как жидкое стекло, является одним из немногих соединений кремния. растворяется в воде. Используется в производстве мыла, клеев и пищевых консервантов. |
| Применение | Силикат натрия — продукт, используемый в качестве консерванта для яиц. |
| Применение | Силикат натрия (Na2O) известен как «жидкое стекло» и используется при очистке воды и в
изготовление мыла, моющих средств, клеев, буровых растворов, отбеливателей. |
| Определение | ЧЭБИ: Неорганическая натриевая соль, противоионом которой является силикат. |
| Воспламеняемость и взрывоопасность | Не классифицируется |
| Промышленное использование | Силикат натрия широко используется при флотации полезных ископаемых в качестве депрессорной, диспергирующей и регулирующей присадки агент некоторых растворимых ионов Например, силикат натрия взаимодействует с кальцием ионов в растворе, образуя почти нерастворимый силикат кальция. Для промышленных и сульфатных минералы (барит), силикат натрия обычно входит в состав реагентной схемы. Силикат натрия широко используется во флотации цветных металлов. |
| Промышленное использование | Силикат натрия (жидкий силикат, метсо или гранулы силиката натрия) имеет общую формулу
Na 2 SiO 3 . Жидкие силикаты (марки «О» и «Н») представляют собой прозрачные густые жидкости, в то время как силикаты
порошок представляет собой зернистое белое вещество. Силикат натрия представляет собой смесь натрия или калия
соли. Силикаты натрия в основном используются в практике флотации полезных ископаемых. Жидкие силикаты (марки «О» и «Н») представляют собой прозрачные густые жидкости, в то время как силикаты
порошок представляет собой зернистое белое вещество. Силикат натрия представляет собой смесь натрия или калия
соли. Силикаты натрия в основном используются в практике флотации полезных ископаемых. |
| Методы очистки | Раствор силиката натрия [1344-09-8] pK 1 9,51, pK 2 11,77 (для кремниевой кислоты, h5S i O4) Очищают контактной фильтрацией с активированным углем. |
| Продукты приготовления силиката натрия и сырье |
| Сырье трибромид —> ТЯЖЕЛЫЕ ОСТАТКИ МАСЛА —> СУЛЬФАТ НАТРИЯ ДЕКАГИДРАТ —> Двуокись кремния —> 1,4-Нафтохинон —> Кварцевый песок —> Каустическая сода (жидкая) 30%-48% —> SG Кошачий песок | |
| Препараты для подготовки | Акролеин —> Кварц —> Двуокись кремния —> Синтетическое моющее средство —> Перкарбонат натрия —> Двуокись циркония —> Внутреннее и наружное покрытие для стен —> Анти-водостойкость к щелочам, анти-низкотемпературное покрытие —> Хромат свинца —> Средство для удаления краски с бумаги —> Силикагель, микропористая округлость —> ПЕНТАГИДРАТ МЕТАСИЛИКАТА НАТРИЯ —> Цеолит, L-тип —> Сульфат циркония —> Цеолит —> высокоэффективное чистящее средство FB—>МЕТАСИЛИКАТ ЛИТИЯ—>Барийоксид бора—>детергент EAF—>Метсиликат натрия—>ПЕРЛИТНЫЕ ШАРИКИ МАРКИ 5—>коагулянт TX-203—>модифицированное жидкое стекло |
1344-09-8 | CAS数据库
1344-09-8 | CAS数据库返回ChemicalBook首页>CAS数据库列表>1344-09-8
中文名称 硅酸钠
英文名称 Силикат натрия
КАС 1344-09-8
EINECS 编号 231-130-8
分子式 Na2O3Si
MDL 编号 MFCD00085311
分子量
122. 06
06
MOL 文件 1344-09-8.моль
更新日期 08.03.2023 08:28:49
1344-09-8 结构式
基本 信息
中文 同义词
硅酸钠 (液体)
硅酸钠, 玻璃
水
№
№
№
№
№
泡花碱 (液体)
水 玻璃 (液体)
粉状 泡花碱
RM (1)-粉状 硅酸钠
硅 aa 标准 溶液
硅 ICP 标准 溶液
硅 AA 标准 1000PPM в H3SO4
英文 同义词 同义词
Кремний
Кремний АА/ICP Калибровка/проверка Стандарт
Силиконовый AA Стандарт Silicon Silicon Absorption Atsorption Atmicaon Atmicaon Absorption Atmicaon Absorption Atshon Absorption Atmicaon Absorption Atmicaon Absorption AtmoN Absorption Atmic. АТОМНАЯ СПЕКТРОСКОПИЯ СТАНДАРТ
АТОМНАЯ СПЕКТРОСКОПИЯ СТАНДАРТ
Силиконовый ICP/DCP Стандарт ICP/DCP
Стандарт ICP
Силиконовый металлоорганический стандарт
Стандартный раствор Silacon Silecon Silacon Silacmon Plasma Standard Emoring
, 9043,
, 9043,
, 9043,
, Plas Emishame,
, Plas Emishame
. Стандарт кремниевого одноэлемента
Стандарт кремния
所 属 类别
无机 化工: 无机 盐: CN 硅化 及 硅酸盐
液体。 溶于水呈碱性。
溶解性 溶于 水呈 碱性。
熔点 1410 ° C (горит.)
沸点 2355 ° C (горит.)
密度 2,33 г/мл при 25 ° C (Lit.)
储存 条件 -20 ° C
溶解度 H 2 O: Растворимый
Форма порошка
. 8751
稳定性Стабильный. Несовместим с кислотами, большинством металлов, многими органическими материалами.
ИНЧИКЕЙNTHWMYGWWRZVTN-UHFFFAOYSA-N
CAS 数据库1344-09-8(CAS DataBase Reference)
EPA化学物质信息Sodium silicate (1344-09-8)
应用领域
用途一
主要用作粘结剂、洗涤剂、 肥皂 的 , 土壤 稳定剂 , 纺织 工业 助染剂 、 漂白剂 和 浆纱剂 , 浮选剂 等 等
用途 二
主要 于 清洗剂 及 合成 洗涤剂 也 也 除 油剂 、 、 、 合成 洗涤剂 也 用作 油剂 油剂 油剂填充剂 和 缓蚀剂 等
用途 三
用作 分析 、 织物防火剂 和 粘合剂 粘合剂
用途 四
主要 胶 粘剂 、 硅胶 和 白炭黑 的 的 填充料 填充料 填充料 用作 胶 胶 的 的 制皂业 以及橡胶 防水剂 等
用途 五
主要 版 纸 、 木材 、 焊条 、 铸造 、 材料 等 方面 黏合剂 , 的 的 填充料 , 以及 稳定剂 、 橡胶 防水剂 用 纸 填充料 填充料 以及 以及 稳定剂 防水剂。 纸 张漂白、矿物浮选、合成洗涤剂。是无机涂料的组分,也是硅胶、分子筛、沉淀法白炭黑等硅糀埓埈丈埈埅糕白炭黑等硅系埈埈0161
用途 六
用作 耐火 黏合剂 , 炉窑 喷补剂 , 焊条 药粉 黏 结剂 耐酸 水泥 黏 结剂 , 洗涤剂 的 油污 助剂 助剂 , 开采 和 隧道 、 加固剂 并 的 油污 , 石油 和 隧道 、 加固剂。 的适于 一般 水 的 各 种 用途。。
参考 标准 标准
参考
指标 名称
指标
模量
2,0 ± 0,1
模量
2,0 ± 0,1
.
氧化钠(Na2O)/%
25.5~29.0
溶解速度/s≤
100
表观密度/(kg/L)≥
0.55
安全数据
危险品标志F,Xi,T,C
危险类别码 R11-R36/38-R34-R23/24/25-R36/37/38-R35
安全说明 S26-S36/37-S45-S7/9-S28-S36/37/39
危险品运输编号 UN 2922 8/PG 2
WGK Germany 2
RTECS号VW0400000
F 34
危险等级8
包装类别II
海关编码28391910
毒害物质数据1344-09-8(Hazardous Substances Data)
毒性LD50 oral in rat: 1960mg/kg
制备方法
方法 一
干法 包括 纯碱法 、 硫酸钠 硫酸钠 (芒硝) 法和 碱法。。
纯碱法 将 和 硅砂 按 一定 比例 混合 , 在 1400 ~ 1500 ℃ 进行 熔融 , 熔融物 冷却形成玻璃料,趁热投入溶解槽内,再通入蒸汽加热溶解,经沉降、浓缩、制得水玻璃。其
SiO2+Na2co3 → Na2o? NsiO2+CO2 ↑
硫酸钠法 将 硫酸 钠 钠 (芒硝) 和 均匀 混合 混合 再 加入 硅砂 混合 均匀 后 快速 加入 进行 反应 反应 , 反应 后 出炉 冷却 冷却 冷却 冷却 冷却 后 出炉 生成物 出炉 生成物 出炉 后 生成物 出炉、 粉碎 、 、 沉淀 、 浓缩 , 制 得 水 玻璃。 其 其
2NA2SO4+2C+2NSIO2 → 2NA2O? NSIO2+S+SO2 ↑+2CO2 ↑
天然 将 、 ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑再 加入 起 作用 的 烧 碱渣 , 把 混合料 经 炉 顶预热 2 ~ 4h 后 炉内 炉内 反应 反应 , 经 3 ~ 5h 生成 熔融物 经出料水淬 , 把 形成 形成 的 溶解 、 、 、 、 、 、 、 、 、 、 、 溶解 、沉淀 、 浓缩 制 得水 玻璃。 其
NA2CO3+NSIO2 → NA2O? NSIO2+CO2 ↑
2NA2SO4+2C+NSIO2 → NA2O? NSIO2+SO2 ↑+2CO2 ↑+S
湿法 将 将 湿法 湿法 将 湿法 将 湿法 将 湿法 湿法 湿法 将 将 湿法 将 将加入 压热釜 中 通人 直接 蒸汽加热 , 待 反应 釜 中 压力 升至 0,7 ~ 0,8 МПа 后 , 通入接 蒸汽 , 用 夹套 蒸汽 保温 维持 此 , 反应数 小时 , 将 过滤 过滤 、 、 、 、 、 、 过滤 过滤浓缩,制得水玻璃。其
2NaO+nSiO2→Na2O?nSiO2+h3O
方法 二
干法 纯碱 与 硅 砂 按 比例 混合 , 经 熔融 、 冷却 、 、 澄清 , 浓缩 至 一定 , 通过 喷雾 干燥 , 制 得 粉状硅酸钠。
9008上下游 产品 制 得 粉状硅酸钠。。
上下游 信息 制 得 粉状硅酸钠 粉状硅酸钠。。。 浓缩 浓缩 至 浓度 , 干燥 信息 制 粉状硅酸钠 粉状硅酸钠。。 浓缩 浓缩 至 一定 浓度
上游 原料
氢氧化钠硫 酸 碳酸 钠 硫酸钠石 砂 三溴化 硼重油 十 水 合 硫 硫 二氧化硅 1,4- 萘醌 砂 液体 碱 猫 砂 砂 硫 硫 酸钠气相 二氧化硅 1,4- 萘醌 砂 液体 碱 猫 砂 砂 硫 硫 酸钠气相 二氧化硅 1,4-萘醌 硅 液体 碱 猫 砂 砂 硫 硫 硫 酸钠气相 二氧化硅 1,4-萘醌 砂 液体 碱 猫 砂 砂 砂 硫 硫 硫 硫 硫 硫 酸钠气相 二氧化硅 1,4-萘醌 砂 液体 烧 猫 砂 砂 砂 硫 硫 硫 硫 酸钠气相 二氧化硅 1,4-萘醌 砂 液体 碱 猫 砂 砂 砂 砂 砂 砂 砂 砂 英 英 英 英 英 英 英 英 英 英 英氧化硅 洗衣粉 碳酸钠 氧化锆 建筑 内外 墙 涂料 耐水 、 防碱 、 抗低 矿物 涂料 铬酸 铅 废纸 脱 墨剂 细孔 硅 胶 五 偏硅 酸钠 l 型沸石 硫酸锆沸石 煮 煮 练剂Fb 硅酸锂 偏硼 钡冼净剂 钡冼净剂 eaf 偏硅 珍珠岩聚合硅 硫酸 硫酸 铝 钾改性 水 玻璃
化学品 安全 说明书 (MSDS)
MSDS 信息 Силиновая кислота соль натрия (1344-09- 8) . msds
msds
常见 问题 列表
理化 性质 性质 性质 性质 水溶性 水溶性 硅酸盐 , 其 溶 液 俗称 水玻璃 种 矿黏合剂 矿黏合剂 其 矿黏合剂 其 其 矿黏合剂 矿黏合剂 其 其 矿黏合剂R2o · nsio2 , 中 中 r2o 为 碱 金属 氧化物 , n 为 与 碱 金属 氧化物摩尔数 的 比值 , 称为 的 摩数。 上 常用 的 水玻璃 是 硅酸钠 (na2o · nsio2 )的水溶液。
石英砂 碱 的 配合 比例 即 即 sio2 和 na2o 的 决定 着 硅 酸钠 模数 n , 模数 即 显示 酸钠 的 组成 , 是 硅酸钠 的 重要 参数 一般 在 1,5 ~ 3,5之间。 越 大 , 固体 硅酸钠越 难 溶于 水 , n 为 1 时常 即 能 溶解 , n 加大 时 需 才 能 溶解 , n 大于 3 时 4 个 大气压 以上 蒸汽 才 能 溶解 溶解 溶解 大于 3 时 需 以上 的 蒸汽 能。 硅酸钠模数 大 , 氧化硅 含量 越 多 , 硅酸钠 粘度 增大 , 分解 硬化 , 粘结力 增大 , 因此 不同 的 硅酸钠 有 着 的 用处 广泛 应用 于 普通 铸造 铸造 铸造 铸造、 精密 、 造纸 、 陶瓷 、 粘土 、 选矿 、 高岭土 、 等 众多 领域。。
分类
硅酸 分 两 种 , , 一 为 偏硅 酸钠 , 化学 式 式 , 式量 式量。 偏硅 偏硅 偏硅 偏硅。 偏硅。 偏硅 酸钠。 偏硅。 酸钠 酸钠别 名 «三氧硅酸 二 钠» , Cas 号: 6834-92-0。 一 种 为 正硅 酸钠 酸钠 (原硅 酸 钠) , 化学 式 na4sio4 , 分子 质量 184.04。
正硅 是 是 无色 相对 质量 质量 质量 质量 质量 质量 质量 质量 质量 质量 质量晶体 , 熔点 1361K (1088 ℃) , 不 多 见。 玻璃 溶液 因 水解 而 呈碱性 呈碱性 呈碱性 呈碱性 碱 稍 强 强。 是 弱酸盐 而 遇盐 酸 , 硫酸 硝酸 、 二氧化碳 都 能 析出 保存 酸 硫酸 、 、 二氧化碳 能 析出 硅 保存 保存 保存 硝酸 都 析出 硅时应 密切 防止 进入 , 并 应 使用 橡胶塞 以 防粘住 磨口 玻璃塞 工业 上 常用 纯碱 与 石英 共 熔制取 na2co3+sio2 → na2sio3+co2 ↑ , 常 因 含 亚铁盐 而 带浅 带浅 带浅 带浅 带浅 带浅 带浅 带浅 带浅 带浅 而 而 而 而 而 而 而 → → →蓝绿色。 用 无机 粘接制剂 粘接制剂 (可 与 滑石粉 等 混合 共 用) , 填充剂 , 调制 耐酸 混凝土 , 加入 颜料 后 做 外墙 的 涂料 灌入 古 基础 土壤 中 土壤 坚固 以 倒塌 , 灌入 建筑 土壤 中 土壤 坚固 防 倒塌 倒塌 倒塌 灌入。
偏硅 是 普通 泡花碱 与 烧 碱水热 反应 而 制得 的 晶体 , 商品 有 无水 、 五 和 九水 合物 , 九 水 合物 有 我 国 市场 存在 , 是 上 世纪 80年代 急 偏硅 酸钠 而 仓促 开发 的 技术 含量 较 低 的 产品 , 因 其 熔点 只 有 42 ℃ , 时 很 容易 液体 或 膏状 , 正 逐步 淘汰 , 但 一些 用户 一些 对 正 逐步 被 , 但 用户 习惯 领域结晶 水 是 很 在意 , 九 水 偏硅 酸钠 还是 有 一定。。
用途
硅酸钠 用途 非常 广泛 几乎 遍及 国民 经济 的 各 个 部门。 在 制造 硅胶 国民 国民 经济 经济 黑 白炭 黑 黑 黑、 沸石 筛 、 五 水 偏硅 酸钠 、 硅 溶胶 、 层硅 速 溶粉 状硅酸钠 、 硅酸 钾钠 等 种 硅酸盐类 产品 , 硅化合物 的 基本。 在 经济 发达 国家 以 以 以硅酸 钠 原料 的 深 加工 系列 产品 已 发展 到 50 余 , 有些 已 应用 于 高 、 精 、 尖 科技 ; 在 轻工业 是 洗衣粉 、 肥皂 等 中 不 可 缺少 的 原料 水质 、 等 等 洗涤剂 不 可 原料 也 水质 软化剂 、助沉剂 ; 纺织 工业 中 用 于 助染 、 漂白 和 浆纱 ; 机械 行业 中 广泛 用 于 铸造 、 制造 和 金属 等 ; 建筑 行业 用于 制造 快 水泥 、 耐酸 防水油 ; 建筑 中 用于 快 干 、 耐酸 防水油 防水油、 土壤 、 耐火 材料 等 ; 在 农业 方面 可 制造 硅素肥料 另外 用作 石油 催化 裂化 的 硅铝 催化剂 肥皂 的 填料 瓦楞纸 的 、 实验室 等 耐 高温 、 金属 防腐剂 水软化 的 、 坩埚 等 高温 材料 金属 防腐剂 水软化 水软化剂 、 助剂 、 耐火 材料 和 陶瓷 原料 、 纺织品 的 漂 染和 浆料 、 矿山 选矿 、 防水 、 、 木材 防火 、 防腐 以及 粘剂 等。
速 状硅酸钠 状硅酸钠
速 状硅酸钠 又 称速 溶泡 花碱 、 水合硅 酸。 该 产品 外观洁白 , 粉末状 , 均匀性。 运输 、 储存 使用 非常 方便 , 特别 均匀性。 、 储存 使用 非常 方便 特别 特别 均匀性 好适用 于 、 自动化 操作。 广泛 应用 于 冶金 、 电力 、 及 建材 工业 中。 被 用来 做为 定形 耐火 材料 中 粘结剂 工业 清洗剂 、 防腐剂 , 在 和 耐酸 、 精细 粘结剂 工业 、 防腐剂 在 和 耐酸 、 精细 精细陶瓷 工业 精密 铸造业 的 快干剂 和 增强剂 等。 速 溶粉 状 产品 还 具有 液体 泡花碱 所 具有 的 一切 和 应用。 溶粉 状硅酸钠 分子 式 na2o · msio2 · nh3o , 式量 一般 在 280 ~ 350 之间 与 通过 机械 粉碎 的 无水 粉末 状硅酸钠 相比 , 前者 有 许多 宝贵 , 如 水溶 速度 纯 净 等。 速 溶粉 属于 精细 产品 产品 , 系 系 系 系 系 系 系对 干法 (芒硝法 、 纯碱法) 泡花碱 化料 、 、 过滤 、 调模 、 干燥 等 加工 过程 制得 的。。
包装 储运
常规 方法
液体 用 小 小 小 小 小 小 小 小铁桶 或 桶 包装 , 桶 用 衬以 胶垫 的 螺丝 口 盖子。 每 桶 净 重 重 重 重 重 重 重 或 或 或 或 或。 也 可 自备 容器。 产品 用 内衬塑 料袋 的 或 编织袋 包装 , 每 固体 用 内衬塑 的 或 编织袋 包装 每 每净重80kg。 贮存于一般库房中,或用槽罐贮存。容器必须密封。不可与酸类物品共贮混运。
.


