Угольная кислота и её соли
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Угольная кислота и её соли
Угольная кислота
• Химическая формула — h3CO3
• Структурная формула – все связи ковалентные
полярные
• Кислота слабая, существует только в водном растворе,
очень непрочная, разлагается на углекислый газ и воду:
• CO2 + h3O ↔ h3CO3
• В ионных уравнениях записываем
• h3CO3 ↔ h3O + CO2
Угольная кислота
• Двухосновная, образует соли:
• -средние – карбонаты (ионы CO32-)
• — кислые – гидрокарбонаты (ионы НCO3-)
Соли угольной кислоты, их
Химическая
формула
Название
Na2CO3
Сода
кальцинирова
н-ная
Сода
питьевая
Поташ
Мел, мрамор,
известняк
Доломит
NaHCO3
K2CO3
CaCO3
MgCO3
Растворимость
Химические свойства
карбонатов и гидрокарбонатов
• 1) Качественная реакция на CO32- карбонат – ион «вскипание» при
действии сильной кислоты:
• Мел СаCO3 + 2HCl = СaCl2 + h3O + CO2↑
Питьевая сода NaНCO3 + HCl = NaCl + h3O + CO2↑
2) Вступают в реакции обмена с другими растворимыми
солями
• Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
3) Карбонаты и гидрокарбонаты могут превращаться друг в друга
• Са(ОН)2 + СО2 = CaCO3↓ + Н2О
• СаСО3 + СО2 + Н2О = Са(НСО3)2
• 4) Разложение гидрокарбонатов и карбонатов при нагревании
• NaHCO3 t˚C → Na2CO3 + h3O + CO2↑
• CaCO3 t˚C → CaO + CO2↑
Здесь, среди миллионов кристаллов кальцита и арагонита человеку сложно понять,
какие силы природы смогли создать это каменное чудо.

взаимопревращения в природе
Пещера «Эмине-Баир-Хосар» в Крыму!
Пещера «Эмине-Баир-Хосар» в Крыму
Сталактиты и сталагмиты в пещере
Авшалом, Израиль
Сталактиты и сталагмиты в пещере
Авшалом, Израиль
Применение солей угольной кислоты
Химическая формула
вещества
ZnCO3
Тривиальное
(историческое)
название
Галмей
Современное
название
Применение
вещества
Карбонат цинка
Производство красок.
Умягчение воды,
производство стекла.
Na2CO3
Кальцинированная
сода
Карбонат натрия
NaHCO3
Питьевая сода
Гидрокарбонат
натрия
Na2CO3·10h3O
Кристаллическая
сода
MgCO3
Жжённая магнезия
Карбонат магния
В медицине.
Смесь MgCO3 и
CaCO3 (1:1)
(CuOH)2CO3
Доломит
В строительстве.
Малахит
K2CO3
Поташ
Смесь карбонатов
магния и кальция
Основной карбонат
меди (II)
Карбонат калия
Мел, мрамор,
известняк
В пищевой промышленности, в
медицине.

Десятиводный гидрат Для умягчения воды
карбоната натрия
при стирке белья.
Карбонат кальция
Поделки, ювелирные
украшения.
Производство стекла,
керамики, цемента,
удобрение.
Производство
строительных
Тест по теме угольная кислота
1.
Какая характеристика относится к угольной кислоте:
с) нестабильная
т)
одноосновная
у)
сильная
2. Формула питьевой соды:
а)
NаНСО3
б)
Са(НСО3)2
в)
3.
Nа2СО3
Условие, необходимое для разложения карбонатов:
а)
температура
б)
давление
в)
свет
4. Вещество, с помощью которого распознают карбонаты:
к)
Са(ОН)2
л)
Н Сl
м)
ВаСl2
5. Где применяется питьевая сода?
а)
в кондитерском деле
б)
в строительстве
в)
в производстве стекла
Тест (продолжение)
6. Что такое «сухой лёд?»
• к) оксид углерода (IV)
• л) оксид углерода (II)
• м) оксид азота (V)
7. Сравните углекислый газ с воздухом
• с) легче воздуха
• т) тяжелее воздуха
• у) одинаковые
8.
 Сильный яд, замещает кислород в гемоглобине крови
Сильный яд, замещает кислород в гемоглобине крови• з) оксид углерода (IV)
• и) оксид углерода (II)
• к) оксид азота (V)
9. При тушении пожаров используют
• с) оксид углерода (II)
• т) оксид углерода (IV)
• у) оксид азота (V)
English Русский Правила
Химические знаки и формулы —
1. Закончите прдложение.
Химический элемент — это вид атомов с одинаковым зарядом ядра.
2. Заполните таблицу 6.
Химические символы и названия некоторых элементов.
3. Напишите, какой химический элемент, по вашему мнению, входит в состав веществ, называемых:
сульфаты — S u O
гидриды — H
фосфаты — P u O
сульфиды — S
нитраты — N u O
оксиды — O
карбонаты — C u O
силикаты — Si u O
4. Соедините линией название химического элемента с соответствующим химическим символом.
Соедините линией название химического элемента с соответствующим химическим символом.
5. Рассмотрите рисунок 5. Постройте столбчатую диаграмму, отражающую содержание некоторых элементов в организме человека по массе. Над соответствующими столбиками напишите символы и русские названия химических элементов, содержащихся в организме человека.
6. Закончите предложения.
а) Химиеческая формула показывает качественный и количественный состав молекулы.
б) Индекс показывает сколько атомов данного элемента входит в состав молекулы вещества.
7. Сернистый газ используют в пищевой промышленности в качестве отбеливающего средства, предохраняющего разрезанные плоды и овощи от потемнения (применяется при производстве джемов, желе, мармелада, повидла, сухого картофельного пюре). Укажите модель молекулы этого вещества, если известно, что в состав данного соединения входит один атом серы и два атома кислорода.
8. Запишите химиеческие формулы:
а) молекула азота, которая состоит из двух атомов азота N2
б) молекулы озона, которая состоит из трех атомов кислорода O3
в) молекулы угольной кислоты, которая состоит из двух атомов водорода, одного атома углерода и трех атомов кислорода h3CO3
г) молекулы аммиака, которая состоит из одного атома азота и трех атомов водорода Nh4
д) пяти молекул воды, каждая из которых состоит из двух атомов водорода и одного атома кислорода 5h3O
е) трех молекул сернистой кислоты, каждая из которых состоит из двух атомов водорода, одного атома серы и трех атомов кислорода 3h3SO3
ж) четырех молекул сероводорода, каждая из которых состоит из двух атомов водорода и одного атома серы 4h3S
з) двух молекул метана, каждая из которых состоит из одного атома углерода и четырех атомов водорода 2Ch5
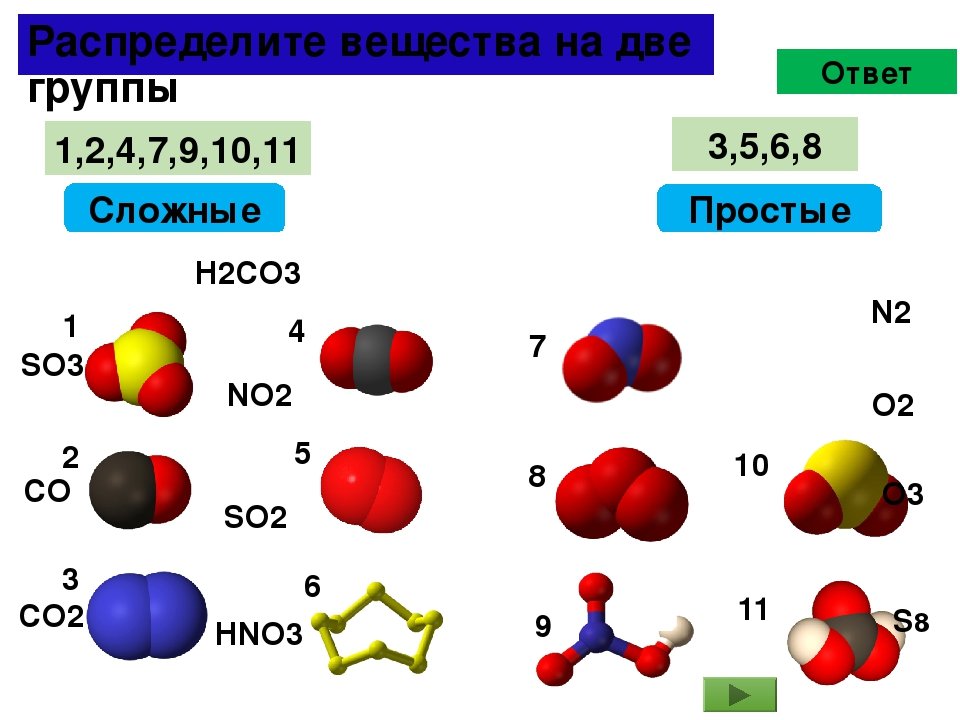
9. На рисунке изображены модели молекул некоторых веществ. Укажите, где показаны простые вщества, где — сложные веещства.
Укажите, где показаны простые вщества, где — сложные веещства.
Простые вещества: а, б, д.
Сложные вещества: в, г.
10. Заполните пропуски в таблице 7.
Названия и формулы некоторых веществ.
| НАЗВАНИЕ ВЕЩЕСТВА | ХИМИЧЕСКАЯ ФОРМУЛА | ЧТЕНИЕ ФОРМУЛЫ | КЛАССИФИКАЦИЯ ВЕЩЕСТВА (простое или сложное) |
| 1. Углекислый газ | CO2 | це о два | сложное |
| 2. Вода | h3O | аш два о | сложное |
| 3. Кислород | O2 | о два | простое |
| 4. Сернистый газ | SO2 | эс о два | сложное |
| 5. Хлор | Cl2 | хлор два | простое |
| 6. Сернистая кислота | h3SO4 | аш два эс о четыре | сложное |
7. Глюкоза Глюкоза | C6h22O6 | це шесть аш двенадцать о шесть | сложное |
| 8. Гидроксид натрия | NaOH | натрий о аш | сложное |
Угольная кислота — CreationWiki, энциклопедия науки о сотворении
| Угольная кислота | |
|---|---|
| Общие | |
| Систематическое название | диметилкарбонат |
| Другие наименования | раствор диоксида углерода |
| Молекулярная формула | H 2 CO 3 |
| УЛЫБКИ | с(=о)(о)о |
| Молярная масса | Молярная масса::275,74 |
| Внешний вид | белое твердое вещество |
| Номер CAS | номер КАС::463-79-6 |
| Недвижимость | |
| Плотность и фаза | Плотность::1 г/мл |
| Растворимость в воде | нерастворимый |
| Температура плавления | Точка плавления::210°C |
| Температура кипения | Точка кипения::-78°C |
| Кислотность (p K a ) | 6,36 |
| Родственные соединения | |
| Родственные соединения | Бифенилкарбоновая кислота |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) Отказ от ответственности и ссылки | |
Угольная кислота представляет собой неорганическую кислоту и содержится в основном в жидкостях. Он может существовать только в виде раствора и имеет белый цвет в воде. Он состоит в основном из углекислого газа и не является очень сильной кислотой. Вы можете найти его в газированных напитках и многих других вещах. Он вызывает коррозию известняка и кальция, что приводит к образованию множества пещер в течение определенного периода времени, когда он разъедает скалу. Это слабая кислота, которая используется в нескольких отраслях промышленности и поставляется в виде газа. Придает газированным напиткам острый вкус. Он нерастворим в воде, его химическая формула Н9.0031 2
Он может существовать только в виде раствора и имеет белый цвет в воде. Он состоит в основном из углекислого газа и не является очень сильной кислотой. Вы можете найти его в газированных напитках и многих других вещах. Он вызывает коррозию известняка и кальция, что приводит к образованию множества пещер в течение определенного периода времени, когда он разъедает скалу. Это слабая кислота, которая используется в нескольких отраслях промышленности и поставляется в виде газа. Придает газированным напиткам острый вкус. Он нерастворим в воде, его химическая формула Н9.0031 2
Содержание
- 1 История
- 2 Свойства
- 3 события
- 4 варианта использования
- 5 Кислотный дождь и океан
- 6 Каталожные номера
История
Углекислота была впервые обнаружена в водах Пирмонта доктором Браунриггом, а углекислый газ был впервые обнаружен доктором Блэком в 1757 году. Затем он был назван углекислотой в 1785 году. В 1867 году Джозеф Листер, хирург в Королевском лазарете Глазго он обнаружил, что углекислота при нанесении на открытую рану после операции действовала как антисептик, убивая бактерии, которые образовывались вокруг открытой области.
Затем он был назван углекислотой в 1785 году. В 1867 году Джозеф Листер, хирург в Королевском лазарете Глазго он обнаружил, что углекислота при нанесении на открытую рану после операции действовала как антисептик, убивая бактерии, которые образовывались вокруг открытой области.
Свойства
Углекислота образуется при растворении двуокиси углерода в воде и может существовать только в растворе. Это слабая нестабильная двухосновная кислота, образующая карбонатные и бикарбонатные соли. Угольная кислота может давать два ряда солей: карбонатные и гидрокарбонатные соли. Углекислота растворяет камни, металлы, минералы и может образовывать пещеры. Кислотность угольной кислоты составляет 6,36 пК, ее температура кипения составляет -78 °С, а температура плавления составляет 210 °С. Ее молярная масса составляет 275,74 г, а номер CAS — 463-79.-6.
Происшествия
Углекислоту можно найти в пещерах.
Углекислота встречается в крови, дождевой воде, кальците, ферментации, угле, грунтовых водах, метеорах, вулканах, аминокислотах, белках, океанах, растениях, эритроцитах, отложениях серы, солях и пещерах.
Применение
Угольная кислота имеет множество применений, например, в качестве удобрения, газированной воды, в качестве газа в области медицины, фармацевтики, косметики, горючих сланцев, пищевой промышленности, медицины, анестезии, топлива, промышленности, солей, лазеров, розлив, очиститель контактных линз, двигатели, терапевтический, гидролиз крахмала, лекарства и сварка.
Кислотный дождь и океан
Кислотный дождь стирает статуи, как эта горгулья.
Кислотный дождь или обычный дождь содержит растворенную углекислоту, имеет рН от 4,5 до 5,6. Углекислота в океане увеличивается, в результате чего многие животные, такие как планктон, умирают и разъедают раковины и кораллы. Кислотные дожди выпадают и стекают в океан, делая его более кислотным, чем раньше. Уровень pH океана составляет 8,1, что примерно на 0,1 ниже, чем в начале промышленной революции. Кислотный дождь с углекислотой вступает в реакцию с карбонатом кальция в мраморных статуях и зданиях с образованием растворимого гидрокарбоната кальция, медленно разрушая их. Углекислый газ выходит из автомобилей или заводов и попадает в воздух, смешиваясь с дождевой водой, образуя угольную кислоту. Затем он стекает в океан, где наносит ущерб морской жизни.
Углекислый газ выходит из автомобилей или заводов и попадает в воздух, смешиваясь с дождевой водой, образуя угольную кислоту. Затем он стекает в океан, где наносит ущерб морской жизни.
Каталожные номера
- [1] Углекислота
- [2] Джозеф Листер
- [3] Превращение океана в кислоту
- [4] Углекислота
- [5] Acid Rain
Когда углекислый газ растворяется в воде, он находится в равновесии с…
Когда углекислый газ растворяется в воде, он находится в равновесии остроумие… | Каналы Pearson+Недавние каналы
- Общая химия
Химия
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- Колледж Алгебра
- Тригонометрия
- Предварительное исчисление
Физика
- Физика
Бизнес
- Микроэкономика
- Макроэкономика
- Финансовый учет
Социальные науки
- Психология
Начните вводить текст, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия6. Химические количества и водные реакции Электролиты
1:18
минуты
Задача 19a
Вопрос из учебника
Проверенный ответ
Это видео-решение было рекомендовано нашими преподавателями как полезное для решения описанной выше проблемы.
99просмотров
Было ли это полезно?
Смотреть дальше
Мастер Категории электролитов с небольшим видео-объяснением от Жюля Бруно
Начать обучение
Связанные видео
Связанная практика
Что такое электролиты?
Профессор Дэйв объясняет
164views
Оценка электролитов и неэлектролитов
Pearson
113Views
Химия 101 — Электролитные и неэлектролитные растворы
Matthew Gerner
140Views
.IsaacsTEACH
96views
Описание электролитов
Chem Academy
57views
Электролиты: определение, примеры и практика
Уэйн Бреслин
116views
Идентификация сильных электролитов, слабых электролитов и неэлектролитов — примеры химии
.
