Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Фенол не реагирует с Сульфатом бария Гидроксидом натрия Азотной кислотой Хлоридом железа (3) Калием
В чем сходства и различия, между:
1.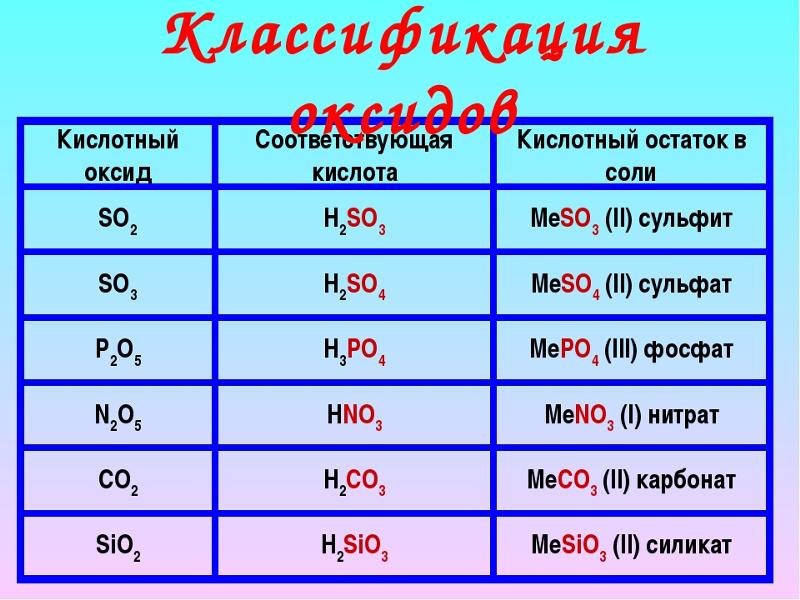 Титан, хром, железо
2. Медь, цинк, серебро ?
Титан, хром, железо
2. Медь, цинк, серебро ?
Определяющее массу осадка феррума (II) гидроксида, добытого при сливе раствора массой 20 г с массовой долей феррум(II) сульфата 8% с раствором массой 20 г с массовой долей гидроксида бария 15%.
Заполните пропуски в таблице. Найдите процентную и нормальную концентрацию 1,2 молярного раствора HCl (плотность раствора 1,02 г/мл)
1)Что реагирует с водородом? Н2О3 НСI S Na СиО 2) Установить последовательность стадий очистки питьевой воды Озонирование или
Пользуйтесь нашим приложением
Вариант 2
Главная \ Подготовка к ОГЭ \ Химия \ Разбор вариантов 2017 года \ Вариант 2
Задание №1.
На приведенном рисунке
изображена модель атома
1. Кремния
2. Серы
3. Кислорода
4. Углерода
Углерода
Объяснение: атом, модель которого приведена на рисунке, имеет два энергетических уровня, на первом уровне находится 2 электрона, а на втором — 4. Значит, это атом элемента №6 в Периодической таблице — углерод. Правильный ответ — 4.
Задание №2.
У химических элементов IVА группы периодической системы с увеличением относительной атомной массы:
1. Усиливаются металлические свойства и увеличивается валентность в водородных соединениях
2. Увеличиваются заряд ядра атома и радиус атома
3. Увеличиваются число электронных слоев в атоме и высшая валентность
4. Усиливаются неметаллические свойства и увеличивается число электронных слоев в атоме
Объяснение: у элементов одной группы валентность в водородных соединениях и высшая валентность. А заряд ядра атома и радиус атома в группе увеличиваются. Например, у углерода заряд ядра — +6, а у кремния — +14. Правильный ответ — 2.
Задание №3.
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно:
1. Хлор и хлороводород
2. Вода и азот
3. Сероводород и метан
4. Кислород и оксид серы (IV)
Объяснение: ковалентная полярная связь характерна для соединений разных неметаллов, а ковалентная неполярная связь — для двухатомных неметаллов, поэтому выбираем воду и азот. Правильный ответ — 2.
Задание №4.
В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени окисления, соответственно равные:
1. +6, +2, +3
2. +6, +3, +2
3. +3, +2, +3
4. +3, +2, +6
Объяснение: CrO3 — кислород в оксидах имеет степень окисления -2, тогда у хрома — +6, CrCl2 — у хлора степень окисления -1, а у хрома — +2, Cr(OH)3 — у гидроксид-иона степень окисления степень окисления -1, а у хрома — +3. Правильный ответ — 1.
Задание №5.
К сложным веществам относится каждое из веществ, указанных в ряду
1. Углекислый газ, вода, азот, хлор
2. Поваренная соль, сахар, хлороводород, аммиак
3. Сероводород, кальций, хлор, метан
4. Серная кислота, фтор, оксид цинка, алюминий
Объяснение: сложные вещества состоят из атомов двух или более элементов, к ним относятся: поваренная соль, сахар, хлороводород, аммиак. Правильный ответ — 2.
Задание №6.
Образование газа происходит при сливании растворов:
1. Хлорида кальция и нитрата серебра
2. Азотной кислоты и гидроксида калия
3. Карбоната натрия и соляной кислоты
4. Гидроксида железа (III) и серной кислоты
Объяснение: выделение газа возможно при образовании угольной или сернистой кислоты или гидроксида аммония, угольная кислота образуется в третьей реакции. Запишем ее:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + h3O
Правильный ответ — 3.
Задание №7.
К электролитам относится каждое из веществ, формулы которых:
1. N2O, KOH, Na2CO3
2. Cu(NO3)2, HCl, Na2SO4
3. Ba(OH)2, Nh4xh3O, h3SiO3
4. CaCl2, Cu(OH)2, SO2
Объяснение: электролит — вещество, проводящее электрический ток при диссоциации на ионы. Сильными электролитами являются щелочи, сильные кислоты и соли. Правильный ответ — 2.
Задание №8.
В соответствии с сокращенным ионным уравнением
Al³+ + 3OH‾ = Al(OH)3
взаимодействует:
1. Сульфат алюминия и гидроксид бария
2. Нитрат алюминия и гидроксид калия
3. Оксид алюминия и гидроксид натрия
4. Фосфат алюминия и гидроксид кальция
Объяснение: данное сокращенное ионное уравнение возможно получить только при реакции, в которой единственным нерастворимым веществом является гидроксид алюминия. В первой реакции сульфат бария нерастворим, в третьей — оксид алюминия, в четвертой — фосфат кальция. Все нитраты и все соли калия растворимы, поэтому выбираем второе уравнение. Правильный ответ — 2.
В первой реакции сульфат бария нерастворим, в третьей — оксид алюминия, в четвертой — фосфат кальция. Все нитраты и все соли калия растворимы, поэтому выбираем второе уравнение. Правильный ответ — 2.
Задание №9.
Железо вытесняет металл из раствора:
1. ZnCl2
2. Cu(NO3)2
3. Al2(SO4)3
4. Mg(NO3)2
Объяснение: железо может вытеснить только более слабый металл, среди перечисленных более слабым металлом является только медь. Правильный ответ — 2.
Задание №10.
Оксид калия взаимодействует с каждым из веществ, указанных в ряду
1. Вода, оксид углерода (II), серная кислота
2. Оксид бария, вода, гидроксид натрия
3. Вода, оксид углерода (IV), соляная кислота
4. Аммиак, кислород, азотная кислота
Объяснение: оксид бария — основный оксид, то есть взаимодействует с веществами с кислотными свойствами, такими, как оксид углерода (IV) и соляная кислота, а с водой с образованием гидроксида калия. Правильный ответ — 3.
Правильный ответ — 3.
Задание №11.
Нерастворимая соль образуется при взаимодействии растворов
1. Хлорида натрия и азотной кислоты
2. Хлорида магния и карбоната натрия
3. Хлорида меди (II) и гидроксида натрия
4. Хлорида алюминия и серной кислоты
Объяснение: в первой реакции образуется растворимая соль — нитрат натрия, во второй — карбонат магния (нерастворимый) и хлорид натрия (растворимый). В третьей — растворимый хлорид натрия, в четвертой — растворимый сульфат алюминия. Правильный ответ — 2.
Задание №12.
Раствор фосфата калия взаимодействует
1. С нитратом кальция
2. С азотной кислотой
3. С сульфатом аммония
4. С гидроксидом натрия
Объяснение: здесь должна пройти реакция обмена, она идет до конца только в случае образования осадка или газа. В первой реакции образуются нитрат калия (все нитраты растворимы) и фосфат кальция (осадок), значит реакция идет до конца. Правильный ответ — 1.
Правильный ответ — 1.
Задание №13.
При смешивании с воздухом взрывоопасным становится каждый из газов:
1. Оксид азота (II) и метан
2. Водород и оксид углерода (II)
3. Оксид серы (IV) и аммиак
4. Метан и водород
Объяснение: в состав воздуха входит кислород, при смешивании кислорода и водорода в определенном объеме происходит реакция со взрывом, а метан — очень энергоемкий газ и на воздухе сгорает с выделением большого количества тепла. Правильный ответ — 4.
Задание №14.
Сера является окислителем в реакции, уравнение которой:
1. 2SO2 + O2 = 2SO3
2. 2h3S + 3O2 = 2h3O + 2SO2
3. h3S + Br2 = 2HBr + S
4. 2Al + 3S = Al2S3
Объяснение: окислитель в окислительно-восстановительной реакции принимает электроны. Рассмотрим изменения степеней окисления серы в приведенных реакция.
1. +4 (-2е) → +6
2. -2 (-6е) → +4
-2 (-6е) → +4
3. -2 (-2е) → 0
4. 0 (+2е) → -2
То есть сера принимает электроны в последней реакции. Правильный ответ — 4.
Задание №15.
Массовая доля кальция в карбонате кальция равна:
1. 0,8
2. 0,4
3. 0,2
4. 0,6
Объяснение: рассчитаем массовую долю кальция по формуле:
ω = (Ar(Ca) x n)/Mr, где n — количество атомов кальция в молекуле.
ω(Ca) = 40/100 = 0,4
Правильный ответ — 2.
Задание №16.
Общим для магния и цинка является
1. Наличие одинакового числа электронных слоев в их атомах
2. Наличие двух электронов на внешнем электронном слое в их атомах
3. Образование ими высших оксидов, которые относятся к основным оксидам
4. То, что они являются восстановителями в реакциях с неметаллами
5. То, что их оксиды хорошо растворяются в воде
Объяснение: магний находится в третьем периоде, во второй А группе и является щелочноземельным металлом, цинк находится в четвертом периоде, второй В группе и является переходным металлом, то есть эти два элемента имею разное количество электронных слоев. Но количество электронов на внешнем уровне у них одно и то же — 2. Оксид цинка является амфотерным, а не основным. А в реакциях с неметаллами являются восстановителями, так как отдают электроны. Их оксиды не растворяются в воде. Правильный ответ — 24.
Но количество электронов на внешнем уровне у них одно и то же — 2. Оксид цинка является амфотерным, а не основным. А в реакциях с неметаллами являются восстановителями, так как отдают электроны. Их оксиды не растворяются в воде. Правильный ответ — 24.
Задание №17.
Для этана характерны следующие утверждения
1. Обесцвечивает бромную воду
2. Вступает в реакцию дегидрирования
3. Атомы углерода в молекуле соединены одинарными связями
4. В состав молекулы входит один атом углерода
5. Относится к кислородсодержащим органическим веществам
Объяснение: этан — предельный углеводород, то есть для него характерны, в основном, реакции замещения. А еще он может дегидрироваться, превращаясь в этилен или ацетилен. Правильный ответ — 23.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
Вещества
1. SO3(г) и O2(г)
SO3(г) и O2(г)
2. HNO3(р-р) и Nh4(р-р)
3. BaCO3(тв) и BaO(тв)
Реактив
1. Na2SO4(р-р)
2. Ca(OH)2(р-р)
3. Фенолфталеин
4. HCl(р-р)
Объяснение: первые два газа можно различить в реакции с гидроксидом кальция: оксид серы будет образовывать соль — сульфат кальция, а кислород реагировать не будет. Растворы азотной кислоты и аммиака можно различить при помощи индикатора — фенолфталеина, он будет давать разную окраску: в кислой среде он будет бесцветный, а в слабо-щелочной — розовый. Правильный ответ — 234.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать
Название вещества
А. Сероводород
Б. Оксид серы (VI)
В. Оксид серы (IV)
Реагенты
1. O2, KOH(р-р)
2. Hg, h3O
3. O2, Cu
4. h3O, CaO
Объяснение: сероводород реагирует с кислородом (при недостатке кислорода образуется сера и вода, а при избытке кислорода образуется оксид серы (IV)) и с гидроксидом калия (с образованием сульфида калия и воды). С этими же реагентами реагирует оксид серы (IV). А оксид серы (VI) реагирует с водой с образованием серной кислоты и с оксидом кальция с образованием сульфата кальция. Правильный ответ — 141.
С этими же реагентами реагирует оксид серы (IV). А оксид серы (VI) реагирует с водой с образованием серной кислоты и с оксидом кальция с образованием сульфата кальция. Правильный ответ — 141.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
K2MnO4 + HCl(конц) → MnCl2 + KCl + Cl2 + h3O
Определите окислитель и восстановитель.
Объяснение: в данной реакции меняют степень окисления — марганец и хлор.
Запишем баланс:
Mn(+6) +4e → Mn(+2) | 1 — окислитель
2Cl(-1) -2e → Cl2(0) | 2 — восстановитель
Расставим коэффициенты.
K2MnO4 + 8HCl(конц) → MnCl2 + 2KCl + 2Cl2 + 4h3O
Задание №21.
К 400 г раствора силиката калия добавили избыток раствора серной кислоты и получили 19,5 г осадка. Какова массовая доля соли (в %) в исходном растворе?
Объяснение: запишем реакцию.
K2SiO3 + h3SO4 → h3SiO3↓ + K2SO4
Рассчитаем количество вещества кремниевой кислоты.
n(h3SiO3) = 19,5/(2+28+48) = 0,25 моль
n(h3SiO3) = n(K2SiO3) = 0,25 моль
Рассчитаем массу вещества силиката калия.
M(K2SiO3) = 39×2 + 28 + 48 = 154 г/моль
m(K2SiO3) = 0,25 x 154 = 38,5 г
ω(K2SiO3) = 38,5/400 x 100% = 9,625%
Ответ: массовая доля соли в исходном растворе равна 9,625%.
Задание №22.
Даны вещества: ZnSO4, HNO3(конц), Hg, Cu, I2, KOH. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди (II). Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: допустим медь прореагирует с концентрированной азотной кислотой.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2h3O
А затем нитрат меди прореагирует с гидроксидом калия, при этом образуется нерастворимый гидроксид меди.
Cu(NO3)2 + KOH = KNO3 + Cu(OH)2↓
Детали вещества | Служба регистрации веществ
Основные метаданные
Внутренний номер отслеживания : 85571
Статус вещества : Утверждено
Тип вещества
Химическое вещество
Регистрационное наименование EPA
Триоксид хрома(VI)
Список реестров EPA
Химическая идентификация
Систематическое название
Оксид хрома (CrO3)
Систематический список имен
Название индекса Chemical Abstracts
Предпочтительная аббревиатура
Номер CAS
1333-82-0
Идентификационный номер Агентства по охране окружающей среды
Молекулярная формула
CrO3
Молекулярный вес
99,99
Определение
Комментарий/Описание
Связанные идентификаторы Нет информации о бывших или неправильно используемых идентификаторах. Состав| Структурное обозначение Тип | Обозначение |
|---|---|
| УЛЫБКИ | O=[Cr](=O)=O |
| ИНЧИ | 1S/Cr. 3O 3O |
Устав/Правила
| Устав/Правила | Синоним | Синоним Качество | Добавлено в реестр TSCA | Удалено из реестра TSCA |
|---|---|---|---|---|
| TSCA Инв | Оксид хрома (CrO3) | Действительный | ||
| 2020 CDR TSCA Inv Активный | Оксид хрома (CrO3) | Неизвестно | ||
| CAA112(b) HAP | Триоксид хрома | Неизвестно | ||
| TSCA 6 Необоснованный риск | Оксид хрома (CrO3) | Действительный | ||
| CWA 311-HS | Триоксид хрома | Действительный | ||
| CWA 311-HS | Хромовый ангидрид | Действительный | ||
| 2020 CDR TSCA 6 Необоснованный риск | Оксид хрома (CrO3) | Неизвестно | ||
| САРА 110 | Триоксид хрома (VI) | Действительный | 28. |
| Приложения/системы Агентства по охране окружающей среды | Синоним | Синоним Качество | Добавлено в реестр TSCA | Удалено из реестра TSCA |
|---|---|---|---|---|
| ЭКОТОКС | Оксид хрома (CrO3) | Неизвестно | ||
| ЭРНС | Хромовый ангидрид | Действительный | ||
| ОГЭ | Оксид хрома | Действительный | ||
| СЭМС | ХРОМ(VI) ОКСИД | Неизвестно | ||
| КАМЕО Химикаты | Трехокись хрома безводная | Действительный | ||
| ICIS-Эйр | Оксид хрома | Действительный | ||
| ЭРНС | Триоксид хрома | Действительный | ||
| ЦЕРКЛИС3 | Триоксид хрома | Действительный | ||
| ИСПРАВЛЕНИЕ | Триоксид хрома | Действительный | ||
| ИКИС | Оксид хрома (CrO3) | Действительный | ||
| ICIS-Эйр | Оксид хрома (VI) | Действительный | ||
| TSCATS | Оксид хрома (CrO3) | Действительный | ||
| ICIS-Эйр | Оксид хрома (VI) | Действительный | ||
| ЭИС | Триоксид хрома | Действительный | 01. 01.1970 01.1970 |
| Другие источники | Синоним | Синоним Качество | Добавлено в Список | Исключено из списка |
|---|---|---|---|---|
| ChemIDStd | Триоксид хрома (VI) | Действительный | ||
| CUS02 | Оксид хрома (CrO3) | Действительный | ||
| CUS98 | Оксид хрома (CrO3) | Действительный | ||
| HSDB | Триоксид хрома | Действительный | ||
| Химический репозиторий НТП | Триоксид хрома | Действительный | ||
| АТСДР | Оксид хрома (CrO3) | Действительный | ||
| АТСДР | Триоксид хрома (VI) | Действительный | ||
| Индекс CA | Оксид хрома (CrO3) | Действительный | ||
| Нью-Джерси-РТК-HS | Оксид хрома (VI+) | Действительный | ||
| FDA | Триоксид хрома | Неизвестно |

Дополнительные синонимы Синонимов этого типа нет.
Похожие ссылки Ниже приведены ссылки на другие источники информации об этом веществе. Следующий список включает ссылки, относящиеся к выбранному веществу. Отказ от ответственности EPA по внешним ссылкам.
| Справочное наименование |
|---|
| Отчет TSCATS с низким уровнем детализации |
| URL-адрес UNII FDA |
| Информация OSHA по отбору химических проб |
| Ссылка на информационную панель CompTox Chemicals |
| Минимальные уровни риска ATSDR для опасных веществ |
| Международная карта химической безопасности NIOSH |
| Информационный бюллетень об опасных веществах NJ RTK |
| Расширенная ссылка ChemID Plus |
| Ссылка на ChemID Plus |
Разница между хромовой кислотой и триоксидом хрома
Ключевое различие между хромовой кислотой и триоксидом хрома заключается в том, что хромовая кислота представляет собой сильнокислотный раствор, полученный путем объединения концентрированной серной кислоты с дихроматом, тогда как триоксид хрома представляет собой кислый ангидрид хромовая кислота .
Хромовая кислота и триоксид хрома являются двумя родственными веществами; Хромовую кислоту можно получить гидратацией триоксида хрома. Это неорганические вещества, содержащие химический элемент хром.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое хромовая кислота
3. Что такое триоксид хрома
4. Прямые сравнения – хромовая кислота и триоксид хрома в табличной форме
5. Резюме 9 Что такое хромовая
Кислота?
Хромовая кислота представляет собой сильнокислый раствор, содержащий молекулы h3CrO4. Однако эту кислоту обычно получают из комбинации концентрированной серной кислоты и дихромата. Следовательно, эта кислота может содержать различные соединения, в том числе твердый триоксид хрома. Эта сильная кислота полезна для очистки стеклянных материалов. Атом хрома в молекулярной хромовой кислоте находится в степени окисления +6. Эта кислота считается сильной и очень агрессивной кислотой.
Обычно хромовую кислоту можно наблюдать в виде темно-красных кристаллов. Молекулярная хромовая кислота имеет общие черты с молекулами серной кислоты. Они имеют схожие модели депротонирования и кислотную силу.
Молекулярная хромовая кислота имеет общие черты с молекулами серной кислоты. Они имеют схожие модели депротонирования и кислотную силу.
Хромовая кислота является важным окислителем и может окислять органические соединения, такие как спирты, до карбоновых кислот и кетонов, первичные и вторичные спирты до соответствующих альдегидов и кетонов и т. д.
Рисунок 01: Хромовая кислота
применения этой сильной кислоты, она важна как промежуточное звено в процессе хромирования, используется в керамической глазури и цветном стекле, как мощный окислитель, используется при очистке лабораторной посуды, в индустрии ремонта музыкальных инструментов из-за ее способности для осветления латунного материала, используемого в производстве красок для волос, в качестве отбеливателя при обратной обработке черно-белых фотографий и т. д.
Что такое триоксид хрома?
Триоксид хрома представляет собой неорганическое соединение, имеющее химическую формулу CrO3. Это кислая безводная форма хромовой кислоты. Поэтому оба эти вещества иногда доступны на рынке под одним и тем же названием. Мы можем наблюдать это вещество как темное твердое вещество пурпурного цвета в безводном состоянии, а когда вещество гидратировано, оно приобретает оранжевый цвет. Это вещество готовят в основном для гальванических процессов. Кроме того, триоксид хрома является очень сильным окислителем; следовательно, это также канцероген.
Это кислая безводная форма хромовой кислоты. Поэтому оба эти вещества иногда доступны на рынке под одним и тем же названием. Мы можем наблюдать это вещество как темное твердое вещество пурпурного цвета в безводном состоянии, а когда вещество гидратировано, оно приобретает оранжевый цвет. Это вещество готовят в основном для гальванических процессов. Кроме того, триоксид хрома является очень сильным окислителем; следовательно, это также канцероген.
Рисунок 02: Влажный триоксид хрома
Помимо процесса хромирования существуют и другие применения триоксида хрома, такие как создание пассивированных хроматных пленок, устойчивых к коррозии, пригодных для производства синтетических рубинов, полезных при нанесении типов анодного покрытия на алюминий и т. д.
В чем разница между хромовой кислотой и триоксидом хрома?
Хромовая кислота представляет собой сильнокислый раствор, содержащий молекулы h3CrO4. Триоксид хрома представляет собой неорганическое соединение, имеющее химическую формулу CrO3.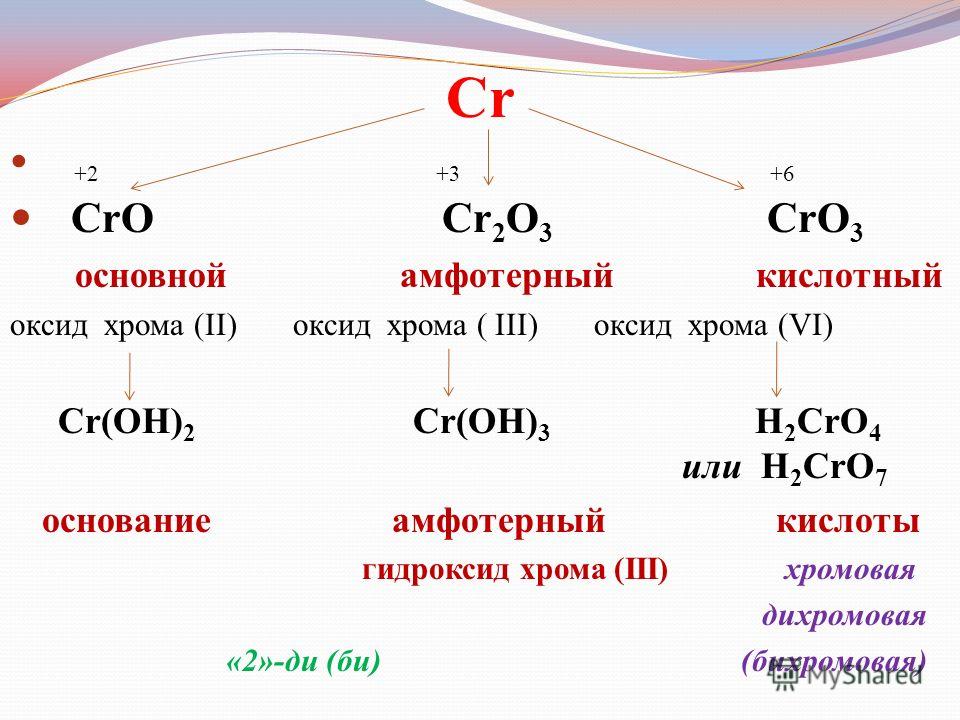

 02.21
02.21