What, How To Balance & FAQs —
By Арти Гокхале
NaClO — это формула гипохлорита натрия, который также известен под названием «Отбеливатель». «Антиформин» — другое название NaClO. Давайте изучим реакцию HCl + NaClO в этой статье.
HCl представляет собой соединение, которое содержит водород и хлор, так называемую двухатомную молекулу. HCl вызывает коррозию по своей природе. Атом хлора более электроотрицателен, чем водород, поэтому форма связи полярна. NaClO — твердое вещество зеленовато-желтого цвета. NaClO имеет сладковатый запах.
В следующей редакционной статье мы изучим различные факты, связанные с реакцией HCl + NaClO.
Что является продуктом HCL и NaClO?Продуктом реакции между HCl + NaClO является NaCl, выделяется вода и газообразный хлор.
HCl + NaClO ⟶ NaCl + H2О+Cl2↑
Какой тип реакции HCL + NaClOРеакция между HCl + NaClO является окислительно-восстановительной реакцией, которую обычно называют окислительно-восстановительной реакцией.
Чтобы уравновесить реакцию, используются следующие шаги.
- Первый шаг заключается в наблюдении за тем, одинаково ли количество атомов на стороне продукта и на стороне реагента; тогда только реакция будет уравновешенной реакцией.
- На следующем этапе, если количество атомов как на стороне реагента, так и на стороне продукта не одинаково, мы должны сбалансировать это.
- Здесь реакция HCl + NaClO ⟶ NaCl + H2О+Cl2.
- В реакции HCl + NaClO сторона реагента содержит один атом водорода, два атома хлорида, один атом натрия и один атом кислорода, тогда как на стороне продукта присутствуют два атома водорода, три атома хлора, один атом натрия и один атом кислорода.
- Этот подсчет указывает на неравное количество атомов как на стороне реагента, так и на стороне продукта, поэтому мы должны сбалансировать это.

- Реакцию HCl + NaClO можно уравновесить с помощью алгебраического метода следующим образом.
- 2HCl + NaClO ⟶ NaCl + H2О + Cl2↑.
| Atom | Количество атомов на стороне реагента | Количество атомов на стороне продукта |
|---|---|---|
| H | 2 | 2 |
| Cl | 3 | 3 |
| Na | 1 | 1 |
| O | 1 | 1 |
HCL + NaClO титрование следует следующей процедуре.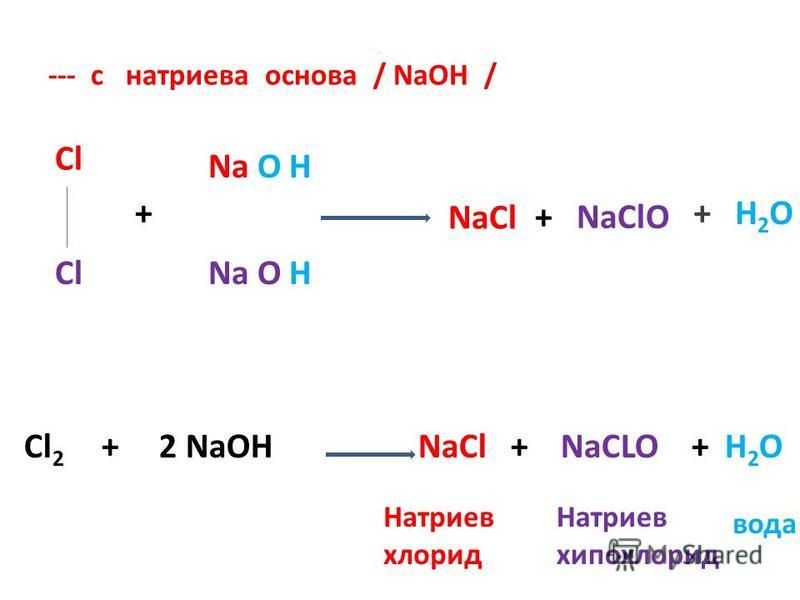
Используемый аппарат
- бюретка
- Подставка для бюреток
- пипетка
- Коническая колба
- Мерная колба
Используемый индикатор
фенолфталеин индикатор, используемый для титрования между HCl + NaClO.
Индикатор фенолфталеин имеет розовую окраску в щелочном растворе и бесцветный в кислом растворе.
Процедура
- Все приборы промывают и сушат перед титрованием. Внутри какого-либо прибора не должно быть воды или влаги, что может изменить точку титрования.
- NaClO — слабое основание, взятое в коническую колбу. Аналит называется.
- В бюретку берется крепкая HCl, которая называется титрантом.
- Перед титрованием в коническую колбу с NaClO добавляют несколько капель индикатора фенолфталеина.

- Индикатор вызывает изменение окраски раствора NaClO, что подтверждает достижение точки эквивалентности.
- Перед титрованием в конической колбе кислота не реагирует с основанием.
- Когда мы добавляем кислоту из бюретки в коническую колбу, содержащую раствор NaClO, появляется изменение цвета, что указывает на то, что кислота прореагировала со слабым основанием NaClO.
- Теперь титрант из бюретки медленно, по капле, добавляют в коническую колбу.
- Встряхните его как следует, чтобы HCl правильно прореагировал с NaClO.
- Через некоторое время достигается конечная точка, которая показывает изменение цвета раствора в конической колбе, что указывает на полное титрование основания.
- Количество NaClO можно рассчитать по количеству HCl, потребляемому NaClO.
- V NaClO * S NaClO = V HCl * S HCl
- V обозначает объем и концентрацию S.

- Таким образом, мы можем узнать количество HCl, необходимое для нейтрализации NaClO..
Чистое ионное уравнение HCl + NaClO приведен ниже.
Na+ +ClO– + 2H+ +2Cl–⟶ Cl2 (водн.) + Na+ + Cl–(с) + Н2О (л).
Сопряженные пары HCL + NaClOHCL + NaCLO имеет следующие сопряженные пары:
- HCl — сильная кислота, а Cl — сопряженное с ней основание.
- Гипохлорит ClO- является сопряженным основанием слабой кислоты HClO.
HCL + NaCLO имеет следующие межмолекулярные силы:
- Наблюдается слабое диполь-дипольное взаимодействие в молекуле HCl.
- Cl– и Н+ ионы проявляют полярную ковалентную силу.

- В NaClO дипольные силы присутствуют между Na+ и полярная молекула гидрохлорита ClO–.
- Дипольная сила в NaClO представляет собой полярную ковалентную силу, что указывает на его растворимость в воде.
Энтальпия реакции реакции HCl + NaClO составляет -107 кДжмоль-1.
Является ли HCL + NACLO буферным раствором?HCl + NaClO не действуют как буферный раствор так как HCl является сильной кислотой. Буфер представляет собой раствор слабой кислоты и соли этой слабой кислоты или слабого основания и соли этого слабого основания. NaClO не соль HCl, а соль HClO.
Является ли HCL + NaClO полной реакцией?HCl + NaClO — это полная реакция, так как Cl2 выделился в виде газа, а H2O, NaCl, образующийся как продукт.
Является ли HCL + NACLO экзотермической или эндотермической реакцией?Реакция HCl + NaClO представляет собой экзотермическая реакция, так как реакция HCl + NaClO имеет отрицательное значение энтальпии, которое находится при -107 кДжмоль. -1.Тепло поглощается в реакции HCl + NaClO. Реагенты более стабильны, чем продукт.
-1.Тепло поглощается в реакции HCl + NaClO. Реагенты более стабильны, чем продукт.
HCL + NACLO – это окислительно-восстановительный потенциал реакция. Здесь NaClO действует как окислитель, а HCl как восстановитель.
- Cl I + А–⟶ Cl0
(Снижение)
- Cl– – 1е–⟶ Cl0
(Окисление)
Является ли HCL + NaClO реакцией осажденияHCl + NaClO не является осадки реакции, так как в реакции HCl + NaClO осадок не образуется. Образовавшийся NaCl растворим в воде.
Является ли реакция HCL + NaClO обратимой или необратимой?HCL + NaClO — необратимая реакция.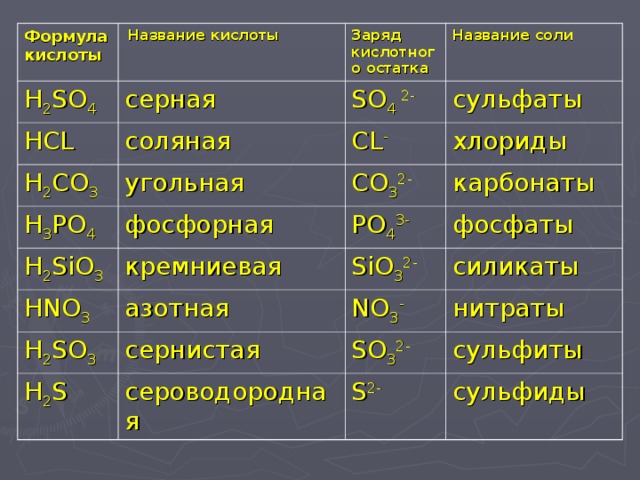 В реакции HCL + NaClO CO2 превратился в газ, так что шансов на обратимость нет.
В реакции HCL + NaClO CO2 превратился в газ, так что шансов на обратимость нет.
HCL + NaClO представляет собой реакцию замещения Натрий из NaClO вытесняет водород из HCl и образует NaCl.
Как сбалансировать HCl + NaClO + KI = I2 + H2О + KCl + NaClHCl + NaClO + KI ⟶ I2 + H2Реакция O + KCl + NaCl уравновешивается с помощью следующих шагов.
- Чтобы сбалансировать реакцию, сторона реагента и сторона продукта должны содержать одинаковое количество атомов.
- В системе HCl + NaClO + KI ⟶ I2 + H2Реакция O + KCl + NaCl, на стороне реагента присутствует один атом водорода, один атом натрия, два атома хлора, один атом кислорода, один атом калия и один атом йода.
- В то время как со стороны продукта присутствуют два атома йода, два атома водорода, один атом кислорода, два атома хлора, один атом натрия и один атом калия.

- Приведенный выше подсчет показывает неравное распределение атомов как на стороне реагента, так и на стороне продукта.
- Мы должны уравнять это, что можно сделать с помощью алгебраического метода, как показано ниже.
- 2HCl + NaClO + 2KI ⟶ I2 + 2KCl + NaCl+ H2O
| Atom | Количество атомов на стороне реагента | Количество атомов на стороне продукта |
|---|---|---|
| Na | 1 | 1 |
| O | 1 | 1 |
| Cl | 3 | 3 |
| K | 2 | 2 |
| I | 2 | 2 |
В этой статье описана реакция между соляной кислотой и гипохлоритом натрия.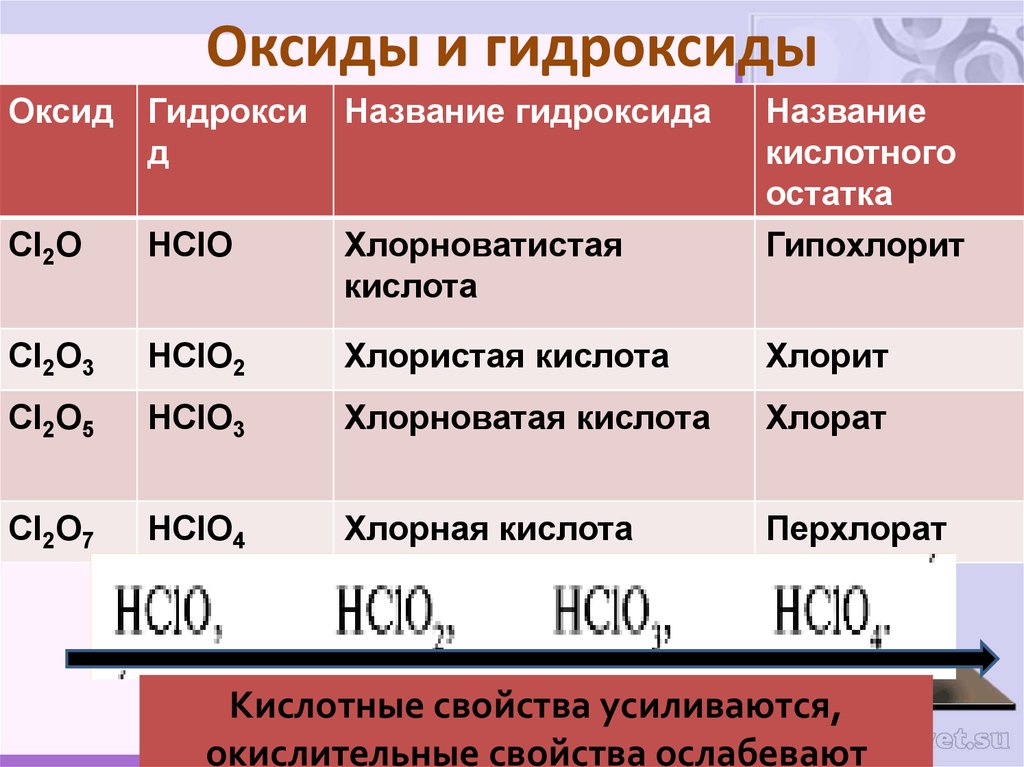 Гипохлорит натрия используется в различных отраслях промышленности, таких как бумажная промышленность, производство моющих средств, текстильная промышленность и т. д. Соляная кислота используется для производства удобрений и красителей.
Гипохлорит натрия используется в различных отраслях промышленности, таких как бумажная промышленность, производство моющих средств, текстильная промышленность и т. д. Соляная кислота используется для производства удобрений и красителей.
Содержит ли Domestos хлор? | Domestos
- На главную
- Здоровье и Гигиена
- Содержит ли Domestos хлор
Бензалкония хлорид, что это за вещество? Узнайте все о его применении!
За Domestos закрепилась репутация универсального средства для поддержания чистоты в доме. Им дезинфицируют поверхности, удаляют известковый и ржавый налет с сантехники, моют плитку и пол, уничтожают плесень, устраняют засоры в трубах и даже используют для отбеливания одежды. Но так ли безопасен Domestos? Чтобы разобраться, подробнее рассмотрим его состав.
Входит ли хлор в состав Domestos
Ответ на вопрос «содержит ли Domestos хлор?» находится на поверхности. Главный действующий компонент универсальных гелей Domestos — гипохлорит натрия, он же водный раствор NaOCl. На 95,2% вещество состоит из активного хлора, который хорошо известен как мощный дезинфицирующий компонент.
На 95,2% вещество состоит из активного хлора, который хорошо известен как мощный дезинфицирующий компонент.
Согласно российским санитарно-гигиеническим требованиям к товарам бытового потребления чистящие средства могут содержать до 8% хлорактивных соединений (1).
Концентрация NaOCl в Domestos не более 5%, что делает его полностью безопасным при точном соблюдении инструкции.
Отбеливающие свойства гипохлорита натрия были открыты еще в 1785 г. французским химиком Клодом Луи Бертолле, после чего в городке Жавель под Парижем начали промышленное производство белил. В 1822 г. аптекарь Антуан Жермен Лабаррак усовершенствовал технологию и тем самым изобрел хлорку в ее современном виде. Отсюда другие названия вещества: жавелева и лабарракова вода
В защиту гипохлорита натрия говорит множество фактов. Его используют для очистки питьевой и бытовой воды, дезинфекции заводского оборудования и помещений, в пищевой и сельскохозяйственной промышленности, производстве тканей и фармакологических препаратов.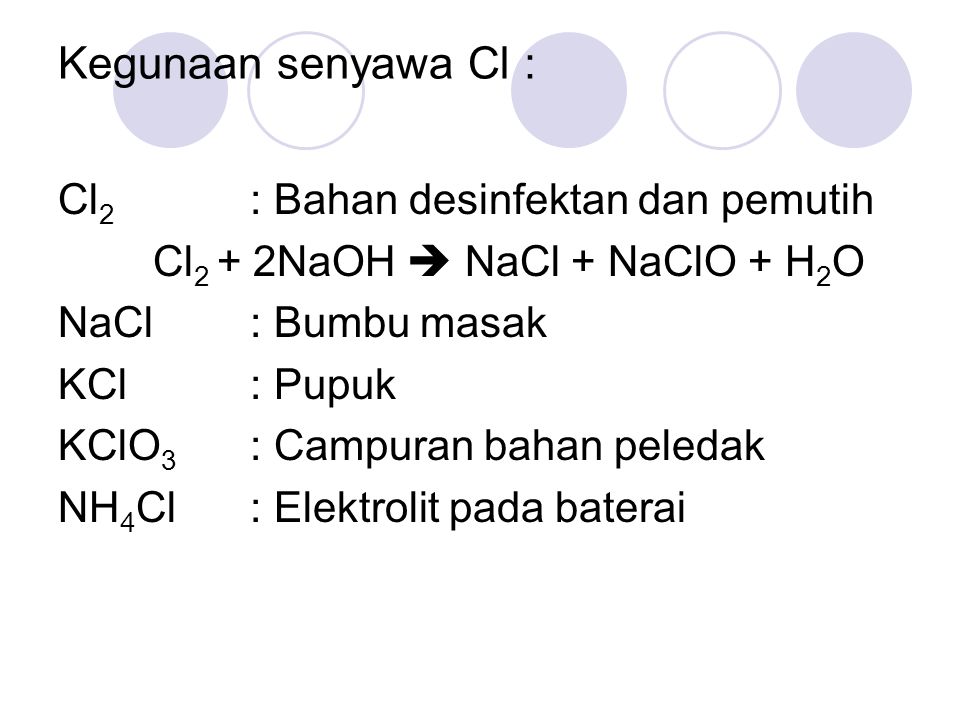 Столь же повсеместно применяется хлор в бытовой химии.
Столь же повсеместно применяется хлор в бытовой химии.
Скрытая угроза моющих средств
Хлор в составе Domestos запускает процессы окисления в клетках микробов. Даже в малых концентрациях он эффективно справляется с болезнетворными бактериями и грибками: кишечной палочкой, сальмонеллой, стафилококками, энтерококками, анаэробными бактериями и грибками. Но при нарушении техники безопасности есть риск испытать вред хлора на себе:
Внимательно читайте инструкцию. Придерживайтесь рекомендованных пропорций при разведении средства водой.
Не смешивайте Domestos с другой бытовой химией. Это может запустить химическую реакцию с выбросом летучего хлора.
Испарения могут действовать на слизистую глаз и органов дыхания — при использовании хлорсодержащих моющих средств обязательно проветривайте помещение.
При попадании на кожу концентрированный препарат может вызвать раздражение. Не пренебрегайте резиновыми перчатками.
Удостоверьтесь в совместимости моющего препарата с материалом обрабатываемой поверхности.

Храните бытовую химию в недоступной для детей и питомцев месте.
Для повседневных нужд высокой концентрации хлора не требуется. Это позволяет избежать негативных последствий для здоровья, но при этом отмыть, отбелить и продезинфицировать даже самые запущенные уголки дома.
1. «Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю) // http://www.tsouz.ru/db/techregulation/sanmeri/Documents/Chimiyailaki.pdf»
Поделиться
FacebookTwitter[Гипохлорит натрия]
Общедоступный Опубликовано 2017
- EintragstypEntry Type
- Chemical Compound
- EintragsspracheEntry Language
- EnglischEnglish
- SchlagwortKeyword
Химическое соединение; Гипохлорит натрия
- ИнХИ
ИнХИ=1S/ClO.
 Na/c1-2;/q-1;+1; SUKJFIGYRHOWBL-UHFFFAOYSA-N
Na/c1-2;/q-1;+1; SUKJFIGYRHOWBL-UHFFFAOYSA-N
| Имя ИЮПАК | натрия; гипохлорит |
| Альтернативные имена | НАТРИЙ
ГИПОХЛОРИТ Гипохлорит натрий |
| Молекулярная формула | NaClO |
| Молярная масса | 74,439 г/моль |
| ИнЧИ | InChI=1S/ClO.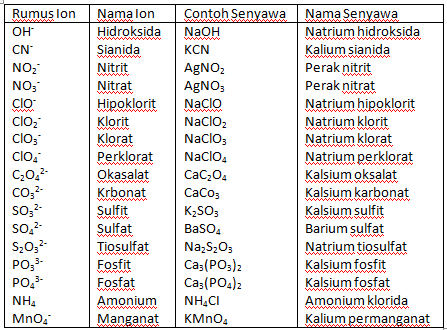 Na/c1-2;/q-1;+1 Na/c1-2;/q-1;+1 |
| Ключ ИнЧИ | SUKJFIGYRHOWBL-UHFFFAOYSA-N |
| Номер КАС 7681-52-9 | |
| PubChem CID 23665760 | |
Гипохлорит натрия
Источник: Национальный центр биотехнологической информации. База данных соединений PubChem; CID=23665760, https://pubchem.ncbi.nlm.nih.gov/compound/23665760
Дополнительную информацию см. на сайте PubChem Compound. База данных
Найти в базе данных IUPAC
Выпуск 74/2002
Высокотемпературное разрушение боевых отравляющих веществ
Выпуск 67/1995
некоторые проблемы в Уничтожение химических боеприпасов и рекомендации по их улучшение
Выпуск 66/1994
Отчет о пестицидах 31: Эффекты хранения и переработки остатков пестицидов в продуктах растительного происхождения
Выпуск 8/1964
Родий (III)
QuelleSource
- TitleTitle
- Chemical Compounds
- VerlagPublisher
- 2016
2 83 900 83 900 83 МДА
Дополнительные материалы
Пожалуйста, войдите или зарегистрируйтесь в De Gruyter, чтобы заказать этот продукт.
ВойтиРегистрация





 Na/c1-2;/q-1;+1; SUKJFIGYRHOWBL-UHFFFAOYSA-N
Na/c1-2;/q-1;+1; SUKJFIGYRHOWBL-UHFFFAOYSA-N
 ..Читать
..Читать