Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
Реакция изомеризации пентана.
Помогите Осуществить превращение P->P2O5->h4PO4->Na3PO4
Допоможіть, будь ласка, розв’язати задачу.
Выведите формулу вещества, содержащего 82,75% углерода и 17,25% водорода. Относительная плотность паров этого вещества по воздуху равна 2.
выведи простейшую формулу минерала, содержащего…
Пользуйтесь нашим приложением
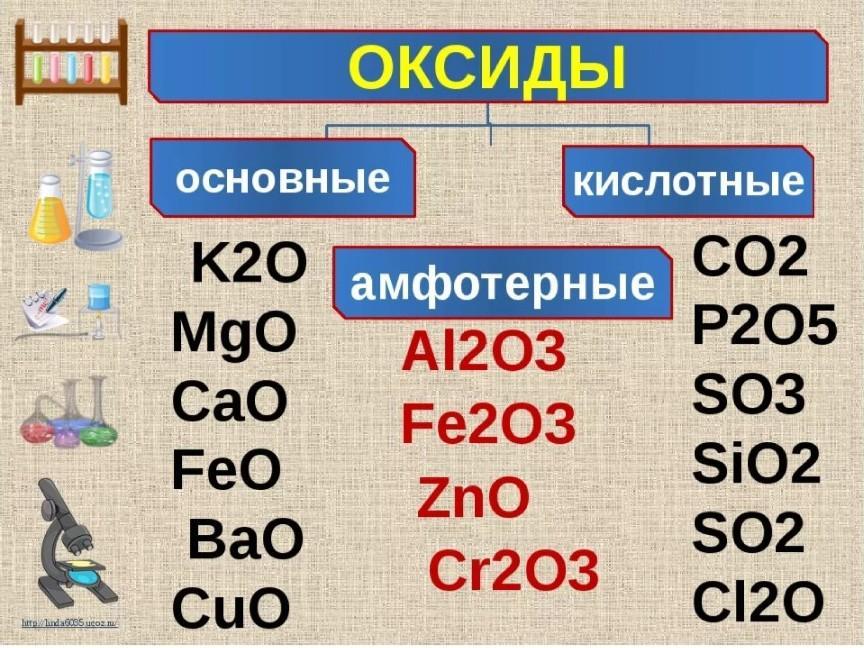
Оксиды металлов — Insch.Ru
Мы объясним, что такое оксиды металлов, как их получают, как они называются и для чего используются. А также, что такое неметаллические оксиды
Оксиды металлов образуются в результате реакции металла с кислородом в воздухе или воде
Что такое оксиды металлов?
химии тип молекулярного соединения, которое получается в результате соединения металла с кислородом, называется основным оксидом или оксидом металла. В этих соединениях атом кислорода имеет степень окисления -2. Его общая формула может быть выражена следующим образом:
Его общая формула может быть выражена следующим образом:
X2On
где X – металлический элемент , а n – валентность этого металла
Эти соединения также называют основными оксидами, поскольку они реагируют с водой, образуя гидроксиды , поэтому они также известны как. Эти типы соединений довольно часто встречаются в повседневной жизни, поскольку наиболее распространенными химическими элементами периодической таблице являются металлические
Оксиды металлов сохраняют некоторые свойства металлического элемента, такие как хорошая проводимость электричества тепла , и высокие температуры плавления. Более того, они встречаются во всех трех агрегатных состояниях материи
Вас также может заинтересовать: Окисление
Как получают оксиды металлов?
Оксиды металлов, как упоминалось выше, получаются при реакции любого металла с кислородом. Например, металл окисляется при постоянном контакте с кислородом, присутствующим в воздухе или воде. Это соотношение обычно выражается следующей формулой
Кислород (O) + Металлический элемент (X) = Основной или металлический оксид
Номенклатура оксидов металлов
Существуют различные системы химической номенклатуры. Для названия оксидов металлов используется стехиометрическая или систематическая система (рекомендованная IUPAC) и система STOCK. Существует также так называемая традиционная номенклатурная система, но она редко используется в настоящее время
Для названия оксидов металлов используется стехиометрическая или систематическая система (рекомендованная IUPAC) и система STOCK. Существует также так называемая традиционная номенклатурная система, но она редко используется в настоящее время
Для того чтобы дать название оксидам металлов в соответствии с этими системами, необходимо сначала принять во внимание некоторые вопросы:
- Когда металлический элемент имеет одно число окисления (например, галлий (Ga) имеет только 3+):
- Традиционный . Суффиксы и префиксы добавляются в соответствии со степенью окисления металлических элементов. Например: оксид галлия (Ga2O3).
- Систематический. Они названы в соответствии с числом атомов каждого типа в молекуле. Например: триоксид дигаллия (Ga2O3).
- Состояние окисления металла в этом соединении указывается в конце названия римскими цифрами и в круглых скобках. Часто, если металл имеет только одну степень окисления, римская цифра опускается.

- Когда металлический элемент имеет два числа окисления (например, свинец (Pb) имеет 2+ и 4+):
- Традиционные . Суффиксы добавляются в соответствии со степенью окисления металлических элементов. Когда элемент имеет высшую степень окисления, используется суффикс -ico, а когда он имеет низшую степень окисления, используется суффикс -oso. Например: оксид плюмбика (PbO2), когда степень окисления самая высокая (4+), и оксид плюмбика (PbO), когда степень окисления самая низкая (2+).
- Систематический. Правила сохраняются. Например: диоксид свинца (PbO2), когда он имеет степень окисления (4+) и монооксид свинца (PbO), когда он имеет степень окисления (2+).
- STOCK. Состояние окисления металла в этом соединении добавляется в конце названия по мере необходимости, римскими цифрами и в круглых скобках. Например: оксид свинца(IV) (PbO2) и оксид свинца(II) (PbO).
Разъяснение . Иногда подзаписи могут быть упрощены. Это относится к оксиду свинца(IV), который можно было бы представить как Pb2O4, но подстрочные индексы упрощены до PbO2.
Иногда подзаписи могут быть упрощены. Это относится к оксиду свинца(IV), который можно было бы представить как Pb2O4, но подстрочные индексы упрощены до PbO2. - Когда металлический элемент имеет три числа окисления (например, хром (Cr) имеет в основном 2+, 3+, 6+):
- Традиционный . Суффиксы и префиксы добавляются в соответствии со степенью окисления металлических элементов. Когда элемент имеет высшую степень окисления, добавляется суффикс -ico, для промежуточной степени окисления – суффикс -oso, а для низшей – префикс -hipo, за которым следует название металла, а затем суффикс -oso. Например: оксид хрома (CrO3), когда он имеет степень окисления (6+), оксид хрома (Cr2O3), когда он имеет степень окисления (3+) и оксид гипохрома (CrO), когда он имеет степень окисления (2+).
- Систематический Правила соблюдаются. Например: монооксид хрома (CrO), когда он имеет степень окисления (2+), триоксид дихрома (Cr2O3), когда он имеет степень окисления (3+) и триоксид хрома (CrO3), когда он имеет степень окисления (6+).

- STOCK . Состояние окисления металла в этом соединении добавляется в конце названия по мере необходимости, римскими цифрами и в круглых скобках. Например: оксид хрома (II) (CrO), оксид хрома (III) (Cr2O3) и оксид хрома (VI) (CrO3).
- Когда элемент имеет четыре числа окисления (марганец (Mn) имеет в основном 2+, 3+, 4+, 7+).
- Традиционный . Когда элемент имеет высшую степень окисления, добавляется приставка per- и суффикс -ico, для следующей степени окисления добавляется суффикс -ico, для следующей степени окисления добавляется суффикс -oso, а для самой низкой степени окисления добавляется приставка hypo- и суффикс -oso. Например: пермангановый оксид (Mn2O7), когда он имеет степень окисления (7+), мангановый оксид (MnO2), когда он имеет степень окисления (4+), мангановый оксид (Mn2O3), когда он имеет степень окисления (3+) и гипомангановый оксид (MnO), когда он имеет степень окисления (2+).
- Систематический. Правила сохраняются.
 Например: гептаоксид димарганца (Mn2O7), когда он имеет степень окисления (7+), диоксид марганца (MnO2), когда он имеет степень окисления (4+), триоксид димарганца (Mn2O3), когда он имеет степень окисления (3+) и монооксид марганца (MnO), когда он имеет степень окисления (2+).
Например: гептаоксид димарганца (Mn2O7), когда он имеет степень окисления (7+), диоксид марганца (MnO2), когда он имеет степень окисления (4+), триоксид димарганца (Mn2O3), когда он имеет степень окисления (3+) и монооксид марганца (MnO), когда он имеет степень окисления (2+). - STOCK . Состояние окисления металла в этом соединении добавляется в конце названия по мере необходимости, римскими цифрами и в круглых скобках. Например: марганец (VII) оксид (Mn2O7), марганец (IV) оксид (MnO2), марганец (III) оксид (Mn2O3) и марганец (II) оксид (MnO).
Применение оксидов металлов
Оксид свинца используется в производстве стекла и хрусталя.
Оксиды металлов имеют гигантское применение в повседневной жизни, особенно в производстве различных химических веществ. Вот некоторые примеры:
- Оксид магния используется в приготовлении лекарств для желудка, а также в производстве противоядий при отравлениях.
- Оксид цинка , используется в производстве красок , красителей и красящих пигментов.
- Оксид алюминия , используется для сплавов высокой твердости и других промышленных металлов.
- оксид свинца. Используется в производстве стекла.
Важность оксидов металлов
Оксиды металлов чрезвычайно важны для человека и современной промышленности , поскольку они служат добавками во многих повседневных соединениях
Кроме того, они являются сырьем в химических лабораториях для получения оснований и других соединений , поскольку их обилие значительно облегчает их получение и обработку
Примеры оксидов металлов
Дополнительными примерами оксидов металлов являются:
- Оксид натрия (Na2O).
- оксид калия (K2O).
- оксид кальция (CaO).
- оксид меди (CuO).
- оксид железа (FeO).
- оксид свинца (PbO).
- Оксид алюминия (AlO3).
Неметаллические оксиды
Неметаллические оксиды это те, в которых кислород соединен с неметаллическим элементом, и известны как ангидриды .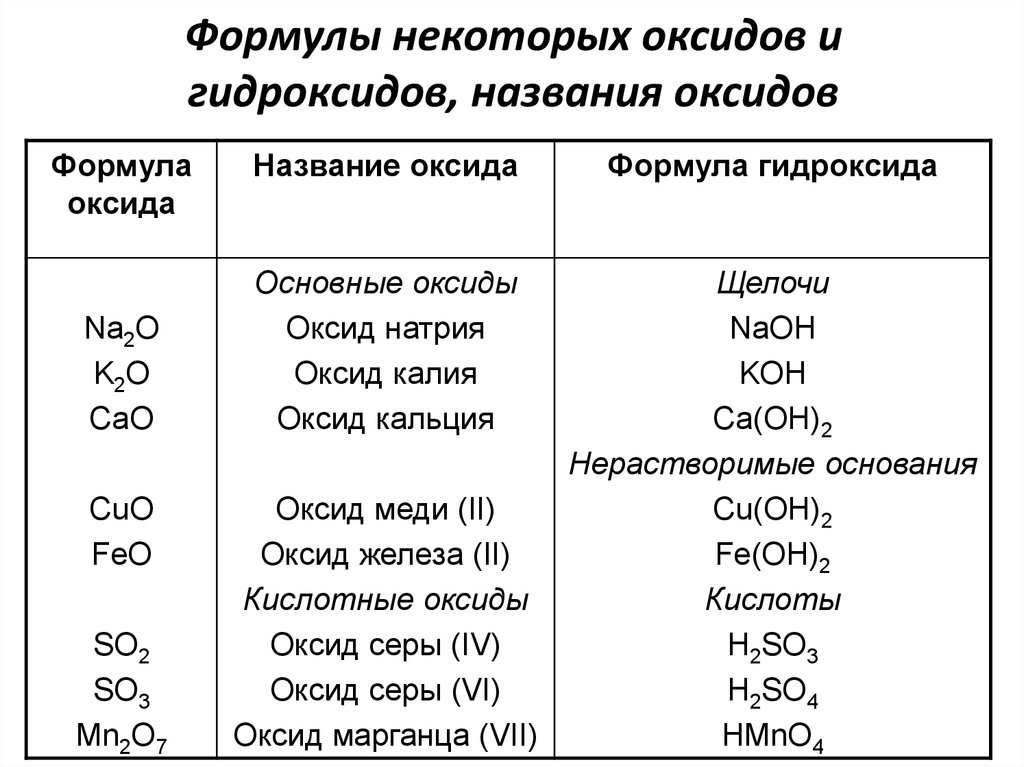 Наиболее распространенным из них является углекислый газ (CO2), который мы выбрасываем в процессе дыхания и который растения потребляют для фотосинтеза
Наиболее распространенным из них является углекислый газ (CO2), который мы выбрасываем в процессе дыхания и который растения потребляют для фотосинтеза
Эти соединения очень важны в биохимии. В отличие от металлических соединений, не являются хорошими проводниками электричества и тепла. При реакции с водой получаются кислоты , также называемые оксакислотами
T3DB: хром (VI) Оксид
| Информация о записи | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Версия | 2,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата создания | 2009-03-06 18:58:01 UTC | 969 2014-12-24 20:21:01 UTC | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Вступление в действие | T3D0065 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификация | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общее название | Хромиум (VI) Оксид | (VI) Oxide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Малая молекула | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Оксид хрома (VI) представляет собой химическое соединение шестивалентного хрома. Используется в основном в гальванике. Шестивалентный хром более токсичен, чем другие степени окисления атома хрома, из-за его большей способности проникать в клетки и более высокого окислительно-восстановительного потенциала. (8) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип соединения |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Structure | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyms |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Formula | CrO 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Average Molecular Mass | 99. 994 g/mol 994 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Monoisotopic Mass | 99.925 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Registry Number | 1333-82- 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Имя IUPAC | Trioxochromium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Традиционное название | Хром -триоксид | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Улыбки | O = [CR] (= O) = O | 9000||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI Identifier | InChI=1S/Cr.3O | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI Key | InChIKey=WGLPBDUCMAPZCE-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Taxonomy | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description | belongs to the class of inorganic compounds known как оксиды переходных металлов. Это неорганические соединения, содержащие атом кислорода со степенью окисления -2, в которых самый тяжелый атом, связанный с кислородом, представляет собой переходный металл. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kingdom | Inorganic compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Super Class | Mixed metal/non-metal compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Class | Transition metal organides | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sub Class | Transition metal oxides | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Direct Parent | Оксиды переходных металлов | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Альтернативные родительские компоненты |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molecular Framework | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| External Descriptors |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological Properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Статус | Обнаружено, но не определено | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Происхождение | Экзогенное | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Расположение клеток | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Места биофлюидов | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Места ткани | Недоступны | ||||||||||||||||||||||||||||||||||||||||||||||||||||
. 0011 Not Available 0011 Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological Roles | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Roles | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical Properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| State | Solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | Dark red-brown solid. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Экспериментальные свойства |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Predicted Properties |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxicity Profile | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Route of Exposure | Oral (7) ; вдох (7) ; кожный (7) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Механизм токсичности | Канцерогенное действие шестивалентного хрома обусловлено его метаболитами, пятивалентным и трехвалентным хромом. Повреждение ДНК может быть вызвано гидроксильными радикалами, образующимися при реокислении пятивалентного хрома присутствующими в клетке молекулами перекиси водорода. Трехвалентный хром также может образовывать комплексы с пептидами, белками и ДНК, что приводит к поперечным связям ДНК-белков, разрывам нитей ДНК, межцепочечным поперечным связям ДНК-ДНК, аддуктам хром-ДНК, хромосомным аберрациям и изменениям в клеточных сигнальных путях. Было показано, что он вызывает канцерогенез за счет чрезмерной стимуляции клеточных регуляторных путей и повышения уровня перекиси путем активации определенных митоген-активируемых протеинкиназ. Он также может вызывать репрессию транскрипции за счет перекрестного связывания комплексов гистондеацетилазы 1-ДНК-метилтрансферазы 1 с хроматином промотора CYP1A1, ингибируя модификацию гистонов. Хром может повышать собственную токсичность, модифицируя фактор транскрипции 1, регулирующий металл, вызывая ингибирование транскрипции металлотионеина, индуцированной цинком. Повреждение ДНК может быть вызвано гидроксильными радикалами, образующимися при реокислении пятивалентного хрома присутствующими в клетке молекулами перекиси водорода. Трехвалентный хром также может образовывать комплексы с пептидами, белками и ДНК, что приводит к поперечным связям ДНК-белков, разрывам нитей ДНК, межцепочечным поперечным связям ДНК-ДНК, аддуктам хром-ДНК, хромосомным аберрациям и изменениям в клеточных сигнальных путях. Было показано, что он вызывает канцерогенез за счет чрезмерной стимуляции клеточных регуляторных путей и повышения уровня перекиси путем активации определенных митоген-активируемых протеинкиназ. Он также может вызывать репрессию транскрипции за счет перекрестного связывания комплексов гистондеацетилазы 1-ДНК-метилтрансферазы 1 с хроматином промотора CYP1A1, ингибируя модификацию гистонов. Хром может повышать собственную токсичность, модифицируя фактор транскрипции 1, регулирующий металл, вызывая ингибирование транскрипции металлотионеина, индуцированной цинком. (1, 7, 2, 3, 4) (1, 7, 2, 3, 4) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метаболизм | Хром всасывается при пероральном, ингаляционном или кожном воздействии и распределяется почти во всех тканях, при этом самые высокие концентрации обнаруживаются в почках и печени. Кость также является основным местом хранения и может способствовать долгосрочному удержанию. Сходство шестивалентного хрома с сульфатом и хроматом позволяет ему транспортироваться в клетки с помощью механизмов транспорта сульфата. Внутри клетки шестивалентный хром восстанавливается сначала до пятивалентного, а затем до трехвалентного хрома многими веществами, включая аскорбат, глутатион и никотинамидадениндинуклеотид. Хром практически полностью выводится с мочой. (1, 7) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Значения токсичности | LD50: 80 мг/кг (перорально, крыса) (6) LD50: 14 мг/кг (внутрибрюшинно, мышь) (6) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Смертельная доза | От 1 до 3 граммов для взрослого человека. (5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Канцерогенность (классификация IARC) | 1, канцероген для человека. (10) (10) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Использование/Источники | Оксид хрома (VI) используется в основном в гальванике. (8) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Минимальный уровень риска | Средний Пероральный: 0,005 мг/кг/день (9) Хроническая пероральная доза: 0,001 мг/кг/день (9) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Воздействие на здоровье | Шестивалентный хром является известным канцерогеном. Хроническое вдыхание особенно связано с раком легких. Также известно, что шестивалентный хром вызывает дефекты репродуктивной функции и развития. (1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Симптомы | Вдыхание шестивалентного хрома может вызвать раздражение слизистой оболочки носа, язвы в носу, насморк и проблемы с дыханием, такие как астма, кашель, одышка или свистящее дыхание. Проглатывание шестивалентного хрома вызывает раздражение и язвы в желудке и тонкой кишке, а также анемию. Контакт с кожей может вызвать кожные язвы. (7) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лечение | Противоядие от отравления хромом неизвестно. Воздействие обычно лечится симптоматическим лечением. (7) (7) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normal Concentrations | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abnormal Concentrations | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| External Links | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | недоступен | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pubchem Compound ID | 14915 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chembl ID | Недоступный | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| CHEMSPIDE Нет в наличии | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| ОМИМ ID | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЧЭБИ ID | 48240 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| BioCyc ID | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| CTD ID | C028801 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stitch ID | Chromium(VI) oxide | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| PDB ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ACToR ID | 8144 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikipedia Link | Chromium триоксид | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылки | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Справочник по синтезу | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| MSDS | T3D0065. pdf pdf | 2 9000 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие ссылки |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Генная регуляция | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гены с положительной регуляцией | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гены с отрицательной регуляцией | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Какое из следующих соединений названо неправильно? (LO 2,23–2 .
 ..
..Недавние каналы
- Общая химия
Химия
- Общая химия
- Chemistry
- Analytitcy
- Chemistry
- .13 Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Бизнес
- Микроэкономика
- Макроэкономика
- Финансовый учет
Общественные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
- 3. Химические реакции
- Называние молекулярных соединений
Задача
Соответствующее решение
2 м
Воспроизвести видео:
Всем было предложено выбрать неправильное название. Начиная с первого, у нас есть MGO. Это оксид магния. Теперь этот будет правильным. Так что это не может быть нашим ответом. Оксид магния является ионным соединением, и когда мы называем ионные соединения, металл сохраняет свое название и пишется первым, а неметалл сохраняет свое основное название, но его окончание изменяется на I.D.E. Именно это мы и видим здесь. Для B у нас есть F E C L два, который, как утверждается, является дихлоридом железа. Теперь это название будет неправильным, и причина этого в том, что мы знаем, что хлор имеет минус один заряд. Таким образом, железо должно иметь заряд плюс два, чтобы получить F E C L два. И, как мы узнали, у переходных металлов будет римская цифра для обозначения их заряда. Так что на самом деле название должно быть двуххлоридным железом. Но давайте продолжим и продолжим рассматривать наши варианты ответов. Таким образом, для C у нас есть гексоксид тетрафосфора, и этот будет правильным, потому что здесь у нас есть два неметалла. И поскольку у нас есть четыре фосфора, мы добавляем этот префикс тетра, а для кислорода, поскольку у нас есть шесть кислорода, мы добавляем префикс гекса и меняем окончание на I. D. Так что это тоже будет правильным, и это соединение ковалина. . Теперь, глядя на наш последний, у нас есть M N. 02, который, как говорят, является марганцем для оксида. И это тоже правильно, марганец — переходный металл. Вот почему у нас есть эта римская цифра четыре, чтобы обозначить ее плюс четыре заряда. И снова у нас окончание I.D. Для нашего нон-метала. И это тоже будет ионное соединение. Итак, наш окончательный ответ здесь будет «Сейчас». Я надеюсь, что это имело смысл, и дайте нам знать, если у вас есть какие-либо вопросы.
Но давайте продолжим и продолжим рассматривать наши варианты ответов. Таким образом, для C у нас есть гексоксид тетрафосфора, и этот будет правильным, потому что здесь у нас есть два неметалла. И поскольку у нас есть четыре фосфора, мы добавляем этот префикс тетра, а для кислорода, поскольку у нас есть шесть кислорода, мы добавляем префикс гекса и меняем окончание на I. D. Так что это тоже будет правильным, и это соединение ковалина. . Теперь, глядя на наш последний, у нас есть M N. 02, который, как говорят, является марганцем для оксида. И это тоже правильно, марганец — переходный металл. Вот почему у нас есть эта римская цифра четыре, чтобы обозначить ее плюс четыре заряда. И снова у нас окончание I.D. Для нашего нон-метала. И это тоже будет ионное соединение. Итак, наш окончательный ответ здесь будет «Сейчас». Я надеюсь, что это имело смысл, и дайте нам знать, если у вас есть какие-либо вопросы.
Связанные видео
Связанная практика
Как назвать ковалентные молекулярные соединения — легкий способ!
от The Organic Chemistry Tutor
140views
Названия ионных и молекулярных соединений | Как пройти химию
от Melissa Maribel
59Views
Урок химии: названия и формулы молекулярных соединений
By Getchemistry
54Views
.

 09.14
09.14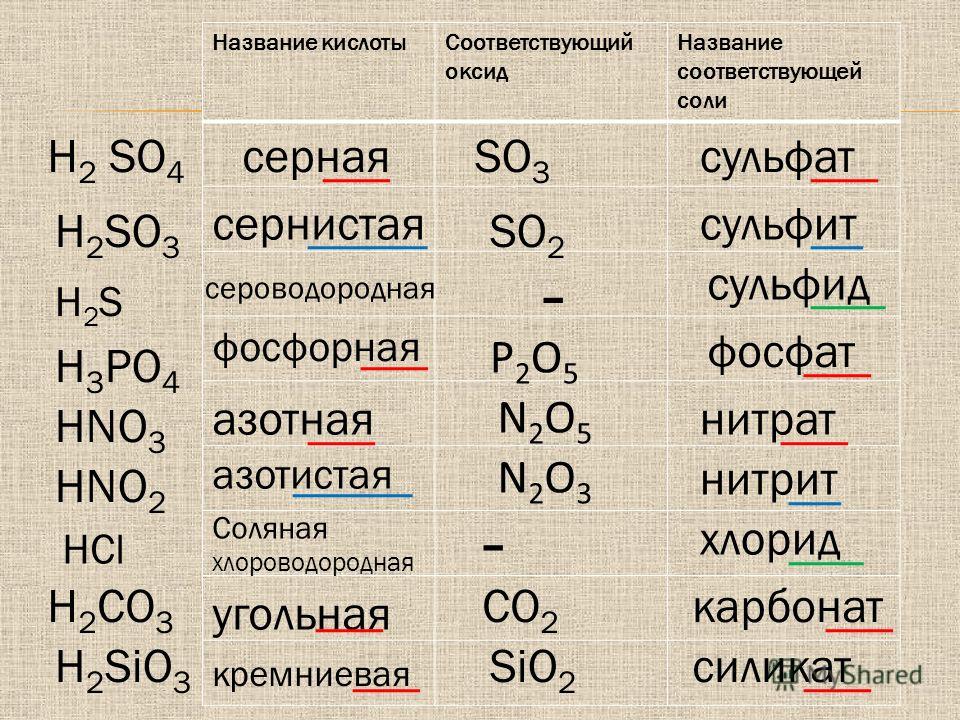 0009 Класс
0009 Класс
 1999;37(2):173-94. [10382554]
1999;37(2):173-94. [10382554]