Карбонат натрия — Википедия
| Карбонат натрия | |
| Общие | |
|---|---|
| Систематическое наименование | Карбонат натрия |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Хим. формула | Na2CO3 |
| Физические свойства | |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Т. плав. | 852 °C |
| Т. кип. | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| PubChem | 10340 |
| Рег. номер EINECS | 207-838-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500 |
| RTECS | VZ4050000 |
| ChEBI | 29377 |
| ChemSpider | 9916 |
| Безопасность | |
| ЛД50 | 4 г/кг (крысы, орально) |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Карбона́т на́трия Na2CO3 (другие названия — кальцинированная сода) — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda),[источник не указан 252 дня] из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать, то есть нагревать до высокой температуры. В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.
Видео по теме
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4+2C→Na2S+2CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- Na2S+CaCO3→Na2CO3+CaS{\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH 4HCO3:
- Nh4+CO2+h3O+NaCl→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3→otNa2CO3+h3O+CO2↑{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2Nh5Cl+Ca(OH)2→CaCl2+2Nh4+2h3O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2426 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100-120 °C моногидрат теряет воду. Плавится при 852 °C, при дальнейшем нагревании разлагается (выше 1000 °C).
Безводный карбонат натрия представляет собой бесцветный порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- CO32−+h3O⇄HCO3−+OH−{\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3+h3SO4→Na2SO4+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство[3].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
Примечания
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
wiki2.red
Натрия карбонат — это… Что такое Натрия карбонат?
- Натрия карбонат
- углекислый натрий, Na2CO3, кальцинированная Сода.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Натрия иодид
- Натрия нитрат
Смотреть что такое «Натрия карбонат» в других словарях:
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
НАТРИЯ КАРБОНАТ — Natrii carbonas. Синонимы: натрий углекислый, сода неочищенная, угленатриевая соль. Свойства. Белый рыхлый порошок, хорошо поглощающий воду, щелочной реакции. Легко растворяется в воде, частично распадается с образованием едкой щелочи и гидрокар … Отечественные ветеринарные препараты
НАТРИЯ КАРБОНАТ — то же, что кальцинированная сода … Большой Энциклопедический словарь
натрия карбонат — то же, что кальцинированная сода. * * * НАТРИЯ КАРБОНАТ НАТРИЯ КАРБОНАТ, то же, что кальцинированная сода (см. СОДА) … Энциклопедический словарь
натрия карбонат — natrio karbonatas statusas T sritis chemija formulė Na₂CO₃ atitikmenys: angl. calcined soda; soda ash; sodium carbonate rus. кальцинированная сода; натрий углекислый; натрия карбонат ryšiai: sinonimas – dinatrio trioksokarbonatas sinonimas –… … Chemijos terminų aiškinamasis žodynas
НАТРИЯ КАРБОНАТ — (кальцинир. сода) Na2CO3, бесцв. кристаллы; до 350 °С существует а модификация (см. табл.), в интервале 350 479 °С b с моноклинной кристаллич. решеткой, а выше 479 °С гексагoн. модификация g ( а =0,5215 нм, с =0,6584 нм, z = 2,… … Химическая энциклопедия
НАТРИЯ КАРБОНАТ — то же, что кальцинированная сода … Естествознание. Энциклопедический словарь
НАТРИЯ КАРБОНАТ — (Natrii carbonas), сода, дезинфицирующее средство. Белый рыхлый кристаллический порошок, хорошо растворим в воде. Применяют 0,1% ный раствор наружно перед противочесоточными обработками, 12% ные растворы для стерилизации инструментов … Ветеринарный энциклопедический словарь
Натриум карбоникум — Natrium carbonicum, Натрия карбонат — Na2CO3 карбонат натрия, в виде бесцветных кристаллов. Хорошо растворяется в воде. Водные растворы имеют щелочную реакцию.Вдыхание пыли карбоната натрия и контакт кожи с кальцинированной содой вызывает у рабочих на производстве разрыхление кожи,… … Справочник по гомеопатии
Карбонат калия — Карбонат калия … Википедия
dal.academic.ru
Натрия карбонат — это… Что такое Натрия карбонат?
- Натрия карбонат
- углекислый натрий, Na2CO3, кальцинированная Сода.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Натрия иодид
- Натрия нитрат
Смотреть что такое «Натрия карбонат» в других словарях:
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
НАТРИЯ КАРБОНАТ — Natrii carbonas. Синонимы: натрий углекислый, сода неочищенная, угленатриевая соль. Свойства. Белый рыхлый порошок, хорошо поглощающий воду, щелочной реакции. Легко растворяется в воде, частично распадается с образованием едкой щелочи и гидрокар … Отечественные ветеринарные препараты
НАТРИЯ КАРБОНАТ — то же, что кальцинированная сода … Большой Энциклопедический словарь
натрия карбонат — то же, что кальцинированная сода. * * * НАТРИЯ КАРБОНАТ НАТРИЯ КАРБОНАТ, то же, что кальцинированная сода (см. СОДА) … Энциклопедический словарь
натрия карбонат — natrio karbonatas statusas T sritis chemija formulė Na₂CO₃ atitikmenys: angl. calcined soda; soda ash; sodium carbonate rus. кальцинированная сода; натрий углекислый; натрия карбонат ryšiai: sinonimas – dinatrio trioksokarbonatas sinonimas –… … Chemijos terminų aiškinamasis žodynas
НАТРИЯ КАРБОНАТ — (кальцинир. сода) Na2CO3, бесцв. кристаллы; до 350 °С существует а модификация (см. табл.), в интервале 350 479 °С b с моноклинной кристаллич. решеткой, а выше 479 °С гексагoн. модификация g ( а =0,5215 нм, с =0,6584 нм, z = 2,… … Химическая энциклопедия
НАТРИЯ КАРБОНАТ — то же, что кальцинированная сода … Естествознание. Энциклопедический словарь
НАТРИЯ КАРБОНАТ — (Natrii carbonas), сода, дезинфицирующее средство. Белый рыхлый кристаллический порошок, хорошо растворим в воде. Применяют 0,1% ный раствор наружно перед противочесоточными обработками, 12% ные растворы для стерилизации инструментов … Ветеринарный энциклопедический словарь
Натриум карбоникум — Natrium carbonicum, Натрия карбонат — Na2CO3 карбонат натрия, в виде бесцветных кристаллов. Хорошо растворяется в воде. Водные растворы имеют щелочную реакцию.Вдыхание пыли карбоната натрия и контакт кожи с кальцинированной содой вызывает у рабочих на производстве разрыхление кожи,… … Справочник по гомеопатии
Карбонат калия — Карбонат калия … Википедия
doc.academic.ru
НАТРИЯ КАРБОНАТ — это… Что такое НАТРИЯ КАРБОНАТ?
- НАТРИЯ КАРБОНАТ
на́трия карбона́т (Natrii carbonas), сода, дезинфицирующее средство. Белый рыхлый кристаллический порошок, хорошо растворим в воде. Применяют 0,1%-ный раствор наружно перед противочесоточными обработками, 12%-ные растворы для стерилизации инструментов кипячением, горячие 3%-ные растворы для дезинфекции кормушек, животноводческих помещений, кормокухонь. Хранят в 46-слойных бумажных мешках, в банках и бочонках.
Ветеринарный энциклопедический словарь. — М.: «Советская Энциклопедия». Главный редактор В.П. Шишков. 1981.
- НАТРИЯ ЙОДИД
- НАТРИЯ НИТРИТ
Смотреть что такое «НАТРИЯ КАРБОНАТ» в других словарях:
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
НАТРИЯ КАРБОНАТ — Natrii carbonas. Синонимы: натрий углекислый, сода неочищенная, угленатриевая соль. Свойства. Белый рыхлый порошок, хорошо поглощающий воду, щелочной реакции. Легко растворяется в воде, частично распадается с образованием едкой щелочи и гидрокар … Отечественные ветеринарные препараты
НАТРИЯ КАРБОНАТ — то же, что кальцинированная сода … Большой Энциклопедический словарь
натрия карбонат — то же, что кальцинированная сода. * * * НАТРИЯ КАРБОНАТ НАТРИЯ КАРБОНАТ, то же, что кальцинированная сода (см. СОДА) … Энциклопедический словарь
натрия карбонат — natrio karbonatas statusas T sritis chemija formulė Na₂CO₃ atitikmenys: angl. calcined soda; soda ash; sodium carbonate rus. кальцинированная сода; натрий углекислый; натрия карбонат ryšiai: sinonimas – dinatrio trioksokarbonatas sinonimas –… … Chemijos terminų aiškinamasis žodynas
НАТРИЯ КАРБОНАТ — (кальцинир. сода) Na2CO3, бесцв. кристаллы; до 350 °С существует а модификация (см. табл.), в интервале 350 479 °С b с моноклинной кристаллич. решеткой, а выше 479 °С гексагoн. модификация g ( а =0,5215 нм, с =0,6584 нм, z = 2,… … Химическая энциклопедия
Натрия карбонат — углекислый натрий, Na2CO3, кальцинированная Сода … Большая советская энциклопедия
НАТРИЯ КАРБОНАТ — то же, что кальцинированная сода … Естествознание. Энциклопедический словарь
Натриум карбоникум — Natrium carbonicum, Натрия карбонат — Na2CO3 карбонат натрия, в виде бесцветных кристаллов. Хорошо растворяется в воде. Водные растворы имеют щелочную реакцию.Вдыхание пыли карбоната натрия и контакт кожи с кальцинированной содой вызывает у рабочих на производстве разрыхление кожи,… … Справочник по гомеопатии
Карбонат калия — Карбонат калия … Википедия
veterinary.academic.ru
натрия карбонат — это… Что такое натрия карбонат?
- натрия карбонат
- на́трия карбона́т
то же, что кальцинированная сода.
* * *
НАТРИЯ КАРБОНАТ НА́ТРИЯ КАРБОНА́Т, то же, что кальцинированная сода (см. СОДА).
Энциклопедический словарь. 2009.
- натрия иодид
- натрия нитрат
Смотреть что такое «натрия карбонат» в других словарях:
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
НАТРИЯ КАРБОНАТ — Natrii carbonas. Синонимы: натрий углекислый, сода неочищенная, угленатриевая соль. Свойства. Белый рыхлый порошок, хорошо поглощающий воду, щелочной реакции. Легко растворяется в воде, частично распадается с образованием едкой щелочи и гидрокар … Отечественные ветеринарные препараты
НАТРИЯ КАРБОНАТ — то же, что кальцинированная сода … Большой Энциклопедический словарь
натрия карбонат — natrio karbonatas statusas T sritis chemija formulė Na₂CO₃ atitikmenys: angl. calcined soda; soda ash; sodium carbonate rus. кальцинированная сода; натрий углекислый; натрия карбонат ryšiai: sinonimas – dinatrio trioksokarbonatas sinonimas –… … Chemijos terminų aiškinamasis žodynas
НАТРИЯ КАРБОНАТ — (кальцинир. сода) Na2CO3, бесцв. кристаллы; до 350 °С существует а модификация (см. табл.), в интервале 350 479 °С b с моноклинной кристаллич. решеткой, а выше 479 °С гексагoн. модификация g ( а =0,5215 нм, с =0,6584 нм, z = 2,… … Химическая энциклопедия
Натрия карбонат — углекислый натрий, Na2CO3, кальцинированная Сода … Большая советская энциклопедия
НАТРИЯ КАРБОНАТ — то же, что кальцинированная сода … Естествознание. Энциклопедический словарь
НАТРИЯ КАРБОНАТ — (Natrii carbonas), сода, дезинфицирующее средство. Белый рыхлый кристаллический порошок, хорошо растворим в воде. Применяют 0,1% ный раствор наружно перед противочесоточными обработками, 12% ные растворы для стерилизации инструментов … Ветеринарный энциклопедический словарь
Натриум карбоникум — Natrium carbonicum, Натрия карбонат — Na2CO3 карбонат натрия, в виде бесцветных кристаллов. Хорошо растворяется в воде. Водные растворы имеют щелочную реакцию.Вдыхание пыли карбоната натрия и контакт кожи с кальцинированной содой вызывает у рабочих на производстве разрыхление кожи,… … Справочник по гомеопатии
Карбонат калия — Карбонат калия … Википедия
dic.academic.ru
Бикарбонат натрия — это… Что такое Бикарбонат натрия?
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета.
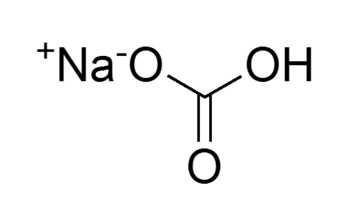
Химическая формула
Безопасность
Двууглекилый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей.[1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.[1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
- NaHCO3 + HCl → NaCl + H2CO3
- H2CO3 → H2O + CO2↑
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Термическое разложение
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
- 2NaHCO3 → Na2CO3 + H2O + CO2↑
При дальнейшем нагревании до 1000 °C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
- Na2CO3 → Na2O + CO2
Применение

Гидрокарбонат натрия
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Применение:
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
Кулинария
Основное применение питьевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смести с карбонатом аммония), например, в бисквитном и песочном тесте.
Медицина
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В РФ производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия».[2]
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
Примечания
- ↑ 1 2 ГОСТ 2156-76 «Натрий двууглекислый. Технические условия».[1]
Ссылки
Wikimedia Foundation. 2010.
biograf.academic.ru
Гидрокарбонат натрия — это… Что такое Гидрокарбонат натрия?
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода (пищевая добавка E-500), пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета. Используется в пищевой промышленности, в кулинарии, в медицине как нейтрализатор ожогов кожи человека кислотами и снижения кислотности желудочного сока. Также — в буферных растворах, так как в широком диапазоне концентраций растворов его pH незначительно изменяется.
Безопасность
Двууглекислый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок солоноватого (мыльного) вкуса, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей.[1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.[1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
В быту чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
Термическое разложение
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
При дальнейшем нагревании до 1000 °C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Применение
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Применение:
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
Кулинария
Основное применение пищевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, вместе с карбонатом аммония) и в готовых смесях для выпечки (кексы, торты и пр.). При применении в чистом виде важно соблюсти правильную дозировку, так как оставляет в продукте не безвкусный карбонат натрия.
Медицина
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, лечения больных почечной недостаточностью[2][3], а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В Российской Федерации производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» на предприятии «Сода» (г. Стерлитамак, Республика Башкортостан).
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
Примечания
Плазмозамещающие и перфузионные растворы — АТХ код: B05
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
dal.academic.ru
