Натрий взаимодействует со следующей парой веществ медь, гидроксид калия соляная кислота, кальций хлорид натрия, серная кислота серная кислота, вода Только подробно
по химии делаем экзаменационные задачи
Экзаменационные задачи.
1. Определите какой объем занимают (при н. у.): а) 8,8 г оксида углерода (IV) CO2; б) 2г гелия?
2. Решите задачу. Чему равна молярная масса газа, молярная масса газа, плотность которого 1,34 г/л?
3. Решите задачу. Чему равна масса 1 л озона О3, измеренного при н. у.?
4. Вычислите массу воды, подвергшуюся разложению, если при разложении воды получается 4 г кислорода.
5. Рассчитайте какой объем водорода требуется для получения 15 м3 фтороводорода HF.
6. Изобразите распределение электронов в атоме ванадия (элемент №23) по квантовым ячейкам.
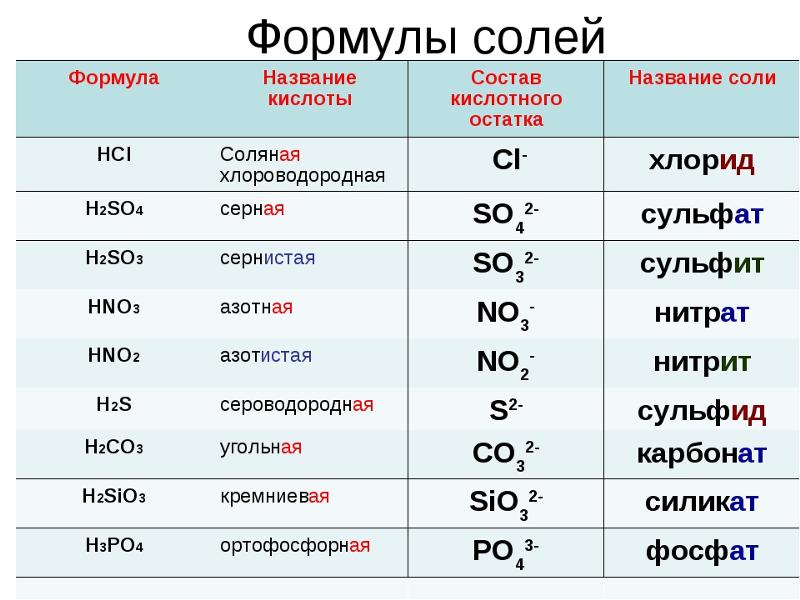
7. Составьте формулы кислородных и водородных соединений элементов IV группы? Укажите их степени окисления.
8. Составьте уравнение ядерной реакции, протекающей при бомбардировке ядер урана U92238 нейтронами, зная что при этом излучаются β частицы.
9. Изобразите химическую связь в молекуле водорода, хлора.
10. Вычислите молярность 28% -ного раствора HNO3 (пл. 1,167 г/см3).
11. Вычислите чему равна процентная концентрация полученного раствора, при смешении 2 л 10%-ного раствора KOH (пл. 1,09 г/см3) и 1 л 20 % — ного раствора KOH (пл. 1,19 г/см3).
12. Составьте уравнения диссоциации молекул следующих веществ: Sr(OH)2, CuSO4.
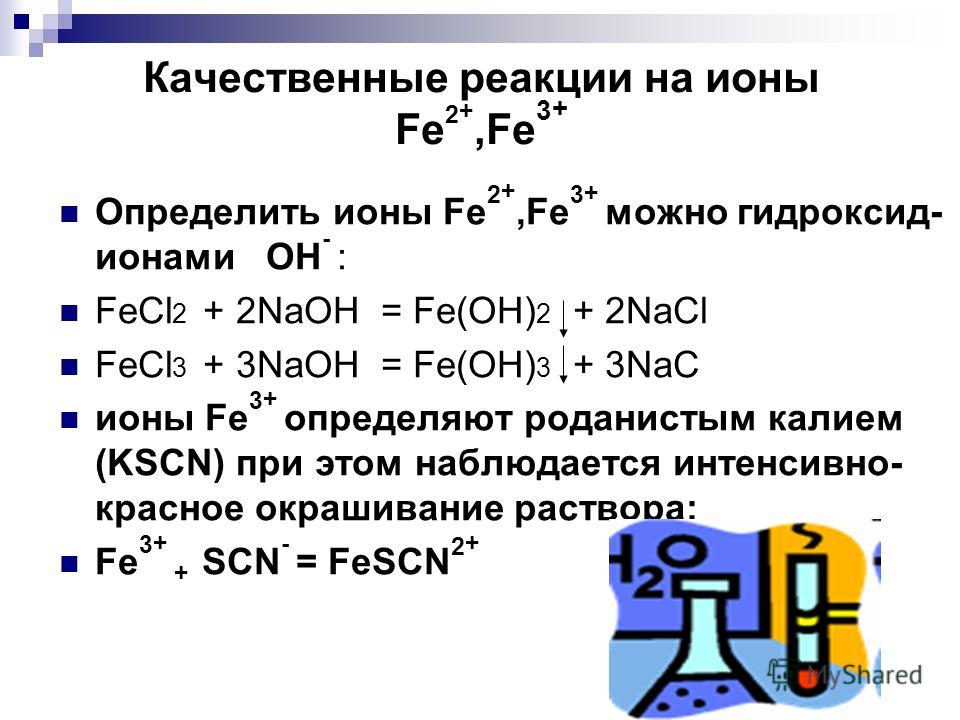
13. Составьте молекулярное и ионное уравнения реакции между хлоридом железа (III) и гидроксидом калия.
14. Объясните, почему индикатор лакмус окрашивается в красный цвет в растворе хлорида алюминия AlCl3.
15. Вычислите рН и рОН 0,01 М раствора иодоводородной кислоты HI. Как изменится концентрация ионов Н+ и ОН- при разбавлении раствора в 1000 раз?
16. Изобразите схему гальванической цепи для определения стандартного электродного потенциала алюминия.
17. Составьте уравнения реакций , которые протекают при коррозии цинка в атмосферных условиях.
18. Объясните, как происходит электролиз водного раствора K2 SO4 c инертным анодом.
Объясните, как происходит электролиз водного раствора K2 SO4 c инертным анодом.
19. Составьте схему электролиза раствора CuCl2 с медным анодом.
20. Вычислите жесткость воды, для устранения которой к 50 л воды добавили 5,1 г КОН.
21. Составьте формулы изомеров С5 Н12.
22. Решите задачу. Сколько кубических метров воздуха, содержащего 20% кислорода, требуется для сгорания 1 м3 природного газа состава: 90% метана, 5% этан, 3% водорода, 2% азота?
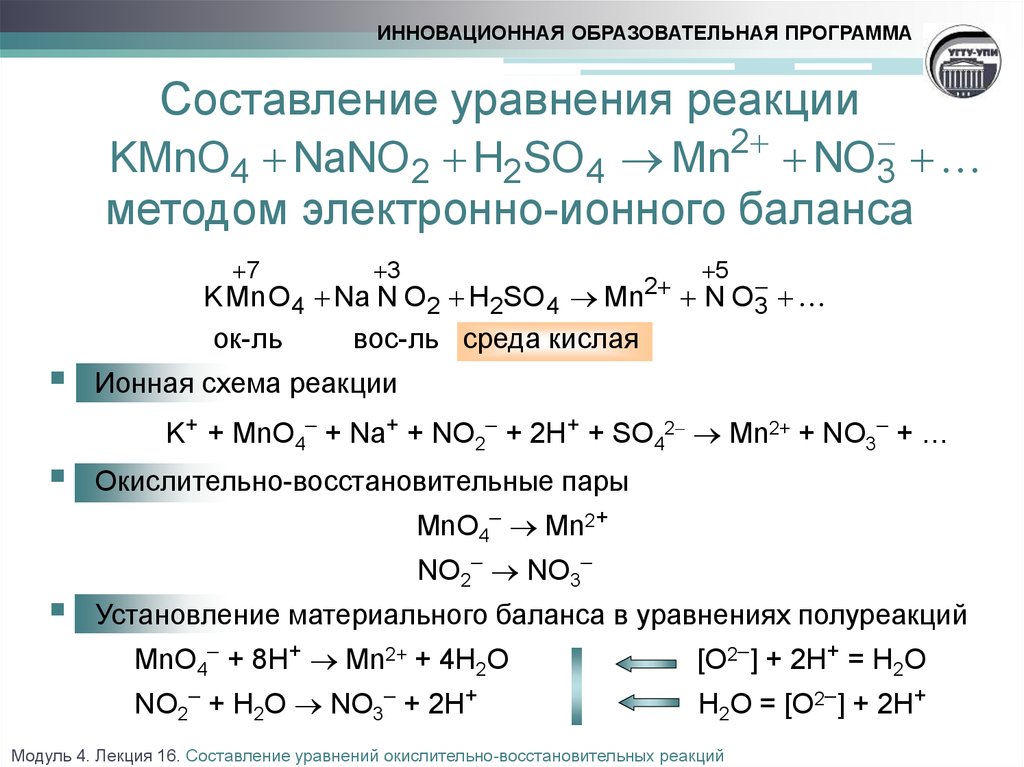
23. Составьте уравнение окислительно-восстановительной реакции дихромата калия K2Cr2O7 с раствором соляной кислоты. Укажите элемент-окислитель и элемент- восстановитель.
24. Решите задачу. Смесь металлов натрия и кальция массой 6,3 г растворили в воде, при этом выделился газ объемом 3,36 л (н.у.). Сколько граммов каждого из металлов содержалось в смеси?
25. Изобразите строение ароматического углеводорода молекулярной формулой С8 Н10? Назовите возможные изомеры по систематической номенклатуре и по правилам ИЮПАК.
26. Рассчитайте состав исходной смеси спиртов, если известно, что в смесь этанола и пропанола массой 16,6 г поместили избыток натрия, при этом выделился водород (н.у.) объемом 3,36 л.
27. Определите массу технического карбида кальция с массовой долей СаС2 87%, необходимую для получения «ледяной» уксусной кислоты массой 1 т привыходе продукта 100%.
28. Составьте уравнения процесса получения метилформиата из метанола.
29. Решите задачу. В трех склянках находятся растворы глицерина, ацетальдегида, глюкозы. Определите содержимое каждой склянки. Составьте наиболее рациональный план проведения анализа и напишите уравнения реакций.
30. Напишите структурные формулы изомерных аминокислот, соответствующих составу С4 Н9 О2 N. Назовите их по рациональной и международной номенклатуре.
Проверочная работа «Сера и её соединения»
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 1
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Задания с выбором одного правильного ответа (10 баллов)
Для серы характерна степень окисления:
1. -2 2. -3 3. -4 4. +7
Сера – более сильный окислитель, чем
1. Фтор 2. Хлор 3. Фосфор 4. Кислород
Степени окисления серы изменяются в последовательности +6, -2, 0 в группе веществ
1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
Схема превращения S+6 → S+4 соответствует уравнению реакции
1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3
2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O
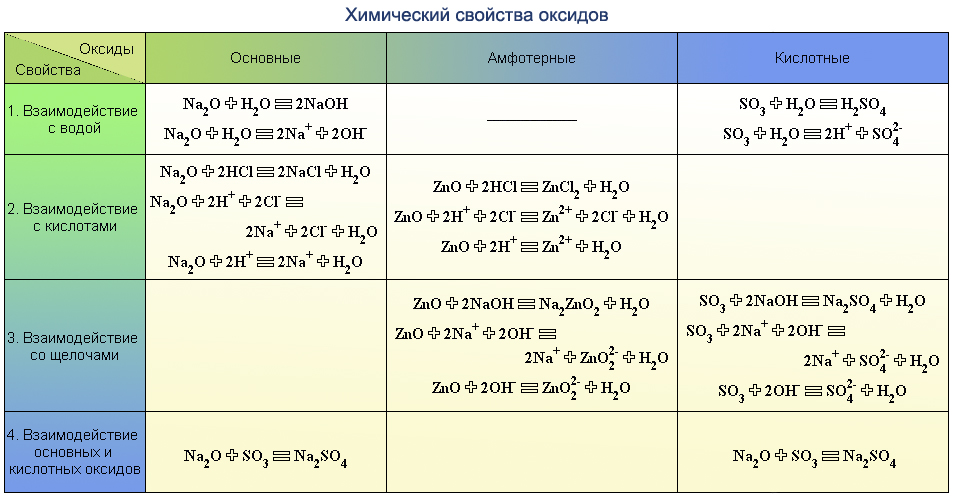
Раствор серной кислоты может взаимодействовать со всеми веществами группы
1. MgO, CO2, NaCl, Fe(OH)3 3. NaOH, ZnO, Cu, Na2CO3
2. CuO, Fe, HNO3, NaOH Mg(OH)2, 4. BaCl2, FeO, Zn, KOH
И сернистый газ, и оксид серы (VI) будут реагировать со следующей парой веществ
1. Н2О и СО2 2. NaOH и CaO 3. h3O и Cl2 4. h3S и О2
Н2О и СО2 2. NaOH и CaO 3. h3O и Cl2 4. h3S и О2
Для осуществления превращения H2S→SO2→SO3→ K2SO4 нужно последовательно использовать
1. Воду, кислород, оксид калия 3. Кислород, воду, калий
2. Кислород, кислород, гидроксид калия 4. Воду, кислород, карбонат калия
Качественную реакцию на сульфат-анион можно представить сокращённым ионным уравнением
1. 2H+ + SO42- → h3SO4 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. S2- + 2H+ → h3S
Газ с запахом тухлых яиц, образующий при растворении в воде слабую кислоту, называется
1. Сернистый 2. Угарный 3. Сероводород 4. Хлор
Верны ли следующие утверждения о свойствах серы и её соединений?
А. Самой устойчивой аллотропной модификацией серы является ромбическая.
Б. Чтобы приготовить раствор серной кислоты, нужно в концентрированную кислоту вливать воду.
1. Верно А 2. Верно Б 3. Оба суждения верны 4. Оба суждения неверны
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду S – Se – Te
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции |
1 | h3S + O2 (избыток) → | 1 | не взаимодействует |
2 | Ag + h3SO4 (разб) → | 2 | h3O + S |
3 | SO2 + NaOН(избыток) → | 3 | NaHSO3 |
4 | Fe + S → | 4 | Na2SO3 + h3O |
| 5 | Ag2SO4 + h3↑ | |
6 | Fe2S3 | ||
7 | h3O + SO2↑ | ||
8 | FeS | ||
Часть С Задания со свободным ответом (10 баллов)
(4 балла) Через 240 г 10% раствора гидроксида натрия пропускают сернистый газ объёмом 5,6 л. Определить массу полученной соли. (Ответ: 31,5 г.)
Определить массу полученной соли. (Ответ: 31,5 г.)
( 5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
S → h3S → Na2S → PbS Для последней реакции составьте уравнение в сокращённой ионной форме, укажите цвет образовавшегося осадка.
(3 балла) Для реакции h3SO4(конц.) + Zn → …. + h3S + h3O определить коэффициенты методом
электронного баланса, указать окислитель и восстановитель.
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 2
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Для серы нехарактерна степень окисления:
1. -2 2. -4 3. +4 4. +6
Сера является восстановителем в реакции с:
1. Фтором 2. Железом 3. Натрием 4. Водородом
Степени окисления серы изменяются в последовательности +6, +4, -2 в группе веществ
1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
Схема превращения S+6 → S-2 соответствует уравнению реакции
1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3S + h3O
2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O
Раствор серной кислоты может взаимодействовать со всеми веществами группы
1. MgO, SO2, NaCl, Fe(OH)3 3. Fe(OH)3, CaO, Zn, K2SO3
2. CuO, Ag, HNO2, NaOH 4. Ba(OH)2, NaCl, FeO, Zn
И сернистый газ, и серная кислота будут реагировать со следующей парой веществ
1. Н2О и СО2 2. КOH и MgO 3. h3O и SO3 4. Na2S и О2
Для осуществления превращения S→SO2→SO3→ BaSO4 нужно последовательно использовать
1. Воду, кислород, оксид бария 3. Кислород, кислород, гидроксид бария
2. Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария
Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария
Качественную реакцию на сульфит-анион можно представить сокращённым ионным уравнением
1. Pb2+ + S2-→PbS 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. 2H+ + SO32- → SO2 + h3O
Газ с запахом горящих спичек, образующий при растворении в воде слабую кислоту, называется
1. Сернистый 2. Угарный 3. Сероводород 4. Фтор
Верны ли следующие утверждения о свойствах серы и её соединений?
А. Пластическую серу можно получить при нагревании и последующем охлаждении ромбической серы.
Б. Раствор сернистого газа в концентрированной серной кислоте называется «олеум».
1. Верно А 2. Верно Б 3. Оба суждения верны 4. Оба суждения неверны
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду Р – S – Cl
В ряду Р – S – Cl
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции |
1 | h3S + O2 (недостаток) → | 1 | не взаимодействует |
2 | Au + h3SO4 (разб) → | 2 | h3O + S |
3 | SO3 + NaOН(избыток) → | 3 | NaHSO4 |
4 | Fe + h3SO4 (разб) → | 4 | Na2SO4 + h3O |
| 5 | Au2SO4 + h3↑ | |
6 | Fe2(SO4)3 + h3↑ | ||
7 | h3O + SO2↑ | ||
8 | FeSO4 + h3↑ | ||
Часть С Задания со свободным ответом (10 баллов)
13. (4 балла) Через 1120 г 5% раствора гидроксида калия пропускают серный ангидрид объёмом 4,48 л. Определить массу полученной соли. (Ответ: 34,8 г.)
(4 балла) Через 1120 г 5% раствора гидроксида калия пропускают серный ангидрид объёмом 4,48 л. Определить массу полученной соли. (Ответ: 34,8 г.)
14. (5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
SО2 → SО3 → h3SО4 → ВаSО4 Для последней реакции составьте уравнение в сокращённой ионной форме, укажите цвет образовавшегося осадка.
15. (3 балла) Для реакции Mg + h3SO4 → …. + S + h3O определить коэффициенты методом электронного баланса, указать окислитель и восстановитель.
Ответы к проверочной работе по теме «Сера и её соединения» 9 класс
№ п/п | Вариант 1 | Балл | № п/п | Вариант 2 | Балл |
1 | 1 | 1 | 1 | 2 | 1 |
2 | 3 | 1 | 2 | 1 | 1 |
3 | 3 | 1 | 3 | 2 | 1 |
4 | 4 | 1 | 4 | 3 | 1 |
5 | 4 | 1 | 5 | 3 | 1 |
6 | 2 | 1 | 6 | 2 | 1 |
7 | 2 | 1 | 7 | 3 | 1 |
8 | 3 | 1 | 8 | 4 | 1 |
9 | 3 | 1 | 9 | 1 | 1 |
10 | 1 | 1 | 10 | 1 | 1 |
11 | 23 | 2 | 11 | 14 | 2 |
12 | 7148 | 2 | 12 | 2148 | 2 |
13 |
| 4 | 13 |
| 4 |
14 |
| 5 | 14 |
| 5 |
15 |
| 3 | 15 |
| 3 |
Критерий: 0-9 = 2, 10-16 =3, 17-23 = 4, 24-26 = 5
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 3
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Задания с выбором одного правильного ответа (10 баллов)
1. Распределение электронов по энергетическим уровням в атоме серы:
1) 2, 6 2) 2, 8, 8 3) 2, 8, 6 4) 2, 8, 8, 6
2. Сера — более сильный окислитель, чем:
1) фтор 2)хлор 3) фосфор 4) кислород
3. Степени окисления серы изменяются с +6 до 0 в группе веществ:
1)S, SO2, SO3 2) h3SO4, SO2, h3S 3) Na2SO4, K2S, S 4) SO2, K2SO3, S
4. Раствор серной кислоты может взаимодействовать со всеми веществами из группы:
1) MgO, CO2, NaCl, Fe(OH)3 3) NaOH, ZnO, Cu, Na2CO3
2) CuO, Fe, HNO3, NaOH 4) Mg(OH)2, BaCl2, FeO, Zn
5. Схеме превращения S+6 → S+4 соответствует уравнению реакции:
1) SO3 + h3O = h3SO4 3) h3SO4 + Zn = ZnSO4 + h3
2) 2SO2 + O2 = 2SO3 4) Cu +2h3SO4 = CuSO4 + SO2 + 2h3O
6. И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ:
И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ:
1) h3O , CO2 2) NaOH, CaO 3) h3O, Cl2 4) h3S, O2
7. Для осуществления превращения H2S → SO2 → SO3→ K2SO4 нужно последовательно использовать:
1) воду, кислород, оксид калия 3) кислород, воду, калий
2) кислород, кислород. гидроксид калия 4) воду, кислород, карбонат калия
8. В реакции, уравнение которой H2SO3 + Br2 + H2O= H2SO4 + HBr , сера
1) является восстановителем 3) является окислителем
2) понижает степень окисления 4) не изменяет степень окисления
9. Разбавленная серная кислота не будет взаимодействовать с каждым веществом из следующей пары веществ:
Разбавленная серная кислота не будет взаимодействовать с каждым веществом из следующей пары веществ:
1) CuO, HCl 2) Cu, NaCl 3) Zn, NaOH 4) CuSO4, MgO
10. Верны ли следующие утверждения о свойствах серы и её соединений?
А. Чтобы приготовить раствор серной кислоты, нужно в концентрированную кислоту вливать воду.
Б. Раствор серного ангидрида в концентрированной серной кислоте называется «олеум».
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду S – Se – Te
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции | ||
1 | h3S + O2 (избыток) → | 1 | не взаимодействует | ||
2 | Ag + h3SO4 (разб) → | 2 | h3O + S | ||
3 | SO2 + NaOН(избыток) → | 3 | NaHSO3 | ||
4 | Fe + S → | 4 | Na2SO3 + h3O | ||
| 5 | Ag2SO4 + h3↑ | |||
6 | Fe2S3 | ||||
7 | h3O + SO2↑ | ||||
8 | FeS | ||||
Часть С Задания со свободным ответом (10 баллов)
(4 балла) Через 120 г 20% раствора гидроксида натрия пропускают сернистый газ объёмом 2,24 л. Определить массу полученной соли.
Определить массу полученной соли.
( 5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
S → h3S → Na2S → PbS Для последней реакции составьте уравнение в полной и сокращённой ионной форме, укажите цвет образовавшегося осадка.
(3 балла) Для реакции h3SO4 + Zn …. + h3S + h3O определить коэффициенты методом
электронного баланса, указать окислитель и восстановитель.
Ответы к диагностике по сере
3 вариант
1 | 3 | 1 |
2 | 3 | 1 |
3 | 3 | 1 |
4 | 4 | 1 |
5 | 4 | 1 |
6 | 2 | 1 |
7 | 2 | 1 |
8 | 1 | 1 |
9 | 3 | 1 |
10 | Б | 1 |
11 | 23 | 2 |
12 | 7148 | 2 |
13 |
| 4 |
14 |
| 5 |
15 |
| 3 |
Использование растворения для идентификации неизвестного | Глава 5: Молекула воды и растворение
- Скачать
- Электронная почта
- Распечатать
- Добавить в закладки или поделиться
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Спасибо!
Урок 5.5
Ключевые понятия
- Различные вещества состоят из разных атомов, ионов или молекул, которые по-разному взаимодействуют с водой.
- Поскольку растворение зависит от взаимодействия между водой и растворяемым веществом, каждое вещество имеет характерную растворимость.
Резюме
Ученики проведут тест на растворимость соли и сахара. Затем им будут представлены четыре известных кристалла и неизвестный. Основываясь на демонстрации растворимости, класс разработает тест на растворимость, чтобы определить личность неизвестного.
Цель
Учащиеся смогут определять и контролировать переменные при разработке теста на растворимость. Учащиеся смогут объяснить, почему разные вещества в разной степени растворяются в воде.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки.
Материалы для демонстраций
- Весы по граммам
- Простые весы
- Градуированный цилиндр
- Вода
- 4 прозрачных пластиковых стаканчика
- Соль
- Сахар
- Зерновые шарики (хорошо работает Kix)
- Пластиковый пакет с застежкой-молнией (размером в четверть, подходит для хранения)
Материалы для каждой группы
- Соль (хлорид натрия)
- Соль Эпсома (сульфат магния)
- MSG (глутамат натрия)
- Сахар (сахароза)
- Соль кошерная крупная (хлорид натрия)
- Вода
- Черная плотная бумага
- Малярная лента
- Ручка или перманентный маркер
- Лупа
- Баланс в граммах
- 5 маленьких пластиковых стаканчиков
- 5 прозрачных пластиковых стаканчиков
- Градуированный цилиндр
- Бумажные полотенца
Об этом уроке
Этот урок займет два или три урока.
Проведите демонстрацию, чтобы показать, что разные вещества имеют разную растворимость.
Скажите учащимся, что на этой демонстрации вы будете сыпать соль и сахар в воду, чтобы выяснить, что растворяется лучше. Чтобы сделать этот тест честным, вы будете использовать одинаковое количество (массу) соли и сахара, одинаковое количество воды при одинаковой температуре и будете вращать их одинаковым образом в течение одинакового промежутка времени.
Вопрос для изучения
Что лучше растворяется в воде, соль или сахар?
Материалы для демонстрации
- Весы в граммах
- Градуированный цилиндр
- Вода
- 2 прозрачных пластиковых стаканчика
- 2 маленьких пластиковых стаканчика
- Соль
- Сахар
Подготовка учителей
- Этикетка 1 прозрачная пластиковая чашка и 1 маленькая чашка Соль.
- Пометьте другую прозрачную пластиковую чашку и еще одну маленькую чашку сахаром.

- Отмерьте 5 граммов соли и 5 граммов сахара и поместите их в пару маленьких маркированных чашек.
- Налейте 5 мл воды комнатной температуры в пару больших пустых чашек.
Процедура
- Одновременно всыпать соль и сахар в воду в соответствующие чашки. Вращайте каждую чашку одновременно и одинаково в течение примерно 20 секунд.
- Пройдитесь по комнате и покажите ученикам, сколько соли и сахара осталось на дне каждой чашки. Если у вас есть проектор, поставьте чашки на проектор, чтобы весь класс мог сравнить, что осталось нерастворенным в каждой чашке. Спросите учащихся, растворяется ли одно вещество лучше, чем другое.
- Снова вращайте в течение 20 секунд и наблюдайте. Затем вращайтесь еще 20 секунд, и пусть ученики сделают свои последние наблюдения.
- Медленно и осторожно перелейте раствор из каждой чашки обратно в пустую помеченную чашку. Старайтесь не допускать попадания в эти чашки нерастворившихся кристаллов.
 Покажите учащимся чашки, чтобы они могли сравнить количество оставшихся нерастворенных кристаллов.
Покажите учащимся чашки, чтобы они могли сравнить количество оставшихся нерастворенных кристаллов.
Ожидаемые результаты
Сахара растворится гораздо больше, чем соли. В чашках останется больше нерастворенной соли, чем сахара.
Примечание. Растворимость обычно измеряется количеством граммов вещества, которое растворяется в определенном объеме воды при данной температуре. В предыдущей демонстрации используется этот традиционный способ измерения растворимости. Другой подход может заключаться в сравнении количества молекул или ионов каждого вещества, растворяющегося в воде. Для этого потребуется способ «подсчета» молекул или ионов в каждом веществе.
Обсудите результаты демонстрации и введите идею о том, что каждое вещество имеет свою характерную растворимость.
Спросите студентов:
- На дне чашки осталось больше соли или сахара?
- На дне чашки осталось еще не растворившейся соли.
- Что растворяется лучше, соль или сахар?
- Поскольку на дне чашки было мало или совсем не было сахара, большая его часть должна была раствориться в воде.

- Как вы думаете, мы получили бы такие же результаты, если бы снова попытались растворить соль и сахар?
- Мы, вероятно, получили бы похожие результаты, потому что количество растворяющейся соли или сахара как-то связано с тем, как каждое вещество взаимодействует с водой.
- То, насколько хорошо вещество растворяется в воде, называется его растворимостью. Можно ли ожидать, что разные вещества будут иметь одинаковую или разную растворимость?
- Каждое вещество состоит из молекул своего типа, которые по-разному взаимодействуют с водой. Разные вещества должны иметь разную растворимость.
Скажите учащимся, что они будут сравнивать растворимость четырех различных бытовых кристаллов — соли (хлорид натрия), английской соли (сульфат магния), глутамата натрия (глутамат натрия) и сахара (сахароза). Объясните, что они также будут тестировать неизвестный кристалл, химически такой же, как один из других кристаллов. Поскольку он химически одинаков, он должен иметь такую же растворимость, как и один из кристаллов, которые они будут тестировать.
К концу занятия учащиеся должны уметь идентифицировать неизвестное.
Дайте каждому учащемуся лист с заданиями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Предложите учащимся определить неизвестное по внешнему виду.
Сообщите учащимся, что перед выполнением теста на растворимость они внимательно рассмотрят кристаллы, чтобы увидеть, смогут ли они получить некоторые подсказки о личности неизвестного только по внешнему виду. Предложите учащимся выполнить приведенную ниже процедуру и записать свои наблюдения о кристаллах в листе с заданиями. Сообщите учащимся, что они могут смотреть на кристаллы и прикасаться к ним, но не должны пробовать их на вкус.

Вопрос для изучения
Сможете ли вы опознать неизвестный кристалл по внешнему виду?
Материалы для каждой группы
- Черная плотная бумага
- Малярная лента
- Ручка или перманентный маркер
- 5 маленьких пластиковых стаканчиков
- Соль
- Английская соль
- глутамат натрия
- Сахар
- Неизвестно (Грубая кошерная соль)
- Лупа
Подготовка учителей
- Пометьте 5 маленьких пластиковых стаканчиков солью, английской солью, глутаматом натрия, сахаром и неизвестным.
- Добавьте не менее двух чайных ложек каждого кристалла в чашку с маркировкой.
Процедура
- Используйте клейкую ленту и ручку, чтобы пометить четыре угла листа черной плотной бумаги: сахар, соль, английская соль и глутамат натрия. Обозначьте центр Неизвестно.
- Поместите небольшие образцы английской соли, поваренной соли, сахара, глутамата натрия и неизвестного вещества на отмеченные участки плотной бумаги.

Используйте лупу, чтобы внимательно рассмотреть каждый тип кристалла.
Ожидаемые результаты
Все кристаллы белые, но некоторые из них более прозрачны или непрозрачны, чем другие. Каждый тип кристалла также отличается размером и формой.
Обсудите наблюдения учащихся и попросите группы спланировать, как они могут провести тест на растворимость, чтобы идентифицировать неизвестное.
Спросите студентов:
- Что вы заметили в каждом кристалле? Включите любые сходства или различия, которые вы заметили среди них.
- Учащиеся должны описать физические свойства, такие как размер, форма, цвет и текстура. Они также должны описать, являются ли кристаллы блестящими, тусклыми, прозрачными или непрозрачными.
- Можете ли вы определить неизвестное еще?
- На данный момент у учащихся не должно быть достаточно доказательств, чтобы правильно идентифицировать неизвестное. Пока не говорите ученикам, что неизвестное — это грубая кошерная соль.
 Они обнаружат это к концу этого урока.
Они обнаружат это к концу этого урока.
Объясните, что одного взгляда на кристаллы недостаточно, чтобы определить неизвестное. Но тест на растворимость даст полезную информацию, если он хорошо контролирует переменные. Попросите учащихся подумать о том, как они могут провести тест на растворимость соли, соли Эпсома, глутамата натрия, сахара и неизвестного вещества. Пусть учащиеся поработают в группах, чтобы обсудить свои идеи и записать простой план в свой рабочий лист.
Попросите группы студентов поделиться своими идеями относительно теста на растворимость и рассмотреть, как каждый план контролирует переменные.
По мере того, как каждая группа представляет свои планы, попросите класс определить, как каждый тест на растворимость контролирует переменные. Все группы, скорее всего, предложат использовать одинаковый объем воды при одинаковой температуре в одинаковых контейнерах и одинаковое количество каждого кристалла. Но могут быть некоторые разногласия в том, как измерить одинаковое количество каждого кристалла.
 Некоторые учащиеся могут предложить использовать одинаковый объем каждого кристалла, в то время как другие могут предложить одинаковую массу каждого кристалла. Если никто не предлагает использовать массу, объясните, что в демонстрации вы использовали одинаковую массу соли и сахара — по 5 г каждого.
Некоторые учащиеся могут предложить использовать одинаковый объем каждого кристалла, в то время как другие могут предложить одинаковую массу каждого кристалла. Если никто не предлагает использовать массу, объясните, что в демонстрации вы использовали одинаковую массу соли и сахара — по 5 г каждого.Спросите студентов:
- Лучше использовать одинаковый объем (например, чайную ложку или 5 мл) или одинаковую массу (например, 5 г) каждого кристалла? Почему?
- Скажите учащимся, что вы проведете демонстрацию, которая поможет им понять, следует ли им использовать меру объема или массы, чтобы они могли растворить одинаковое количество каждого кристалла в воде.
Проведите демонстрацию, чтобы показать, что масса лучше, чем объем при измерении равных количеств для теста на растворимость.
Вопрос для изучения
Лучше ли измерять один и тот же объем или одинаковую массу каждого кристалла при проведении теста на растворимость для идентификации неизвестного?
Материалы для демонстрации
- 2 прозрачных пластиковых стаканчика
- Зерновые шарики (хорошо работает Kix)
- Пластиковый пакет с застежкой-молнией (размером в четверть)
- Баланс
Подготовка учителя
Полностью наполните два прозрачных пластиковых стаканчика овсяными хлопьями.
 Обе чашки должны быть одинаковыми и содержать одинаковое количество овсяных хлопьев. Проверьте эти чашки на весах, чтобы убедиться, что они имеют одинаковую массу.
Обе чашки должны быть одинаковыми и содержать одинаковое количество овсяных хлопьев. Проверьте эти чашки на весах, чтобы убедиться, что они имеют одинаковую массу.Процедура
- Поднимите чашки, наполненные хлопьями, так, чтобы учащиеся могли видеть, что в обоих содержится примерно одинаковое количество хлопьев.
- Поместите чашки в центр каждого конца простых весов, чтобы доказать своим ученикам, что обе содержат одинаковое количество хлопьев.
Попросите учащихся сделать прогноз:
- Я собираюсь растолочь шарики хлопьев в одну чашку. Как вы думаете, высота хлопьев в этой чашке будет выше, ниже или такой же, как в другой чашке?
- Студенты, вероятно, скажут, что измельченные хлопья не займут столько места в чашке.
- Пересыпьте хлопья из одной из чашек в пригодный для хранения пластиковый пакет с застежкой-молнией. Выпустите как можно больше воздуха и закройте пакет.

- Положите мешок на землю и тщательно разомните хлопья ногой. Как только хлопья превратятся в порошок, откройте пакет и высыпьте измельченные хлопья обратно в чашку.
- Пересыпьте хлопья из одной из чашек в пригодный для хранения пластиковый пакет с застежкой-молнией. Выпустите как можно больше воздуха и закройте пакет.
Спросите студентов:
- В какой чашке больше хлопьев?
- Учащиеся поймут, что обе чашки содержат одинаковое количество хлопьев, но у некоторых может возникнуть желание сказать, что в чашке с шариками из хлопьев больше хлопьев.
- Были ли добавлены или удалены какие-либо хлопья из одной из чашек?
- Укажите, что, хотя измельченные хлопья занимают меньше места, в них остается то же количество вещества (хлопьев), которое было в чашке до того, как они были измельчены.
- Как вы могли бы доказать, что эти две чашки содержат одинаковое количество материи?
- Учащиеся должны предложить поставить чашки на весы, как вы это делали раньше.
Поставьте чашки на противоположные концы весов, чтобы доказать, что масса хлопьев в каждой чашке одинакова.

Ожидаемые результаты
Несмотря на то, что объем зерновых шариков больше, чем объем дробленых зерновых шариков, чашки будут балансировать на весах.
Соотнесите наблюдения учащихся на демонстрации с пятью кристаллами, которые они растворяют в воде.
Предложите учащимся представить, что большие шарики хлопьев представляют собой большие кристаллы, а дробленые хлопья представляют собой маленькие кристаллы. Объясните, что размер и форма кристаллов могут быть разными, но вес показывает, что их масса одинакова. Напомните учащимся, что масса – это мера количества вещества. Поскольку большие и маленькие кристаллы (хлопья) имеют одинаковую массу, обе чашки содержат одинаковое количество вещества. Сделайте вывод, что для измерения равных количеств лучше измерять массу веществ, чем объем.
Спросите студентов:
- В тесте на растворимость вам нужно будет измерить равные количества пяти кристаллов.
 Как вы будете измерять равные суммы?
Как вы будете измерять равные суммы? - После этой демонстрации учащиеся должны понять, что измерение массы для теста на растворимость лучше измерения по объему.
Основываясь на том, что учащиеся наблюдали, когда внимательно рассматривали разные кристаллы, а также на доказательствах из демонстрации, они должны понять, что разные кристаллы имеют немного разные размеры или форму. Это приведет к тому, что они будут по-разному упаковываться в ложку, так что в ложке будет больше гранул одного, чем другого.
Примечание. Следующее объяснение может быть слишком сложным для учащихся, но оно приведено здесь, чтобы вы могли подумать и обсудить его со студентами, если считаете его уместным. Даже если гранулы соли и сахара будут точно такого же размера и формы и точно так же упакованы в ложку, все равно не будет хорошей идеей использовать чайную ложку для измерения равных количеств для теста на растворимость. И вот почему: соль примерно на 25% плотнее сахара. Поэтому чайная ложка соли весит больше чайной ложки сахара почти на 25%.
 Ваш тест на растворение не будет точным, потому что вы начнете с большей массы соли, чем сахара.
Ваш тест на растворение не будет точным, потому что вы начнете с большей массы соли, чем сахара.- В тесте на растворимость вам нужно будет измерить равные количества пяти кристаллов.
Предложите учащимся взвесить по пять граммов каждого кристалла для теста на растворимость.
Материалы для каждой группы
- Баланс в граммах
- 5 маленьких пластиковых стаканчиков
- 5 прозрачных пластиковых стаканчиков
- Малярная лента и ручка или перманентный маркер
- Соль
- Английская соль
- глутамат натрия
- Сахар
- Неизвестно (грубая кошерная соль)
- Вода
Процедура
- Используйте клейкую ленту и ручку, чтобы пометить 5 маленьких пластиковых стаканчиков с солью, английской солью, глутаматом натрия, сахаром и неизвестно.
- Таким же образом пометьте 5 больших прозрачных пластиковых стаканчиков.
- Взвесьте 5 г каждого кристалла и поместите каждый в маленькую промаркированную чашку.
Если у вас недостаточно времени, вы можете остановиться здесь и попросить учеников сохранить кристаллы и провести тест в другой день.
 Если у вас есть время для проведения теста, процедура следующая.
Если у вас есть время для проведения теста, процедура следующая.Предложите учащимся растворить четыре известных кристалла и неизвестный в воде комнатной температуры.
Количество воды, используемой в процедуре, является специфическим, и его следует использовать, поскольку оно дает четкие результаты. Вращение кристаллов в воде — хороший способ их смешивания, чтобы помочь им раствориться. Проведите класс так, чтобы все группы одновременно высыпали свои образцы кристаллов в воду. Также скажите учащимся, когда нужно взболтать воду и кристаллы, а когда остановиться и понаблюдать. Будет три 20-секундных интервала.
Вопрос для изучения
Можете ли вы идентифицировать неизвестное вещество с помощью теста на растворимость?
Материалы для каждой группы
- Градуированный цилиндр
- По 5 г соли, английской соли, глутамата натрия, сахара и неизвестного (крупнозернистая кошерная соль)
- 5 прозрачных пластиковых стаканчиков
- Вода
Процедура
- Используйте градуированный цилиндр, чтобы добавить 5 мл воды комнатной температуры в каждую пустую прозрачную пластиковую чашку.

- Сопоставьте каждую пару помеченных чашек так, чтобы каждая чашка из кристалла находилась рядом с соответствующей чашкой с водой.
Когда ваш учитель скажет вам, работайте с вашими партнерами по лаборатории, чтобы одновременно высыпать взвешенное количество каждого кристалла в соответствующую чашку с водой.
- С помощью ваших партнеров по лаборатории взболтайте каждую чашку одновременно и одинаково в течение примерно 20 секунд и наблюдайте. Снова покрутите еще 20 секунд и наблюдайте. Вращайтесь снова в течение последних 20 секунд и сделайте свои последние наблюдения.
Медленно и осторожно перелейте раствор из каждой чашки обратно в ее маленькую пустую чашку. Старайтесь не допустить, чтобы нерастворившиеся кристаллы попали в маленькую чашку. Сравните количество кристаллов, оставшихся в каждом прозрачном пластиковом стаканчике.
Ожидаемые результаты
Результаты могут отличаться. Однако больше всего должен раствориться сахар, за ним следует соль Эпсома.
 MSG должен растворяться немного больше, чем соль и неизвестность. Соль и неизвестность должны казаться растворяющимися в одинаковой степени.
MSG должен растворяться немного больше, чем соль и неизвестность. Соль и неизвестность должны казаться растворяющимися в одинаковой степени.Обсудите наблюдения учащихся и возможную личность неизвестного.
Спросите студентов:
- Есть ли какие-нибудь кристаллы, которые вы могли бы исключить как неизвестную?
- Основываясь на своих наблюдениях, учащиеся чаще всего исключают сахар и английскую соль как неизвестные.
- В какой чашке или чашках осталось примерно такое же количество нерастворенных кристаллов, как и в неизвестном?
- Неизвестный, соль и глутамат натрия имеют одинаковое количество кристаллов, которые не растворились.
- Как вы думаете, личность неизвестного?
- Учащиеся могут решить, что неизвестным является соль, но в некоторых случаях они могут подумать, что это также может быть глутамат натрия.
- Какие доказательства у вас есть в поддержку вашего вывода?
- Учащиеся должны назвать количество кристаллов, оставшихся в каждой чашке, в качестве доказательства того, что неизвестным является либо соль, либо глутамат натрия.

- Если бы у кого-то в классе были совсем другие выводы и наблюдения, что, по вашему мнению, могло привести к этим различиям?
- Учащиеся должны упомянуть о возможных ошибках при взвешивании кристаллов, измерении количества использованной воды, неправильном перемешивании или случайном высыпании кристаллов не в те чашки.
Сообщите учащимся, что их тест показал, что разные вещества имеют разную растворимость. По сути, растворимость – это характерное свойство вещества. Объясните учащимся, что этот тип теста на растворимость может помочь устранить некоторые кристаллы, но может быть недостаточно точным, чтобы идентифицировать неизвестное. Так как у них могут быть сомнения в подлинности неизвестного вещества, учащиеся проведут тест на перекристаллизацию растворов кристаллов, приготовленных во время теста на растворимость.
Предложите учащимся провести еще один тест, чтобы подтвердить личность неизвестного.
Объясните учащимся, что они смогут получить больше информации о личности неизвестного, если позволят раствору растворенных кристаллов перекристаллизоваться.
 Если позволить веществам перекристаллизоваться из их растворов, это может показать сходства и различия, которые не так легко увидеть в исходных кристаллах.
Если позволить веществам перекристаллизоваться из их растворов, это может показать сходства и различия, которые не так легко увидеть в исходных кристаллах.Примечания к материалам: Испытание на перекристаллизацию следует проводить сразу же после испытания на растворимость с растворами, приготовленными во время испытания на растворимость. Учащиеся будут повторно использовать большие прозрачные пластиковые стаканчики и растворы из части растворения в соответствии с процедурой.
Вопрос для изучения
Помогут ли кристаллы, образующиеся при испарении растворов, идентифицировать неизвестное?
Материалы для каждой группы
- Пять растворов, приготовленных в ходе упражнения, каждый в маленьком пластиковом стаканчике
- 5 прозрачных пластиковых стаканчиков из задания
- Лупа
- Вода
- Бумажные полотенца
Процедура
- Промойте каждый большой прозрачный пластиковый стаканчик водой, чтобы удалить оставшиеся кристаллы.
 Обсушите каждую бумажным полотенцем.
Обсушите каждую бумажным полотенцем. - Осторожно перелейте раствор из каждой маленькой чашки в соответствующую большую прозрачную пластиковую чашку.
- Оставьте растворы на ночь.
- На следующий день с помощью лупы внимательно осмотрите кристаллы сверху и снизу чашки.
Ожидаемые результаты
Соль и неизвестность очень похожи. Соль Эпсома, глутамат натрия и сахар отличаются друг от друга и отличаются от соли и неизвестности. Сахар, возможно, еще не перекристаллизовался, но через некоторое время он сформирует кристаллы.
Спросите студентов:
- Опишите кристаллы в каждой чашке. Как вы думаете, что является личностью неизвестного?
- Учащиеся должны обсудить форму и размер различных кристаллов и заметить, что и соль, и неизвестное выглядят очень похоже.
Скажите учащимся, что неизвестное — это крупная кошерная соль. По химическому составу она такая же, как обычная соль, но процесс изготовления обычной поваренной соли и кошерной соли отличается, и поэтому они выглядят по-разному.

Показать молекулярные модели соли, соли Эпсома, сахара и глутамата натрия.
Спроецируйте изображение Все четыре кристалла.
Объясните: поскольку эти вещества состоят из разных атомов и ионов, связанных друг с другом по-разному, они по-разному взаимодействуют с водой, придавая каждому из них свою характерную растворимость.
- Соль
- Напомните учащимся, что хлорид натрия является ионным соединением. Существует положительный ион натрия (Na + ) и отрицательный ион хлорида (Cl — ). Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя соль.
- Английская соль
- Скажите учащимся, что английская соль является ионным соединением. Существует положительный ион магния (Mg 2+ ) и отрицательный сульфат-ион (SO 4 2− ). Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя соль Эпсома.

- глутамат натрия
- MSG состоит из положительного иона натрия (Na + ) и отрицательного иона глутамата, который имеет молекулярную формулу (C 5 H 8 NO 4 — ). Полярная вода взаимодействует с этими противоположно заряженными ионами, растворяя глутамат натрия.
- Сахар
- Сахароза не является ионным соединением. Сахароза имеет много связей O–H, которые придают ей положительные и отрицательные полярные области. Эти области притягивают другие молекулы сахарозы и удерживают их вместе в кристалле. Эти полярные области взаимодействуют с водой и заставляют целые молекулы сахарозы отделяться друг от друга и растворяться.
Помогите учащимся рассмотреть сходства и различия в способах растворения соли и сахара в воде.
Скажите учащимся, что в зависимости от растворяемого вещества ионы отделяются друг от друга или молекулы отделяются друг от друга. Соль и сахар являются распространенными примерами растворения обоих типов твердых веществ.

Спроецируйте изображение Вода растворяет соль.
Спросите студентов:
- Когда соль растворяется, почему молекулы воды притягиваются к ионам натрия и хлорида?
- Хлорид натрия представляет собой ионное соединение с положительным ионом натрия (Na + ) и отрицательным ионом хлорида (Cl — ). Полярная вода взаимодействует с этими противоположно заряженными ионами, что приводит к ее растворению.
Спроецируйте изображение Вода растворяет сахар.
Спросите студентов:
- Когда сахар растворяется, почему молекулы воды притягиваются к молекулам сахарозы?
- Сахароза имеет много связей O–H, которые придают ей положительные и отрицательные полярные области. Эти области притягивают другие молекулы сахарозы и удерживают их вместе в кристалле. Эти полярные области взаимодействуют с водой и заставляют целые молекулы сахарозы отделяться друг от друга и растворяться.
- Каковы сходства и различия между солью, растворяющейся в воде, и сахаром, растворяющимся в воде?
- Ионы натрия и хлора отделяются друг от друга и по мере растворения попадают в окружение молекул воды.
 Целые молекулы сахарозы отделены от других молекул сахарозы. Ковалентные связи, удерживающие атомы в молекуле сахарозы, не распадаются.
Целые молекулы сахарозы отделены от других молекул сахарозы. Ковалентные связи, удерживающие атомы в молекуле сахарозы, не распадаются.
Глава 4.1: Ионная связь — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 17556
- Анонимный
- LibreTexts
Цели обучения
- Количественно описать энергетические факторы, участвующие в образовании ионной связи.
Ионные связи образуются, когда положительно и отрицательно заряженные ионы удерживаются вместе электростатическими силами. Энергия электростатического притяжения ( E ), мера силы взаимодействия, обратно пропорциональна межъядерному расстоянию между заряженными частицами ( r ):
\(E \propto \dfrac{Q_{1}Q_{2}}{r }\quad \quad E = k\dfrac{Q_{1}Q_{2}}{r} \tag{4. 1.1} \)
1.1} \)
, где заряд каждого иона представлен символом Q . Константа пропорциональности k равна 2,31 × 10 −28 Дж·м. Это значение k включает в себя заряд одного электрона (1,6022 × 10 -19 С) для каждого иона. Уравнение также можно записать, используя заряд каждого иона, выраженный в кулонах (Кл), включенный в константу. В этом случае константа пропорциональности k равна 8,999 × 109 Дж·м/Кл 2 . В приведенном примере Q 1 = +1 (1,6022 × 10 −19 C) и Q 2 = −1 (1,6022 × 10 −19 C). Если Q 1 и Q 2 имеют противоположные знаки (как, например, в NaCl, где Q 1 равно +1 для Na + и Q 2 равно −1 для Cl − ), тогда E отрицательно, что означает выделение энергии при переносе противоположно заряженных ионов вместе с бесконечного расстояния, чтобы сформировать изолированную ионную пару.
Рисунок 4.1.1 Влияние заряда и расстояния на силу электростатических взаимодействий. Как заряд ионов увеличивается или расстояние между ионами уменьшается, так же как и сила притяжения (-…+) или отталкивания (-…- или +…+) взаимодействий. Сила этих взаимодействий представлена толщиной стрелок.
Для ионов с противоположным зарядом притяжение увеличивается по мере увеличения заряда и уменьшается по мере увеличения расстояния между ионами
Как показано зеленой кривой в нижней половине рисунка 4.1.2, максимальная энергия высвобождается, когда ионы бесконечно близки друг к другу, при r = 0. Однако, поскольку ионы занимают пространство и имеют структуру с положительным ядром, окруженным электронами, они не могут быть бесконечно близко друг к другу. На очень коротких расстояниях отталкивающие электрон-электронные взаимодействия между электронами на соседних ионах становятся сильнее, чем притягивающие взаимодействия между ионами с противоположными зарядами, как показано красной кривой в верхней половине рис. 4.1.2. Полная энергия системы представляет собой баланс между притягивающими и отталкивающими взаимодействиями. Фиолетовая кривая на рис. 4.1.2 показывает, что полная энергия системы достигает минимума при r 0 , точка, в которой электростатическое отталкивание и притяжение точно сбалансированы. Это расстояние совпадает с экспериментально измеренным расстоянием связи.
4.1.2. Полная энергия системы представляет собой баланс между притягивающими и отталкивающими взаимодействиями. Фиолетовая кривая на рис. 4.1.2 показывает, что полная энергия системы достигает минимума при r 0 , точка, в которой электростатическое отталкивание и притяжение точно сбалансированы. Это расстояние совпадает с экспериментально измеренным расстоянием связи.
Обратите внимание на шаблон
При образовании связи высвобождается энергия.
Рис. 4.1.2 График зависимости потенциальной энергии от межъядерного расстояния при взаимодействии ионов с разными зарядами: газообразный ион Na + и газообразный Cl − Ион Энергия системы достигает минимума на определенном расстоянии ( r 0 ), когда взаимодействия притяжения и отталкивания уравновешены. Ниже представлено приложение от pHet, иллюстрирующее ту же точку зрения для нейтральных атомов. { — 12} \cancel{m/pm}} \right) = — 9{ 23}\; \отменить{ион\; пар}/моль\право )=-589\; кДж/моль \tag{4.1.3} \)
{ — 12} \cancel{m/pm}} \right) = — 9{ 23}\; \отменить{ион\; пар}/моль\право )=-589\; кДж/моль \tag{4.1.3} \)
Это энергия, выделяющаяся при образовании 1 моль газообразных ионных пар, , а не , когда 1 моль положительных и отрицательных ионов конденсируется с образованием кристаллической решетки. Из-за дальнодействующих взаимодействий в структуре решетки эта энергия не соответствует непосредственно энергии решетки кристаллического твердого тела. Однако большое отрицательное значение указывает на то, что объединение положительных и отрицательных ионов энергетически очень выгодно, независимо от того, образуется ли ионная пара или кристаллическая решетка.
Подытожим важные моменты об ионной связи:
- При r 0 ионы более стабильны (имеют меньшую потенциальную энергию), чем на бесконечном межъядерном расстоянии. При сближении противоположно заряженных ионов от r = ∞ до r = r 0 энергия системы понижается (выделяется энергия).

- Из-за низкой потенциальной энергии r 0 в систему необходимо добавить энергию для разделения ионов. Необходимое количество энергии – это энергия связи.
- Энергия системы достигает минимума на определенном межъядерном расстоянии (расстоянии связи).
Ионные кристаллические решетки
Ионное твердое тело формируется из бесконечно повторяющихся структур ионных пар. Поскольку мы хотим установить основы ионной связи и не вдаваться в подробности, мы продолжим использовать поваренную соль NaCl для обсуждения ионной связи.
В NaCl, конечно, электрон переносится от каждого атома натрия к атому хлора, оставляя Na + и кл.—. Размер решетки зависит от физического размера кристалла, который может быть микроскопическим, несколько нанометров со стороной, до макроскопических, сантиметров или даже больше. Кристаллы соли, которые вы покупаете в магазине, могут иметь размер от нескольких десятых долей миллиметра в поваренной соли мелкого помола до нескольких миллиметров в соли грубого помола, используемой в кулинарии. Учитывая, что расстояние между ионами Na + и Cl — составляет ~ 240 пм, кристалл размером 2,4 мм на ребре имеет 10 +7 Na + — Cl — единиц, а кубик соли со стороной 2 мм будет иметь примерно 2 x 10 21 атомов.
Учитывая, что расстояние между ионами Na + и Cl — составляет ~ 240 пм, кристалл размером 2,4 мм на ребре имеет 10 +7 Na + — Cl — единиц, а кубик соли со стороной 2 мм будет иметь примерно 2 x 10 21 атомов.
Ионы выстраиваются в протяженную решетку. Отличительной особенностью этих решеток является то, что они объемные, в них нет пустот. Думая об этом в трех измерениях, это оказывается немного сложным. В природе существует всего 14 таких решеток, названных решетками Браве в честь Огюста Браве, который впервые классифицировал их в 1850 году. Если интересно, вы можете просмотреть видео-визуализацию 14 решеток Мануэля Морейры Баптисты
Рис. 4.1.3 Небольшой разрез расположения ионов в кристалле NaCl . Взаимные положения ионов натрия показаны синим цветом, хлора — зеленым
Помните, что ионы Na + , показанные здесь фиолетовым цветом, будут намного меньше атомов Na, а Cl — ионы будут намного больше, чем атомы Cl. Повторяющийся узор называется элементарной ячейкой.
Повторяющийся узор называется элементарной ячейкой.
Рисунок 4.1.4 Элементарная ячейка кристаллической решетки NaCl. Если вы внимательно посмотрите на схему, то увидите, что ионы натрия и ионы хлора чередуются друг с другом в каждом из трех измерений.
Эту диаграмму достаточно легко нарисовать с помощью компьютера, но чрезвычайно сложно убедительно нарисовать вручную. Обычно мы рисуем «разобранную» версию, которая выглядит так:
Рис. 4.1.5. «Покомпонентный» вид элементарной ячейки для кристаллической решетки NaCl. Ион натрия в центре соприкасается с 6 ионами хлорида, как показано синими линиями.
Случайно мы могли бы с тем же успехом центрировать диаграмму вокруг иона хлорида, который, конечно же, будет соприкасаться с 6 ионами натрия. Хлорид натрия описывается как координированный 6: 6. Эта диаграмма представляет собой лишь крошечную часть всего кристалла хлорида натрия; картина повторяется таким образом для бесчисленных ионов.
Хлорид натрия имеет высокую температуру плавления и кипения
Между положительными и отрицательными ионами существует сильное электростатическое притяжение, и для его преодоления требуется много тепловой энергии. Все ионные вещества имеют высокие температуры плавления и кипения. Различия между ионными веществами будут зависеть от таких вещей, как:
- Число зарядов ионов: Оксид магния имеет точно такое же строение, как и хлорид натрия, но гораздо более высокую температуру плавления и кипения. Ионы 2+ и 2- притягиваются друг к другу сильнее, чем 1+ притягивает 1-.
- Размеры ионов: если ионы меньше, они сближаются, поэтому электростатическое притяжение больше. Иодид рубидия, например, плавится и кипит при несколько более низких температурах, чем хлорид натрия, потому что ионы рубидия и йодида больше, чем ионы натрия и хлорида. Притяжение между более крупными ионами меньше, поэтому для их разделения требуется меньше тепловой энергии.
Кристаллы хлорида натрия хрупкие
Хрупкость также характерна для ионных веществ. Представьте, что произойдет с кристаллом, если приложить к нему напряжение, которое слегка сместит ионные слои.
Представьте, что произойдет с кристаллом, если приложить к нему напряжение, которое слегка сместит ионные слои.
Рисунок 4.1.5 Расщепление ионного кристалла. При раскалывании ионного кристалла острый инструмент, такой как нож, смещает соседние слои кристалла, наталкивая ионы с одинаковым зарядом друг на друга. В этот момент две части отталкиваются друг от друга, разбивая кристалл.
Электрические свойства хлорида натрия
Твердый хлорид натрия не проводит электричество, так как в нем нет электронов, которые могли бы свободно двигаться. Когда она плавится, конечно, при очень высокой температуре, ионы натрия и хлора могут свободно перемещаться, когда к жидкости приложено напряжение. Положительные ионы натрия движутся к отрицательно заряженному электроду (катоду). Когда они туда попадают, каждый ион натрия захватывает электрон с электрода, образуя атом натрия. Они всплывают на поверхность расплава в виде расплавленного металлического натрия. (И если вы делаете это на открытом воздухе, это сразу же загорается и горит оранжевым пламенем.) 9− \notag \]
(И если вы делаете это на открытом воздухе, это сразу же загорается и горит оранжевым пламенем.) 9− \notag \]
Новые электроны, осевшие на аноде, откачиваются источником питания по внешней цепи, в конечном итоге попадая на катод, где они передаются ионам натрия. Расплавленный хлорид натрия проводит электричество из-за движения ионов в расплаве и разряда ионов на электродах. И то, и другое должно произойти, если вы хотите, чтобы электроны текли во внешней цепи. В твердом хлориде натрия, конечно, это движение ионов не может происходить, и это исключает любую возможность протекания тока в цепи.
Благодарность: обсуждение решетки NaCl представляет собой слегка измененную версию статьи Джима Кларка на ChemWiki
Пример 1
Рассчитайте количество энергии, выделяемой при 1 моль газообразного Li + F − ионных пар образуется из отделенных ионов. Наблюдаемое межъядерное расстояние в газовой фазе равно 156 пм.
Дано: катион и анион, количество и межъядерное расстояние
Запрошено: энергия, выделяющаяся при образовании газообразных ионных пар
Стратегия:
Подставьте соответствующие значения в уравнение 4. 1.1, чтобы получить энергию, выделяемую при образовании одной пары ионов, а затем умножьте это значение на число Авогадро, чтобы получить энергию, выделяемую на моль.
1.1, чтобы получить энергию, выделяемую при образовании одной пары ионов, а затем умножьте это значение на число Авогадро, чтобы получить энергию, выделяемую на моль.
Решение:
Вставка значений для Li + F — в уравнение 4.1,1 (где Q 1 = +1, Q 2 2 2 2 2 2 2 2 2 . = 156 пм), находим, что энергия, связанная с образованием одиночной пары Li 9{ 23}\; \отменить{ион\; пара}/моль\право )=-891\; кДж/моль \)
Поскольку Li + и F — меньше, чем Na + и Cl — (см. рис. 3.2.7), межъядерное расстояние в LiF короче, чем в NaCl. Следовательно, в соответствии с уравнением 4.1.1, при образовании 1 моль газообразных пар ионов Li + F − выделяется гораздо больше энергии (-891 кДж/моль), чем при образовании 1 моль газообразных Na + Cl Образуется − ионных пар (−589кДж/моль).
Упражнение
Рассчитайте количество энергии, выделяющейся при образовании 1 моль газообразных ионных пар MgO из разделенных ионов. Межъядерное расстояние в газовой фазе равно 175 пм.
Ответ: −3180 кДж/моль = −3,18 × 10 3 кДж/моль
Резюме
Сила электростатического притяжения между ионами с противоположными зарядами прямо пропорциональна величине зарядов на ионах. и обратно пропорциональна межъядерному расстоянию. Полная энергия системы представляет собой баланс между отталкивающими взаимодействиями между электронами на соседних ионах и притягивающими взаимодействиями между ионами с противоположными зарядами.
Ионные соединения обычно образуют твердые кристаллические вещества, которые плавятся при довольно высоких температурах и очень устойчивы к испарению. Их можно легко расколоть. При растворении в водном растворе ионы делают раствор хорошим проводником электричества. Эти свойства проистекают из характерной внутренней структуры ионного твердого тела, схематически показанной в части (а) на рис. 4.1.5, которая показывает трехмерный массив чередующихся положительных и отрицательных ионов, удерживаемых вместе сильным электростатическим притяжением.
4.1.5, которая показывает трехмерный массив чередующихся положительных и отрицательных ионов, удерживаемых вместе сильным электростатическим притяжением.
Key Takeaway
- Количество энергии, необходимое для разделения пары газообразных ионов, является энергией связи.
Концептуальные проблемы
Опишите различия в поведении NaOH и CH 3 OH в водном растворе. Какое решение было бы лучшим проводником электричества? Объясните свои рассуждения.
Какая связь между силой электростатического притяжения между противоположно заряженными ионами и расстоянием между ионами? Как изменяется сила электростатических взаимодействий с увеличением размера ионов?
Что приведет к выделению большего количества энергии: взаимодействие газообразного иона натрия с газообразным ионом оксида или взаимодействие газообразного иона натрия с газообразным ионом бромида? Почему?
Что приведет к выделению большего количества энергии: взаимодействие газообразного иона хлора с газообразным ионом натрия или газообразным ионом калия? Поясните свой ответ.

Какие взаимодействия преобладают, когда противоположно заряженные ионы
- далеко друг от друга?
- на межъядерных расстояниях, близких к r 0 ?
- очень близко друг к другу (на расстоянии, которое меньше , чем сумма ионных радиусов)?
Несколько факторов способствуют стабильности ионных соединений. Опишите один тип взаимодействия, который дестабилизирует ионных соединений. Опишите взаимодействия, которые стабилизируют ионных соединений.
Какая связь между энергией электростатического притяжения между заряженными частицами и расстоянием между ними?
Ответ
Взаимодействие иона натрия и оксид-иона. Энергия электростатического притяжения между ионами противоположного заряда прямо пропорциональна заряду каждого иона ( Q 1 и Q 2 в уравнении 4.
 1.1). Таким образом, по мере увеличения заряда ионов выделяется больше энергии (при условии, что межъядерное расстояние существенно не увеличивается). Ион натрия имеет заряд +1; оксид-ион, заряд -2; и бромид-ион, заряд -1. Для взаимодействия иона натрия с оксид-ионом Q 1 = +1 и Q 2 = -2, а для взаимодействия иона натрия с бромид-ионом Q 1 = +1 и Q 2 = −1. Большее значение Q 1 × Q 2 для взаимодействия иона натрия с ионом оксида означает, что оно будет выделять больше энергии.
1.1). Таким образом, по мере увеличения заряда ионов выделяется больше энергии (при условии, что межъядерное расстояние существенно не увеличивается). Ион натрия имеет заряд +1; оксид-ион, заряд -2; и бромид-ион, заряд -1. Для взаимодействия иона натрия с оксид-ионом Q 1 = +1 и Q 2 = -2, а для взаимодействия иона натрия с бромид-ионом Q 1 = +1 и Q 2 = −1. Большее значение Q 1 × Q 2 для взаимодействия иона натрия с ионом оксида означает, что оно будет выделять больше энергии.
Численные задачи
Какова энергия электростатического взаимодействия между ионами с зарядами +1 и −1 по сравнению с энергией взаимодействия между ионами с зарядами +3 и −1, если расстояние между ионами одинаково в обоих случаях? Как это соотносится с величиной взаимодействия между ионами с зарядами +3 и -3?
Сколько граммов газообразного MgCl 2 необходимо для получения той же энергии электростатического притяжения, что и 0,5 моль газообразного LiCl? Ионные радиусы: Li + = 76 пм, Mg +2 = 72 пм и Cl — = 181 пм.

Нарисуйте диаграмму, показывающую зависимость между потенциальной энергией и межъядерным расстоянием (от r = ∞ до r = 0) для взаимодействия бромид-иона и калия с образованием газообразного KBr. Объясните, почему энергия системы увеличивается с уменьшением расстояния между ионами от r = r 0 до r = 0,
Рассчитайте величину энергии электростатического притяжения ( E , в килоджоулях) для 85,0 г пар газообразных ионов SrS. Наблюдаемое межъядерное расстояние в газовой фазе равно 244,05 пм.
Какова энергия электростатического притяжения ( E , в килоджоулях) 130 г газообразного HgI 2 ? Межъядерное расстояние равно 255,3 пм.
Ответы
Согласно уравнению 4.1.1, в первом случае Q 1 Q 2 = (+1)(-1) = -1; во втором случае Q 1 Q 2 = (+3)(-1) = -3.
 Таким образом, E будет в три раза больше для ионов +3/−1. Для ионов +3/-3 Q 1 Q 2 = (+3)(-3) = -9, поэтому E будет в девять раз больше, чем для +1/-1 ионы.
Таким образом, E будет в три раза больше для ионов +3/−1. Для ионов +3/-3 Q 1 Q 2 = (+3)(-3) = -9, поэтому E будет в девять раз больше, чем для +1/-1 ионы.При r < r 0 энергия системы увеличивается за счет электрон-электронных отталкиваний между перекрывающимися электронными распределениями на соседних ионов. При очень коротких межъядерных расстояниях также становятся важными электростатические отталкивания между соседними ядрами .
Авторы
- Anonymous
Изменено Джошуа Халперном
Моделирование двухатомных молекул из pHet
Эта страница под названием «Глава 4.1: Ионная связь» распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована Anonymous.


 Покажите учащимся чашки, чтобы они могли сравнить количество оставшихся нерастворенных кристаллов.
Покажите учащимся чашки, чтобы они могли сравнить количество оставшихся нерастворенных кристаллов.



 Они обнаружат это к концу этого урока.
Они обнаружат это к концу этого урока. Некоторые учащиеся могут предложить использовать одинаковый объем каждого кристалла, в то время как другие могут предложить одинаковую массу каждого кристалла. Если никто не предлагает использовать массу, объясните, что в демонстрации вы использовали одинаковую массу соли и сахара — по 5 г каждого.
Некоторые учащиеся могут предложить использовать одинаковый объем каждого кристалла, в то время как другие могут предложить одинаковую массу каждого кристалла. Если никто не предлагает использовать массу, объясните, что в демонстрации вы использовали одинаковую массу соли и сахара — по 5 г каждого. Обе чашки должны быть одинаковыми и содержать одинаковое количество овсяных хлопьев. Проверьте эти чашки на весах, чтобы убедиться, что они имеют одинаковую массу.
Обе чашки должны быть одинаковыми и содержать одинаковое количество овсяных хлопьев. Проверьте эти чашки на весах, чтобы убедиться, что они имеют одинаковую массу.

 Как вы будете измерять равные суммы?
Как вы будете измерять равные суммы? Ваш тест на растворение не будет точным, потому что вы начнете с большей массы соли, чем сахара.
Ваш тест на растворение не будет точным, потому что вы начнете с большей массы соли, чем сахара. Если у вас есть время для проведения теста, процедура следующая.
Если у вас есть время для проведения теста, процедура следующая.
 MSG должен растворяться немного больше, чем соль и неизвестность. Соль и неизвестность должны казаться растворяющимися в одинаковой степени.
MSG должен растворяться немного больше, чем соль и неизвестность. Соль и неизвестность должны казаться растворяющимися в одинаковой степени.
 Если позволить веществам перекристаллизоваться из их растворов, это может показать сходства и различия, которые не так легко увидеть в исходных кристаллах.
Если позволить веществам перекристаллизоваться из их растворов, это может показать сходства и различия, которые не так легко увидеть в исходных кристаллах. Обсушите каждую бумажным полотенцем.
Обсушите каждую бумажным полотенцем.

 Целые молекулы сахарозы отделены от других молекул сахарозы. Ковалентные связи, удерживающие атомы в молекуле сахарозы, не распадаются.
Целые молекулы сахарозы отделены от других молекул сахарозы. Ковалентные связи, удерживающие атомы в молекуле сахарозы, не распадаются.

 1.1). Таким образом, по мере увеличения заряда ионов выделяется больше энергии (при условии, что межъядерное расстояние существенно не увеличивается). Ион натрия имеет заряд +1; оксид-ион, заряд -2; и бромид-ион, заряд -1. Для взаимодействия иона натрия с оксид-ионом Q 1 = +1 и Q 2 = -2, а для взаимодействия иона натрия с бромид-ионом Q 1 = +1 и Q 2 = −1. Большее значение Q 1 × Q 2 для взаимодействия иона натрия с ионом оксида означает, что оно будет выделять больше энергии.
1.1). Таким образом, по мере увеличения заряда ионов выделяется больше энергии (при условии, что межъядерное расстояние существенно не увеличивается). Ион натрия имеет заряд +1; оксид-ион, заряд -2; и бромид-ион, заряд -1. Для взаимодействия иона натрия с оксид-ионом Q 1 = +1 и Q 2 = -2, а для взаимодействия иона натрия с бромид-ионом Q 1 = +1 и Q 2 = −1. Большее значение Q 1 × Q 2 для взаимодействия иона натрия с ионом оксида означает, что оно будет выделять больше энергии.
 Таким образом, E будет в три раза больше для ионов +3/−1. Для ионов +3/-3 Q 1 Q 2 = (+3)(-3) = -9, поэтому E будет в девять раз больше, чем для +1/-1 ионы.
Таким образом, E будет в три раза больше для ионов +3/−1. Для ионов +3/-3 Q 1 Q 2 = (+3)(-3) = -9, поэтому E будет в девять раз больше, чем для +1/-1 ионы.