КАРБОНАТ НАТРИЯ — это… Что такое КАРБОНАТ НАТРИЯ?
- КАРБОНАТ НАТРИЯ
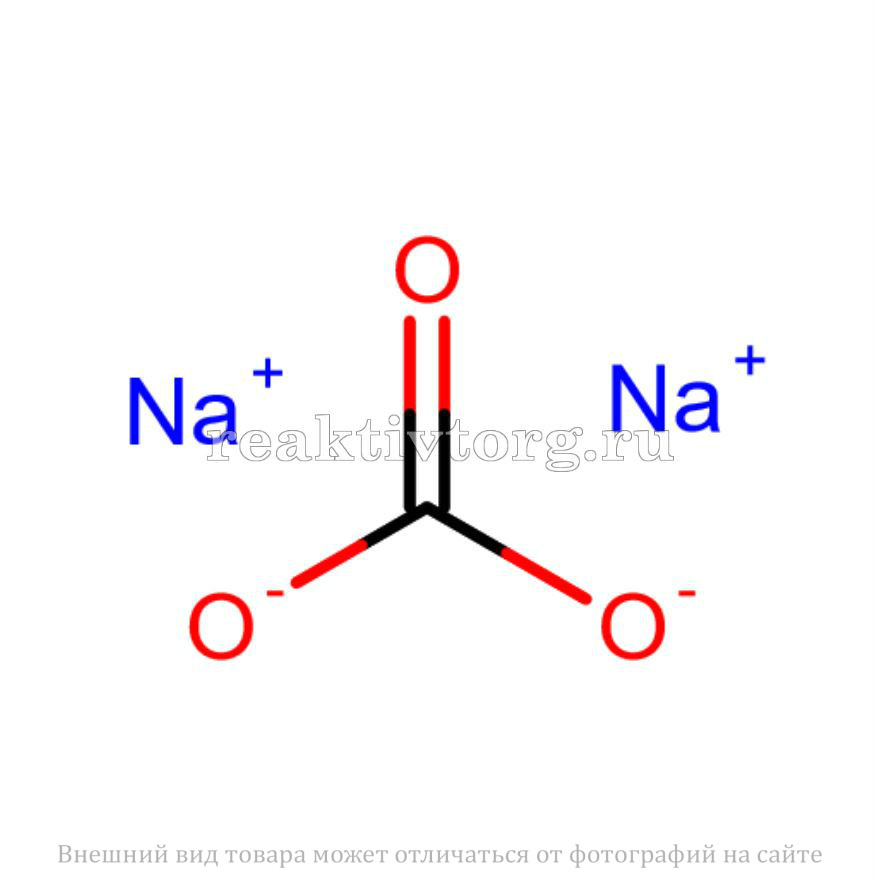
КАРБОНАТ НАТРИЯ (сода, стиральная сода), белая кристаллическая соль (Na2CO3 ) обычно получаемая из хлорида натрия (поваренной соли, NaCL), и АММИАКА При помощи ПРОЦЕССА СОЛЬВЕ. Дегидратированная (безводная) форма (На2СО3) известна как кальцинированная сода, гидратированная — как стиральная сода (Nа2СО3.10Н2О).
Научно-технический энциклопедический словарь.
- КАРБОНАТ КАЛЬЦИЯ
- КАРБОНАТЫ
Полезное
Смотреть что такое «КАРБОНАТ НАТРИЯ» в других словарях:
Карбонат натрия — Карбонат натрия … Википедия
карбонат натрия — углекислый натрий … Cловарь химических синонимов I
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
Карбонат серебра(I) — Общие Систематическое наименование … Википедия
Карбонат калия — Карбонат калия … Википедия
Натрия гидроксид — Гидроксид натрия [править] Наименование едкий натр, каустик, каустическая сода, едкая щелочь Химическая формула Na OH Молярная масса 39.
 9971 г/моль … Википедия
9971 г/моль … ВикипедияНатрия гидрокарбонат — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия Nah3PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
НАТРИЯ КАРБОНАТ — Natrii carbonas. Синонимы: натрий углекислый, сода неочищенная, угленатриевая соль. Свойства. Белый рыхлый порошок, хорошо поглощающий воду, щелочной реакции. Легко растворяется в воде, частично распадается с образованием едкой щелочи и гидрокар … Отечественные ветеринарные препараты
Карбонат марганца(II) — Карбонат марганца(II) … Википедия
Krisanalyt — Натрий сернистокислый б/в
Натрий сернистокислый б/вНатрия сульфит — бесцветные кристаллы; соль. Химическая формула — Na2SO3.
Химическая формула — Na2SO3.
Натрия сульфит — сильный восстановитель. При обычной температуре из водных растворов кристаллизуется Na2SO3x7h3O. В водных растворах легко окисляется кислородом воздуха. В водных растворах Na2SO3 присоединяет при нагревании серу с образованием тиосульфата натрия.
Натрия сульфит применяют как компонент фиксажей и проявителей в фотографии, для удаления следов хлора после отбеливания тканей, для удаления S из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих Сr.
|
№ п/п |
Наименование показателей |
Требования ГОСТ |
Результаты анализа |
|
1 |
Массовая доля основного вещества, не менее % |
96,0 |
96,8 |
|
2 |
Массовая доля примесей, % не более: |
|
|
|
3 |
Кислотность |
исп. |
выдерживает |
|
4 |
Нерастворимые в воде вещества |
0,01 |
0,006 |
|
|
Щелочность (Na2СО3) |
0,1 |
0,02 |
|
6 |
Тиосульфаты |
не нормируется |
— |
|
7 |
Хлориды (CI) |
0,01 |
0,004 |
|
8 |
Железо (Fe) |
0,001 |
0,0003 |
|
9 |
Мышьяк (Аs) |
0,001 |
0,0001 |
|
10 |
Тяжелые металлы (РЬ) |
0,001 |
0,0006 |
Гарантийный срок хранения – 6 месяцев.
|
Стандарт/ТНПА |
ТУ BY 600122610.001-2015 |
|||||
|
Калия гидрат окиси технический |
твердый |
раствор |
||||
|
|
Марка А |
Марка Б |
Марка В |
Марка Г |
Марка А |
Марка Б |
|
1 Внешний вид |
Чешуйки зеленого, сиреневого, белого или серого цвета |
Раствор голубого, зеленого, серого цвета или бесцветный. |
Раствор голубого, зеленого, серого цвета или бесцветный |
|||
|
2 Массовая доля едких щелочей (KOH+NaOH) в пересчете на KОН, %, не менее |
95,0 |
94,0 |
92,0 |
90,0 |
54,0 |
46,0 |
|
3 Массовая доля углекислого калия (K2СО3), %, не более |
1,0 |
1,2 |
1,4 |
1,5 |
0,4 |
0,4 |
|
4 Массовая доля хлоридов в пересчете на Сl, %, не более |
0,01 |
0,05 |
0,1 |
0,1 |
0,1 |
0,7 |
|
5 Массовая доля железа (Fe), %, не более |
0,0005 |
0,001 |
0,01 |
0,01 |
0,002 |
0,004 |
|
6 Массовая доля сульфатов (SО4), %, не более |
0,005 |
0,005 |
0,025 |
0,05 |
0,005 |
0,03 |
|
7 Массовая доля нитратов и нитритов в пересчете на азот (N), %, не более |
0,0005 |
0,001 |
0,003 |
0,003 |
0,001 |
0,003 |
|
8 Массовая доля натрия в пересчете на NaOH, %, не более |
1,4 |
1,4 |
1,5 |
2,0 |
1,0 |
1,7 |
|
9 Массовая доля кальция (Са), %, не более |
0,005 |
0,005 |
0,01 |
0,01 |
0,002 |
0,005 |
|
10 Массовая доля алюминия (Аl), %, не более |
0,002 |
0,002 |
0,003 |
0,005 |
0,001 |
0,003 |
|
11 Массовая доля кремния (Si), %, не более |
0,001 |
0,001 |
0,01 |
0,02 |
0,001 |
0,015 |
|
12 Массовая доля хлорноватокислого калия (KClO3), %, не более |
0,01 |
0,01 |
0,1 |
0,2 |
0,1 |
0,15 |
|
2. Карбонат натрия, или кальцинированная сода, (Na2СО3) — мелкокристаллический порошок белого цвета; молекулярная масса 106; плотность 2532 кг/м3; насыпная плотность 550 — 600 кг/м3; температура плавления 854 °С_. На воздухе карбонат натрия поглощает С02 и H2O (частично превращаясь в бикарбонат натрия), что усложняет его хранение и перевозку.
Водные растворы карбоната натрия имеют сильнощелочную реакцию; рН = 11,2 — 11,5 при изменении концентрации от 0,04 до 0,44 г-экв.
В рецептуры CMC гидрокарбонат натрия вводят для повышения щелочности среды, в результате чего повышается суспендирующая и моющая способность CMC.
Сульфат натрия (Na2S04) — кристаллы белого цвета; молекулярная масса 142,05; плотность 2698 кг/м3 ; насыпная плотность 1370 кг/м3; температура плавления 884 °С.
Насыщенный раствор содержит 33,6 % (масс.) соли при 32,5 °С. В щелочных растворах растворимость сульфата натрия понижается.
|
ГОСТ 18190-72 Вода питьевая. Методы определения содержания остаточного активного хлора / 18190 72
ГОСТ 18190-72
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ВОДА ПИТЬЕВАЯ
Методы определения содержания
остаточного активного хлора
|
|
Москва Стандартинформ 2009 |
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
|
ВОДА ПИТЬЕВАЯ Методы определения Drinking water. |
ГОСТ |
Дата введения 01.01.74
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания остаточного активного хлора.
1.1. Пробы воды отбирают по ГОСТ 24481* и ГОСТ 2874**.
________
* На территории Российской Федерации действует ГОСТ Р 51593-2000.
** На территории Российской Федерации действует ГОСТ Р 51232-98.
1.2. Объем пробы воды для определения содержания активного хлора не должен быть менее 500 см3.
1.3. Пробы воды не консервируют. Определение следует проводить немедленно после отбора пробы.
2.1. Сущность метода
Метод основан на окислении йодида активным хлором до
йода, который титруют тиосульфатом натрия. Озон, нитриты, окись железа и другие
соединения в кислом растворе выделяют йод из йодистого калия, поэтому пробы
воды подкисляют буферным раствором с pH 4,5.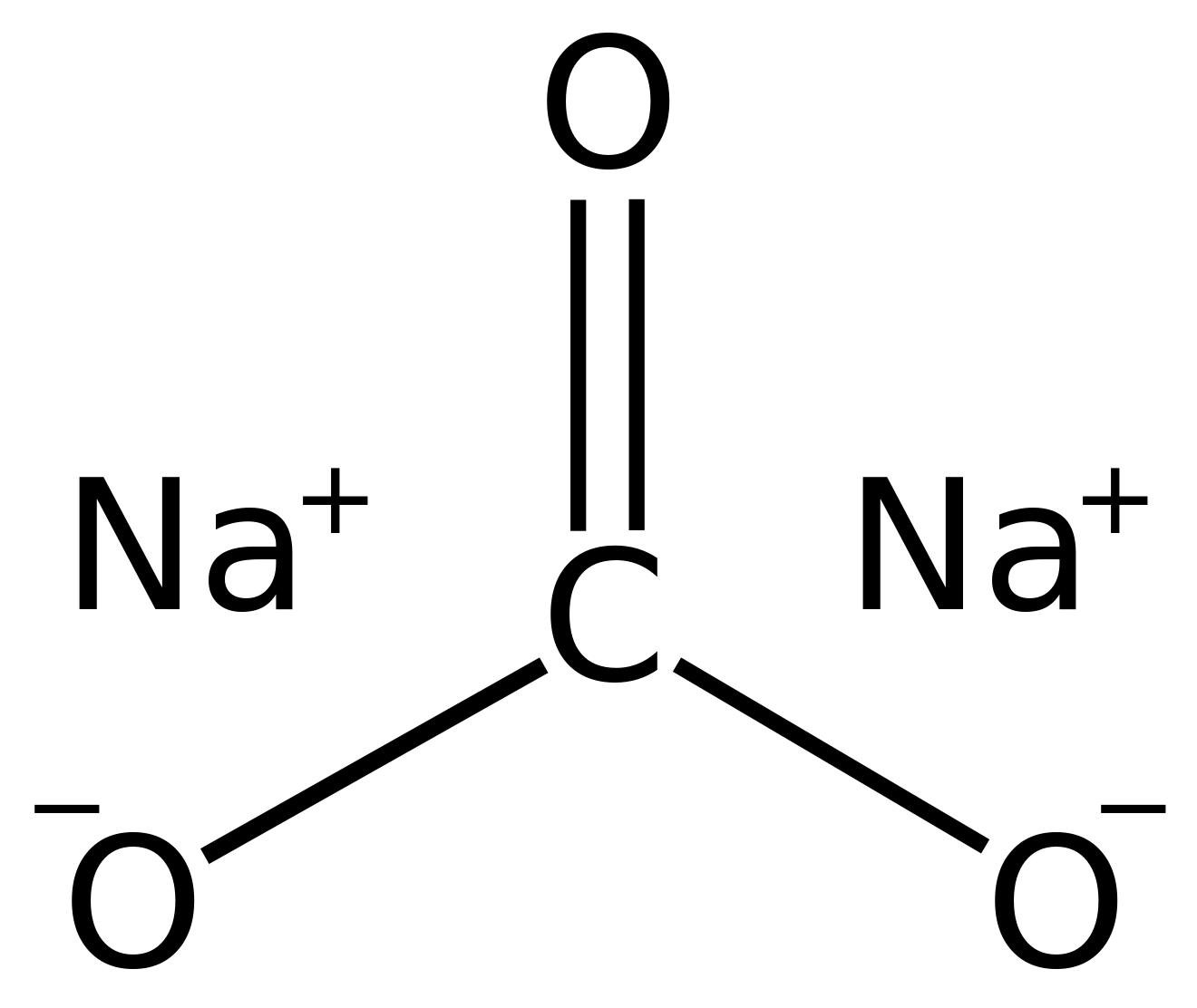
Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/дм3 при объеме пробы 250 см3. Метод может быть рекомендован также для окрашенных и мутных вод.
2.2. Аппаратура, материалы и реактивы
Посуда мерная лабораторная стеклянная по ГОСТ 1770, ГОСТ 29169 и ГОСТ 29251, вместимостью: колбы 100 и 1000 см3; пипетки без делений 5, 10, 25 см3; бюретка с краном 25, 50 см3; микробюретка 5 см3.
Колбы конические с пришлифованными пробками вместимостью 250 см3 по ГОСТ 25336.
Калий йодистый по ГОСТ 4232, х. ч. в кристаллах.
Вода дистиллированная по ГОСТ 6709.
Хлороформ (трихлорметан).
Кислота салициловая.
Кислота уксусная ледяная по ГОСТ 61.
Калий двухромовокислый по ГОСТ 4220.
Кислота серная по ГОСТ 4204.
Крахмал растворимый по ГОСТ 10163.
Натрий углекислый кристаллический по ГОСТ 84.
Натрий серноватистокислый (тиосульфат натрия) по ГОСТ 27068.
Все реактивы, используемые в анализе, должны быть квалификации «чистые для анализа» (ч. д. а.).
2.3. Подготовка к анализу
2.3.1. Приготовление 0,1 н раствора серноватистокислого натрия
25 г тиосульфата натрия Na2S2O3 · 5H2O растворяют в свежепрокипяченной и охлажденной дистиллированной воде, добавляют 0,2 г углекислого натрия (Nа2СО3) и доводят объем до 1 дм3.
2.3.2. Приготовление 0,01 н раствора серноватистокислого натрия
100 см3 0,1 н. раствора тиосульфата натрия
разбавляют свежепрокипяченной и охлажденной дистиллированной водой, добавляют
0,2 г углекислого натрия и доводят раствор до 1 дм3. Раствор
применяют при содержании активного хлора в пробе более 1 мг/дм3.
2.3.3. Приготовление 0,005 н. раствора серноватистокислого натрия
50 см3 0,1 н. раствора тиосульфата натрия разбавляют свежепрокипяченной и охлажденной дистиллированной водой, добавляют 0,2 г углекислого натрия и доводят раствор до 1 дм3. Раствор применяют при содержании активного хлора в пробе менее 1 мг/дм3.
2.3.4. Приготовление 0,01 н. раствора калия двухромовокислого
0,4904 г двухромовокислого калия К2Сr2О7, взвешенного с точностью до ± 0,0002 г, перекристаллизованного и высушенного при 180 °C до постоянной массы, растворяют в дистиллированной воде и доводят объем до 1 дм3.
2.3.5. Приготовление 0,5 %-ного раствора крахмала
0,5 г растворимого крахмала смешивают с небольшим
объемом дистиллированной воды, приливают к 100 мл кипящей дистиллированной воды
и кипятят несколько минут. После охлаждения консервируют, добавляя хлороформ
или 0,1 г салициловой кислоты.
2.3.6. Приготовление буферного раствора pH 4,5
102 см3 1 М уксусной кислоты (60 г ледяной уксусной кислоты в 1 дм3 воды) и 98 см3 1 М раствора уксуснокислого натрия (136,1 г уксуснокислого натрия СН3СОONа · 3Н2О в 1 дм3 воды) наливают в мерную колбу вместимостью 1 дм3 и доводят до метки дистиллированной водой (предварительно прокипяченной и охлажденной до 20 °C, свободной от двуокиси углерода).
2.3.7. Поправочный коэффициент 0,01 н. раствора
серноватисто-кислого натрия определяют по 0,01 н раствору двухромовокислого
калия следующим образом: в коническую колбу и с пришлифованной пробкой помещают
0,5 г йодистого калия, проверенного на отсутствие йода, растворяют в 2 см3
дистиллированной воды, прибавляют 5 см3 серной кислоты (1:4), затем
10 см3 0,01 н. раствора двухромовокислого калия, добавляют 80 см3
дистиллированной воды, закрывают колбу пробкой, перемешивают и ставят в темное
место на 5 мин. Выделившийся йод титруют тиосульфатом натрия в присутствии 1 см3
крахмала, прибавленного в конце титрования.
Выделившийся йод титруют тиосульфатом натрия в присутствии 1 см3
крахмала, прибавленного в конце титрования.
2.3.8. Поправочный коэффициент (K) (0,01; 0,005 н. растворов серноватистокислого натрия) вычисляют по формуле
где v — количество серноватистокислого натрия, израсходованное на титрование, см3.
2.4. Проведение анализа
В коническую колбу насыпают 0,5 г йодистого калия,
растворяют его в 1 — 2 см3 дистиллированной воды, затем добавляют
буферый раствор в количестве, приблизительно равном полуторной величине
щелочности анализируемой воды, после чего добавляют 250 — 500 см3
анализируемой воды. Выделившийся йод оттитровывают 0,005 н. раствором
тиосульфата натрия из микробюретки до появления светло-желтой окраски, после
чего прибавляют 1 см3 0,5 %-ного раствора крахмала и раствор титруют
до исчезновения синей окраски. При определении щелочности воду предварительно
дехлорируют с помощью тиосульфата натрия в отдельной пробе.
При определении щелочности воду предварительно
дехлорируют с помощью тиосульфата натрия в отдельной пробе.
При концентрации активного хлора менее 0,3 мг отбирают для титрования большие объемы воды.
2.5. Обработка результатов
Содержание суммарного остаточного хлора (X), мг/дм3 вычисляют по формуле
где v — количество 0,005 н. раствора тиосульфата натрия, израсходованное на титрование, см3;
K — поправочный коэффициент нормальности раствора тиосульфата натрия;
0,177 — содержание активного хлора, соответствующее 1 см3 0,005 н. раствора тиосульфата натрия;
V — объем пробы воды, взятый для анализа, см3.
3.1. Сущность метода
Метод основан на окислении свободным хлором метилового
оранжевого, в отличие от хлораминов, окислительный потенциал которых
недостаточен для разрушения метилового оранжевого.
3.2. Аппаратура, материалы, реактивы
Посуда мерная лабораторная стеклянная по ГОСТ 1770 и ГОСТ 29251 вместимостью: колбы мерные 100 и 1000 см3; микробюретка с краном 5 см3.
Капельница по ГОСТ 25336.
Чашки фарфоровые выпарительные по ГОСТ 9147.
Кислота соляная по ГОСТ 3118, плотностью 1,19 г/см3.
Метиловый оранжевый (пара-диметиламиноазобензолсульфокислый натрий) по ТУ 6-09-5171.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, применяемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
3.3. Подготовка к анализу
3.3.1. Приготовление 0,005 %-ного раствора метилового оранжевого
50 мг метилового оранжевого растворяют в дистиллированной воде в мерной колбе и доводят дистиллированной водой до 1 дм3. 1 см3 этого раствора соответствует 0,0217 мг свободного хлора.
3. 3.2. Приготовление 5 н. раствора соляной кислоты
3.2. Приготовление 5 н. раствора соляной кислоты
В мерную колбу наливают дистиллированную воду, затем медленно добавляют 400 см3 соляной кислоты HCl и доводят дистиллированной водой до 1 дм3.
3.4. Проведение анализа
100 см3 анализируемой воды помещают в фарфоровую чашку, добавляют 2 — 3 капли 5 н. раствора соляной кислоты и, помешивая, быстро титруют раствором метилового оранжевого до появления неисчезающей розовой окраски.
3.5. Обработка результатов
Содержание свободного остаточного хлора (X1), мг/дм3, вычисляют по формуле
где v — количество 0,005 %-ного раствора метилового оранжевого, израсходованного на титрование, см3;
0,0217 — титр раствора метилового оранжевого;
0,04 — эмпирический коэффициент;
V — объем воды,
взятый для анализа, см3.
По разности между содержанием суммарного остаточного хлора, определенного методом титрования, метилоранжевым, находят содержание хлораминового хлора (Х2):
Х2 = X — Х1.
4.1. Сущность метода
Метод основан на способности разных видов хлора
превращать в определенных условиях восстановленную бесцветную форму
диэтилпарафенилендиамина в полуокисленную окрашенную форму, которую
восстанавливают опять до бесцветной ионами двухвалентного железа. Используются
серия титрований раствором соли Мора для определения свободного хлора,
монохлорамина и дихлорамина в присутствии диэтилпарафенилендиамина, как
индикатора. Свободный хлор образует окраску индикатора в отсутствии йодистого
калия, монохлорамин дает окраску в присутствии очень маленьких количеств
йодистого калия (2 — 3 мг), а дихлорамин образует окраску лишь в присутствии
больших количеств KI (около 1 г) и при стоянии раствора в течение 2 мин. По количеству раствора соли Мора, израсходованному на титрование, определяют
содержание того вида активного хлора, за счет которого образуется окрашенная
форма индикатора.
По количеству раствора соли Мора, израсходованному на титрование, определяют
содержание того вида активного хлора, за счет которого образуется окрашенная
форма индикатора.
4.2. Аппаратура, материалы, реактивы
Посуда мерная стеклянная лабораторная по ГОСТ 1770 и ГОСТ 29251 вместимостью: колбы мерные 100 и 1000 см3; цилиндры мерные 5 и 100 см3; микробюретки 1 и 2 см3.
Колбы конические вместимостью 250 мл; склянки из темного стекла вместимостью 100 — 200 см3.
Двойная сернокислая соль закиси железа и аммония (соль Мора) по ГОСТ 4208.
Калий йодистый по ГОСТ 4232.
Калий фосфорнокислый однозамещенный по ГОСТ 4198, х. ч.
Кислота серная по ГОСТ 4204.
Натрий фосфорнокислый двузамещенный безводный по ГОСТ 11773.
Трилон Б (комплексон III, двунатриевая соль этилендиаминтетрауксусной кислоты) по ГОСТ 10652.
Вода дистиллированная по ГОСТ 6709.
Диэтилпарафенилендиамин оксалат или сульфат.
Все реактивы, применяемые для анализа, должны быть квалификации «чистые для анализа» (ч. д. а.).
4.3. Подготовка к анализу
4.3.1. Приготовление стандартного раствора соли Мора
1,106 г соли Мора Fe(NH4)2(SO4)2 · 6H2O растворяют в дистиллированной воде, подкисляют 1 см3 25 %-ного раствора серной кислоты H2SO4 и доводят свежепрокипяченной и охлажденной дистиллированной водой до 1 дм3. 1 см3 раствора соответствует 0,1 мг активного хлора. Если определение проводится в 100 см3 воды, то количество миллилитров соли Мора, израсходованное на титрование, соответствует мг/дм3 хлора, или монохлорамина или дихлорамина. Раствор устойчив в течение месяца. Хранить его следует в темном месте.
4.3.2. Приготовление фосфатного буферного раствора
К 2,4 г фосфорнокислого натрия двузамещенного Na2HPO4 и 4,6 г фосфорнокислого калия однозамещенного КН2РО4
приливают 10 см3 0,8 %-ного раствора трилона Б и доводят дистиллированной
водой до 100 см3.
4.3.3. Приготовление индикатора диэтилпарафенилендиамин (оксалат или сульфат) 0,1 %-ного раствора
0,1 г диэтилпарафенилендиамина оксалата (или 0,15 г соли сульфата) растворяют в 100 см3 дистиллированной воды с добавлением 2 см3 10 %-ного раствора серной кислоты. Раствор индикатора следует хранить в склянке из темного стекла.
4.4. Проведение анализа
4.4.1. Определение содержания свободного хлора
В коническую колбу для титрования помещают 5 см3
фосфатного буферного раствора, 5 см3 раствора индикатора
диэтилпарафенилендиамин оксалата или сульфата и приливают 100 см3
анализируемой воды, раствор перемешивают. В присутствии свободного хлора
раствор окрашивается в розовый цвет, его быстро титруют из микробюретки
стандартным раствором соли Мора до исчезновения окраски, энергично перемешивая.
Расход соли Мора, пошедший на титрование (А, см3),
соответствует содержанию свободного хлора, мг/дм3.
При наличии в анализируемой воде значительных количеств свободного хлора (более 4 мг/дм3) для анализа следует брать менее 100 см3 воды, так как большие количества активного хлора могут разрушить полностью индикатор.
4.4.2. Определение содержания монохлорамина
В колбу с оттитрованным раствором добавляют кристаллик (2 — 3 мг) йодистого калия, раствор перемешивают. В присутствии монохлорамина мгновенно появляется розовая окраска, которую тотчас же оттитровывают стандартным раствором соли Мора. Количество миллилитров соли Мора, пошедших на титрование (B, см3), соответствует содержанию монохлорамина, мг/дм3.
4.4.3. Определение содержания дихлорамина
К оттитрованному раствору после определения содержания
монохлорамина вновь добавляют около 1 г йодистого калия, перемешивают до
растворения соли и оставляют раствор стоять в течение 2 мин. Появление розовой
окраски свидетельствует о наличии в воде дихлорамина. Раствор титруют
стандартным раствором соли Мора до исчезновения окраски. Расход соли Мора (С,
см3) соответствует содержанию дихлорамина, мг/дм3.
Раствор титруют
стандартным раствором соли Мора до исчезновения окраски. Расход соли Мора (С,
см3) соответствует содержанию дихлорамина, мг/дм3.
4.5. Обработка результатов
Содержание суммарного остаточного активного хлора (X3), мг/дм3, вычисляют по формуле
Х3 = A + B + C,
где А — содержание свободного хлора, мг/дм3;
В - содержание монохлорамина, мг/дм3;
С - содержание дихлорамина, мг/дм3.
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 25.10.72 № 1967
2. ВВЕДЕН ВПЕРВЫЕ
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД, на который дана ссыпка |
Номер пункта |
Обозначение НТД, на который дана ссыпка |
Номер пункта |
|
ГОСТ 61-75 |
2. |
ГОСТ 9147-80 |
3.2 |
|
ГОСТ 84-76 |
2.2 |
ГОСТ 10163-76 |
2.2 |
|
ГОСТ 1770-74 |
2.2, 3.2, 4.2 |
ГОСТ 10652-73 |
4.2 |
|
ГОСТ 2874-82 |
1.1 |
ГОСТ 11773-76 |
4.2 |
|
ГОСТ 3118-77 |
3. |
ГОСТ 24481-80 |
1.1 |
|
ГОСТ 4198-75 |
4.2 |
ГОСТ 25336-82 |
2.2, 3.2 |
|
ГОСТ 4204-77 |
2.2, 4.2 |
ГОСТ 27068-86 |
2.2 |
|
ГОСТ 4208-72 |
4.2 |
ГОСТ 29169-91 |
2.2 |
|
ГОСТ 4220-75 |
2. |
ГОСТ 29251-91 |
2.2, 3.2, 4.2 |
|
ГОСТ 4232-74 |
2.2, 4.2 |
ТУ 6-09-5171-84 |
3.2 |
|
ГОСТ 6709-72 |
2.2, 3.2, 4.2 |
4. Ограничение срока действия снято Постановлением Госстандарта СССР от 25.12.91 № 2120
5. ПЕРЕИЗДАНИЕ. Ноябрь 2009 г.
СОДЕРЖАНИЕ
Реактивы для гальваники | Сода кальцинированная
- Главная
- \ Продукты высшей категории (химия)
- \ Сода кальцинированная
СОДА КАЛЬЦИНИРОВАННАЯ «техн.
 «, марка Б, 1-й сорт, ГОСТ 5100-85
«, марка Б, 1-й сорт, ГОСТ 5100-85- Химическая формула: Na2CО3
- Внешний вид: Порошок белого цвета
- Синонимы: натрий углекислый, карбонат натрия
- CAS №: 497-19-8
- ГОСТ: 5100-85
- Квалификация : «Тех. Марка Б, сорт 1»
- Производитель: Россия
- Гарантийный срок хранения: марки Б — 6 мес, упакованной в мягкие специализированные контейнеры — 5 лет со дня изготовления.
- Фасовка: мешки 50 кг
Физико-химические показатели:
| Наименование показателя | Марка Б ОКП 21 3111 0100 | ||
|---|---|---|---|
| Высший | Первый | Второй | |
| Массовая доля углекислого натрия (Na2СО3), %, не менее | 99,4 | 99,0 | 99,0 |
| Массовая доля углекислого натрия (Na2СО3) в пересчете на непрокаленный продукт, %, не менее | 98,9 | 98,2 | 97,5 |
| Массовая доля потери при прокаливании (при 270-300) 0С, %, не более | 0,5 | 0,8 | 1,5 |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,4 | 0,5 | 0,8 |
| Массовая доля железа в пересчете на Fe2О3, %, не более | 0,003 | 0,003 | 0,008 |
| Массовая доля веществ, нерастворимых в воде, %, не более | 0,03 | 0,04 | 0,08 |
| Массовая доля сульфатов в пересчете на Na2SO2, %, не более | 0,04 | 0,05 | Не нормируется |
Заказать продукцию можно:
+7(495) 150-54-00
E-mail: zakaz@galvanik. ru
ruили отправить заявку нашим менеджерам
О реактивах
План
Растворы
Техника приготовления растворов
Растворы
Растворы весьма распространены в природе, технике, организмах человека и животных, с ними мы сталкиваемся повседневно и повсюду. Это и вода морей, океанов, рек, озер, воздух, которым мы дышим, металлические сплавы, используемые в авиации и космической технике, автомобилестроении, энергетике — чугун, сталь, бронзы, латунь, дюралюминий.
Химические процессы, известные с глубокой древности и изучаемые современными химиками и инженерами — технологами, в основном происходят в растворах. Растворы относятся к дисперсным системам.
Если в каком либо веществе (среде) распределено, в виде очень мелких частиц, другое вещество, то такая система называется дисперсной.
Примером сложной дисперсной системы может служить молоко, основными составными частями которого (не считая воду) являются жир, казеин и молочный сахар. Жир находится в виде эмульсии и при стоянии молока постепенно поднимается к верху (сливки). Казеин содержится в виде коллоидного раствора и самопроизвольно не выделяется, но легко может быть осажден (в виде творога) при подкислении молока, например, уксусом. В естественных условиях выделение казеина происходит при скисании молока. Наконец, молочный сахар находится в виде молекулярного раствора и выделяется лишь при испарении воды.
Жир находится в виде эмульсии и при стоянии молока постепенно поднимается к верху (сливки). Казеин содержится в виде коллоидного раствора и самопроизвольно не выделяется, но легко может быть осажден (в виде творога) при подкислении молока, например, уксусом. В естественных условиях выделение казеина происходит при скисании молока. Наконец, молочный сахар находится в виде молекулярного раствора и выделяется лишь при испарении воды.
Свойства дисперсных систем, в первую очередь их устойчивость, зависят от размеров распределенных частиц. Если последние очень велики по сравнению с размерами молекул, дисперсные системы не прочны и распределенное вещество сравнительно быстро оседает вниз или, если оно легче вещества среды, поднимается вверх. Такие системы называются взвесями.
Если распределенное вещество находится в состоянии молекулярного раздробления, системы получаются устойчивые, не разделяющиеся при сколь долгом стоянии. Такие системы называются молекулярными растворами или просто растворами.
Промежуточную область занимают коллоидные растворы, в которых размеры частиц находятся между размерами частиц взвесей и молекулярных растворов.
Наибольшее значение для химии имеют дисперсные системы, в которых средой является жидкая фаза.
Вся наша жизнь связана с водой, точнее, с водными растворами самых различных веществ. Нет ни одного факта, который показал бы возможность возникновения жизни без участия воды или без ее присутствия. Человек не может жить без воды.
Мы говорим «вода», но в действительности — это водный раствор. Даже если вода находится в металлическом сосуде, она содержит ионы (или атомы) этого металла, а это — раствор!
Раствор — это однофазная термодинамически равновесная система, состоящая из смеси двух или более веществ (компонентов). Это научное определение понятия «раствор». Все слова этого определения вам известны, и смысл их понятен. Вам следует только объединить понятия в одно общее представление.
В растворе все компоненты его находятся в виде молекул, ионов или небольших ассоциатов (небольших групп, скоплений, ансамблей) частиц.
Иногда растворы рассматривают как фазы переменного состава, в которых соотношение веществ может быть изменено в определенных пределах без появления новых фаз.
Растворы могут быть жидкими, твердыми (кристаллическими) и газообразными.
То вещество (тот компонент), которое находится в большем количестве по сравнению с другими, принято называть растворителем, а другие вещества раствора называют растворенными веществами.
Важнейшей характеристикой раствора является его состав, который выражается концентрацией растворенных компонентов.
Пользуются различными способами выражения концентрации.
Отношение массы данного вещества (компонента) к массе всего раствора (всей системы) есть долевая концентрация по массе. Если долевую концентрацию умножить на 100, то это будет процентная концентрация ( по массе). Иногда ее называют массовым процентом или процентом по массе. Так, 35% раствор — это раствор, в 100 г которого содержится 35 г растворенного вещества.
Иногда говорят о растворении металлов, например натрия в воде или цинка в соляной кислоте. Это не правильно, в данном случае образуется химическое соединение. Растворением называется только такой процесс, при котором растворенное вещество можно выделить из раствора в его исходном состоянии такими простыми операциями, как выпаривание растворителя, перекристаллизация и так далее.
Итак, растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Состав раствора, в отличие от химического соединения, может изменяться в широких пределах. В свойствах раствора проявляются ряд свойств его компонентов, что также не присуще химическим соединениям. К механическим смесям близко подходит непостоянство состава растворов, но от них они отличаются гомогенностью.
Процесс растворения кристаллических твердых тел протекает под влиянием молекул растворителя и колебательного движения частиц тела. Выравнивание концентрации растворенного вещества происходит по диффузионному механизму. Растворение с течением времени выравнивается по скорости с образным ему процессом кристаллизации. Наступает в итоге состояние динамического равновесия между числом перешедших в раствор и выделившихся из него молекул. Такой раствор называется насыщенным раствором.
Растворение с течением времени выравнивается по скорости с образным ему процессом кристаллизации. Наступает в итоге состояние динамического равновесия между числом перешедших в раствор и выделившихся из него молекул. Такой раствор называется насыщенным раствором.
Растворение большинства кристаллических тел в воде идет с поглощением теплоты, обусловленным большим расходом энергии на разрушение кристаллической решетки твердого тела, которая часто не компенсируется при образовании гидратированных ионов. Между тем растворение в воде гидроксидов натрия, калия и др. сопровождается сильным разогревом раствора. Тепловой эффект реакции гидратации КОН составляет +54 кДж (ДН= —54 кДж).
Растворимостью вещества называется его способность образовывать однородную систему с другим веществом, являющимся растворителем.
Растворимость жидкостей в жидкости бывает неограниченной и ограниченной. Для первого вида это система «спирт—вода», для второго — «эфир—вода». После встряхивания эфира с водой происходит расслоение, что можно наблюдать на опыте по образованию границы раздела между двумя растворами: водный раствор эфира (внизу) и эфирный раствор воды (вверху).
После встряхивания эфира с водой происходит расслоение, что можно наблюдать на опыте по образованию границы раздела между двумя растворами: водный раствор эфира (внизу) и эфирный раствор воды (вверху).
Приведем некоторые виды растворов, определяемые качественными и количественными параметрами растворенного вещества и растворителя.
По массе растворенного вещества растворы подразделяют на разбавленные и концентрированные (условно). К разбавленным можно отнести растворы, содержащие один или менее моль растворенного вещества в 1 л раствора. При этом насыщенным называется раствор, концентрация которого при определенной температуре отвечает растворимости вещества. Если для растворения взято больше этого количества то избыток будет находиться в осадке. Между осадком и раствором устанавливается подвижное равновесие. В ненасыщенном растворе концентрация растворенного вещества ниже его растворимости.
Содержание вещества в насыщенном растворе при данной температуре является критерием его растворимости. Чаще всего эту величину выражают как массу в граммах безводного вещества, содержащегося в 100 г растворителя в насыщенном растворе. Ее называют коэффициентом растворимости.
Чаще всего эту величину выражают как массу в граммах безводного вещества, содержащегося в 100 г растворителя в насыщенном растворе. Ее называют коэффициентом растворимости.
В некоторых случаях возможно также образование пересыщенных растворов, которые содержат избыток растворенного вещества. Такие растворы образуются путем длительного охлаждения насыщенных растворов и представляют собой неустойчивые (лабильные) системы, при внесении в которые затравки в виде кристаллика соли или другого соединения, а также при встряхивании или сотрясении раствора происходит лавинная кристаллизация основной массы растворенного в избытке вещества. Этот опыт относится к очень наглядным и демонстрационным, в частности, его производят на примере раствора иодида свинца, образующего красивые тонкие чешуйки золотисто-желтого цвета.
По характеру взаимодействия растворенного вещества с растворителем различают ионные и молекулярные растворы. В первых растворяемое вещество представлено в виде молекул и продуктов их диссоциации на ионы. Во вторых — в виде молекул и их ассоциатов. Например, водные растворы соляной кислоты 10%, 12%, 14%, 20%, 33%, 4%, сульфата кальция, гидроксида калия 20%, 30%, 45%, 50% — ионные, растворы глюкозы, альбумина, кислорода в воде — молекулярные.
Во вторых — в виде молекул и их ассоциатов. Например, водные растворы соляной кислоты 10%, 12%, 14%, 20%, 33%, 4%, сульфата кальция, гидроксида калия 20%, 30%, 45%, 50% — ионные, растворы глюкозы, альбумина, кислорода в воде — молекулярные.
Ионные растворы, или растворы электролитов, относятся к проводникам электричества II рода, т. е. им присуща ионная проводимость. Это растворы солей, кислот, оснований, а также их расплавы и некоторые соединения в виде твердых тел.
По степени диссоциации электролиты относят к сильным (? > 30%), слабым (? < 3%) и средним (3% < ? < 30%). Сила электролитов и их растворимость не коррелируют друг с другом, так как малорастворимые соли, например РbSO4, относятся к сильным электролитам ввиду высокой степени ионизации молекул, находящихся в растворе. К сильным электролитам относятся кислоты НСlO4, НС1, Н2SO4, НNО3, щелочи КОН, NаОН, Са(ОН)2, большинство хорошо растворимых в воде солей — Са(НСO3)2, FеSO4, МgСl2 и др.
К средним электролитам принадлежат НF, Н2SО3, Н3РO4, НСООН, к слабым — Н2СО3, Н2S, СН3СООН, НCN, NН4ОН, Fе(СNS)3 и др. Это деление в некоторой мере зависит от природы растворителя, температуры и концентрации раствора. При разбавлении водой возрастает ?, к такому же результату приводит повышение температуры раствора, приводящее к усилению разрыва молекул на ионы.
Техника приготовления растворов
Независимо от того, какие готовят растворы, применять следует только чистые растворители. Если растворителем служит вода, то необходимо применять только дистиллированную или деминерализованную воду, а в отдельных случаях даже бидистиллят или специально очищенную дистиллированную воду.
Предварительно готовят соответствующие емкости (посуду), в которых будут готовить и хранить получаемый раствор. Посуда должна быть чистой.
Перед приготовлением растворов нужно подготовить по возможности два одинаковых сосуда: один — для растворения, а другой — для хранения раствора. Может случиться, что раствор нужно будет отфильтровывать от какого-либо осадка или примеси, не растворившейся в данных условиях.
Вымытый сосуд полезно предварительно проградуировать.
Для растворения следует применять по возможности чистые вещества. Готовые растворы обязательно проверяют на содержание нужного вещества и, если это будет необходимо, поправляют растворы, т. е. добавляют в них недостающее количество вещества или воды.
Нужно принимать меры для защиты приготовленных растворов от попадания в них пыли или газов, с которыми могут реагировать некоторые растворы. Так, щелочи следует защищать от двуокиси углерода, для этого бутыль со щелочью снабжают хлоркальциевой трубкой, заполненной натронной щелочью или аскаритом.
При хранении бутыли или другая посуда обязательно должны быть закрыты предварительно подобранными пробками.
При особо точных и ответственных анализах следует обязательно принимать во внимание возможность выщелачивания стекла и применять, если это допустимо, кварцевую посуду или такую, стекло которой не содержало бы искомый элемент. Так, неизбежна ошибка при определении бора, цинка, алюминия, свинца и некоторых других элементов в посуде из стекла, содержащего эти элементы.
В некоторых случаях растворы следует хранить в атмосфере инертного газа, как азот, или в атмосфере двуокиси углерода. Для этого существуют специальные устройства или особые бюретки, приспособленные для каждого случая титрования.
Щелочные растворы нельзя оставлять надолго в фарфоровой и особенно — в стеклянной посуде.
Растворы кислот
При разбавлении кислот следует помнить, что нужно приливать кислоту к воде, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Кислота — это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Рассмотрим растворы некоторых кислот.
Раствор соляной кислоты 10%, 12%, 14%, 20%, 33%, 4% — один из самых широко используемых растворов кислот. Его используют при очистке сплавов различных металлов, в гальванике, для очистки и дезинфекции, в пищевой промышленности и медицине.
Раствор серной кислоты — используется при изготовлении минеральных удобрений, электролита для свинцовых аккумуляторов, при создании искусственных волокон, в нефтехимической и нефтеперерабатывающей промышленности.
Раствор фосфорной кислоты — используется для производства удобрений, при очистке металлов, в текстильном производстве, при создании искусственных материалов, выплавке стекла, для производства медикаментов и в других отраслях промышленности.
Растворы щелочей
Если вещество содержит гидроксильную группу (ОН), которая может отщепляться (подобно отдельному «атому») в реакциях с другими веществами, то такое вещество является основанием. Существует много оснований, которые состоят из атома какого-либо металла и присоединенных к нему гидрокси-групы. Например:
Гидроксильные группы одновалентны, поэтому формулу основания легко составить по валентности металла. К химическому символу металла надо приписать столько гидрокси-групп, какова валентность металла. Большинство оснований — ионные соединения.
Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.
Существует также основание, в котором гидроксильная группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в реакции присоединения воды к аммиаку, когда аммиак растворяют в воде:
NH3 + H2O = NH4OH (гидроксид аммония).
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей «мыльные» на ощупь и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками. При растворении щелочи происходит сильное разогревание, в особенности в тех местах, где лежат куски ее. Чтобы растворение шло быстрее, раствор следует все время перемешивать.
Концентрированные растворы щелочей сильно выщелачивают стекло, поэтому хранение осуществляется в полиэтиленовой таре
Если раствор щелочи все-таки попал в лицо, необходимо промыть глаза большим количеством воды, а затем разбавленным раствором слабой кислоты (например, борной).
Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH — гидроксид калия (едкое кали), NaOH — гидроксид натрия (едкий натр), LiOH — гидроксид лития, Ca(OH)2 — гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 — гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
Щелочами называются растворимые в воде сильные основания.
Раствор гидроокиси калия 20%, 30%, 45%, 50% — используется для производства метана, изготовления Калий — Литиевого электролита для щелочных аккумуляторов, в целлюлозном производстве и еще многих отраслях промышленности. Незаменимо это вещество в лабораторной практике: с его помощью выявляется уровень кислотности сред.
Раствор гидроокиси натрия (каустической соды, едкого натра) — один из наиболее широко используемых щелочных растворов. Использование его настолько широко что перечисление займет не одну страницу. Это и моющие средства используемые как в пищевой промышленности, так и дома, это и бумажное производство, и производство современного вида топлива, это химическая и нефтехимическая промышленность, и так далее.
Приготовление растворов у нас
Реакции элементов основной группы с карбонатами
Карбонат-ионы образуются при реакции угольной кислоты с металлами или органическими соединениями. В этом случае объясняется реакция карбонатов с элементами основной группы и ее продуктами — солями.
Рисунок 1: Карбонат-ион.Химические характеристики
В общем, наиболее распространенными элементами основной группы, используемыми в качестве карбонатов, являются щелочные и щелочные металлы. Карбонаты всех основных групп, кроме Na, K, Rb и Cs, нестабильны при нагревании и нерастворимы в воде.Обычно все карбонаты растворимы в кислоте из-за образования бикарбонат-иона. Его обычный внешний вид представляет собой белый порошок. В основном карбонаты используются в качестве сырья в различных промышленных процессах, таких как разработка лекарств, производство стекла, целлюлозно-бумажная промышленность, химикаты натрия (силикаты), производство мыла и моющих средств, бумажная промышленность, умягчение воды, производство глины и бетона, среди прочего. . Другие карбонаты, такие как карбонат бериллия (BeCO 3 ) и карбонат таллия (Tl 2 CO 3 ), считаются токсичными и используются в производстве фунгицидов и ядов.
Из основных элементов группы наиболее часто используются карбонат натрия (\ (Na_2CO_3 \)) и карбонат кальция (\ (CaCO_3 \)).
Карбонат натрия , известный как кальцинированная сода, является очень важным промышленным химическим веществом. В основном его получают методом Solvay process путем химической реакции известняка (CaCO3) и хлорида натрия (NaCl).
2 NaCl + CaCO 3 → Na 2 CO 3 + CaCl
Na 2 CO 3 обычно используются в производстве стекла, целлюлозно-бумажной промышленности, химикатов натрия (силикаты), производстве мыла и моющих средств, бумажной промышленности и в производстве умягчителей воды.
Карбонат кальция — основная составляющая известняка (осадочная порода), и его чистое состояние достигается в три этапа путем прокаливания известняка и последующей реакции с водой и диоксидом углерода.
Ca (OH) 2 (с) + CO 2 (водный) → CaCO 3 (с) + H 2 O (л)
Карбонат кальция обычно используется в производстве стекла, текстиля, красок, бумаги и пластика, в производстве герметиков, для производства чернил и герметиков.Он также используется как пищевая добавка (не токсичен), как средство для разработки лекарств и производства мела.
Карбонатная жесткость
Жесткая вода — это термин, используемый в отношении большого количества неорганических соединений, таких как карбонаты, бикарбонаты, сульфаты или хлориды в воде. Присутствие в воде высоких уровней карбонатов и бикарбонатов определяется как временная жесткость воды. Считается жесткой водой, когда это неорганическое соединение превышает приблизительное значение 100 мг / л, и обычно выражается как количество карбоната кальция, присутствующего в воде.Это важно, когда вода используется в промышленных целях или в целях очистки.
Осаждение образуется, когда неорганические соединения в присутствии высокомолекулярных органических соединений (например, мыла) производят нежелательные нерастворимые осадки. Эти осадки являются причиной грязного или серовато-белого цвета и низкой эффективности чистящих средств.
Другой способ образования осадков — повышение температуры жесткой воды; его неорганические соединения, такие как карбонат кальция, осаждаются, оставляя отложенное покрытие в водопроводных трубах или над котлами.Вот пример того, что происходит:
Ca 2 + (водн.) + 2HCO 3 — (водн.) → CaCO 3 (с) + H 2 O + CO 2
Один из способов уменьшить временную жесткость, такую как ионы кальция, — это кипячение или добавление гидроксида кальция (извести), но он не часто используется. Лучший способ смягчить воду — это добавить в воду кальцинированную соду или использовать ионообменную колонку.
Карбонаты в моющих средствах
Некоторые карбонаты, такие как карбонат натрия или карбонаты калия, используются для создания некоторых моющих средств.Кальцинированная сода (другое название карбоната натрия) используется, поскольку с одной стороны это дешево, а также помогает смягчить воду за счет осаждения карбонатов кальция и магния. Карбонаты калия используются из-за его растворимости.
Карбонаты в производстве стекла
Некоторые неорганические соединения, такие как карбонат кальция, карбонат натрия и карбонат калия, используются в качестве необработанного материала для изготовления стекла из-за их химических характеристик, высокого качества и низкой цены. Карбонаты кальция и карбонаты натрия используются в качестве сырья при производстве бумаги из-за их низкой стоимости за счет их использования вместо целлюлозы, а также для улучшения белизны и глянца бумаги.
Группа 1: Щелочные металлы и карбонаты (X
2 CO 3 )— реакция между Li, Na, K, Rb и Cs с CO 3 . Все, кроме лития, растворимы в воде и устойчивы к нагреванию.
Карбонат лития ( Li 2 CO 3 )
- Использование: разработка лекарств.
- Химические характеристики:
- Низкая растворимость в воде.
- Нестабильно к нагреванию.
- Внешний вид: белый порошок без отдушек
Карбонат натрия ( Na 2 CO 3 )
- Область применения: стекольная, целлюлозно-бумажная промышленность, химикаты натрия (силикаты), производство мыла и моющих средств, бумажная промышленность и производство умягчителей воды.
- Известен как кальцинированная сода
- Очень важный промышленный химикат
- Химические характеристики:
- Гигроскопичное вещество
- Растворим в воде
- Устойчив к нагреву
- Внешний вид: кристально-белый твердый
Карбонат калия ( K 2 CO 3 )
- Область применения: производство стекла, производство мягкого мыла, текстильная и фотохимия.
- Характеристики:
- гигроскопичен.
- Растворим в воде.
- Может нагреваться до высокой температуры. температуры.
- Внешний вид: белое твердое вещество
Карбонат рубидия ( Rb 2 CO 3 )
- Область применения: производство стекла, производство короткоцепочечного спирта.
- Характеристики:
- Гигроскопичное вещество
- Растворим в воде.
- Растворим в воде.
- Можно нагревать до высоких температур.
- Внешний вид: белое твердое вещество.
Карбонат цезия ( Cs 2 CO 3 )
- Использование: производство прочих солей цезия.
- Характеристики:
- Вещество гигроскопичное.
- Растворим в воде.
- Можно нагревать до высоких температур.
- Внешний вид: белый порошок.
Группа 2: Щелочноземельные металлы и карбонаты (XCO
3 )Это реакция между Be, Mg, Ca, Sr и Ba с CO3. Все они нерастворимы в воде и неустойчивы к нагреванию.
Карбонат бериллия ( BeCO 3 )
Карбонат магния ( MgCO 3 )
- Область применения: средства по уходу за кожей, косметика, противопожарные средства, мел для лазания.
- Характеристики:
- Не растворим в воде.
- Вещество гигроскопичное.
- Внешний вид: белое твердое вещество.
Карбонат кальция ( CaCO 3 )
- Области применения: текстильная, лакокрасочная, бумажная, пластмассовая, герметизирующая промышленность. Используется для производства чернил и герметиков. Используется как пищевая добавка (нетоксичная), при разработке лекарств и производстве мела.
- Главный компонент известняка (осадочная порода).
- Характеристики:
- Ответственный за жесткую воду.
- Низкая растворимость в воде.
- Растворим в кислотах.
- Внешний вид: белый порошок.
Карбонат стронция ( SrCO 3 )
- Область применения: фейерверки, производство магнитов и керамики.
- Характеристики:
- Низкая растворимость в воде.
- Реагирует с кислотами.
- Нейтрализует кислоты.
- Вещество гигроскопичное.
- Внешний вид: белый порошок без запаха.
Карбонат бария ( BaCO 3 )
- Область применения: стекло, цемент, керамика, фарфор, производство крысиного яда.
- Характеристики:
- Низкая растворимость в воде.
- Внешний вид: белые кристаллы.
Группа 13: Семейство бора и карбонаты (X
2 CO 3 )Реакция между Al и Tl с CO 3 .Оба нерастворимы в воде и неустойчивы к нагреванию.
Карбонат алюминия ( Al 2 ( CO 3 ) 3 )
- Использование: разработка лекарств.
- Химические характеристики:
- Внешний вид: белый порошок.
Карбонат таллия ( Tl 2CO 3 )
- Область применения: производство фунгицидов.
- Характеристики:
- Токсично.
- Внешний вид: белые кристаллы без запаха.
Группа 14: Семейство углерода и карбонаты (XCO
3 )Реакция между Pb и CO 3 . Нерастворим в воде и неустойчив к нагреванию.
Карбонат свинца ( PbCO 3 )
- Область применения: стекло, цемент, керамика, фарфор, производство крысиного яда.
- Характеристики:
- Токсично.
- Низкая растворимость в воде.
- Внешний вид: белый порошок.
Список литературы
- Chemistry, B Ричард Сибринг, Нью-Йорк, 1965, MacMillan
- Общая химия: принципы и современные приложения, Ральф Х. Петруччи, (10-е издание).
- Энциклопедия химии Ван Ностранда, Гленн Д. Консидайн, Хобокен, Нью-Джерси: Wiley-Interscience, 5-е изд.
- www.omya.com
- www.nssga.org
Проблемы
1) Какие обычные карбонаты используются в качестве сырья?
Карбонат кальция и карбонат натрия
2) Растворимы ли карбонаты в воде?
Карбонаты всех основных групп, за исключением Na, K, Rb и Cs, нерастворимы в воде.
3) Какой карбонат влияет на жесткость воды?
Карбонат кальция чаще всего
4) Какой карбонат можно использовать в качестве смягчителя жесткой воды?
Карбонат натрия (кальцинированная сода)
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Элементы воды для пивоварения
Карбонат и бикарбонат (CO3 и HCO3)
Карбонат считается наиболее важным ионом для любого зернового пивоварения.Карбонат (или бикарбонат), который во многих отчетах о воде выражается как «общая щелочность», — это ион, определяющий кислотность затора. Это также является основным фактором, определяющим уровень «временной жесткости» воды. Если уровень карбоната слишком низкий, затор будет слишком кислым, особенно при использовании более темного солода (который имеет более высокую кислотность). Если карбонат будет слишком высоким, эффективность затора снизится. Рекомендуемые уровни составляют 25-50 мг / л для светлого пива и 100-300 мг / л для более темного пива. Обратите внимание, что бикарбонаты и временную жесткость можно уменьшить, предварительно закипев воду — осадок, выпадающий после кипячения, в основном состоит из бикарбоната.
Натрий (Na)
Натрий придает пиву консистенцию и приятные ощущения во рту, но если его использовать в избытке, он приобретет соленый привкус морской воды. Вода с высоким содержанием натрия часто поступает из бытовых умягчителей воды, поэтому большинство пивоваров не рекомендуют замешивать ее умягченной водой. Уровни натрия в диапазоне 10-70 мг / л являются нормальными, а уровни до 150 мг / л могут улучшить солодовое тело и полноту, но уровни выше 200 мг / л нежелательны.
Хлорид (CI)
Хлорид, как и натрий, при низких концентрациях также улучшает вкусовые качества и сложность пива.Хлор часто используется в городских системах водоснабжения для дезинфекции, а также может достигать высоких концентраций из-за использования отбеливателя в качестве дезинфицирующего средства для пивоварения. Сильно хлорированная вода будет иметь лечебный или хлороподобный привкус, который нежелателен для готового пива. Нормальный уровень пивоварения должен быть ниже 150 мг / л и никогда не должен превышать 200 мг / л. Если городская вода сильно хлорирована, концентрацию можно уменьшить с помощью угольного фильтра или путем предварительного кипячения воды в течение 20-30 минут перед использованием.
Сульфат (SO4)
Сульфат играет важную роль в выявлении хмелевой горечи и добавляет сухой, резкий, хмелевой профиль хорошо охмеленному пиву.Он также играет второстепенную роль в снижении pH затора, но эффект намного меньше, чем при использовании карбонатов, поскольку сульфат имеет лишь слабую щелочность. Высокий уровень сульфата создаст нежелательный вяжущий профиль. Нормальные уровни составляют 10-50 мг / л для пилснеров и светлого пива и 30-70 мг для большинства элей. Уровни от 100 до 130 мг / л используются в стилях Вены и Дортмундер для усиления горечи, а в пейл-элях Burton on Trent используются концентрации до 500 мг / л.
Кальций (Ca)
Кальций — это основной ион, определяющий «постоянную жесткость» воды.Кальций играет множество ролей в процессе пивоварения, включая снижение pH во время затирания, помощь в осаждении белков во время кипячения, повышение стабильности пива, а также действие в качестве важного питательного вещества для дрожжей. Уровни кальция в диапазоне 100 мг / л очень желательны, и следует рассмотреть вопрос о добавках, если профиль воды имеет уровни кальция ниже 50 мг / л. Диапазон от 50 до 150 мг / л является предпочтительным для пивоварения.
Магний (Mg)
Магний является важным питательным веществом для дрожжей, если используется в небольших количествах.Он также ведет себя как кальций, повышая жесткость воды, но это второстепенная роль. Уровни в диапазоне 10-30 мг / л желательны, в первую очередь, для помощи дрожжам. Уровни выше 30 мг / л придадут пиву сухой, терпкий или кисло-горький вкус.
Ниже приведены различные концентрации в воде Игана. Большинство компонентов указано в миллиграммах на литр (мг / л), что эквивалентно одной части на миллион (ppm).
The Critical Seven
Щелочность, карбонат (CO3)……………………… от 1,3 до 1,7 мг / л
Щелочность, бикарбонат (HCO3) ………. ………………… 270 мг / л
Натрий (Na) ………………. …………………….. от 3,75 до 4,50 мг / л
Хлорид (Cl) ………… …………………………… от 6,58 до 15,7 мг / л
Сульфат (SO4) ….. ……………………………….. от 13,0 до 19,4 мг / л
Кальций (Ca) ………………………………………….. ……. 170 мг / л
Магний (Mg)…………………………………. от 110 до 120 мг / л
Другое Уровни химического состава воды
Общие
Растворенный кислород …………………………… от 9,12 до 12,0 мг / L
pH ………………………………………. ………….. от 7,7 до 7,8 единиц
Твердость ……………………….. ………………. от 290 до 300 мг / л
Редокс-потенциал ………………… ……………….. от 529 до 659 мВ
Температура…………………………………. от 10,7 до 14,8 ° C
Неорганическое, не -металлы
Щелочность, общая …………………………………… …….. 270 мг / л
Бромид …………………………….. …………. от 0,02 до 0,09 мг / л
Азот, аммиак, общий …………………… ………. 0,02 мг / л
Азот, нитрат плюс нитрит, общий …… Менее 0,05 мг / л
Азот, нитрит, общий …………………… Менее 0,01 мг / л
Фосфаты, всего ………………….. ……….. от 0,03 до 0,05 мг / л
Неорганические, металлы
Мышьяк …………………. ………………….. Менее 0,01 мг / л
Барий ……………… ………………………….. от 0,08 до 0,24 мг / л
Железо ……… ………………………………………. от 0,04 до 0,60 мг / Л
Марганец ……………………………………. от 0,01 до 0,35 мг / л
Калий …………………………….. ……… от 1,62 до 6,84 мг / л
Стронций ………………………….. ………….. от 0,09 до 0,52 мг / л
Органический
Органический углерод, общий ………………. ……… Менее 1 мг / л
Регулировка воды
Для разных сортов пива требуются разные профили воды. Можно разбавить водопроводную воду дистиллированной водой, если количество ионов слишком велико для целевого профиля воды.Аналогичным образом можно использовать добавки для повышения уровня ключевых ионов. Популярные добавки включают поваренную соль (NaCl), гипс (CaSO4), хлорид кальция (CaCl), английскую соль (MgSO4), пищевую соду (NaHCO3) и мел (CaCO3). К сожалению, добавки не добавляют прямое количество ионов к профилю воды, поэтому лучше использовать какой-нибудь инструмент профиля воды, чтобы определить корректировки для достижения целевого профиля. Обычно для достижения целевого профиля требуется всего несколько граммов добавок.
Спасибо BeerSmith за основу для этой статьи — http: // beersmith.com / blog / 2008/08/24 / brewing-water-hard-or-soft /
% PDF-1.3 % 547 0 объект> эндобдж xref 547 143 0000000016 00000 н. 0000003634 00000 н. 0000003699 00000 н. 0000003889 00000 н. 0000004064 00000 н. 0000004230 00000 н. 0000004395 00000 н. 0000004431 00000 н. 0000004641 00000 п. 0000005019 00000 н. 0000005228 00000 п. 0000005606 00000 н. 0000006818 00000 н. 0000008051 00000 н. 0000009239 00000 п. 0000010486 00000 п. 0000010508 00000 п. 0000010671 00000 п. 0000010880 00000 п. 0000012168 00000 п. 0000013379 00000 п. 0000014242 00000 п. 0000015567 00000 п. 0000016366 00000 п. 0000029982 00000 н. 0000032316 00000 п. 0000050512 00000 п. 0000050533 00000 п. 0000050554 00000 п. 0000051353 00000 п. 0000051389 00000 п. 0000051411 00000 п. 0000057644 00000 п. 0000057855 00000 п. 0000058097 00000 п. 0000058264 00000 п. 0000058286 00000 п. 0000062657 00000 п. 0000062864 00000 н. 0000062942 00000 п. 0000063107 00000 п. 0000063129 00000 п. 0000065082 00000 п. 0000065284 00000 п. 0000065310 00000 п. 0000065331 00000 п. 0000065606 00000 п. 0000065758 00000 п. 0000065780 00000 п. 0000067675 00000 п. 0000067878 00000 п. 0000067944 00000 п. 0000068104 00000 п. 0000068236 00000 п. 0000068686 00000 п. 0000068707 00000 п. 0000068728 00000 п. 0000069527 00000 н. 0000069563 00000 п. 0000069585 00000 п. 0000073198 00000 п. 0000073406 00000 п. 0000073600 00000 п. 0000073765 00000 п. 0000073787 00000 п. 0000075822 00000 п. 0000076024 00000 п. 0000076051 00000 п. 0000076072 00000 п. 0000076347 00000 п. 0000076499 00000 н. 0000076521 00000 п. 0000078475 00000 п. 0000078678 00000 п. 0000078816 00000 п. 0000078976 00000 п. 0000078998 00000 п. 0000083914 00000 п. 0000084125 00000 п. 0000084267 00000 п. 0000084433 00000 п. 0000084561 00000 п. 0000085175 00000 п. 0000085196 00000 п. 0000085217 00000 п. 0000086016 00000 п. 0000086052 00000 п. 0000086074 00000 п. 0000088109 00000 п. 0000088311 00000 п. 0000088338 00000 п. 0000088359 00000 п. 0000088634 00000 п. 0000088786 00000 п. 0000088808 00000 п. 00000
00000 п. 00000 00000 п. 0000091103 00000 п. 0000091263 00000 н. 0000091285 00000 п. 0000096104 00000 п. 0000096315 00000 п. 0000096461 00000 п. 0000096627 00000 н. 0000096649 00000 н. 0000100262 00000 н. 0000100470 00000 н. 0000100664 00000 н. 0000100829 00000 н. 0000100961 00000 п. 0000101539 00000 н. 0000101560 00000 н. 0000101581 00000 н. 0000102380 00000 п. 0000102416 00000 н. 0000102438 00000 н. 0000107126 00000 н. 0000107337 00000 н. 0000107547 00000 н. 0000107714 00000 н. 0000107736 00000 п. 0000111349 00000 н. 0000111557 00000 н. 0000111751 00000 н. 0000111916 00000 н. 0000111938 00000 н. 0000113972 00000 н. 0000114174 00000 н. 0000114201 00000 н. 0000114222 00000 п. 0000114497 00000 н. 0000114649 00000 н. 0000114671 00000 н. 0000116625 00000 н. 0000116828 00000 н. 0000116966 00000 н. 0000117126 00000 н. 0000117256 00000 н. 0000117760 00000 н. 0000117781 00000 н. 0000117803 00000 н. 0000117826 00000 н. 0000003156 00000 н. трейлер ] >> startxref 0 %% EOF 689 0 obj> поток xlQ; HAl.? 0o {
Определение структурной формулы трис-карбонатокобальтата (III) натрия, Na3 [Co (CO3) 3] · 3h3O методом термогравиметрии
Bauer HF, Drinkard WC. Общий синтез комплексов кобальта (III). Новое промежуточное соединение, Na 3 [Co (CO 3 ) 3 ] · 3H 2 O. J Am Chem Soc. 1960; 82: 5031–2.
CAS Статья Google ученый
McCutcheon TP, Schuele WJ. Комплексные кислоты кобальта и хрома.Зеленые анионы карбонатокобальта (III). J Am Chem Soc. 1953; 75: 1845–6.
CAS Статья Google ученый
Menger FM, Erlington AR. Органическая реакционная способность в микроэмульсионных системах. J Am Chem Soc. 1991; 113: 9621–4.
CAS Статья Google ученый
Джонассон И.Р., Линкольн С.Ф., Странкс Д.Р. Протонный магнитный резонанс и препаративное исследование триметилендиаминовых комплексов кобальта (III).Aust J Chem. 1970; 23: 2267–78.
CAS Статья Google ученый
Springborg J, Schaffer CE. Новый метод получения комплексов дианионбис (диамин) кобальта (III). Acta Chem Scand. 1973; 27: 2223–5.
CAS Статья Google ученый
Эль-Шобаки Г.А., Ахмад А.С., Аль-Ноами А.Н., Эль-Шобаки Х.Г. Термическое разложение основных карбонатов кобкальта и меди.Термическая стабильность образующихся оксидов под действием гамма-излучения. J Therm Anal. 1996. 46 (6): 1801–1808.
CAS Статья Google ученый
Geue RJ, Snow MR. Строение и конформационный анализ координационных комплексов II. Рентгеновская кристаллическая структура цис [карбонатобис (триметилендиамин-кобальт (III)] перхлората и конформационный анализ комплексов триметилендиамина. J Chem Soc A. 1971; 19: 2981–7.
Article Google ученый
Болдуин Д.С., Битти Дж. К., Колман Л. М., Джонс ДР. Гидролиз эфиров фосфорной кислоты, опосредованный минеральными фазами. Environ Sci Technol. 1995. 29 (6): 1806–17089.
Артикул Google ученый
Tafesse F, Deppa NC. Полиметаллические комплексы в микроэмульсиях для гидролиза 4-нитрофенилфосфата: биомиметическая модель обеззараживания органофосфатов в окружающей среде. Ecotoxicol Environ Saf. 2004. 58 (2): 260–6.
CAS Статья Google ученый
Tafesse F. Гидролиз стимуляторов нервно-паралитического действия синергетическим действием тетрааминкобальта (III) и микроэмульсий. Inorg Chim Acta. 1998. 269 (2): 287–91.
CAS Статья Google ученый
Шомакер Р. Дж., Стикдорн К., Шомакер Р. Микроэмульсии в технических процессах. Chem Rev.1995; 95: 849–64.
Артикул Google ученый
Базоло Ф.Спектры поглощения некоторых координационных соединений кобальта (III). J Am Chem Soc. 1950; 72: 4393–7.
CAS Статья Google ученый
Jordan AB, Sargeson AM, Taube H. Механизм реакции карбонатопентааминкобальта (III) с двухвалентными ионами. Inorg Chem. 1966. 5 (3): 486–8.
CAS Статья Google ученый
Tafesse F, Massoud SS, Milburn RM.Гидролиз аденозин-5’трифосфата (АТФ), стимулируемый высокореактивными ионами гидроксоакво (3,3 ‘, 3 дюйма, триаминопропропиламин) кобальта (III). Закономерности реактивности и механистическое рассмотрение. Inorg Chem. 1985; 24: 2591–3.
CAS Статья Google ученый
Hubner PWA, Milburn RM. Гидролиз пирофосфата до ортофосфата под действием кобальта (III). Доказательства роли многоядерных видов. Inorg Chem. 1980; 19: 1267–72.
Артикул Google ученый
Tafesse F, Massoud SS, Milburn RM. Эффекты аминного лиганда в ионе гидроксоакватетрааминкобальта (III) способствовали гидролизу аденозинтрифосфата. Inorg Chem. 1993; 32: 1864–5.
CAS Статья Google ученый
Wangilia G, Jordan RB. Удобный источник гексааквакобальта (III). Inorg Chim Acta. 2003; 343: 347–50.
Артикул Google ученый
Эль-Асри С., Лагзизил А., Алауи А., Саояби А., Хамди Р.М., Эль-Аббасси К. и др. Структура и термическое поведение марокканского фосфорита (Bengurir). J Therm Anal Calorim. 2009; 95: 15–9.
CAS Статья Google ученый
Howell BA. Использование термогравиметрии для изучения механизма реакции. J Therm Anal Calorim. 2008; 93: 27–34.
CAS Статья Google ученый
Кислота | химическое соединение | Британника
Азотная кислота, HNO 3 , была известна алхимикам 8 века как «аквафортис» (крепкая вода).Он образуется при реакции пятиокиси азота (N 2 O 5 ) и двуокиси азота (NO 2 ) с водой. Небольшие количества азотной кислоты обнаруживаются в атмосфере после грозы, а ее соли, называемые нитратами, широко распространены в природе. Огромные залежи нитрата натрия NaNO 3 , также известного как чилийская селитра, обнаружены в пустынном районе недалеко от границы Чили и Перу. Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов).Нитрат калия, KNO 3 , иногда называемый бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотная кислота может быть получена в лаборатории путем нагревания нитратной соли, такой как упомянутые выше, с концентрированной серной кислотой; Например, NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 . Поскольку HNO 3 кипит при 86 ° C (187 ° F), а H 2 SO 4 кипит при 338 ° C (640 ° F), а NaNO 3 и NaHSO 4 являются нелетучими солями, азотная кислота легко удаляется перегонкой.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасВ промышленных масштабах азотная кислота производится по методу Оствальда. Этот процесс включает окисление аммиака, NH 3 , до оксида азота, NO, дальнейшее окисление NO до диоксида азота, NO 2 , а затем преобразование NO 2 в азотную кислоту (HNO 3 ) . Это поточный процесс, в котором смесь аммиака и избыточного воздуха нагревается до 600–700 ° C (от 1100 до 1300 ° F) и проходит через платино-родиевый катализатор.(Катализатор увеличивает скорость реакции, но сам не расходуется на нее.) Когда происходит окисление до NO, эта газовая смесь буквально горит пламенем. Дополнительный воздух добавляется для окисления NO до NO 2 . NO 2 , избыток кислорода и инертный азот из воздуха пропускаются через водяную струю, где HNO 3 и NO образуются в виде непропорционального NO 2 . Газообразный NO рециркулирует в процессе с большим количеством воздуха, а жидкая HNO 3 отводится и концентрируется.Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производятся в США в промышленных масштабах, при этом большая часть производится по методу Оствальда.
В чистом виде азотная кислота представляет собой бесцветную жидкость, которая кипит при 86 ° C (187 ° F) и замерзает при -42 ° C (-44 ° F). Под воздействием света или тепла он разлагается с образованием кислорода, воды и смеси оксидов азота (в основном NO 2 ). 4HNO 3 + свет (или тепло) → 4ΝΟ 2 + 2H 2 O + O 2 Следовательно, азотная кислота часто имеет желтый или коричневый цвет из-за NO 2 , который образуется при разложении.Азотная кислота стабильна в водном растворе, и 68-процентные растворы кислоты (т.е. 68 граммов HNO 3 на 100 граммов раствора) продаются как концентрированные HNO 3 . Это одновременно сильный окислитель и сильная кислота. Неметаллические элементы, такие как углерод (C), йод (I), фосфор (P) и сера (S), окисляются концентрированной HNO 3 до их оксидов или оксикислот с образованием NO 2 ; Например, S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O.Кроме того, многие соединения окисляются HNO 3 . Соляная кислота, водная HCl, легко окисляется концентрированной HNO 3 до хлора, Cl 2 , и диоксида хлора, ClO 2 . Царская водка («королевская вода»), смесь одной части концентрированной HNO 3 и трех частей концентрированной HCl, активно вступает в реакцию с металлами. Использование этой смеси алхимиками для растворения золота зарегистрировано еще в 13 веке.
Действие азотной кислоты на металл обычно приводит к восстановлению кислоты (т.е.е., снижение степени окисления азота). Продукты реакции определяются концентрацией HNO 3 , металлом (т.е. его реакционной способностью) и температурой. В большинстве случаев образуется смесь оксидов азота, нитратов и других продуктов восстановления. Относительно инертные металлы, такие как медь (Cu), серебро (Ag) и свинец (Pb), восстанавливают концентрированную HNO 3 в основном до NO 2 . Реакция разбавленной HNO 3 с медью дает NO, тогда как более химически активные металлы, такие как цинк (Zn) и железо (Fe), реагируют с разбавленной HNO 3 с образованием N 2 O.При использовании очень разбавленной HNO 3 может образоваться газообразный азот (N 2 ) или ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
Нитраты, представляющие собой соли азотной кислоты, образуются при взаимодействии металлов или их оксидов, гидроксидов или карбонатов с азотной кислотой. Большинство нитратов растворимы в воде, и азотная кислота в основном используется для производства растворимых нитратов металлов.Все нитраты разлагаются при нагревании и могут привести к взрыву. Например, при нагревании нитрата калия (KNO 3 ) образуется нитрит (соединение, содержащее NO 2 —) и выделяется газообразный кислород. 2KNO 3 + тепло → 2KNO 2 + O 2 При нагревании нитратов тяжелых металлов образуется оксид металла, как, например, в 2Cu (NO 3 ) 2 + тепло → 2CuO + 4NO 2 + O 2 . Нитрат аммония, (NH 4 ) 2 NO 3 , образует закись азота, N 2 O, и особенно опасен при нагревании или взрыве.
Азотная кислота широко используется в лабораториях и в химической промышленности как сильная кислота и как окислитель. Кислота широко используется при производстве взрывчатых веществ, красителей, пластмасс и лекарств. Нитраты ценны как удобрения. Порох представляет собой смесь нитрата калия, серы и древесного угля. Аммонал, взрывчатое вещество, представляет собой смесь нитрата аммония и алюминиевого порошка.
Простое приготовление аналога берлинской лазури Co3 [Co (CN) 6] 2 с точной настройкой температуры перехода цвета в качестве термохромного материала
Для термохромных материалов всегда стремятся к тонкой настройке термохромных свойств, чтобы полностью реализовать их потенциал.Однако на сегодняшний день выполнение точной настройки все еще остается большой проблемой, и о ней редко сообщается. В настоящей работе аналог берлинской лазурки Co 3 [Co (CN) 6 ] 2 с точной настройкой температуры перехода цвета синтезирован простым влажным химическим методом. Просто регулируя количество цитрата натрия в системе, часть молекул воды лиганда, координированных с решеткой Co ( II ), может быть заменена цитратом, что подтверждается расчетами DFT и экспериментальными результатами, что приводит к переходу цвета по сравнению с температура как реакция на координационное изменение содержания Со в окружающей среде ( II ).Наконец, осуществляется точная настройка температуры перехода цвета от 40 до 80 ° C с изменением цвета с розового на синий при нагревании. Помимо настраиваемой температуры перехода цвета, высокая скорость перехода цвета и долговременная стабильность были также достигнуты благодаря пористой и стабильной структуре решетки Co 3 [Co (CN) 6 ] 2 . Насколько нам известно, это первый отчет о металлоорганическом каркасе (MOF) с регулируемым обратимым термохромным свойством, и настоящая контролируемая стратегия может быть расширена до получения других подобных материалов.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова? .
 9971 г/моль … Википедия
9971 г/моль … Википедия по п.3.4
по п.3.4
 2.2. Карбонат и гидрокарбонат натрия, сульфат натрия
2.2. Карбонат и гидрокарбонат натрия, сульфат натрия Кроме того, кальцинированная сода способна умягчать жесткую воду, связывая ионы кальция и магния и переводя их соли в водорастворимые соединения. Карбонат натрия применяется в безводной форме без примесей тяжелых металлов (они ухудшают цвет моющего средства). Выпускаемая кальцинированная сода первого сорта содержит [в % (масс.)]: карбоната натрия — не менее 99,4, хлоридов натрия — не более 0,45, нерастворимых в воде примесей — не более 0,03.
Кроме того, кальцинированная сода способна умягчать жесткую воду, связывая ионы кальция и магния и переводя их соли в водорастворимые соединения. Карбонат натрия применяется в безводной форме без примесей тяжелых металлов (они ухудшают цвет моющего средства). Выпускаемая кальцинированная сода первого сорта содержит [в % (масс.)]: карбоната натрия — не менее 99,4, хлоридов натрия — не более 0,45, нерастворимых в воде примесей — не более 0,03.

 2
2
 2
2 2
2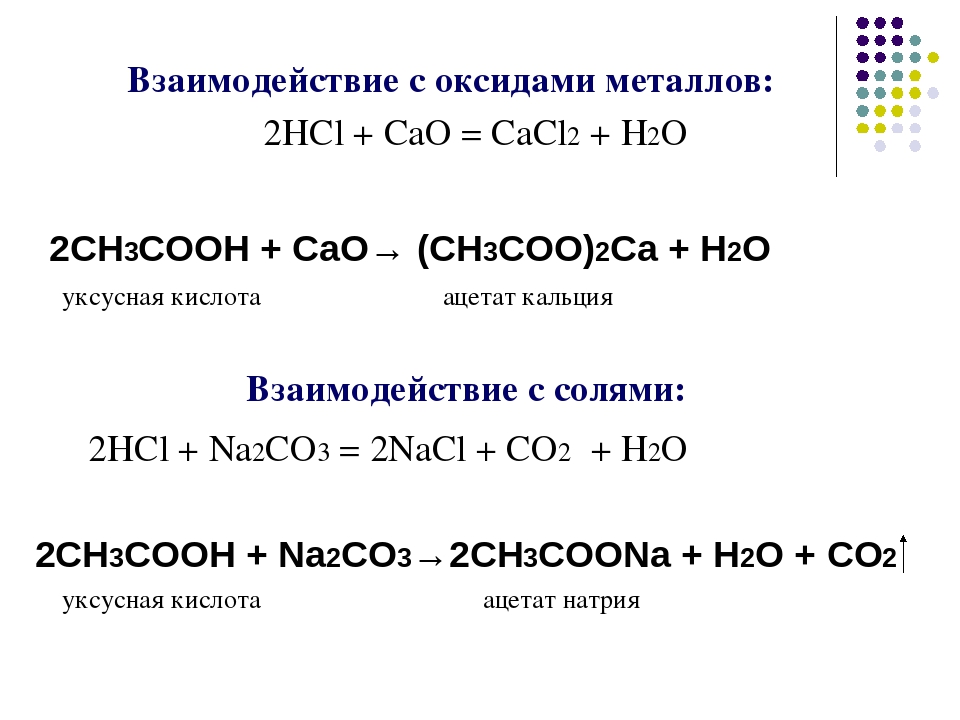 2
2