Натрий: химические свойства и получение
Натрий — это щелочной металл, серебристо-белого цвета. Легкий, очень мягкий, низкая температура плавления.
Относительная молекулярная масса Mr = 22,990; относительная плотность по твердому состоянию d = 0,968; относительная плотность по жидкому состоянию d = 0, 27; tпл = 97,83º C; tкип = 886º C.
1. Натрий получают в промышленности электролизом расплава гидроксида натрия, в результате образуется натрий, кислород и вода:
4NaOH → 4Na + O2↑ + 2H2O
Качественная реакция на натрий — окрашивание пламени солями натрия в желтый цвет.
Натрий — активный металл; на воздухе реагирует с кислородом и покрывается оксидной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Натрий — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
1.1. Натрий легко реагирует с галогенами с образованием галогенидов:
2Na + I2 = 2NaI
1.2. Натрий реагирует с серой с образованием сульфида натрия:
2Na + S = Na2S
1.3. Натрий активно реагирует с фосфором и водородом. При этом образуются бинарные соединения — фосфид натрия и гидрид натрия:
3Na + P = Na3P
2Na + H2 = 2NaH
1.4. С азотом натрий реагирует при температуре 100º С и электрическом разряде с образованием нитрида:
6Na + N2 = 2Na3N
1. 5. Натрий реагирует с углеродом с образованием карбида:
5. Натрий реагирует с углеродом с образованием карбида:
2Na + 2C = Na2C2
1.6. При взаимодействии с кислородом при температуре 250–400º C натрий образует пероксид натрия:
2Na + O2 = Na2O2
2. Натрий активно взаимодействует со сложными веществами:
2.1. Натрий реагирует с водой. Взаимодействие натрия с водой приводит к образованию щелочи и водорода:
2Na0 + 2H2O = 2Na+OH + H20
2.2. Натрий взаимодействует с кислотами. При этом образуются соль и водород.
Например, натрий реагирует с разбавленной соляной кислотой:
2Na + 2HCl = 2NaCl + H2 ↑
2.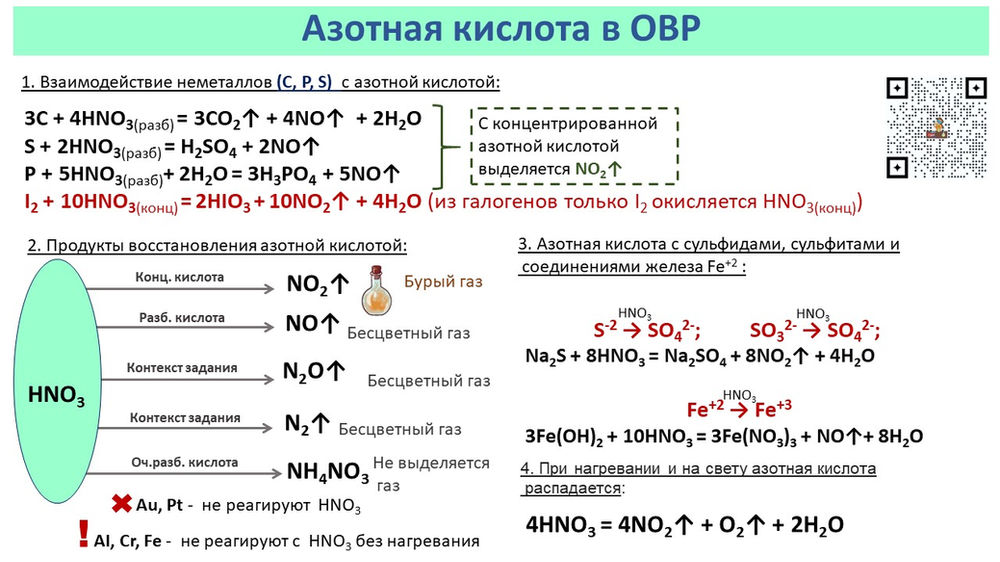 3. Натрий может реагировать с аммиаком, при этом образуются амид натрия и водород:
3. Натрий может реагировать с аммиаком, при этом образуются амид натрия и водород:
2Na + 2NH3 = 2NaNH2 + H2 ↑
2.4. Натрий может взаимодействовать с гидроксидами:
Например, натрий взаимодействует с гидроксидом натрия при температуре 600º С:
2Na + 2NaOH = 2Na2O + H2
Понравилось это:
Нравится Загрузка…
свойства, соединения, применение, получение, содержание, месторождение
НАТРИЙ, Na (лат. Natrium, от араб. натрун, греч. nitron, первоначально — природная сода * а. sodium, natrium; н. Natrium; ф. sodium; и. sodio), — химический элемент I группы периодической системы Менделеева; атомный номер 11, атомная масса 22,98977; относится к щелочным металлам. В природе встречается один стабильный изотоп 23Na. Соединения натрия известны с глубокой древности. Металлический натрий впервые получил (1807) английский учёный Г. Дэви.
Соединения натрия известны с глубокой древности. Металлический натрий впервые получил (1807) английский учёный Г. Дэви.
Физические свойства натрия
Натрий — серебристо-белый мягкий металл, кристаллизуется в объёмно-центрированной кубической решётке (а=0,428 нм). Плотность 968 кг/м3, t плавления 97,83°С, t кипения 882,9°С, коэффициент теплопроводности 1,32•102 Вт/(м•К), удельная теплоёмкость 1,23•103 Дж/(кг•К) при 20°С, удельное электрическое сопротивление 4,3•10-8 Ом•м (20°С), температурный коэффициент линейного расширения 7,1•10-5 К-1. Твердость по Moocy 0,5.
Химические свойства натрия
Степень окисления +1. Твёрдый натрий на воздухе быстро окисляется, жидкий — загорается. Хранят под слоем смеси парафина с трансформаторным маслом, бензина или керосина, очищенных от влаги и кислорода, в атмосфере аргона или азота, а также в запаянных стеклянных ампулах. Известен пероксид Na2О2. С водой натрий бурно реагирует с образованием гидроксида и водорода. Натрий, взаимодействуя с галогенами, даёт галогениды, с водородом, серой и азотом (при электрическом разряде) — соответственно гидрид, сульфид и нитрид. Натрий и его гидроксид взаимодействуют с неорганическими кислотами с образованием солей. Натрий растворяется в аммиаке, давая аммиачные комплексы. Известно большое число натрийорганических соединений, используемых в качестве алкилирующих агентов в органическом синтезе. Натрий входит в состав многих сплавов.
С водой натрий бурно реагирует с образованием гидроксида и водорода. Натрий, взаимодействуя с галогенами, даёт галогениды, с водородом, серой и азотом (при электрическом разряде) — соответственно гидрид, сульфид и нитрид. Натрий и его гидроксид взаимодействуют с неорганическими кислотами с образованием солей. Натрий растворяется в аммиаке, давая аммиачные комплексы. Известно большое число натрийорганических соединений, используемых в качестве алкилирующих агентов в органическом синтезе. Натрий входит в состав многих сплавов.
Реклама
Нахождение в природе
Натрий — очень распространённый литофильный элемент (шестое место среди химических элементов), его кларк 2,64 по массе. Известно свыше 220 минералов натрия различных классов (полевые шпаты, плагиоклазы, галит, селитра, тенардит, мирабилит). Распространённость (в % по массе) натрия в каменных метеоритах 7•10-1, в ультраосновных породах — 5,7•10-1, в основных — 1,94, в средних — 3,0, в кислых — 2,77, в глинах — 9,6•10-1, в песчаниках — 3,3•10-1, в карбонатных породах — 4•10-2, в океанической воде — 1,03534. При интенсивном испарении в замкнутых морских бассейнах (например, лагунах), солёных озёрах в степях и пустынях образуются мощные отложения солей натрия, имеющих большое практическое значение (см. Галогенные породы). Натрий участвует в минеральном обмене всех живых организмов. Суточная потребность человека в хлориде натрия — 2-10 г. Основные генетические типы месторождений и схемы обогащения см. в ст. Каменная соль.
При интенсивном испарении в замкнутых морских бассейнах (например, лагунах), солёных озёрах в степях и пустынях образуются мощные отложения солей натрия, имеющих большое практическое значение (см. Галогенные породы). Натрий участвует в минеральном обмене всех живых организмов. Суточная потребность человека в хлориде натрия — 2-10 г. Основные генетические типы месторождений и схемы обогащения см. в ст. Каменная соль.
Получение и применение
Получают натрий термохимическим восстановлением соединений, содержащих этот металл, или электролизом расплавов NaCl с добавлением CaCl2 и BaCl2 и др. или расплавов NaOH с добавлением Na2CO3.
Натрий и его сплавы используются как теплоносители для процессов, требующих равномерного обогрева (например, в ядерных энергетических установках). Na2О2 применяется для получения кислорода в регенерационных устройствах. В металлургической промышленности натрий служит восстановителем при выделении некоторых редких элементов (Ti, Zr, Ta). Натрий — источник свечения в натриевых газоразрядных лампах. Соли натрия находят большое применение в различных отраслях народного хозяйства.
Натрий — источник свечения в натриевых газоразрядных лампах. Соли натрия находят большое применение в различных отраслях народного хозяйства.
Натрий | Факты, использование и свойства
натрий
Посмотреть все СМИ
- Ключевые люди:
- сэр Хамфри Дэви Жозеф-Луи Гей-Люссак Рудольф Фиттиг
- Похожие темы:
- химический элемент щелочной металл дефицит натрия натрий-22 натрий-24
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
натрий (Na) , химический элемент группы щелочных металлов (группа 1 [Ia]) периодической таблицы. Натрий — очень мягкий серебристо-белый металл. Натрий является наиболее распространенным щелочным металлом и шестым по распространенности элементом на Земле, составляющим 2,8 процента земной коры. Он широко встречается в природе в соединениях, особенно в поваренной соли — хлориде натрия (NaCl), который образует минерал галит и составляет около 80% растворенных компонентов морской воды.
| atomic number | 11 |
|---|---|
| atomic weight | 22.9898 |
| melting point | 97.81 °C (208 °F) |
| boiling point | 882.9 ° C (1621 °F) |
| удельный вес | 0,971 (20 °C) |
| степени окисления | +1, −1 (редко) |
| 2-8-1 или 1 S 2 2 S 2 2 P 6 3 S 1 |
 В 1807 году сэр Хамфри Дэви первым получил натрий в его элементарной форме, применив электролиз к расплавленному гидроксиду натрия (NaOH). Натрий является важным компонентом ряда силикатных материалов, таких как полевые шпаты и слюды. В разных частях света имеются огромные залежи каменной соли, а в Чили и Перу — месторождения нитрата натрия. Содержание натрия в море составляет примерно 1,05%, что соответствует концентрации примерно 3% галогенидов натрия. Натрий идентифицирован как в атомарной, так и в ионной формах в спектрах звезд, в том числе Солнца, и в межзвездной среде. Анализ метеоритов показывает, что присутствующий силикатный материал имеет среднее содержание примерно 4,6 атома натрия на каждые 100 атомов кремния.
В 1807 году сэр Хамфри Дэви первым получил натрий в его элементарной форме, применив электролиз к расплавленному гидроксиду натрия (NaOH). Натрий является важным компонентом ряда силикатных материалов, таких как полевые шпаты и слюды. В разных частях света имеются огромные залежи каменной соли, а в Чили и Перу — месторождения нитрата натрия. Содержание натрия в море составляет примерно 1,05%, что соответствует концентрации примерно 3% галогенидов натрия. Натрий идентифицирован как в атомарной, так и в ионной формах в спектрах звезд, в том числе Солнца, и в межзвездной среде. Анализ метеоритов показывает, что присутствующий силикатный материал имеет среднее содержание примерно 4,6 атома натрия на каждые 100 атомов кремния.Легче воды, натрий можно резать ножом при комнатной температуре, но он становится хрупким при низких температурах. Он легко проводит тепло и электричество и проявляет фотоэлектрический эффект (испускание электронов при воздействии света) в заметной степени.
Натрий является наиболее коммерчески важным щелочным металлом. Большинство процессов производства натрия включают электролиз расплавленного хлорида натрия. Недорогой и доступный в автоцистернах элемент используется для производства присадок к бензину, полимеров, таких как нейлон и синтетический каучук, фармацевтических препаратов и ряда металлов, таких как тантал, титан и кремний. Он также широко используется в качестве теплообменника и в натриевых лампах. Желтый цвет натриевой лампы и натриевого пламени (основа аналитического теста для натрия) идентифицируется двумя заметными линиями в желтой части светового спектра.
Большинство процессов производства натрия включают электролиз расплавленного хлорида натрия. Недорогой и доступный в автоцистернах элемент используется для производства присадок к бензину, полимеров, таких как нейлон и синтетический каучук, фармацевтических препаратов и ряда металлов, таких как тантал, титан и кремний. Он также широко используется в качестве теплообменника и в натриевых лампах. Желтый цвет натриевой лампы и натриевого пламени (основа аналитического теста для натрия) идентифицируется двумя заметными линиями в желтой части светового спектра.
Существенные области применения
Два из первых применений металлического натрия были в производстве цианида натрия и пероксида натрия. Значительные количества тетраэтилсвинца использовались в производстве в качестве добавки к бензину, но этот рынок исчез с появлением неэтилированного бензина. Значительные количества натрия используются в производстве алкилсульфатов натрия в качестве основного ингредиента синтетических моющих средств.
Натрий также используется в качестве исходного материала при производстве гидрида натрия (NaH) и боргидрида натрия (NaBH 4 ). Кроме того, натрий используется в производстве красителей и их промежуточных продуктов, в синтезе отдушек и в различных органических восстановителях. Он используется при очистке углеводородов и при полимеризации ненасыщенных углеводородов. Во многих органических применениях натрий используется в виде дисперсий в жидких углеводородных средах.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Расплавленный натрий является отличным теплоносителем, и благодаря этому свойству он нашел применение в качестве теплоносителя в жидкометаллических реакторах-размножителях на быстрых нейтронах. Натрий широко используется в металлургии в качестве раскислителя и восстановителя для получения кальция, циркония, титана и других переходных металлов. Промышленное производство титана включает восстановление тетрахлорида титана (TiCl 4 ) с натрием. Продукты представляют собой металлический Ti и NaCl.
Продукты представляют собой металлический Ti и NaCl.
Основные соединения
Натрий обладает высокой реакционной способностью, образуя широкий спектр соединений почти со всеми неорганическими и органическими анионами (отрицательно заряженными ионами). Обычно он имеет степень окисления +1, и его единственный валентный электрон легко теряется, образуя бесцветный катион натрия (Na + ). Также были синтезированы соединения, содержащие анион натрия Na — . Основными коммерческими соединениями натрия являются хлорид, карбонат и сульфат.
Наиболее важным и известным соединением натрия является хлорид натрия, или поваренная соль, NaCl. Большинство других соединений натрия получают прямо или косвенно из хлорида натрия, который содержится в морской воде, в природных рассолах и в виде каменной соли. Большие количества хлорида натрия используются в производстве других тяжелых (промышленных) химикатов, а также используются непосредственно для удаления льда и снега, для кондиционирования воды и в продуктах питания.
Другие основные коммерческие применения хлорида натрия включают его использование в производстве хлора и гидроксида натрия путем электролитического разложения и в производстве карбоната натрия (Na 2 CO 3 ) по методу Solvay. Электролиз водного хлорида натрия дает гипохлорит натрия, NaOCl, соединение натрия, кислорода и хлора, используемое в больших количествах в бытовых хлорных отбеливателях. Гипохлорит натрия также используется в качестве промышленного отбеливателя для бумажной массы и текстиля, для хлорирования воды и в некоторых лекарственных препаратах в качестве антисептика и фунгицида. Это нестабильное соединение известно только в водном растворе.
Карбонаты содержат карбонат-ион (CO 3 2– ). Бикарбонат натрия, также называемый гидрокарбонатом натрия или бикарбонатом соды, NaHCO 3 , является источником двуокиси углерода и поэтому используется в качестве ингредиента разрыхлителей, шипучих солей и напитков, а также в качестве основного компонента сухих напитков. химические огнетушители. Его легкая щелочность делает его полезным при лечении повышенной кислотности желудка или мочевыводящих путей и ацидоза. Он также используется в некоторых промышленных процессах, таких как дубление и подготовка шерсти. Карбонат натрия, или кальцинированная сода, Na 2 CO 3 , широко распространен в природе, встречается в составе минеральных вод и в виде твердых минералов натрона, трона и термонатрита. Большие количества этой щелочной соли используются в производстве стекла, моющих и чистящих средств. Карбонат натрия обрабатывают двуокисью углерода с получением бикарбоната натрия. Моногидрат карбоната натрия Na 2 CO 3 · H 2 O широко используется в фотографии в качестве компонента проявителей.
химические огнетушители. Его легкая щелочность делает его полезным при лечении повышенной кислотности желудка или мочевыводящих путей и ацидоза. Он также используется в некоторых промышленных процессах, таких как дубление и подготовка шерсти. Карбонат натрия, или кальцинированная сода, Na 2 CO 3 , широко распространен в природе, встречается в составе минеральных вод и в виде твердых минералов натрона, трона и термонатрита. Большие количества этой щелочной соли используются в производстве стекла, моющих и чистящих средств. Карбонат натрия обрабатывают двуокисью углерода с получением бикарбоната натрия. Моногидрат карбоната натрия Na 2 CO 3 · H 2 O широко используется в фотографии в качестве компонента проявителей.
Сульфат натрия, Na 2 SO 4 , представляет собой белое кристаллическое твердое вещество или порошок, используемый в производстве крафт-бумаги, картона, стекла и моющих средств, а также в качестве сырья для производства различных химических веществ. Его получают либо из месторождений сульфатно-натриевых минералов мирабилита и тенардита, либо синтетически путем обработки хлорида натрия серной кислотой. Кристаллизованный продукт представляет собой гидрат Na 2 SO 4 · 10H 2 O, широко известный как глауберова соль. Тиосульфат натрия (гипосульфит натрия), Na 2 S 2 O 3 , используется фотографами для фиксации проявленных негативов и отпечатков; он действует, растворяя часть солей серебра, нанесенных на пленку, которые остаются неизменными под воздействием света.
Его получают либо из месторождений сульфатно-натриевых минералов мирабилита и тенардита, либо синтетически путем обработки хлорида натрия серной кислотой. Кристаллизованный продукт представляет собой гидрат Na 2 SO 4 · 10H 2 O, широко известный как глауберова соль. Тиосульфат натрия (гипосульфит натрия), Na 2 S 2 O 3 , используется фотографами для фиксации проявленных негативов и отпечатков; он действует, растворяя часть солей серебра, нанесенных на пленку, которые остаются неизменными под воздействием света.
Гидроксид натрия (NaOH) представляет собой едкое белое кристаллическое твердое вещество, которое легко поглощает влагу до тех пор, пока не растворится. Гидроксид натрия, обычно называемый едким натром или щелочью, является наиболее широко используемой промышленной щелочью. Он сильно разъедает ткани животных и растений. Щелочные растворы, которые он образует при растворении в воде, нейтрализуют кислоты в различных промышленных процессах: при переработке нефти он удаляет серную и органические кислоты; в мыловарении реагирует с жирными кислотами. Растворы NaOH используются при обработке целлюлозы и в производстве многих химических веществ.
Растворы NaOH используются при обработке целлюлозы и в производстве многих химических веществ.
Нитрат натрия, или нитрат натрия, NaNO 3 , обычно называют чилийской селитрой из-за месторождений полезных ископаемых в северной части Чили, основного источника. Нитрат натрия используется как азотное удобрение и как компонент динамита.
Обзор, применение, побочные эффекты, меры предосторожности, взаимодействие, дозировка и обзоры
Обзор
Натрий — это тип металла, который всегда встречается в виде соли. Наиболее распространенной диетической формой является хлорид натрия. Хлорид натрия обычно называют поваренной солью.
На поваренную соль приходится 90% потребления натрия с пищей в США. Натрий помогает сбалансировать уровень жидкости и электролитов в организме. Этот баланс может повлиять на кровяное давление и здоровье почек и сердца.
Люди используют натрий в виде вдыхаемого хлорида натрия при муковисцидозе. Он также используется при низком уровне натрия, для предотвращения токсичности почек, вызванной препаратом амфотерицином В, и при многих других состояниях, но нет убедительных научных данных, подтверждающих многие из этих других применений.
Он также используется при низком уровне натрия, для предотвращения токсичности почек, вызванной препаратом амфотерицином В, и при многих других состояниях, но нет убедительных научных данных, подтверждающих многие из этих других применений.
Не путайте натрий с бикарбонатом натрия. Это не то же самое.
Использование и эффективность ?
Вероятно, эффективен для
- Муковисцидоз. Использование ингалятора хлорида натрия в течение длительного времени вместе с лекарствами для расширения дыхательных путей уменьшает проблемы с легкими и улучшает качество жизни у людей с муковисцидозом.
Возможно эффективен для
- Поражение почек, вызванное противогрибковым препаратом (нефротоксичность амфотерицина В). Введение раствора хлорида натрия перорально или внутривенно людям, получающим амфотерицин В, помогает предотвратить проблемы с почками, вызванные этим препаратом. Препараты для внутривенного вливания может вводить только поставщик медицинских услуг.

Есть интерес к использованию натрия для ряда других целей, но нет достаточно надежной информации, чтобы сказать, может ли это быть полезным.
Побочные эффекты
При приеме внутрь : Натрий, вероятно, безопасен для большинства людей при использовании в дозах менее 2,3 грамма в день. У некоторых людей натрий может повышать артериальное давление. Натрий, возможно, небезопасен при приеме в дозах, превышающих 2,3 грамма в день. Большие дозы могут привести к накоплению слишком большого количества натрия в организме. Это может вызвать серьезные побочные эффекты, включая высокое кровяное давление и сердечные заболевания.
При нанесении на кожу : Недостаточно надежной информации, чтобы знать, безопасен ли натрий или какие могут быть побочные эффекты.
При попадании в глаза : Недостаточно надежной информации, чтобы знать, безопасен ли натрий или каковы могут быть побочные эффекты.
Особые меры предосторожности и предупреждения
При приеме внутрь : Натрий, вероятно, безопасен для большинства людей при приеме в дозах менее 2,3 грамма в день. У некоторых людей натрий может повышать артериальное давление. Натрий, возможно, небезопасен при приеме в дозах, превышающих 2,3 грамма в день. Большие дозы могут привести к накоплению слишком большого количества натрия в организме. Это может вызвать серьезные побочные эффекты, включая высокое кровяное давление и сердечные заболевания.
При нанесении на кожу : Недостаточно надежной информации, чтобы знать, безопасен ли натрий или какие могут быть побочные эффекты.
При попадании в глаза : Недостаточно надежной информации, чтобы знать, безопасен ли натрий или каковы могут быть побочные эффекты.
Беременность и кормление грудью : Натрий безопасно принимать перорально в дозах менее 1,5 грамма в день во время беременности или кормления грудью. Но натрий, возможно, небезопасен при приеме в больших количествах. Большие дозы увеличивают риск высокого кровяного давления.
Но натрий, возможно, небезопасен при приеме в больших количествах. Большие дозы увеличивают риск высокого кровяного давления.
Дети : Натрий, вероятно, безопасен для большинства детей при правильном приеме внутрь. Натрий безопасен при использовании в дозах менее 1,2 грамма в день у детей в возрасте 1-3 лет, 1,5 грамма в день у детей 4-8 лет, 1,8 грамма в день у детей 9-13 лет и 2,3 грамма в день у подростков. Натрий, возможно, небезопасен при приеме в больших количествах. Большие дозы увеличивают риск высокого кровяного давления.
Расстройство, связанное с употреблением алкоголя : Люди, употребляющие чрезмерное количество алкоголя, должны потреблять натрий в умеренных количествах. Потребление натрия может увеличить риск высокого кровяного давления.
Сердечно-сосудистые заболевания : Людям с сердечно-сосудистыми заболеваниями следует употреблять натрий в умеренных количествах. Потребление натрия на уровне выше 2,3 грамма в день может увеличить риск сердечных заболеваний и смерти.
Высокий уровень натрия в организме : Прием натрия повышает уровень натрия в организме и может ухудшить это состояние.
Высокое кровяное давление : Прием большого количества натрия может повысить кровяное давление.
Заболевание почек : Людям с заболеванием почек следует ограничить потребление натрия. Потребление большого количества натрия может усугубить заболевание почек.
Рассеянный склероз (РС) : Потребление слишком большого количества соли в рационе может усугубить течение РС. Людям с рассеянным склерозом не следует употреблять максимально рекомендуемую дозу в 2,3 грамма в день.
Ожирение : Людям, страдающим ожирением или подверженным риску ожирения, следует употреблять натрий в умеренных количествах. Потребление большого количества натрия может привести к увеличению веса.
Слабые и ломкие кости (остеопороз) : Потребление слишком большого количества соли в рационе может усугубить остеопороз. Людям с остеопорозом следует употреблять меньше максимально рекомендуемой дозы в 2,3 грамма в день.
Людям с остеопорозом следует употреблять меньше максимально рекомендуемой дозы в 2,3 грамма в день.
Взаимодействие ?
Диданозин содержит натрий. Прием диданозина вместе с натрием может привести к повышению уровня натрия.
Увеличение потребления натрия может увеличить количество выводимого из организма лития. Но снижение потребления натрия может уменьшить количество выводимого лития из организма. Людям, принимающим литий, следует избегать значительных изменений в потреблении натрия без предварительной консультации с врачом.
Фосфаты натрия, которые иногда используются для очищения кишечника перед операцией, могут привести к повышению уровня натрия. Прием натрия вместе с этими лекарствами может увеличить этот риск.
 Людям следует избегать употребления большого количества натрия перед приемом лекарств для очистки кишечника.
Людям следует избегать употребления большого количества натрия перед приемом лекарств для очистки кишечника.Большие количества натрия могут повышать кровяное давление. Прием большого количества натрия может уменьшить действие лекарств от артериального давления. Внимательно следите за своим артериальным давлением.
Некоторые лекарства влияют на солевой и водный баланс в организме. Эти лекарства могут повышать уровень натрия. Прием этих лекарств вместе с натрием может привести к тому, что уровень натрия станет слишком высоким.
Толваптан — это лекарство, используемое для повышения уровня натрия у некоторых людей. Прием толваптана вместе с натрием может привести к слишком высокому уровню натрия.
Умеренное взаимодействие
Будьте осторожны с этой комбинацией
Дозировка
Натрий помогает сбалансировать уровень жидкости и электролитов в организме. Рекомендуется, чтобы взрослые 19лет и старше, в том числе беременным и кормящим грудью, употреблять по 1,5 г в день. Взрослым не следует потреблять более 2,3 грамма в день. Рекомендуемое количество для детей зависит от возраста. Поговорите с врачом, чтобы узнать, какая доза лучше всего подходит для конкретного состояния.
Рекомендуется, чтобы взрослые 19лет и старше, в том числе беременным и кормящим грудью, употреблять по 1,5 г в день. Взрослым не следует потреблять более 2,3 грамма в день. Рекомендуемое количество для детей зависит от возраста. Поговорите с врачом, чтобы узнать, какая доза лучше всего подходит для конкретного состояния.
Посмотреть ссылки
УСЛОВИЯ ИСПОЛЬЗОВАНИЯ И ВАЖНАЯ ИНФОРМАЦИЯ: Эта информация предназначена для дополнения, а не для замены рекомендаций вашего врача или поставщика медицинских услуг и не предназначена для охвата всех возможных способов использования, мер предосторожности, взаимодействий или побочных эффектов. Эта информация может не соответствовать состоянию вашего здоровья. Никогда не откладывайте и не пренебрегайте обращением за профессиональной медицинской консультацией к своему врачу или другому квалифицированному поставщику медицинских услуг из-за чего-то, что вы прочитали на WebMD. Вы всегда должны поговорить со своим врачом или медицинским работником, прежде чем начать, прекратить или изменить любую предписанную часть вашего плана медицинского обслуживания или лечения, а также определить, какой курс терапии подходит именно вам.


 Людям следует избегать употребления большого количества натрия перед приемом лекарств для очистки кишечника.
Людям следует избегать употребления большого количества натрия перед приемом лекарств для очистки кишечника.