Карбонат натрия — frwiki.wiki
Кристаллы карбоната натрия под поляризационным микроскопом.Карбонат натрия представляет собой тело неорганического химическое соединение , имеющее формулу Na 2 CO 3 и соответствующее природные минеральные виды называют natrite . Это представляет собой соль натрия из угольной кислоты , она представляет собой один из самых больших универсальных продуктов современной химии. На обыденном языке это ионное твердое вещество, чаще всего в порошкообразной форме, и его водные растворы, соответственно, называются содой и кристаллами соды — обычное название этой древней минеральной щелочи , использовавшейся в начале древней стекольной промышленности.
С другой стороны, карбонат натрия Na 2 CO 3 не следует путать с каустической содой NaOH (гидроксид натрия) или с бикарбонатом натрия NaHCO 3 , ранее широко известным как бикарбонат натрия .
Резюме
- 1 Получение
- 3 Токсичность
- 4 Использование
- 4.
 1 Бытовая химия
1 Бытовая химия - 4.2 В лаборатории
- 4.3 История
- 4.
- 5 Примечания и ссылки
- 6 См. Также
- 6.1 Библиография
- 6.2 Внешние ссылки
Получение
Натрия карбонат может быть получен из Natron отложений Na 2 (СО 3 ) • 10 H 2 O, часто хранится в геологическом заповеднике в виде термонатрита Na 2 (CO 3 ) • H 2 O, или троны Na 2 CO 3 • NaHCO 3 • 2H 2 O. В Древнем Египте он был обнаружен в цветке натрона Горьких озер или в выщелоченном золе многих растений Chenopodiaceae, растущих на почве . Salicornia на берегу Средиземноморья или различных растений берегов Атлантики, обычно называют натриево, получают путем сжигания золы , из которых растворимую соль или щелочи называется соды было получено . Это минеральная щелочь древних.
Это минеральная щелочь древних.
Щелочные пустыни и особенно их щелочные бессточные озера предлагают множество ресурсов карбоната натрия. К ним относятся море Магади в Кении , озеро Оуэнс и множество содовых или щелочных озер в Калифорнии, Орегоне , Британской Колумбии … Существует также множество древних озер, таких как озеро Сирлс .
Процесс Леблана был разработан между 1771 и 1791 годами. Он бурно процветал после 1830 года, но потерпел крах около 1870 года.
Процесс Solvay или процесс аммиака, который производит карбонат натрия из соли и мела, заменил его до 1870 года, потому что он менее затратный с точки зрения топлива и относительно менее загрязняющий окружающую среду. В нем часто используются недорогие рассолы каменной соли и высокая растворимость бикарбоната аммония в воде, в отличие от низкой растворимости бикарбоната натрия NaHCO  Сварщики производят порошкообразное соединение Na 2 CO 3 , называемое легкой содой. Его кажущаяся плотность порядка 0,5 т / м 3 . Для различных промышленных применений необходима перекристаллизация моногидрата, а затем прокаливание во вращающейся печи для получения различных плотных карбонатов натрия: это плотные гидроксиды натрия (часто обозначаемые заглавной буквой, обозначающей область применения) с кажущейся плотностью порядка 1 т / м 3 .
Сварщики производят порошкообразное соединение Na 2 CO 3 , называемое легкой содой. Его кажущаяся плотность порядка 0,5 т / м 3 . Для различных промышленных применений необходима перекристаллизация моногидрата, а затем прокаливание во вращающейся печи для получения различных плотных карбонатов натрия: это плотные гидроксиды натрия (часто обозначаемые заглавной буквой, обозначающей область применения) с кажущейся плотностью порядка 1 т / м 3 .
Производственные процессы Na 2 CO 3 , безводного и очищают от горных извлечений, натрона или тронов , преобладают над процессом Solvay, который сохраняет в лучшем случае только две трети мирового производства. Это оценивается в 40 миллионов тонн в начале 1990-х годов.
Это оценивается в 40 миллионов тонн в начале 1990-х годов.
Физико-химические свойства
Растворимость Na 2 CO 3 в воде.Растворимость карбоната натрия в воде увеличивается с повышением температуры до 33% по массе при 40 
Раствор 50 г / л имеет плотность 1,045 г / л при нормальных условиях температуры и давления . Его pH с участием гидрокарбонатной пары HCO 3 —/ карбонат CO 3 2– составляет 11,9.
Под воздействием влажного воздуха безводный карбонат натрия распадается на пищевую соду .
Безводный твердый Na 2 CO 3 + водяной пар H 2 O или путем конденсации + газ CO 2 на уровне земли → 2 твердого NaHCO 3
Na 2 CO 3 плохо растворяется в этаноле и не растворяется в ацетоне .
Карбонат натрия реагирует с большинством кислот с образованием диоксида углерода . Он также осаждает посредством ионного обмена несколько растворимых солей металлов.
Токсичность
Карбонат натрия не токсичен для окружающей среды . Это может вызвать раздражение кожи, поэтому лучше обращаться с ним в перчатках.
использовать
Еще в Древнем Египте, 4000 лет назад, эта щелочь использовалась при производстве стекла . В стекольной промышленности он по-прежнему используется для подачи Na 2 O.или оксид натрия в составе стекла. Носит техническое название соды V. Последняя также может быть необходима для изготовления эмали, глазури, эмалей для керамики.
Минеральная щелочь была использована в промышленных количествах в мыловарении в наше время. Он по-прежнему используется в производстве мыла и моющих средств , особенно стиральных порошков . Используется в дополнение к стирке, когда вода жесткая, увеличивает ее эффективность, но не предотвращает образование известковых отложений.
Он был и широко используется в качестве щелочи в целлюлозно-бумажной промышленности.
В сталелитейной промышленности гидроксид натрия Na 2 CO 3одновременно является флюсом, десульфуратором, десилицирующим агентом, дефосфорантом и денитратором. В операциях сероочистки между доменными печами и сталеплавильными заводами используются брикеты соды.
В металлургии цветных металлов, например Cr , V или U , используется сода, часто обозначаемая М.
Сода широко используется в химическом синтезе. Подводя итог этим чрезмерным применениям, его добавление часто позволяет получить натриевые производные одного или нескольких соединений, причем это производное (я) становится намного более растворимым (ями) в воде, чем исходное соединение. Некоторые продукты, полученные из соды, представляют собой очищенный бикарбонат натрия, силикат натрия и его производные, фосфаты, перкарбонат натрия , дихромат калия , сульфиты , удобрения .
Карбонат натрия используется в пищевых продуктах как пищевая добавка и регулируется под номером E500 (i). Он служит средством , препятствующим слеживанию , регулятором pH пищевых продуктов и дрожжевым агентом .
Он используется в составе некоторых изоляторов на основе конопли , используемый в строительном секторе.
Это нейтрализующий агент для агрессивной воды, он участвует в производстве питьевой воды по официальным стандартам. Он также нейтрализует серную кислоту в батареях.
Бытовая уборка
Карбонат натрия (продаваемый как «кальцинированная сода») все чаще используется людьми в качестве экологически чистого домашнего продукта.
Действительно, карбонатный ион является средним основанием (pH от 11,5 до 12,5), он будет обладать способностью гидролизовать и, следовательно, омылять присутствующие жиры (гидрофобные эфиры жирных кислот).
Очевидно, что в стиральной или посудомоечной машине поверхностно-активные вещества или мыло будут улавливать гидрофобные частицы своим неполярным хвостом и смешивать их с водой, чтобы удалить их полярной головкой, карбонат натрия будет поступать. Превращая жир на месте в мыло, способное связывания с водой.
Превращая жир на месте в мыло, способное связывания с водой.
Таким образом, карбонат натрия не будет «смывать» в первом смысле этого слова, но солюбилизирует молекулы жирных веществ, гидролизуя их, превращая их в молекулы мыла, которые действуют как таковые или уходит непосредственно с промывной водой.
В лаборатории
Карбонат натрия — простое в использовании слабое основание. Сода, помимо ее роли, упомянутой в химическом синтезе, используется в исследовательских лабораториях для стабилизации кислотно-щелочной среды для проведения простых реакций.
Точно так же в биохимии определенный раствор позволяет остановить ферментативную реакцию.
Он участвует в процессе извлечения многих алкалоидов , веществ, которые определяются, в частности, кокаином из листа коки .
Карбонат натрия входит в состав Каффенола, проявителя черно-белой пленки, который можно легко приготовить в домашних условиях.
Карбонат натрия также используется в процессе производства нитроглицерина (точнее, при его промывке).
История
Во времена Прекрасной эпохи карбонат натрия уже был одним из наиболее широко используемых веществ в промышленности. Это действительно процесс Solvay, который позволил сделать продукт и его производные обычным явлением во многих повседневных, кустарных и промышленных целях, до такой степени, что их стали называть «содовой Solvay».
Что касается счастливого бельгийского промышленника, ставшего миллионером, Эрнеста Сольвея , он стал европейским покровителем науки и техники, способствуя развитию (прикладных) наук и научных встреч или встреч на высшем уровне, в частности тех, которые войдут в историю науки под название « Сольвейский конгресс ».
Примечания и ссылки
- ↑ a b c и d БЕЗВОДНЫЙ КАРБОНАТ НАТРИЯ , паспорт (-ы) безопасности Международной программы по химической безопасности , проверено 9 мая 2009 г.
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .

- ↑ a и b Михал Дусек , Жерве Шапюи , Матиас Мейер и Вацлав Петричек , « Новый взгляд на карбонат натрия », Acta Crystallographica Section B , Международный союз кристаллографии, т. 59, п о 3,, стр. 337–352 ( ISSN 0108-7681 , DOI 10.1107 / S0108768103009017 , читать онлайн , по состоянию на 25 июля 2014 г. )
- ↑ «Карбонат натрия» , на ESIS , по состоянию на 20 февраля 2009 г.
- ↑ Индексный номер 011-005-00-2 в таблице 3.1 приложения VI постановления ЕС № 1272/2008 (16 декабря 2008 г.)
- ↑ « Сода » в базе данных химических продуктов Reptox в CSST (организации Квебека , ответственного за охрану труда и здоровья), доступ к 23 апреля 2009
- ↑ Латинский термин, адаптированный из коптского или древнеегипетского языков, дал нам слово «натрон», которое сегодня обозначает именно природный декагидрат карбоната натрия, соответствующее греческое слово — нитрум .

- ↑ Все минералы x Na 2 CO 3 • y NaHCO 3 • z H 2 O (x ненулевое целое число, в отличие от y и z) геологи называют натронами.
- ↑ Остерегайтесь родовым названием соды из бурых водорослей , произведенная на побережье Атлантического океана или канале, например , из золы бурых морских водорослей или пузырчатых РУЛЕВЫХ огней или присутствующий на берегу или печи водорослей в Бретани . Эти соли ламинарии состоят из поваренной соли NaCl и солей калия. Тип хлорида калия KCl или сульфата калия K 2 SO 4 , конечно, с небольшим количеством соды Na 2 CO 3 . Биллон, цитируемый опус, § соли калия
- ↑ Содовое озеро
- ↑ Установки оставались до 1920 года в местных условиях, лишенных известняка или щелочи.
- ↑ Температура максимума одной фазы энергии процесса не превышает 200 ° C .

- ↑ В начале 1990-х во Франции было добыто едва ли 1,3 млн т. В то время по всему миру развивались природные карбонатные месторождения. Оценка в две трети предложена Робертом Перреном и Жан-Пьером Шарффом в первом томе Industrial Chemistry , цитируется в опусе.
- ↑ Это очень распространенная помадка с кальцием.О.
- ↑ « BBC — GCSE Bitesize Science — Hard and soft water: Revision, page 4 » (по состоянию на 27 сентября 2016 г. )
- ↑ Это чудесное свойство щелочей, известное с древности.
- ↑ Codex Alimentarius (1989) Названия классов и международная система нумерации пищевых добавок . CAC / GL 36-1989, стр. 1-35 .
- ↑ Росс дена выдры, « Caffenol: Разработка аналоговых Фильмов с кофе и другие Продуктовыми Ингредиентами , » на фотографии блог ,(по состоянию на 28 июня 2018 г. )
Смотрите также
Библиография
- Ф. Биллон, «Soudes и др potasses», Малая энциклопедия практической промышленной химии п Ø 3 , Е. Бернар и др Cie принтеров-издателей, Париж, 1898 г., 160 стр.
- Анри Герэн, Промышленная химия , сб. «Евклид», 2 тома формата 8 °, PUF, 1969, в частности том 2 Du sel au teflon. Хлорид натрия и производные или связанные с ним отрасли промышленности , 58 цифр, 567 стр., Предисловие профессора Жоржа Шампетье (для протокола: том 1, La Grande Industrie Chimique. Les Industries du Sulphur et de ses connections , 1962, 415 стр., Предисловие Луи Хакспилл)
- Роберт Перрен, Жан-Пьер Шарфф, Промышленная химия , Массон, Париж, 1993, 1136 с.
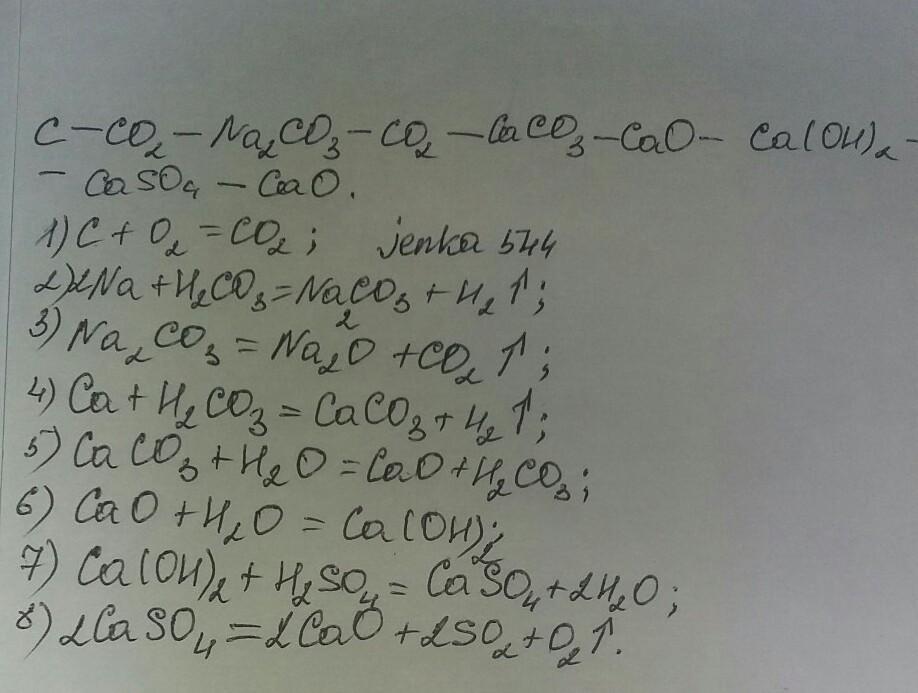 в двух томах с библиографией и указателем ( ISBN 978-2-225-84037-1 и 978-2-225-84181-1 ) (в частности, небольшая часть тома 1 о газированных напитках)
в двух томах с библиографией и указателем ( ISBN 978-2-225-84037-1 и 978-2-225-84181-1 ) (в частности, небольшая часть тома 1 о газированных напитках) - Карл Виннакер, Леопольд Кучлер, Огюст Зундель, Mineral Technology , Париж, 1962, 3 тома; в частности, том I Карла Виннакера и Леопольда Кухлера (краткое изложение: вода; сжижение и разделение газов; калийная промышленность; бор и его комбинации; поваренная соль, сода и поташ; хлор; фтор; комбинации пероксидов, 647 стр.)
Внешние ссылки
- Основные данные о растворимости
- Технический лист на октябрь 2002 г. для SIAM 15
- Натрит
- «Водоросли вчера и сегодня. Химическая промышленность в Бретани »
Соединения натрия | |
|---|---|
| NaAlO 2 · NaBH 4 · NaBr · NaBrO 3 · NaCN · NaCNO · NaCl · NaClO · NaClO 2 · NaClO 3 · NaClO 4 · NaF · NaH · NaHCO 2 · NaHCO 3 · NaHF 2 · NaHSO 3 · NaHSO 4 · NaH 2 AsO 4 · NaI · NaIO 3 · NaIO 4 · NaBiO 3 · NaMnO 4 · NaN 3 · NaNO 2 · NaNO 3 · NaOCN · NaOH · NaO 2 · NAPF 6 · NaSCN · Натко 4 · Na 2 CO 3 · Na 2 CrO 4 · Na 2 Cr 2 O 7 · Na 2 FeO 4 · Na 2 MnO 4 · Na 2 O · Na 2 O 2 · Na 2 PtCl 4 · Na 2 PtCl 6 · Na 2 S · Na 2 SO 3 · Na 2 SO 4 · Na 2 WO 4 · Na 2 SO 5 · Na 2 S 2 O 5 · Na 2 S 2 O 7 · Na 2 S 2 O 8 · Na 2 SiO 3 · Na 3 [Fe (CN) 6 ] · Na 4 [Fe (CN) 6 ] · Na 3 [Fe (C 2 O 4 ) 3 ] · Na 3 PO 4 · Na 4 MnO 4 · Na 4 Mo 2 Cl 8 |
 wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Карбонат натрия (Na2CO3) структура, использование и свойства / химия | Thpanorama
карбонат натрия (Na2Колорадо3) Это неорганическая соль натрия, щелочного металла и углекислоты. Он также известен во всем мире как кальцинированная сода. Озера и вулканическая деятельность обогатили почвы натрием, из которого растения питались; затем, после пожара, эти растения разбросали карбонатный пепел.
Как возникает эта соль металлического натрия? Чистый натрий имеет валентную конфигурацию [Ne] 3s1. Электрон 3s орбитали1 он легко выделяется другими элементами природы (такими как сера, кислород, хлор, фтор и т. д.), образуя минеральные соединения, в которых участвует стабильный ион Na+.
На+ это сопровождается другими ионными разновидностями в этих твердых телах; Из них карбонат натрия является еще одним присутствующим в природе. С тех пор он использовался во всех цивилизациях на протяжении веков. Эти цивилизации находили в этой серовато-белой пыли полезные свойства для своих домов и людей..
С тех пор он использовался во всех цивилизациях на протяжении веков. Эти цивилизации находили в этой серовато-белой пыли полезные свойства для своих домов и людей..
Эти свойства отметили их использование, которые сегодня поддерживают традиционные аспекты прошлого, а другие адаптированы к текущим потребностям.
Карбонат натрия очень распространен в природе и, возможно, также на других территориях за пределами планеты Земля, таких как некоторые из спутников Солнечной системы..
индекс
- 1 Формула
- 2 Структура
- 3 использования
- 4 Как это сделать??
- 5 свойства
- 6 Ссылки
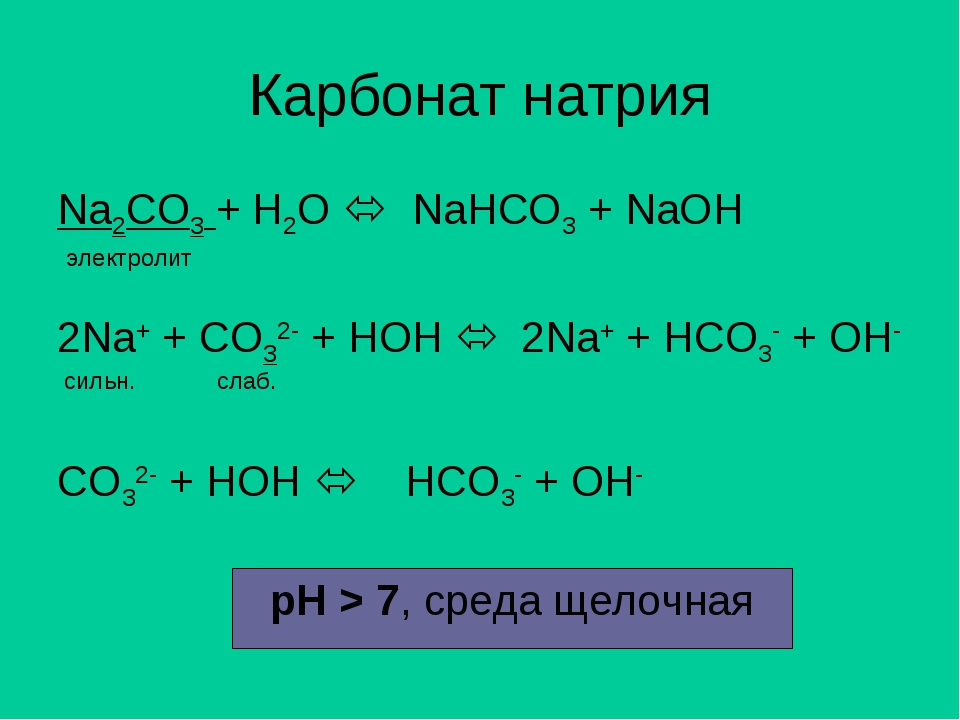
Химическая формула карбоната натрия Na2Колорадо3. Как это интерпретируется? Это означает, что в кристаллическом твердом теле для каждого иона СО32- Есть два иона Na+.
структураНа верхнем изображении представлена структура Na2Колорадо3 ангидрид (также называемый кальцинированной содой). Фиолетовые сферы соответствуют ионам Na+, в то время как черный и красный для ионов CO32-.
Фиолетовые сферы соответствуют ионам Na+, в то время как черный и красный для ионов CO32-.
Карбонат-ионы имеют плоскую тригональную структуру с атомами кислорода в своих вершинах.
Изображение дает панораму, видимую с более высокой плоскости. Na-ионы+ они окружены шестью атомами кислорода, исходящими от ионов СО32-. То есть в На2Колорадо3 Ангидрид натрия соответствует октаэдрической координационной геометрии (он заключен в центр октаэдра).
Однако эта структура также способна содержать молекулы воды, взаимодействующие водородными связями с вершинами треугольников..
На самом деле, гидраты Na2Колорадо3 (Na2Колорадо3· 10H2О, На2Колорадо3· 7Н2О, На2Колорадо3· H2Или и другие) более распространены, чем безводная соль.
Термонатрит (Na2Колорадо3· H2О) натрон (Na2Колорадо3· 10H2О) и стульчик (Na3(HCO3) (CO3) · 2H2Или они являются основными природными источниками карбоната натрия, особенно минерала трона, представленного на первом изображении.
Карбонат натрия выполняет многочисленные функции в людях, домах и на производстве, в число которых входят следующие:
— Карбонат натрия используется во многих чистящих средствах. Это связано с его дезинфицирующей способностью, способностью растворять жиры и свойством умягчать воду. Он входит в состав моющих средств, используемых в прачечных, автоматических посудомоечных машинах, очистителях стекла, пятновыводителях, отбеливателях и т. Д..
— Карбонатное дезинфицирующее средство можно использовать на твердых, не шероховатых поверхностях, таких как полы, стены, фарфор и ванны, за исключением стекловолокно и алюминий, который может быть поцарапан этим.
— Он используется в некоторых продуктах, чтобы предотвратить спекание, которое может произойти в этих.
— Он присутствует в различных продуктах личной гигиены, таких как жемчужные ванны, зубные пасты и мыло.
— Используется в стекольной промышленности благодаря способности разлагать силикаты. .
.
— Используется для обслуживания бассейнов, где выполняет дезинфицирующую функцию и функцию регулирования pH..
— У людей он используется терапевтически при лечении кислотности и дерматита..
— В ветеринарной медицине его применяют при лечении стригущего лишая и очищении кожи.
Как это сделать??Карбонат натрия может быть изготовлен с использованием рассола из морей и известняка (CaCO3) в процессе Сольве. На верхнем изображении показана схема процесса с указанием маршрутов производства, а также реагентов, посредников и продуктов. Реагенты написаны зелеными буквами, а продукты — красными буквами..
Наблюдение за этими реакциями может быть немного сложным, но глобальное уравнение, которое указывает только на реагенты и продукты:
2NaCl (водн.) + CaCO3(S), не доступно2Колорадо3(s) + CaCl2(Aq)
CaCO3 Он имеет очень стабильную кристаллическую структуру, поэтому для его разложения на CO постоянно требуется много энергии.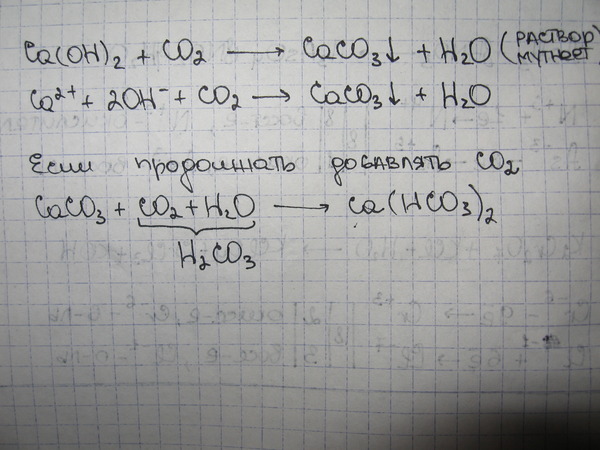 2. Кроме того, этот процесс генерирует большое количество CaCl2 (хлорид кальция) и другие примеси, выбросы которых влияют на качество воды и окружающую среду.
2. Кроме того, этот процесс генерирует большое количество CaCl2 (хлорид кальция) и другие примеси, выбросы которых влияют на качество воды и окружающую среду.
Существуют также другие способы производства карбоната натрия в промышленных условиях, такие как процессы Хоу и Лебланк..
В настоящее время его можно получить из его природных минералов, так как трона является наиболее распространенным из них..
С другой стороны, наиболее традиционным методом было выращивание и сжигание растений и водорослей, богатых натрием. Затем пепел омывали водой и нагревали до получения продукта. Отсюда возник знаменитый пепел соды.
свойстваНа2Колорадо3 представляет собой гигроскопичное белое твердое вещество без запаха, с молекулярной массой 106 г / моль и плотностью 2,54 г / мл при 25 ° C.
Его свойства изменяются, поскольку он включает молекулу воды в свою кристаллическую структуру. Поскольку вода может образовывать водородные мостики, а ионы «открывают пространство» между ними, объем кристалла увеличивается, а плотность гидрата уменьшается. Например, для Na2Колорадо3· 10H2Или его плотность составляет 1,46 г / мл..
Например, для Na2Колорадо3· 10H2Или его плотность составляет 1,46 г / мл..
На2Колорадо3 плавится при 851 ° C, разлагается в соответствии со следующим уравнением:
не доступно2Колорадо3(s) => Na2O (s) + CO2(G)
Опять же, несмотря на то, что ионы СО32- и на+ Они отличаются по размерам, их электростатические взаимодействия очень эффективны и поддерживают стабильную кристаллическую сеть.
Молекулы воды «препятствуют» этим взаимодействиям, и в результате гидраты более подвержены разложению, чем ангидрид..
Это основная соль; растворение в воде приводит к образованию раствора с рН выше 7. Это связано с гидролизом СО32-, чья реакция высвобождает ОН— в середине:
Колорадо32-(ac) + H2O (l) HCO3—(ac) + OH—(Aq)
Он очень хорошо растворяется в воде и в полярных растворителях, таких как глицерин, глицерин, ацетон, ацетаты и жидкий аммиак. .
.
- Дрожь и Аткинс. (2008). Неорганическая химия В Элементы группы 1. (Четвертое издание, стр. 265). Mc Graw Hill.
- scifun.org. (2018). Карбонат натрия и карбонат натрия. Получено 8 апреля 2018 г. с сайта scifun.org.
- Wikipedia. (2018). Карбонат натрия. Получено 8 апреля 2018 г. с сайта en.wikipedia.org
- PubChem. (2018). Карбонат натрия. Получено 8 апреля 2018 г. из: pubchem.ncbi.nlm.nih.gov
- Ciner Resources Corporation. (2018). Кальцинированная сода Получено 8 апреля 2018 г. с сайта: ciner.us.com
- Qniemiec. (7 мая 2010 г.) Solvay процесс. [Рисунок]. Получено с: Wikimedia.org
- Пельтье К. (3 июля 2018 г.). Все, что вам нужно знать о карбоните натрия. Получено 8 апреля 2018 г. с сайта thespruce.com
- Net Industries. (2018). Карбонат натрия — Использование карбоната натрия. Получено 8 апреля 2018 г. с сайта: science.jrank.org
Глицерин — Sciencemadness Wiki
Глицерин , альтернативно пишется глицерин или глицерин , представляет собой простой сахарный спирт, иногда используемый в качестве растворителя. Это полиол, состоящий из молекулы пропана с одним водородом на каждом из атомов углерода, замещенным гидроксильной группой.
Это полиол, состоящий из молекулы пропана с одним водородом на каждом из атомов углерода, замещенным гидроксильной группой.
Глицерин иногда используется в качестве лабораторного растворителя, хотя это затруднено из-за его высокой вязкости. Он также используется в производстве известного взрывчатого нитроглицерина.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Глицерин имеет несколько нишевых применений в бытовой химии. Смесь глицерина и щавелевой кислоты можно перегнать для получения муравьиной кислоты. Эта реакция протекает в несколько стадий при температуре выше 100°С.
При нагревании глицерина до 280 °C он разлагается на акролеин:
- (CH 2 OH) 2 CHOH → CH 2 =CHCHO + 2 H серной и азотной кислот на ледяной бане для получения нитроглицерин, чувствительная жидкая взрывчатка, используемая для изготовления динамита.
Может также использоваться в качестве инертного растворителя для получения растительных экстрактов или проведения органических реакций.
Физический
Глицерин представляет собой бесцветную, вязкую жидкость без запаха при комнатной температуре с мягким сладким вкусом, похожим на искусственные подсластители. Он растворим в воде, но имеет ограниченную растворимость в большинстве органических растворителей, таких как ацетон, хлороформ и диэтиловый эфир. Он гигроскопичен.
Доступность
Глицерин можно найти во многих аптеках и продуктовых магазинах, где он используется в качестве «защитного средства для кожи». Как и многие другие медицинские товары и товары для здоровья, он продается с очень высокой наценкой, а это означает, что покупка глицерина в Интернете у определенных оптовиков на самом деле намного дешевле.

Препарат
Глицерин получают путем гидролиза или омыления растительных и животных жиров с использованием сильного основания, такого как гидроксид натрия. Однако обычно его проще купить, чем проходить процесс очистки продукта от этой реакции.
Проекты
- Изготовление муравьиной кислоты
- Сделать нитроглицерин
- Сделать аллиловый спирт
- Сделать акролеин
- Антифриз
- Сделать медно-полиольный комплекс [1]
Обращение
Безопасность
Глицерин более или менее нетоксичен, так как является важным биологическим химическим веществом. Любопытным можно попробовать пищевой глицерин, хотя внешние лекарственные сорта не могут быть гарантированно безопасными для употребления (пользовательница Sciencemadness Ave369 использовала медицинский глицерин для смягчения домашней водки, и ничего плохого с ней не случилось).
Хранение
Глицерин следует хранить в герметичных емкостях, так как он гигроскопичен и его очень трудно удалить водой.
Утилизация
Глицерин малотоксичен для окружающей среды и может быть безопасно слит в канализацию.
Ссылки
- ↑ https://www.youtube.com/watch?v=EKj3Oa5GTcM
Соответствующие нити Sciencemadness
- Глицерин для сушки
- Повышение ценности глицерина при производстве биодизеля
Ацетон — Sciencemadness Wiki0004 (химическая формула
(CH 3 ) 2 CO ) является популярным растворителем и полезным химическим веществом во многих областях органической химии, являясь простейшим кетоном.Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 См. также
- 7 Каталожные номера
- 7.1 Соответствующие темы Sciencemadness
Свойства
Химический
Ацетон легко воспламеняется и горит на воздухе с выделением углекислого газа и паров воды.

Реагирует с галогенами с образованием галогенированных органических соединений, т.е. хлорацетона, бромацетона, йодацетона. Ацетон очень экзотермически реагирует с галогенами, растворенными в основных растворах, с образованием галоформа указанного галогена, процесс, известный как галоформная реакция. Одним из примеров является использование бытового отбеливателя и других гипохлоритов с образованием хлороформа.
Ацетон образует непредсказуемую и опасную взрывоопасную перекись ацетона при окислении перекисью водорода при определенных условиях, например, с кислотным катализатором.
Ацетон реагирует с холодной концентрированной азотной кислотой с образованием уксусной и муравьиной кислот. В результате реакции выделяется много тепла, из-за чего продукты испаряются из реакционной колбы.
Физический
Ацетон — прозрачная жидкость с очень низкой вязкостью, смешиваемая с водой, кипит при 56 °C и замерзает при температуре –9от 5 до −93 °C. Он имеет резкий, несколько сладкий и цветочный аромат, похожий на другие кетоны.
 Он также смешивается с большинством органических растворителей, таких как ледяная уксусная кислота, бензол, хлороформ, диэтиловый эфир, этанол, гептан, гексан и метанол. Однако ацетон не смешивается с глицерином.
Он также смешивается с большинством органических растворителей, таких как ледяная уксусная кислота, бензол, хлороформ, диэтиловый эфир, этанол, гептан, гексан и метанол. Однако ацетон не смешивается с глицерином.Доступность
Ацетон можно найти в хозяйственных магазинах в качестве разбавителя краски или жидкости для снятия лака, в чистом виде или в смеси с другими органическими веществами (обычно сложными эфирами). Для очистки ацетона может потребоваться перегонка.
Большинство технических сортов ацетона, как правило, довольно чистые и содержат очень мало воды, если вообще содержат ее. Если вы хотите, чтобы он был более чистым, вы можете перегнать его снова.
Препарат
В промышленности ацетон получают кумольным процессом, при котором бензол алкилируется пропиленом с получением кумола, который окисляется воздухом с получением фенола и ацетона.
До этого метода ацетон производился путем сухой перегонки ацетатной соли, обычно ацетата кальция или ацетата натрия.

- 2 Na(CH 3 COO) → Na 2 CO 3 + (CH 3 ) 2 CO
- Ca(CH 3 COO) 2 → CaCO 3 + (CH 3 ) 2 CO
Поскольку эта реакция происходит при температуре около 400-50 0°С, температура выше температуры кипения и самовоспламенения ацетона, это должно быть выполнено в бескислородной камере (достаточно углекислого газа или только атмосферы), и, поскольку ацетон образуется в виде паров, его необходимо конденсировать.
Ацетон можно извлечь из водного раствора высаливанием безводным ацетатом натрия, который обычно получают из уксуса и пищевой соды.
Проекты
- Синтез метилметакрилата
- Синтез перекиси ацетона
- Синтез хлороформа
- Органические экстракты
- Сделать этенон
Обращение
Безопасность
Контакт с кожей с ацетоном не рекомендуется, так как длительное воздействие может привести к обезжириванию кожи.
 Низкая температура кипения ацетона требует работы в проветриваемом помещении. Хотя ацетон летуч и его пары не особенно токсичны, в больших количествах они могут вызывать раздражение. Однако ацетон является одним из наименее токсичных растворителей, и, как показали многие исследования, в случае многократного воздействия не возникает долговременного риска.
Низкая температура кипения ацетона требует работы в проветриваемом помещении. Хотя ацетон летуч и его пары не особенно токсичны, в больших количествах они могут вызывать раздражение. Однако ацетон является одним из наименее токсичных растворителей, и, как показали многие исследования, в случае многократного воздействия не возникает долговременного риска.Основная опасность ацетона связана с его воспламеняемостью. Его пары имеют температуру воспламенения намного ниже комнатной температуры, поэтому смеси воздух/ацетон могут легко взорваться или загореться даже при ударах статическим электричеством.
При температуре выше 486 °C ацетон самовоспламеняется.
Хранение
Ацетон лучше всего хранить в закрытых бутылях, вдали от любых источников тепла.
Утилизация
Ацетон можно безопасно сжигать. Следы ацетона могут выделяться на открытом воздухе. Сильно разбавленные растворы ацетона можно выливать в канализацию, но не выпускать в больших количествах.


 1 Бытовая химия
1 Бытовая химия