Титрование 0,1 м раствора h3co3 0,1 м раствором NaOh
Министерство народного образования
Республики Башкортостан
Расчетно-графическое задание
по титриметрии.
2. Титрование 0,05 М раствора NaCl 0,05 М раствором AgNO3
Выполнил: студент 2 курса гр.В
химического факультета
Гатауллин С.С.
Проверил: к.х.н., доцент
Кручкова Е.С.
Уфа-2005
Содержание:
Кислотно-основное титрование
1. Сущность титриметрии
1.1. Основные понятия….………………………………………………………..3
1.2. Стандартные растворы……………..…………………….…………………5
2. Кислотно-основное титрование…………………………………….…………6
3.
Вывод формул для расчета pH
при титровании слабой двухосновной
кислоты сильным основанием
…………………………………….
4. Значение pH в различные моменты титрования……………….…………….9
5. Кривая титрования 0,1 М раствора угольной кислоты
0,1 М раствором гидроксида натрия…………………………….……………..10
6. Выбор индикатора. Индикаторная погрешность………………….…………11
7. Вывод по кривой титрования. Титрование 0,1 М раствора угольной кислоты 0,1 М раствором гидроксида натрия. Осадительное титрование…..14
8. Вывод формул pCl на различных этапах титрования………………………14
9. Значения pCl в различные моменты титрования……………………………16
10. Кривая осадительного титрования 0,1 М раствора NaCl 0,1 М раствором AgNO3…………………………………………………………………….………17
11. Способ фиксирования точки эквивалентности……………………………18
12. Расчет индикаторных погрешностей……………………………………….19
13. Вывод по кривой титрования 0,1 М раствора NaCl 0,1 М раствором AgNO3 ……………………………………………………………………………19
Список
литературы……. .………………………………………………….…….21
.………………………………………………….…….21
1.1. Основные понятия.
Титриметрический, или объёмный анализ – метод количественного анализа, основанный на измерении объёма (или массы) реагента Т, затраченного на реакцию с определяемым веществом Х. Другими словами, титриметрический анализ – это анализ, основанный на титровании.
Титрование – прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества.
Титрованный, или стандартный, раствор – раствор, концентрация которого известна с высокой точностью.
Титрант – раствор, содержащий активный реагент Т, с помощью которого проводят титрование.
Аликвотная доля (аликвота) – это точно известная часть анализируемого раствора, взятая для анализа.
Точка эквивалентности
– это момент титрования, когда количество
добавленного титранта химически
эквивалентно количеству титруемого
вещества.
Конечная точка титрования (КТТ) – точка (момент) титрования, в которой некоторое свойство раствора (например, его окраска) оказывает заметное изменение. КТТ соответствует более или менее ТЭ, но чаще всего не совпадает с ней.
Индикатор – вещество, которое проявляет видимое изменение в ТЭ или вблизи её.
Интервал перехода индикатора – область концентрации ионов водорода, металла или других ионов, в пределах которой глаз способен обнаружить изменение в оттенке, флуоресценции или другого свойства визуального индикатора, вызванное изменением соотношения двух соответствующих форм индикатора.
Степень оттитрованности f – отношение объёма V(T) добавленного титранта к объёму V(ТЭ) титранта, соответствующему ТЭ:
f=V(T)/V(ТЭ)
Другими словами,
степень оттитрованности раствора –
это отношение количества оттитрованного
вещества к его исходному количеству в
анализируемом растворе.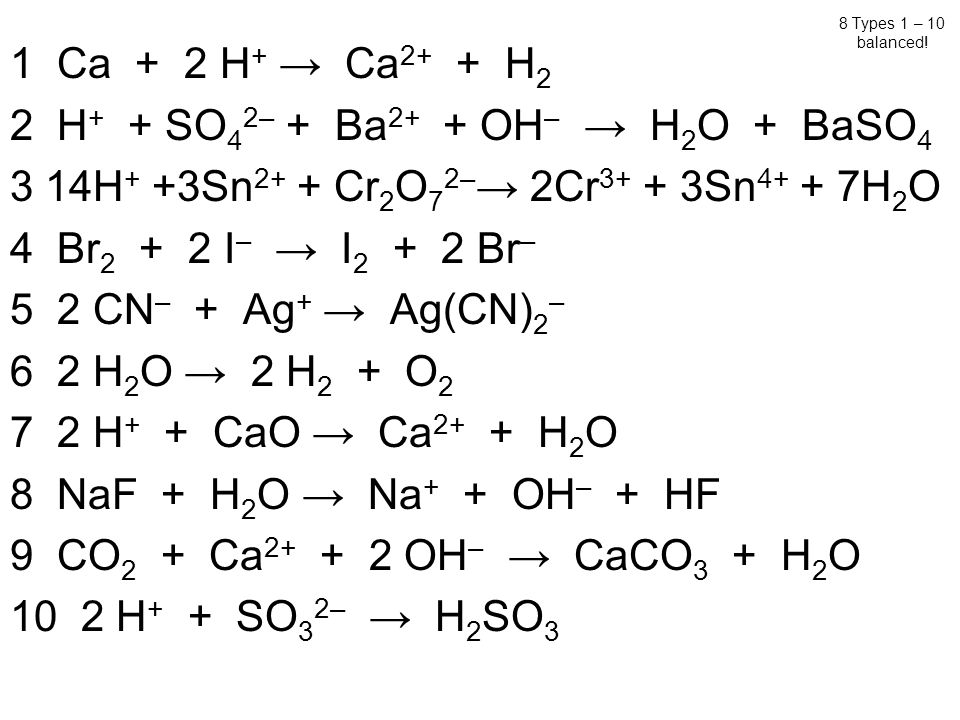
(1-f) – показывает какая часть титруемого вещества от исходного количества осталась (недотитровалась) в растворе.
(f-1) показывает какая часть от исходного количества вещества перетитровалась.
Кривая титрования – графическое изображение зависимости изменения концентрации c(X) определяемого вещества X или некоторого связанного с ним свойства системы (раствора) от объёма V(T) прибавленного титранта Т.
Требования, предъявляемые к реакциям в титриметрическом анализе
Реакции, используемые в титриметрическом анализе, должны отвечать следующим основным требованиям:
Реакция должна протекать по строго определённому стехиометрическому уравнению. Побочные реакции должны быть исключены.
Реакция должна протекать количественно, т. е. практически до конца. Равновесие в системе должно быть полностью смещено в сторону продуктов реакции.
 Степень превращения
исходных веществ в продукты реакции в
ТЭ должна быть не менее 99,90 – 99,99%.
Константа равновесия должна быть
достаточно большой. Для реакции типа
А + В = С, в которой участвуют два исходных
реагента А и В, значение константы
равновесия К должно быть К
10 8, в этих условиях реакция
протекает не менее чем на 99,99%. Для
реакций с участием большего числа
реагентов величина константы равновесия
должна быть ещё больше.
Степень превращения
исходных веществ в продукты реакции в
ТЭ должна быть не менее 99,90 – 99,99%.
Константа равновесия должна быть
достаточно большой. Для реакции типа
А + В = С, в которой участвуют два исходных
реагента А и В, значение константы
равновесия К должно быть К
10 8, в этих условиях реакция
протекает не менее чем на 99,99%. Для
реакций с участием большего числа
реагентов величина константы равновесия
должна быть ещё больше.
Так, например, хлорид-ионы осаждаются из водного раствора при прибавлении растворов солей серебра(I) и свинца(II):
Ag+ + Cl— AgCl; K0s(AgCl) = 1,8 10-14; K = 5,6 1013;
Pb2+ + Cl— PbCl2; K0s(PbCl2) = 1,6 10-5; K = 6,3 104.
Константы равновесия
К этих реакций (обратные величине
произведения растворимости) равны 5,6
1013 и 6,3
104 соответственно. Следовательно,
первую реакцию можно использовать для
титрования хлорид-ионов, поскольку
константа равновесия K =
5,6
10
Следовательно,
первую реакцию можно использовать для
титрования хлорид-ионов, поскольку
константа равновесия K =
5,6
10
Реакция должна протекать быстро, чтобы в любой момент титрования равновесие устанавливалось практически мгновенно. Иногда для ускорения достижения равновесия растворы нагревают или же вводят в них катализаторы.
Реакция должна позволять точно и удобно определять КТТ вблизи ТЭ.
что, как сбалансировать и часто задаваемые вопросы
HCl и H2CO3 являются химическими соединениями, присутствующими в водной среде, и соляная кислота и угольная кислота легко реагируют, и конечным продуктом является хлор и окись углерода. Давайте обсудим HCl и H2CO3 реакции.
Давайте обсудим HCl и H2CO3 реакции.
Кислоту HCl также называют соляной кислотой. По внешнему виду она кажется бесцветной, а ее молярная масса равна 36.458 г/моль. H2CO3 это химическое соединение, используемое в пищевой промышленности для процесса ферментации, так как оно является слабым основанием и менее реакционноспособно.
В следующих разделах мы изучим множество фактов о основанных на HCl + H2CO3 реакции. Полученное произведение , сопряженные пары и т.д.
Что является продуктом HCl иHCl — сильная кислота, которая полностью диссоциирует. H2CO3 является слабым основанием и частично диссоциирует в воде, поэтому реакция будет
HCl + H2CO3 = Кл2 + СО + Н2O
Какой тип реакции HCl+? H2CO3Реакция HCl + H2CO3 известен как реакция двойного вытеснения потому что в продукте положительный ион и отрицательный ион меняются местами и образуют два продукта, которые сильно отличаются друг от друга.
Чтобы сбалансировать химическую реакцию, необходимо выполнить следующие шаги:
- Шаг 1: Поскольку коэффициенты равны 5, обозначьте все реагенты и продукты A, B, C, D и E.
- A HCl+В H2CO3 = С Cl2 +Д СО + ЭГ2O
- Шаг 2 – измените уравнение подходящим числом; коэффициенты уже помечены как алфавиты для продукта и реагентов.
- 2H -> A= B= E, Cl = C, D = C
- Шаг 3: Умножение коэффициентов атомов в реакции
- А = 2, С = 1, D = 1
- Шаг 4: Уменьшите результат наименьших целых значений, в результате сбалансированное уравнение:
- 2HCl + H2CO3 = Кл2 +CO +2H2O
Титрование HCl + H2CO3 однако это невозможно из-за кислой природы обоих химических соединений, H2CO3 является слабой кислотой, невозможно рассчитать конечную точку реакции, так как происходит образование газов, таких как окись углерода и хлор.
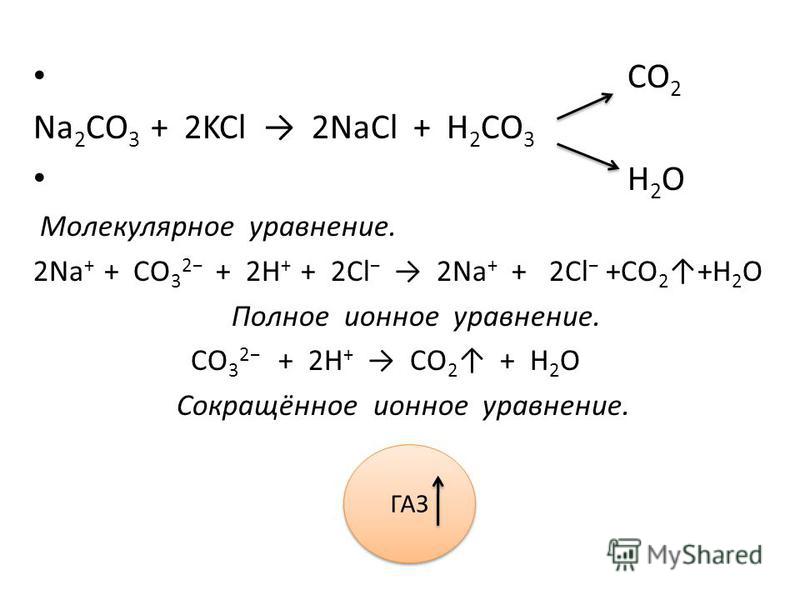
Чтобы написать сеть ионное уравнение первой полной реакции HCl + h3CO3 с соответствующими состояниями записывается
HCl(ж) + H2CO3(л) = Cl2(г) + СО(г) + Н2О (л)
Теперь разделите соединения на ионы –
H+ + Кл– + H+ + CO– = Кл– + CO– + НО
Оставшийся HOH можно записать как H+ и ОН–.
HCl и H2CO3 межмолекулярные силы- Соединение HCl связано двумя межмолекулярные силы это диполь-дипольное взаимодействие и лондоновская дисперсионная сила.
- Компания H2CO3 соединение имеет водородные связи с силой притяжения Ван-дер-Ваальса из-за ковалентных связей.

HCl кислота имеет сопряженное основание Кл– и H2CO3 кислота имеет сопряженное основание HCO3- потому что оба реагента являются кислотами, и образование основания в качестве продукта происходит, когда HCl отдает протон, превращается в Cl– превращаться в сопряженную кислоту и H2CO3 отдает протон, превращается в HCO3-.
Сопряженные кислотно-основные парыHCl + H2CO3 энтальпия реакцииКомпания энтальпия реакции HCl + H2CO3 равно нулю, потому что одна является сильной кислотой, а другая — слабой кислотой, обе могут легко вступать в реакцию из-за одинаковой природы, и для завершения реакции не требуется никакого количества внешней энергии.
HCl + H2CO3 не буферный раствор потому что оба являются кислотными химическими соединениями, которые делают раствор более кислым и H2CO3 очень нестабилен и идеально превращается в газ окись углерода.
HCl+ H2CO3 полная реакцияHCl + H2CO3 является полной реакцией, так как при обмене катионов и анионов образуется полный продукт в виде газов хлора и оксида углерода.
HCl+ H2CO3 экзотермическая или эндотермическая реакцияРеакция HCl + H2CO3 есть экзотермическая реакция что означает кл2 и CO оба соединения также выделяют большое количество тепла с газами.
HCl + H2CO3 не окислительно-восстановительная реакция потому что окисление и восстановление химических соединений не протекают одновременно, но в этой реакции гидратация H2CO3 имеет место, и он отдает только протоны, а не электроны.
HCl+ H2CO3 реакция осажденияРеакция HCl + H2CO3 не реакция осаждения потому что происходит только образование газов хлора и угарного газа, которые не могут осесть в воде.
HCl+ H2CO3 обратимая или необратимая реакцияHCl + H2CO3 есть необратимая реакция потому что образование газов происходит как продукт, а вода остается только как побочный продукт, который не может быть обращен в виде другого химического соединения.
HCl + H2CO3 не является реакцией замещения из-за обмена ионами внутри химических частиц противоположного заряда и Cl2 и CO образуются без смещения.
ЗаключениеH2CO3 (угольная кислота) в основном содержится в пищевых продуктах, поскольку является признаком брожения пищевых продуктов, поскольку выделяет газообразный диоксид углерода, тогда как HCl бывает двух типов: разбавленная и концентрическая, обе используются для химического анализа органических и неорганических соединений в пищевых продуктах. области химии и аналитической химии.
Узнайте больше фактов о HCl:
Кинетика гидратации и дегидратации системы CO2 и равновесное соотношение CO2/h3CO3 в водном растворе NaCl
Перейти к форме поискаПерейти к основному содержаниюПерейти к меню учетной записи : 95917658
@статья{Soli2002CO2SH,
title={Кинетика гидратации и дегидратации системы CO2 и равновесное соотношение CO2/h3CO3 в водном растворе NaCl},
автор = {Алан Л. Соли и Роберт Х. Бирн},
журнал={Морская химия},
год = {2002},
объем = {78},
страницы = {65-73}
}
Соли и Роберт Х. Бирн},
журнал={Морская химия},
год = {2002},
объем = {78},
страницы = {65-73}
} - Alan L. Soli, R. Byrne
- Опубликовано 1 мая 2002 г.
- Химия
- Морская химия
Просмотр через издатель
Аминокислотные соли для CO2-cho2. Г. Паксти, П. Ферон
Химия
Влияние температуры на кинетику ферментативного поглощения углекислого газа в водных растворах МДЭА
- N. P. Elk, C. V. Aken, Geert Versteeg
Биология, химия
- 2016
Механизм диссоциации и разложения угольной кислоты в воде через гидроксидный путь: исследование метадинамики ab.initio
Было обнаружено, что, в отличие от газовой фазы, взаимопревращение между различными конформерами происходит по двум различным путям, один из которых включает изменение одного из двух двугранных углов (O=C-O-H), а другой — перенос протона через водородный — соединительная проволока.
Термокинетические свойства и оценка эффективности растворителей на основе бензиламина для улавливания CO2
- G. Richner, G. Puxty, Amanda Carnal, William Conway, M. Maeder, P. Pearson
Химия
200- 2046 Морская система СО2 и ее особенности в Балтийском море
- M. Koschorreck, Y. Prairie, Jihyeon Kim, R. Marcé
Науки об окружающей среде
- 2021
- R. Behrens, E. Harbou, H. Hasse
Химия
- 2017
- E. Abramson, O. Bollengier, J. Michael Brown, B. Journaux, W. Kaminsky, A. Pakhomova
Geology
American Mineralogist
- 2018
- G.
 Puxty, R. Rowland, M. Attalla
Puxty, R. Rowland, M. Attalla Chemistry, Physics
- 2011
- K. Johnson
Химия
- 1982
- C. S. Patterson, G. H. Slocum, R. Busey, R. Mesmer
Chemistry
- 1982
- A.
 E. Hopkins, Karen S. Sell, Alan L. Soli, R. Byrne
E. Hopkins, Karen S. Sell, Alan L. Soli, R. Byrne Химия
- 2000
Химия
- 1974
Углекислота, образующаяся при растворении СО2 в морской воде, диссоциирует с образованием гидрокарбоната, карбоната и ионов водорода, которые связаны друг с другом константами диссоциации и…
Техническое примечание: CO2 отличается от Ch5 – ограничения и поправки к методу парофазного анализа для анализа pCO2 в пресной воде
Аннотация. Часто используется анализ парофазного анализа CO 2 . для количественного определения концентрации СО 2 в пресной воде. Согласно основным химическая теория, без учета химического равновесия…
Моделирование молекулярной динамики предсказывает ускоренную диссоциацию h3CO3 на границе воздух-вода.

Установлено, что поверхность воды обеспечивает более структурированную сольватную среду вокруг h3CO3, чем в объемной воде, что способствует снижению энергетического барьера диссоциации за счет стабилизации переходного состояния по отношению к недиссоциированной кислоте.
Образование моноалкилкарбонатов в метилдиэтаноламине–h3O–CO2
Carbonic acid monohydrate
Abstract In the В системе вода-углекислый газ при давлении выше 4,4 ГПа наблюдается существование кристаллической фазы, состоящей из аддукта двух веществ, в равновесии с водным… требуется
SHOWING 1-10 OF 22 REFERENCES
SORT BYRelevanceMost Influenced PapersRecency
Carbon dioxide hydration and dehydration kinetics in seawater1
Константы скорости реакций гидратации и дегидратации диоксида углерода с водой и с ионом гидроксила измерены в морской воде методом рН-стата при солености (Х 10 л) с 3.4 по 37.06 в…
Показатели гидратации углекислого газа и дегидратации угольной кислоты при 37 град.
Carbonate equilibria in hydrothermal systems: First ionization of carbonic acid in NaCl media to 300°C
In-situ спектрофотометрические измерения рН: влияние давления на протонирование тимолового синего и характеристики поглощения
Бикарбонат и карбонатный ионный пар Hawley
Экспериментально определены кажущиеся (стехиометрические) константы ассоциации для образования ионных пар между бикарбонатом и карбонатом и основными катионами морской воды при 25°C. В…
Спектрофотометрические измерения pH поверхностной морской воды в условиях in-situ: абсорбция и протонирование тимолового синего . Кинетика дегидратации угольной кислоты при 25° и 37°С.
Влияние ионной среды на морскую воду. Сравнение констант кислотности угольной и борной кислот в хлориде натрия и синтетической морской воде
- D. Dyrssen, Ingemar Hansson
Химия
- 1973
О времени, необходимом для установления химического и изотопного равновесия в системе углекислого газа в морской воде
, D. Zelad-Gladrow,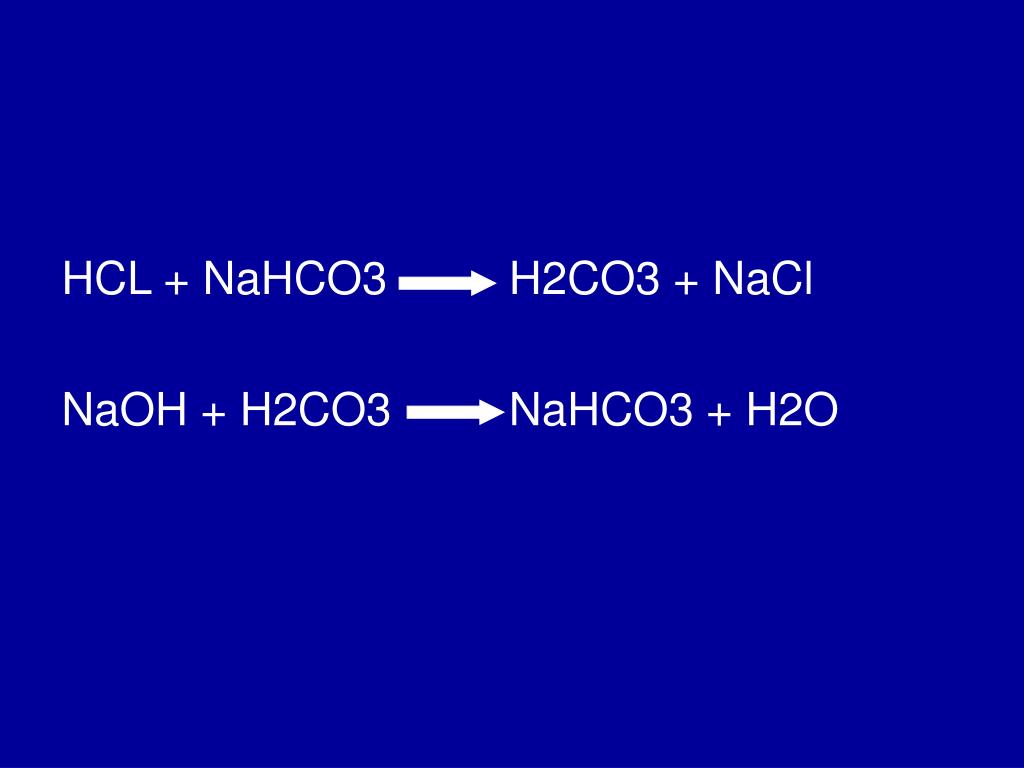 Jansen
JansenНауки об окружающей среде
CO2 – химические, биохимические и физиологические аспекты
- J. Edsall, R. Forster, A. Otis, F. Roughton
Химия, биология
- 1969
Изучается молекулярная структура карбоангидразы, ферментативное карбоксилирование и дыхательный газообмен.
What, How to Balance & FAQs – Lambda Geeks
Автор Soumya Chourasiyain Chemistry
HCl и H 2 CO 3 – это химические соединения, присутствующие в водной среде, и соляная кислота легко вступает в реакцию с угольной кислотой. а конечным продуктом является хлор и окись углерода. Давайте обсудим HCl и H 2 CO 3 реакции.
Кислота HCl также называется соляной кислотой. По внешнему виду она кажется бесцветной, а ее молярная масса равна 36,458 г/моль. H 2 CO 3 представляет собой химическое соединение, используемое в пищевой промышленности для процесса ферментации, так как оно является слабым основанием и менее реакционноспособно.
В следующих разделах мы изучим множество фактов о реакциях на основе HCl + H 2 CO 3 . Полученное произведение , сопряженные пары и т. д.
Что является продуктом HCl иHCl является сильной кислотой, которая полностью диссоциирует, а H 2 CO 3 является слабым основанием и поэтому реакция частично диссоциирует в воде Будет,
HCL + H 2 CO 3 = CL 2 + CO + H 2 + CO + H 2 + CO + H 2 + H 2 . 2 CO 3
Реакция HCL + H 2 CO 3 69 2. меняются местами и образуют два продукта, сильно отличающихся друг от друга.
Для уравновешивания химической реакции необходимы следующие шаги:
- Шаг 1: Поскольку коэффициенты равны 5, обозначьте все реагенты и продукты A, B, C, D и E
- A HCl +B H 2 CO 3 = C CL 2 +D CO +E H 2 O 9 9009
- 944; коэффициенты уже помечены как алфавиты для продукта и реагентов.
- 2H -> A = B = E, CL = C, D = C
- Шаг 3: Умножение коэффициентов атомов в реакции
- 44 A = 2, 2, 2, 2, 2, 2,
- 44444444444444.
 C = 1, D = 1
C = 1, D = 1 - Step 4 : Reduce the result of lowest integer values as a result, the balanced equation is:
- 2HCl + H 2 CO 3 = Cl 2 +CO +2H 2 O
- Соединение HCl связано двумя дисперсионными и межмолекулярными силами Лондон-дипольного взаимодействия.
- Соединение H 2 CO 3 имеет водородные связи с силой притяжения Ван-дер-Ваальса из-за ковалентных связей.
- 444 2 O 9 9009
- 444 2 O
The titration of HCl + H 2 CO 3 is not possible because of хотя кислотная природа обоих химических соединений, H 2 CO 3 является слабой кислотой, невозможно рассчитать конечную точку реакции, так как происходит образование газов, таких как окись углерода и хлор.
HCl + H 2 CO 3 Net Ionic уравнение , чтобы написать ионное ионическое уравнение.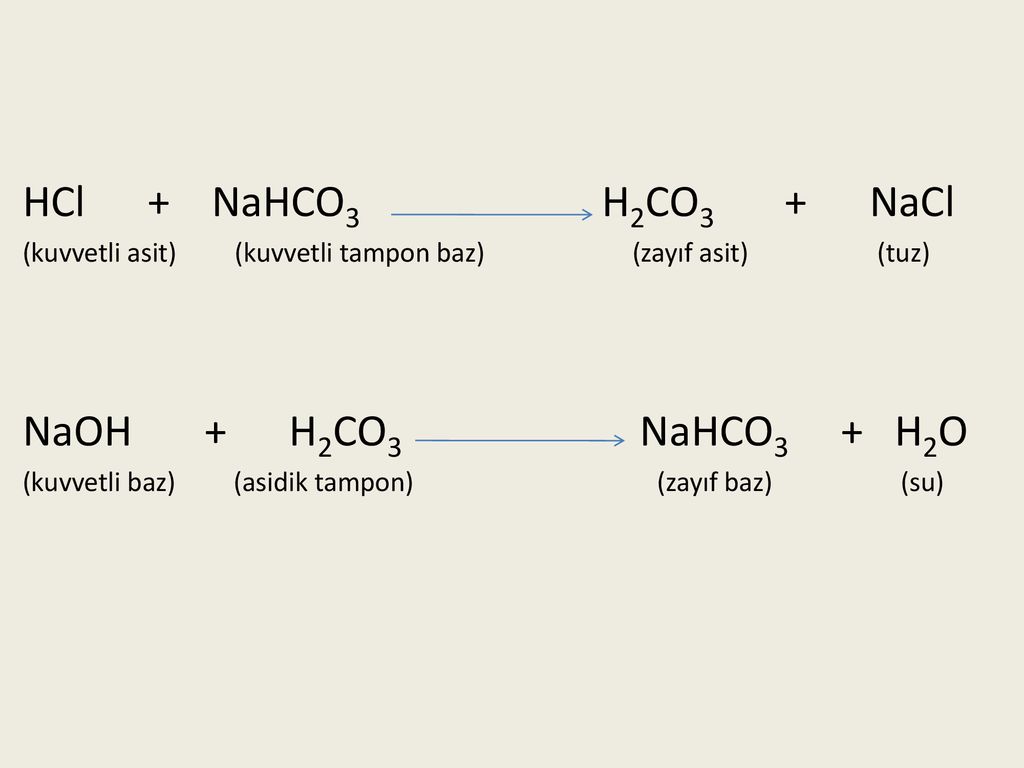 HCl(л) + H 2 CO 3 (л) = Cl 2 (г) + CO(г) + H 2 O(л)
HCl(л) + H 2 CO 3 (л) = Cl 2 (г) + CO(г) + H 2 O(л)
H + + CL — + H + + CO — = CL — + CO — + HOH
.
HCl и H 2 CO 3 межмолекулярные силы HCl acid has the conjugate base of Cl – and H 2 CO 3 acid has the сопряженное основание HCO 3-, потому что оба реагента являются кислотами, и образование основания в качестве продукта происходит, когда HCl отдает протон, превращая его в Cl – превращается в сопряженную кислоту и H 2 CO 3 отдает протон и превращается в HCO 3- .
The reaction enthalpy of HCl + H 2 CO 3 is zero because One is сильная кислота и другая слабая кислота могут легко вступать в реакцию из-за одинаковой природы, и для завершения реакции не требуется никакого количества внешней энергии.
IS HCL + H 2 CO 3 A Bufcer SolutionHCL + H 2 CO 3 HAFL SOUPLEOND. раствор более кислый и H 2 CO 3 очень нестабилен и идеально превращается в газ окись углерода.
Is HCl + H 2 CO 3 полная реакция HCl + H 2 CO 3 полная реакция из-за обмена катионов и анионов образуется полный продукт в виде газов хлора и монооксида углерода.
The reaction of HCl + H 2 CO 3 is an exothermic reaction which means the кл 2 и CO также выделяют большое количество тепла вместе с газами.
IS HCl + H 2 CO 3 A Окислительная реакцияHCl + H 2 Co 3 H 2 CO 3 H 2 CO 3 H 2 CO 3 . не происходят одновременно, но в этой реакции происходит гидратация H 2 CO 3 , и она отдает только протоны, а не электроны.
IS HCl + H 2 CO 3 А реакция осаждения . Реакция HCL + H 2 CO 4. Независимость . газов хлора и угарного газа, которые не могут осесть в воде.
Реакция HCL + H 2 CO 4. Независимость . газов хлора и угарного газа, которые не могут осесть в воде.
HCl + H 2 CO 3 является необратимой реакцией, потому что образование газов происходит как продукт, а вода остается только как побочный продукт, который нельзя обратить в форму другого химического соединения.
IS HCl + H 2 CO 3 Реакция смещения HCl + H 2 CO 3 H 2 CO 3 H 2 CO 3 
