Кремний. Химия кремния и его соединений
1. Положение кремния в периодической системе химических элементов
2. Электронное строение кремния
3. Физические свойства и нахождение в природе кремния
4. Качественные реакции на силикаты
5. Основные соединения кремния
6. Способы получения кремния
7. Химические свойства кремния
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и углеродом
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с щелочами
7.2.2. Взаимодействие с кислотами
7.2.3. Взаимодействие с азотной кислотой
Бинарные соединения кремния — силициды, силан и др.
Оксид кремния (IV)
1. Физические свойства и нахождение в природе
2. Химические свойства
2. 1. Взаимодействие с щелочами и основными оксидами
1. Взаимодействие с щелочами и основными оксидами
2.2. Взаимодействие с водой
2.3. Взаимодействие с карбонатами
2.4. Взаимодействие с кислотами
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
Кремниевая кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
Силикаты
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии:
+14Si 1s22s22p63s23p2
Электронная конфигурация кремния в возбужденном состоянии:
+14Si* 1s22s22p63s13p3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами. Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например, если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 кремниевая кислота H2SiO3 силикаты MeSiO3 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком:
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана:
SiH4 → Si + 2H2
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами, и с неметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагирует с хлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом.
1.4. С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1. 5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 → SiO2
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Видеоопыт взаимодействия кремния с раствором щелочи можно посмотреть здесь.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв. ) + 4HF(г.) = SiF4 + 2H2
) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например, силицид магния разлагается водой на гидроксид магния и силан:
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4
Соляная кислота легко разлагает силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg2Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
SiH4 + 2O2 → SiO2 + 2H2O
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
Силан при нагревании разлагается:
SiH4 → Si + 2H2
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si+4C-4. Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
SiC +2O2 → SiO2 + CO2
Карборунд окисляется кислородом в расплаве щелочи:
SiC + 2O2 + 4NaOH → Na2SiO3 + Na2CO3 + 2H2O
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем:
SiO2 + C + Cl2 → SiCl4 + CO
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
SiCl4 + 3H2O → H2SiO3↓ + 4HCl
Хлорид кремния (IV) восстанавливается водородом:
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой, т.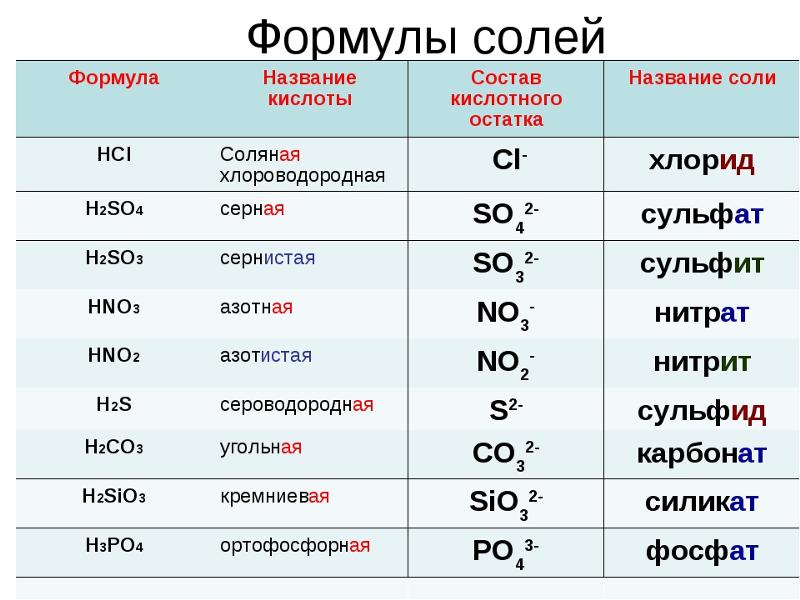 к. кремниевая кислота нерастворима.
к. кремниевая кислота нерастворима.
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 4HF(г) = SiF4 + 2H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидроксидом калия:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + 2H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
Понравилось это:
Нравится Загрузка…
Угольная и кремниевая кислоты — Mind Map
Кремниевая кислота
r
Кремниевая кислота h3SiO3 является двухосновной и более слабой, чем угольная кислота. Её получают взаимодействием силикатов (Na2SiO3 или K2SiO3) с более сильными кислотами, например h3SO4, HCl:Na2SiO3+ 2HCl = h3SiO3🠗 + 2NaCl Сокращенная форма:2H+ + SiO32- = h3SiO3🠗
Cвойства кремниевой кислоты
r
При незначительном нагревании или длительном хранении кислота разлагается на оксид и воду:h3SiO3 ⟶ᵗ h3O + SiO2Качественная реакция на силикат-ион: Na2SiO3+ 2HCl = h3SiO3🠗 + 2NaCl Сокращенная форма:2H+ + SiO32- = h3SiO3🠗 Соли кремниевой кислоты реагируют :1.с кислотами:Na2SiO3+ 2HCl = h3SiO3🠗 + 2NaCl 2.с солями:Na2SiO3 + CaCl2 = 2NaCl + CaSiO3🠗3.с щелочами: h3SiO3 + 2NaOH = Na2SiO3 + 2h3O
Соли кремниевой кислоты
r
Соли кремниевой кислотыДля кремниевой кислоты известны только средние соли — силикаты. Большинство из них плохо растворяются в воде. Растворимые соли силикат натрия и силикат калия называют «растворимые стёкла» и используют как «канцелярский клей». Получить силикаты можно сплавлением оксида кремния(IV) как кислотного оксида со щелочами, оксидами металлов, а также с карбонатами:CaO + SiO2 = CaSiO3;2NaOH(тв) + SiO2 = Na2SiO3 + h3O🠕;Na2CO3 + SiO2 = Na2SiO3 + CO2🠕;
Большинство из них плохо растворяются в воде. Растворимые соли силикат натрия и силикат калия называют «растворимые стёкла» и используют как «канцелярский клей». Получить силикаты можно сплавлением оксида кремния(IV) как кислотного оксида со щелочами, оксидами металлов, а также с карбонатами:CaO + SiO2 = CaSiO3;2NaOH(тв) + SiO2 = Na2SiO3 + h3O🠕;Na2CO3 + SiO2 = Na2SiO3 + CO2🠕;
Качественная реакция на силикат-ион
Производство строительных материалов на основе силикатов и карбонатов
r
Природные силикаты и карбонаты служат основой для производства цемента, бетона, стекла.Цемент получают спеканием известняка CaCO3 и глины, одна из составных частей которой — каолинит, включающий оксиды SiO2 и Al2O3.Бетон изготавливают из смеси песка, цемента и воды. Добавляя в такую смесь шлак, получают шлакобетон. Если свежеприготовленной смесью заливают металлический каркас, то при затвердевании получаются железобетонные конструкции. При использовании в качестве наполнителя газообразных веществ получают пенобетон.Стекло применяют в строительной сфере (остекление окон, витражей, дверей, оранжерей), в оптической промышленности, медицине, машиностроении, приборостроении, современной архитектуре, электронике, быту. Сырьём для производства стекла («варки стекла») являются карбонаты натрия и кальция, а также оксид кремния(IV),то есть кристаллическая сода, мел или известняк и кварцевый песок (Na2CO3, CaCO3, SiO2). В состав стекла входят оксиды натрия, кальция и кремния в мольном соотношении 1 : 1 : 6.Для придания стеклу особых свойств в исходную смесь вводят добавки. Так, для его окрашивания используют различные оксиды: СuO придаёт голубой цвет, FeO — зелёный, СоО — от голубого до сине-фиолетового. Глушители уменьшают прозрачность стекла, делают его матовым. Наклеивание полимерных плёнок увеличивает прочность. Армирование металлической проволокой придаёт декоративные свойства и препятствует образованию больших осколков при растрескивании.
При использовании в качестве наполнителя газообразных веществ получают пенобетон.Стекло применяют в строительной сфере (остекление окон, витражей, дверей, оранжерей), в оптической промышленности, медицине, машиностроении, приборостроении, современной архитектуре, электронике, быту. Сырьём для производства стекла («варки стекла») являются карбонаты натрия и кальция, а также оксид кремния(IV),то есть кристаллическая сода, мел или известняк и кварцевый песок (Na2CO3, CaCO3, SiO2). В состав стекла входят оксиды натрия, кальция и кремния в мольном соотношении 1 : 1 : 6.Для придания стеклу особых свойств в исходную смесь вводят добавки. Так, для его окрашивания используют различные оксиды: СuO придаёт голубой цвет, FeO — зелёный, СоО — от голубого до сине-фиолетового. Глушители уменьшают прозрачность стекла, делают его матовым. Наклеивание полимерных плёнок увеличивает прочность. Армирование металлической проволокой придаёт декоративные свойства и препятствует образованию больших осколков при растрескивании. Следует отметить возможность многократной переработки стекла.
Следует отметить возможность многократной переработки стекла.
Cвойства солей угольной кислоты
r
1.Качественная реакция на карбонат-ион:CaCO3 + 2HCl = CaCl2 + h3O + CO2🠕Сокращенная форма:CaCO3 + 2H+ = Ca2+ + h3O + CO2🠕2.Взаимопревращение карбонатов и гидрокарбонатов:Ca(HCO3)2 + Ca(OH)2 ⟶ 2CaCO3🠗 + 2h3OCaCO3 + h3O + CO2🠕 ⟶ Ca(HCO3)23.Взаимодействие с кислотами:гидрокарбонаты:NaHCO3 + HCl = NaCl + h3O + CO2🠕Сокращенная форма:HCO3- + H+ = h3O + CO2🠕карбонаты:MgCO3 + 2HCl = MgCl2 + h3O + CO2🠕Сокращенная форма:MgCO3 + 2H+ = Mg2+ + h3O + CO2🠕4.Термическое разложение (т.к. угольная кислота обладает невысокой термической устойчивостью (кроме карбонатов натрия и калия, рубидия и цезия):2NaHCO3 = Na2CO3 + h3O + CO2🠕 CaCO3 =CaO + CO2🠕5. с активными металлами: h3CO3 + Mg = MgCO3 + h3🠕6. с основными оксидами:h3CO3 + CaO = CaCO3🠗 + h3O7. с основаниями:h3CO3 + 2NaOH(конц) = Na2CO3 + 2h3Oh3CO3 + 2NaOH(разб) = NaHCO3 + h3O8.В обычных условиях распадается на углекислый газ и воду:h3CO3 ⇆ h3O + CO2🠕
Качественная реакция на карбонат-ион
Как приготовить раствор силиката натрия
••• темно-красный стеклянный горшок и стеклянные голубые шарики. «жидкое стекло», как универсальное и широко используемое решение. Силикат натрия известен как жидкое стекло по уважительной причине: когда вода, в которой он растворен, испаряется, силикат натрия связывается в твердый лист стекла. Тепловая закалка делает силикатную заплату более твердой, но раствор все еще можно использовать для огнезащиты дерева и защиты бетона от пятен, если нанести его и дать ему высохнуть при комнатной температуре.
«жидкое стекло», как универсальное и широко используемое решение. Силикат натрия известен как жидкое стекло по уважительной причине: когда вода, в которой он растворен, испаряется, силикат натрия связывается в твердый лист стекла. Тепловая закалка делает силикатную заплату более твердой, но раствор все еще можно использовать для огнезащиты дерева и защиты бетона от пятен, если нанести его и дать ему высохнуть при комнатной температуре.
- 1 пинта (16 унций) порошка силиката натрия
- 24 унции.
 очищенная вода
очищенная вода - Металлическая ложка
- Перчатки из нитрилового каучука
- 40 унций. герметичный пластиковый контейнер
Этот рецепт можно масштабировать до любого количества раствора силиката натрия. Основные пропорции: 4 части порошка силиката натрия на 6 частей воды.
Перелейте раствор в пластиковый контейнер и как можно скорее закройте его. Раствор силиката натрия быстро разлагается в присутствии кислорода.
Силикат натрия чрезвычайно опасен при неправильном обращении, поэтому никогда не работайте с сухим или водным силикатом натрия без защиты. Сухой силикат натрия чрезвычайно агрессивен, и водные растворы могут легко проникать через кожу. Если раствор проникнет в вашу кожу, он высохнет внутри верхнего слоя и «окаменеет» на нем.
Доведите очищенную воду до слабого кипения (примерно 175 градусов) на электрической плите.
Металлической ложкой с длинной ручкой размешайте порошок силиката натрия в горячей воде. Продолжайте помешивать, пока порошок полностью не растворится.
Снимите раствор с огня и дайте ему остыть до комнатной температуры. Перемешивайте раствор каждые пять минут.
Перелейте раствор в пластиковый контейнер, как только раствор остынет, и закройте его.
Вещи, которые вам понадобятся
Предупреждения
Связанные статьи
Советы
- Этот рецепт можно масштабировать до любого количества раствора силиката натрия.
 Основные пропорции: 4 части порошка силиката натрия на 6 частей воды.
Основные пропорции: 4 части порошка силиката натрия на 6 частей воды. - Перелейте раствор в пластиковый контейнер и как можно скорее закройте его. Раствор силиката натрия быстро разлагается в присутствии кислорода.
Предупреждения
- Силикат натрия чрезвычайно опасен при неправильном обращении, поэтому никогда не работайте с сухим или водным силикатом натрия без средств защиты. Сухой силикат натрия чрезвычайно агрессивен, и водные растворы могут легко проникать через кожу. Если раствор проникнет в вашу кожу, он высохнет внутри верхнего слоя и «окаменеет» на нем.
Об авторе
Ричард Роу профессионально пишет с 2007 года, специализируясь на автомобильной тематике. Работал трактористом и механиком, такелажником на заводе пожарных машин, автогонщиком и строителем. Роу изучал инженерное дело, философию и американскую литературу в Общественном колледже Центральной Флориды.
Фото предоставлено
темно-красный стеклянный горшок и стеклянные голубые шарики. Изображение Марии Бжостовской с сайта Fotolia.com
Изображение Марии Бжостовской с сайта Fotolia.com
Как сделать силикат натрия из гидроксида натрия
••• améthyste image by chantal cecchetti from Fotolia.com
Обновлено 24 апреля 2017 г. «жидкое стекло» — это соединение, используемое во многих сферах промышленности, включая производство автомобилей, керамику и даже окрашивание красок и тканей. Благодаря своим клеящим свойствам его часто используют для заделки трещин или прочного соединения предметов. Это прозрачное водорастворимое соединение можно создать из продуктов, которые можно найти дома (гранулы силикагеля и отбеливатель) или в химической лаборатории (используя гидроксид натрия).
- Силикагельские шарики
- Вода
- Гидроксид натрия
- Bunsen Burner
- ТЕЗАТЕЛЯ
- Тестовая труба
- GLOVES
- Тестовая трубка
- GLOVES
- TEST PUBE
- GLOVES
- 2
- . Эксперимент (6 и 8 граммов) был настроен так, чтобы соответствовать стехиометрическим соотношениям химических веществ. Если вы хотите сделать больше жидкого стекла, просто умножьте оба этих числа на одну и ту же константу.
Гидроксид натрия является распространенным ингредиентом большинства основных бытовых жидких чистящих средств.
Всегда надевайте защитные очки и перчатки при проведении научных экспериментов.
 Родительский контроль за детьми обязателен!
Родительский контроль за детьми обязателен!
Нагрейте 10 мл воды в пробирке над горелкой Бунзена.
Добавьте в пробирку 8 г гидроксида натрия. Закройте крышкой и встряхните до полного растворения.
Измельчите шарики силикагеля, чтобы получить 6 граммов мелкого порошка кремнезема. Шарики силикагеля можно найти в маленьких пакетиках, которые приходят в только что купленную обувь. Они находятся в маленьких бумажных пакетиках с надписью «Силикагель: не есть».
Они находятся в маленьких бумажных пакетиках с надписью «Силикагель: не есть».
Добавьте порошок кремнезема в пробирку. Нагрейте над горелкой Бунзена и встряхните до полного растворения. Если через десять минут порошок не растворится полностью, добавьте в пробирку еще немного воды и встряхните до полного растворения.
вещей, которые вам понадобятся
Предупреждения
Связанные статьи
Наконечники
- Массовые соотношения в этом эксперименте (6 и 8 граммов) были установлены в соответствии со стехиометрическими соотношениями химических веществ. Если вы хотите сделать больше жидкого стекла, просто умножьте оба этих числа на одну и ту же константу.
- Гидроксид натрия является распространенным ингредиентом большинства основных бытовых жидких чистящих средств.
Предупреждения
- Всегда надевайте защитные очки и перчатки при проведении научных экспериментов.
- Требуется родительский контроль за детьми.
Об авторе
Бэйли Ричерт в 2010 году окончила Политехнический институт Ренсселера, получив двойную степень бакалавра в области экологической инженерии и гидрогеологии, а также степень магистра в области системной инженерии. Проработав несколько лет в сфере экологического консалтинга, она поступила в аспирантуру Массачусетского технологического института.

 очищенная вода
очищенная вода Основные пропорции: 4 части порошка силиката натрия на 6 частей воды.
Основные пропорции: 4 части порошка силиката натрия на 6 частей воды. Родительский контроль за детьми обязателен!
Родительский контроль за детьми обязателен!