что, как сбалансировать и часто задаваемые вопросы —
By Сумак Махато
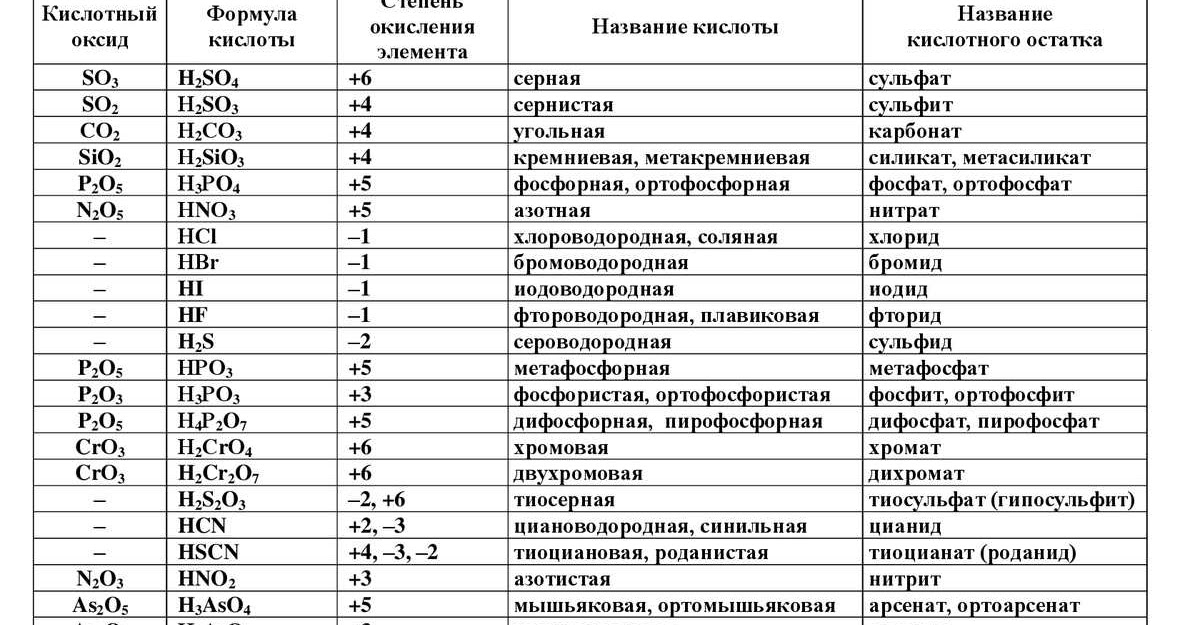
Метасиликат натрия представляет собой белый кристалл, имеющий формулу Na.2SiO3. Давайте посмотрим на его реакцию с сильнокислотным соединением серной кислотой (H2SO4).
Серная кислота представляет собой водорастворимую сильнокислотную жидкость. Метасиликат натрия содержит два Na+ ионы и полимерный анион SiO32-. В2SiO3 представляет собой стеклообразное белое вещество с молярной массой 122.06 г/моль. Растворимость Na2SiO3 в воде 22.2 г/100 мл (25 °С).
В этом контексте некоторые ключевые моменты реакции между H2SO4 и Na2SiO3 обсуждаются ниже.
Что является произведением H2SO4 и Na2SiO3?Метакремниевая кислота ( H2SiO3) и сульфат натрия ( Na2SO4) являются продуктами реакция H2SO4+ На2SiO3.
Na2SiO3 + H2SO4→ H2SiO3 + На2SO4
Какой тип реакции Н2SO4 + На2SiO3?H2SO4+ Na2SiO3 реакция является реакцией двойного замещения.
Как сбалансировать H2SO4 + На2SiO3?Придерживайтесь этих шагов для балансировки H2SO4+ Na2SiO3 реакция:
- Количество атомов в левой части реакции: Na=2, Si=1, O=7, H=2 и S=1.
- С правой стороны Na=2, Si=1, O=7, H=2 и S=1.
- Обе стороны имеют равное количество атомов Na, Si, O, H и S.
- Таким образом, полное сбалансированное химическое уравнение имеет вид
- Na2SiO3 + H2SO4= H2SiO3 + На2SO4
H2SO4+ На2SiO3 титрование невозможно, так как метасиликат натрия имеет полимеризация тенденции, и ни об одном эксперименте по титрованию не сообщалось.
Чистое ионное уравнение H2SO4+ На2SiO3 реакции не существует, потому что если с обеих сторон удалить одинаковые ионы, то никакого суммарного ионного уравнения не будет.
2Na+(водный) + SiO32- (водн.)+ 2H+(водн.) + SO42-(водн.) = 2Na+(водн.) + SO42-(водн.)+ 2H+(водн.) + SiO32- (Водно)
H2SO4 + На2SiO3 сопряженные парыСопряженные пары H2SO4+ Na2SiO3 реакции:
- SO42- является сопряженной основой H2SO4.

- H2SiO3 представляет собой сопряженную кислоту Na2SiO3.
- SiO32- является сопряженным основанием H2SiO3.
Межмолекулярная сила, действующая H2SO4 и Na2SiO3 это:
- Na2SiO3 показывает ионное взаимодействие между противоионами и ионно-дипольное притяжение в растворе.
- H2SO4 обладает диполь-дипольным взаимодействием, Лондонская дисперсионная сила сила водородной связи в растворе.
Энтальпия реакции H2SO4+ Na2SiO3 = -240. 36 кДж/моль.
36 кДж/моль.
| Соединения | Количество молей | Энтальпия образования, ΔH0f (кДж/моль) |
|---|---|---|
| H2SO4 | 1 | -814 |
| Na2SiO3 | 1 | -1518.79 |
| H2SiO3 | 1 | -1188.67 |
| Na2SO4 | 1 | -1384.48 |
- Энтальпия реакции =& delta; H0ф (реакция) = Σ∆H0ф (продукт) – Σ∆Н0f (реагенты)
- & delta; H0ф (реакция)= [1× (-1188.67) + 1× (-1384.48)] – [1× (-814) + 1× (-1518.79)] кДж/моль.
- & delta; H0ф (реакция) = -240.
 36 кДж/моль.
36 кДж/моль.
H2SO4+ На2SiO3 не буферный раствор потому что буферный раствор не может быть образован в присутствии сильных кислот, таких как H2SO4.
Н2SO4 + На2SiO3 полная реакция?H2SO4+ На2SiO3 это полная реакция , так как: в нормальных условиях дальнейшая реакция невозможна.
Н2SO4 + На2SiO3 экзотермическая или эндотермическая реакция?H2SO4+ На2SiO3 реакция является экзотермической реакцией, поскольку в ходе реакции выделяется тепло -240.36 кДж/моль.
Н2SO4 + На2SiO3 окислительно-восстановительная реакция?H2SO4+ На2SiO3 не является окислительно-восстановительной реакцией, потому что ни атом серы (S) H2SO4 ни атом кремния (Si) Na2SiO3 восстанавливается или окисляется, но сохраняет свои степени окисления неизменными как в реагентах, так и в продуктах. Окислительно-восстановительный процесс
Окислительно-восстановительный процесс
H2SO4+ Na2SiO3 реакция не является реакцией осаждения, поскольку в реакционной смеси не наблюдается образования осадка.
Н2SO4 + На2SiO3 обратимая или необратимая реакция?H2SO4+ Na2SiO3 реакция является обратимой реакцией, потому что продукты H2SiO3 и Na2SO4 давать H2SO4 и Na2SiO3 реагируя обратным образом.
Na2SiO3 + H2SO4⇌ H2SiO3 + На2SO4
Н2SO4 + На2SiO3 реакция смещения?H2SO4+ На2SiO3 реакция является реакцией двойного замещения, потому что 2H+ из H2SO4 вытесняет 2Na+ из Na2SiO3 дать Х2SiO3 и 2Na+ из Na2SO4 вытесняет 2H+ из H2SO4 дать На2SO4.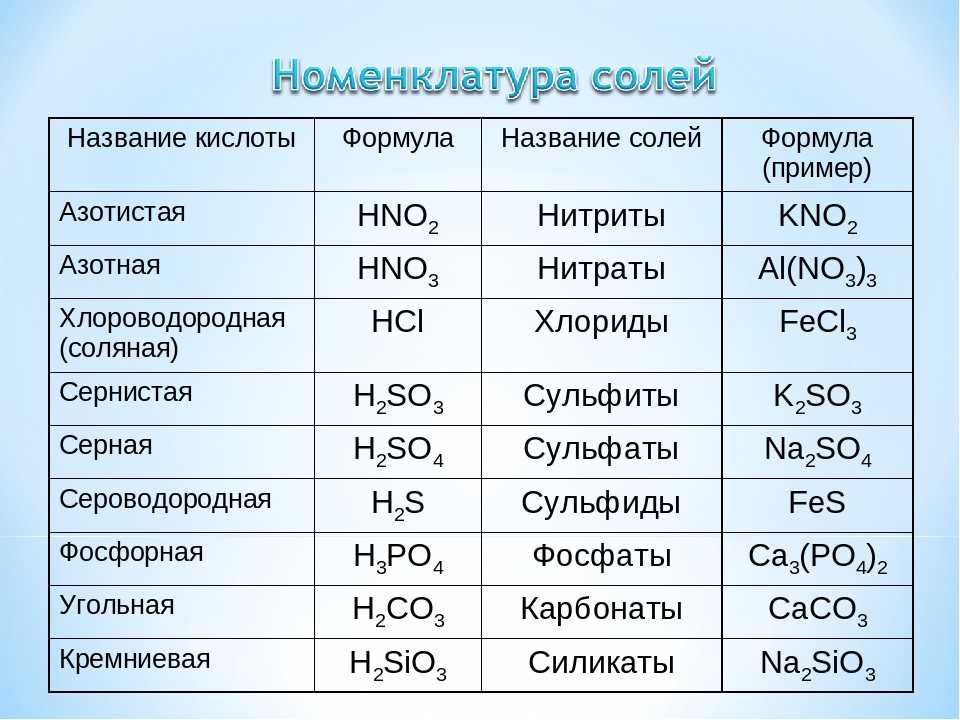 Двойная реакция смещения
Двойная реакция смещения
Заключение
Метасиликат натрия ( Na2SiO3) используется в стакане воды. Он также используется в приготовлении силикагеля. И Х2SO4 является ключевым компонентом в различных процессах синтеза и необходим в каждой лаборатории, а также в химической промышленности.
10.1.3. Химические способы очистки | Всё о красках
Химические способы очистки металлов наиболее распространены в промышленности. Они доступны, универсальны, экономичны. Их используют при обезжиривании поверхности, удалении оксидов металлов (травлении) и снятии старых покрытий.
Обезжиривание. На поверхности металлов могут присутствовать омыляемые (компоненты смазок, полировочных паст, следы от кожи рук) и неомыляемые (консервационные смазки, эмульсионные составы и др.) «жировые» загрязнения.
Различают три степени загрязнения в зависимости от количества примесей на единице поверхности: слабую – не более 1, среднюю – не более 5 и сильную – более 5 г/м2.
Химическое обезжиривание основано на растворении, эмульгировании и разрушении (омылении) жиров и масел. В качестве обезжиривающих веществ применяют: органические растворители, водные моющие растворы и эмульсии растворителей в воде (эмульсионные составы).
Наиболее дешевый, пожаробезопасный и менее токсичный способ — обезжиривание водными моющими растворами. Оно основано на химическом разрушении омыляемых жиров и масел и солюбилизации и эмульгировании неомыляемых загрязнений. Последний процесс схематически можно представить в виде последовательных стадий (рис. 10.1).
Рис. 10.1. схема процесса удаления (эмульгирования) масляного слоя щелочным раствором: р – раствор; м – масло; э – эмульсия; п – подложка
Вода обладает слабым моющим действием по отношению к масляным загрязнениям. Из-за большого поверхностного натяжения и несовместимости с маслами она плохо смачивает зажиренные поверхности и не образует стабильных эмульсий.
Обезжиривание ускоряется при повышении температуры, механическом воздействии, использовании электролитов, повышении рН среды, применении ПАВ. На принципе сочетания температурного и механического воздействий разработан и применяется способ пароструйной очистки. Поверхность обрабатывают водяным паром под давлением 0,6–4,0 МПа или теплой водой, выходящей из насадок под давлением 16–18 МПа.
На принципе сочетания температурного и механического воздействий разработан и применяется способ пароструйной очистки. Поверхность обрабатывают водяным паром под давлением 0,6–4,0 МПа или теплой водой, выходящей из насадок под давлением 16–18 МПа.
Особенно эффективно использование водных растворов щелочных электролитов и ПАВ: едкого натра (каустическая сода) NaOH, карбонат натрия (кальцинированная сода) Na2CO3, силикат натрия (жидкое стекло) Na2SiO3, тринатрийфосфат Na3PO4, пирофосфат натрия Na4P2O7, гексаметафосфат натрия (NaPO3)6, триполифосфат натрия Na3PO4×2NaPO3. Эмульгирующее действие возрастает при введении ионогенных (мыла, алкил — , и арилсульфонаты) и неионогенных (оксиэтиленовые эфиры алкилированных фенолов и др.) ПАВ. Часто используют добавки водорастворимых полимеров, например, Na–карбоксиметилцеллюлозы. Это предотвращает оседание загрязнений на очищаемой поверхности. Для обезжиривания черных металлов обычно применяют растворы с общей концентрацией щелочи и щелочных солей 30–100 г/л (рН=10–13).
Составы для обезжиривания цветных металлов часто отличаются от составов, применяемых для очистки черных металлов. Как правило, они имеют более низкие значения рН среды. В промышленности применяют:
1) готовые составы, выпускаемые в виде концентратов;
2) составы, приготовляемые на месте потребления.
Широко используют моющие композиции КМ–1, КМИ–1, КМА–1 и КМА–2. Это порошковые смеси солей фосфорной, борной, и других кислот с соответствующими ПАВ. Для получения растворов рабочей концентрации (0,5–2,0%) композиции растворяют в воде. Обезжиривание проводят распылением растворов при следующих условиях:
Температура, °С 55-65
Продолжительность, мин 1,5-3
Расход композиции, г/м2 не более 10.
При обезжиривании стали распылением также эффективны моющие средства: МС–5, МС–6, МС–8, СМ–2, МЛ–51, МЛ–52, З–14, лабомид–203, и др.; цинка и алюминия – состав КМ–5. Перечисленные составы образуют растворы с рН=9,8–12,0; степень очистки ими поверхности стали составляет 94–98%.
Рецептуры некоторых составов (в г/л), приготовляемых на месте потребления и применяемых для обезжиривания черных и цветных металлов способом окунания приведены в табл. 10.1.
Таблица 10.1. Рецептуры некоторых составов для обработки металлических поверхностей
Состав | Cталь | Алюминий и сплавы | Магниевые сплавы | Цинк и олово |
1 | 2 | 3 | 4 | 5 |
Едкий натр | 8-10 | 10-25 | Тринатрий-фосфат | 20-30 | 5-10 | 40-60 | 1-3 |
Силикат натрия | 1-3 | 3-4 | 20-30 | 1-3 |
Карбонат натрия | 15-20 | 10-15 | ||
Триполифосфат натрия | 2-3 | |||
Эмульгатор (синтанол ДС-10 сульфонол ОП-7 или ОП-10) | 1-3 | 3-5 | 1-3 | 0,2-0,5 |
Обезжиривание проводят при температуре рабочего раствора 50-80°С, продолжительность — 5-20 мин. Обезжиривание органическими растворителями, в отличие от щелочного, основано на растворении масляных и жировых загрязнений. Этим способом удается достичь хорошей степени очистки поверхности за короткое время.
Обезжиривание органическими растворителями, в отличие от щелочного, основано на растворении масляных и жировых загрязнений. Этим способом удается достичь хорошей степени очистки поверхности за короткое время.
Применяются растворители, обладающие высокой активностью (растворяющей способностью) по отношению к загрязнениям, стабильностью (стойкостью к разложению), низким поверхностным натяжением, умеренной летучестью. В первую очередь используют алифатические и хлорированные углеводороды:
Ткип °С | ||
Метиленхлорид | 71 | |
Тетрахлорметан (четыреххлористый углерод) | 77 | |
Дихлорэтан | 83 | |
Трихлорэтилен | 87 | |
Перхлорэтилен | 121 | |
Пентахлорэтан | 159 | |
Уайт-спирит. | 155-195. |
Хлорированные углеводороды, в отличие от алифатических, негорючи, однако они более токсичны (предельно допустимая концентрация паров трихлорэтилена и пентахлорэтана составляет 10 мг/м3, уайт-спирита 300мг/м3). Хлорсодержащие растворители, кроме того, склонны к гидролизу при действии воды. Особенно подвержен гидролизу трихлорэтилен, наиболее широко применяемый для обезжиривания растворитель. Образующийся при гидролизе хлороводород может вызвать коррозию изделий и аппаратуры (ванн). Для локализации его действия в состав растворителей вводят ингибиторы коррозии и вещества, нейтрализующие хлороводород, например аммиак, триэтаноламин, уротропин (0,001 г/л) и др.
Обработку растворителями проводят как в жидкой, так и паровой фазах. Особенно часто сочетают оба способа воздействия.
Обезжиривать растворителями можно практически любые металлы. Не рекомендуется применять триэтаноламин, не содержащий ингибиторов, для обезжиривания алюминия, магния и их сплавов во избежание нежелательных реакций с металлической поверхностью.
Эмульсионное обезжиривание — комбинированный способ, сочетающий многие достоинства очистки органическими растворителями и водными щелочными растворами.
Эмульсионное обезжиривание особенно эффективно при большом количестве механических загрязнений на поверхности. Из-за пониженной токсичности и пожаробезопасности эмульсионные составы оправдали себя и при ручной очистке изделий взамен органических растворителей. Применяют составы, представляющие собой эмульсии органических растворителей в воде, стабилизированные ионогенными или неионогенными ПАВ.
Растворители – алифатические, ароматические или хлорированные углеводороды. Их массовая доля в готовых для применения эмульсиях колеблется от 5 до50%. Для стабилизации вводят небольшое количество смешивающихся с водой растворителей (спиртов, эфиров). Моющие составы, в которых массовая доля растворителя не превышает 10%, считаются не огнеопасными при применении.
Рецептура одного из составов на основе трихлорэтилена, %:
Трихлорэтилен 20
Пирофосфат натрия 0,5
Ингибитор (амин) 0,5
Эмульгаторы (ОП–10, сульфонол) 2,0
Вода 77
Технологический процесс обезжиривания включает следующие операции: обработка поверхности моющим составом, последующая промывка (в случае водно-щелочных и эмульсионных составов) и сушка.
Обезжиривание погружением проводят в стационарных ваннах, снабженных паровым, газовым или электрическим обогревом. Агрегаты струйной очистки работают в непрерывном и периодическом режимах. Наиболее распространены агрегаты непрерывного действия. Изделия в них проходят на подвесных конвейерах последовательно три зоны: обезжиривания, первой и второй промывок. Промывка осуществляется водой Т=20–70°С. Вода, как и обезжиривающий состав, подается на изделие через специальные насадки под давлением 0,15–0,20 МПа; продолжительность обезжиривания 2–3 мин., промывки – 1–2 мин.
Обезжиривание растворителями проводят в закрытых камерах или установках непрерывного действия. Загрязненные изделия на конвейере последовательно проходят через ванну с растворителем, зону облива и зону выдержки в пазах. Общее время обезжиривания 2–5 мин. Загрязненный растворитель регенерируют перегонкой.
Загрязненные изделия на конвейере последовательно проходят через ванну с растворителем, зону облива и зону выдержки в пазах. Общее время обезжиривания 2–5 мин. Загрязненный растворитель регенерируют перегонкой.
Ультразвуковое обезжиривание – ускоряет процесс, улучшает качество очистки поверхности. Процесс ведут в акустическом (ультразвуковом) поле. Используют этот прием для очистки изделий небольших размеров и сложной формы, от которых требуется высокая степень чистоты поверхности (детали часов и приборов, инструмент и т.д.). Крупные изделия требуют больших по размерам ванн. Входная мощность преобразователя при этом резко возрастает (на 4,5 л жидкости входная мощность составляет приблизительно 100 Вт), что экономически не выгодно.
Ультразвуковую очистку проводят в специальных установках – ваннах (УЗВ–15м, УЗВ–16м, УЗВ–18м), снабженных магнитострикционными, пьезокерамическими или ферритовыми преобразователями. Полезный объем ванны 15–150 л. Очистку проводят при следующем режиме:
Частота, кГц 20–40
Удельная мощность, кВт/м2 10–30
Температура водно-
щелочных и эмульсионных составов, °С 40-50
Продолжительность очистки, мин 0,5–2,0
Температура растворителей, °С 20–40
Электрохимическое обезжиривание. Водные растворы для электрохимического обезжиривания содержат, в основном те же компоненты, что и растворы, применяемые при химической очистке. Учитывая активную роль, которую играют в электрохимическом процессе выделяющиеся на электроде пузыри газов, концентрация компонентов (как и в случае ультразвукового обезжиривания) может быть значительно понижена. Электрохимическим способом можно обезжиривать как черные, так и цветные металлы. Типовой состав электролита (г/л):
Водные растворы для электрохимического обезжиривания содержат, в основном те же компоненты, что и растворы, применяемые при химической очистке. Учитывая активную роль, которую играют в электрохимическом процессе выделяющиеся на электроде пузыри газов, концентрация компонентов (как и в случае ультразвукового обезжиривания) может быть значительно понижена. Электрохимическим способом можно обезжиривать как черные, так и цветные металлы. Типовой состав электролита (г/л):
Кальцинированная сода 40–50
Тринатрийфосфат 50–60
Метасиликат натрия 3–5
Синтанол 1–2
Условия проведения процесса:
Плотность тока, кА/м2 0,5–1,0
Температура, °С 60–80
Продолжительность очистки, мин 1–2.
ICSC 1137 — СИЛИКАТ НАТРИЯ (раствор 25-50%)
ICSC 1137 — СИЛИКАТ НАТРИЯ (раствор 25-50%)« вернуться к списку результатов поиска
Китайский — ZHАнглийский — ENФинский — FIFФранцузский — FRНемецкий — DEИврит — HEВенгерский — HUIИтальянский — ITЯпонский — JAKКорейский — KOPперсидский — FAПольский — PLПортугальский — PTРусский — RUSиспанский — ES
| СИЛИКАТ НАТРИЯ (раствор 25-50%) | ICSC: 1137 (октябрь 2001 г. ) ) |
| Силикат натрия Кремниевая кислота, натриевая соль Жидкое стекло | |
| Номер CAS: 1344-09-8 |
| Номер ЕС: 215-687-4 |
| ОСТРЫЕ ОПАСНОСТИ | ПРЕДУПРЕЖДЕНИЕ | ПОЖАРОТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючий. | В случае возгорания поблизости используйте соответствующие средства пожаротушения. |
| ПРЕДОТВРАТИТЬ ОБРАЗОВАНИЕ ТУМАНА! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Больное горло. Больное горло. | Используйте вентиляцию. Используйте местную вытяжку. | Свежий воздух, отдых. |
| Кожа | Покраснение. Боль. | Защитные перчатки. | Сначала промыть большим количеством воды в течение не менее 15 минут, затем снять загрязненную одежду и снова прополоскать. Обратитесь за медицинской помощью. |
| Глаза | Покраснение. Боль. | Наденьте защитную маску. | Сначала промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно), затем обратиться за медицинской помощью. |
| Проглатывание | Диарея. Тошнота. Рвота. | Не ешьте, не пейте и не курите во время работы. | Прополоскать рот. Дайте выпить один или два стакана воды. Не вызывает рвоту. Обратитесь за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Соберите подтекающую и пролитую жидкость в герметичные контейнеры, насколько это возможно. Абсорбировать оставшуюся жидкость песком или инертным абсорбентом. Затем храните и утилизируйте в соответствии с местным законодательством. Индивидуальная защита: автономный дыхательный аппарат. Абсорбировать оставшуюся жидкость песком или инертным абсорбентом. Затем храните и утилизируйте в соответствии с местным законодательством. Индивидуальная защита: автономный дыхательный аппарат. | В соответствии с критериями СГС ООН Транспорт |
| ХРАНЕНИЕ | |
| Отдельно от сильных кислот, алюминия и цинка. | |
| УПАКОВКА | |
| НАТРИЯ СИЛИКАТ (раствор 25-50%) | КМГС: 1137 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физические опасности Химическая опасность | Формула: Na 2 Si 3 O 7 Относительная плотность (вода = 1): 1,4 |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Последствия кратковременного воздействия | Опасность при вдыхании Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА РАБОЧЕМ МЕСТЕ |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
| Классификация ЕС |
Все права защищены. Опубликованный материал распространяется без каких-либо явных или подразумеваемых гарантий. Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. | |
Технический раствор силиката натрия или жидкое стекло, 1 галлон. продается. Купить в The Science Compa
- Главная
- Химикаты
- Общие химические вещества
Раствор силиката натрия, 1 гал.
Цена: 44,95 доллара США
Кол-во: — +
- Описание
- Также в категории
Силикат натрия (жидкое стекло) представляет собой прозрачную бесцветную жидкость. Используется в мылах, моющих средствах, клеях и гидроизоляции. Иногда используется для герметизации небольших трещин или утечек в системе охлаждения.
Используется в мылах, моющих средствах, клеях и гидроизоляции. Иногда используется для герметизации небольших трещин или утечек в системе охлаждения.
Силикат натрия Физические и химические свойства …
- Силикат натрия: 37 % мас. % (28 % кремнезема + 9 % оксида натрия)*
- Вода: 63% мас.%
- Внешний вид: Густая жидкость.
- Цвет: От прозрачного до мутно-белого.
- Запах: Без запаха или затхлый запах.
- pH: Приблизительно 11,3
- Удельный вес: 1,39г/см3 (20°C), 41° BÈ, 11,62 фунта/галлон
- Растворимость в воде: Смешивается.
Силикат натрия доступен в больших размерах …
- Ведро на пять галлонов. (Кат. №: NC-5424)
- Бочка на 52–55 галлонов. (Кат. №: NC-11830).
Позвоните по телефону 1-800-372-6726 в рабочее время, чтобы заказать барабаны.
* Силикат натрия получают путем плавления песка высокой чистоты с карбонатом натрия (кальцинированной содой) в высокотемпературных печах. Полученный продукт представляет собой растворимый в воде силикатный порошок, известный как жидкое стекло или раствор силиката натрия после его растворения в воде. Раствор силиката натрия химически состоит из весового соотношения кремнезема и оксида натрия, растворенного в воде. Наш силикат натрия имеет массовое соотношение 3,22 (SiO2:Na2O), которое распадается на ~28,7% кремнезема (SiO2) до ~8,9%.% оксида натрия (Na2O), что соответствует раствору, который содержит примерно 37,5% силиката натрия по весу в воде.
Раствор силиката натрия, 5 гал.
NC-5424
114,95 долларов США
Карбонат аммония (аммиак Baker’s), пищевой, 8 унций.
NC-11841
$14,95
Хлорид железа, 2,5 кг
NC-11856
$84,95
Реагент для теста на витамин С (без флакона), 1 таблетка
NC-11720
$9,95
ПОЛИТИКА ВОЗВРАТА:
Неоткрытые химические вещества в оригинальной упаковке могут быть возвращены в течение 30 дней с момента отправки при условии предварительного согласования.


 36 кДж/моль.
36 кДж/моль.