что, как сбалансировать и часто задаваемые вопросы —
By Падмакши Котоки
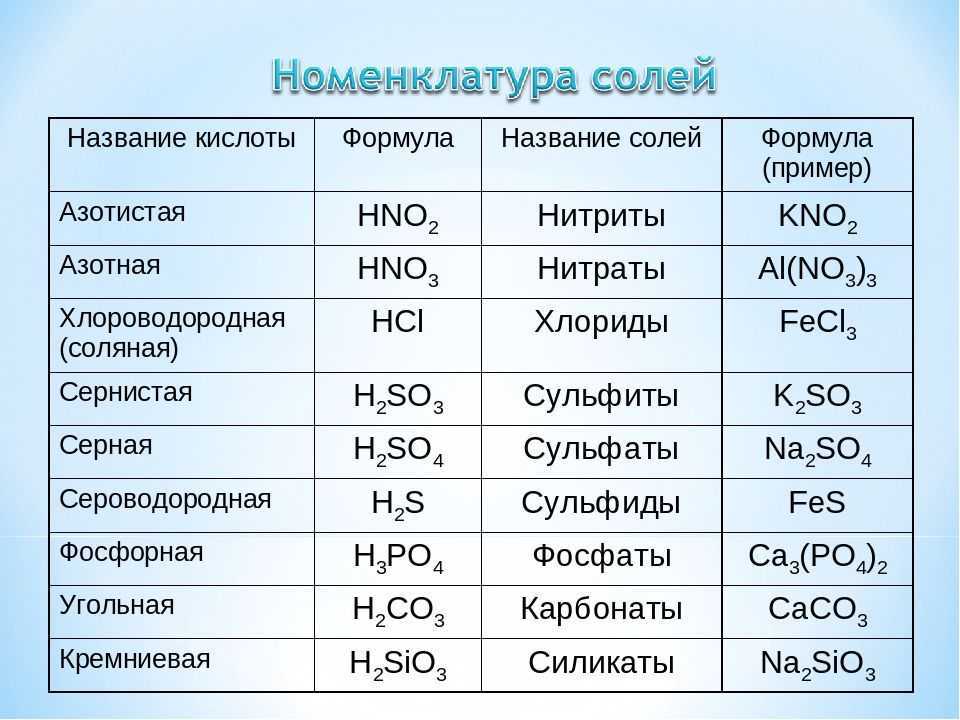
Соляная кислота является сильной реакционноспособной кислотой, которая имеет тенденцию взаимодействовать с такими основаниями, как карбонат натрия. Давайте подробно изучим их реакцию.
HCl + Na2CO3 является фундаментальной реакцией между сильной кислотой и слабым основанием. Соляная кислота обычно образуется из водного раствора газообразного хлороводорода. Карбонат натрия (Na2CO3), также известный как стиральная сода, представляет собой неорганическое химическое вещество, которое смешивается с водой и выглядит как белое кристаллическое твердое вещество без запаха.
В этой статье будут рассмотрены различные характеристики этой реакции, такие как продукты, тип реакции, титрование, энтальпия реакции и т. д.
Что является продуктом HCl + Na2CO3Образуется хлорид натрия. вместе с водой и углекислый газ, когда HCl реагирует с Na2CO3.
вместе с водой и углекислый газ, когда HCl реагирует с Na2CO3.
2HCl (Водно) + На2CO3(Водно) —> 2NaCl (Водно) + H2O (L) + CO2(g)
Какой тип реакции HCl + Na2CO3HCl + Na2CO3 кислотно-щелочная реакция, называемая также реакция нейтрализации, где HCl является сильной кислотой, а Na2CO3 является слабым основанием.
Как сбалансировать HCl + Na2CO3Уравнение дисбаланса: HCl + Na2CO3 = NaCl + H2О + СО2
Для уравнивания вышеупомянутой реакции применяются следующие шаги:
- Чтобы реакция была сбалансированной, количество атомов каждого элемента, присутствующего как на стороне реагента, так и на стороне продукта, должно быть одинаковым.

| атомы | Сторона реагента | Сторона продукта |
|---|---|---|
| Соль | 2 | 1 |
| Хлор | 1 | 1 |
| углерод | 1 | 1 |
| водород | 1 | 2 |
| Oxygen | 3 | 3 |
- Стехиометрические коэффициенты добавляются к несбалансированным атомам со стороны реагента и продукта по мере необходимости.
- Чтобы сбалансировать атом натрия, NaCl умножают на коэффициент 2.

- Атомы углерода и кислорода уже уравновешены по обе стороны реакции.
- Наконец, атом водорода уравновешивается умножением HCl на коэффициент 2.
- Следовательно, сбалансированное химическое уравнение:
- 2HCl + Na2CO3 = 2NaCl + H2О + СО2
HCl + Na2CO3 Титрование подпадает под категорию сильнокислотного титрования слабым основанием и может быть проведено следующим образом.
Необходимые аппараты и химикаты
Бюретка 50 мл, Пипетка, Коническая колба 250 мл, Мерная колба, Подставка для бюретки, Химический стакан, Воронка, Дистиллированная вода, Соляная кислота, Карбонат натрия
Индикаторные
Это титрование проводят с использованием индикатора метилового оранжевого, чтобы отметить конечную точку физического перехода в растворе.
Процедура
- Стандартный раствор Na2CO3 готовят путем растворения нескольких граммов его в дистиллированной воде.
- Бюретка заполнена стандартизированным Na2CO3 раствор после мытья и полоскания его.
- Раствор HCl переносят в чистую, промытую колбу для титрования с помощью пипетки и добавляют к ней 2 капли метилового оранжевого.
- Раствор карбоната натрия добавляют в колбу для титрования по каплям. Колбу энергично встряхивают до изменения цвета раствора на светло-розовый. Это изменение цвета указывает на конечную точку реакции.
- Затем отмечают окончательное показание и количество Na2CO3 раствора, используемого для нейтрализации раствора HCl.
- Предыдущие шаги повторяются до тех пор, пока не будут получены три согласующихся показания.
- Объем необходимого химиката рассчитывается по формуле M1V1 = М2V2
Суммарное ионное уравнение HCl + Na2CO3это: CO32-(Водно) + 2H+(Водно) = H2O (L) + CO2(Г)
Ниже приведены шаги для получения чистого ионного уравнения:
- Во-первых, полное сбалансированное уравнение записывается вместе с их физическими состояниями.

- 2HCl (Водно) + На2CO3(Водно) = 2NaCl (Водно) + H2O (L) + CO2(g)
- Теперь атомы расщеплены на ионы. Таким образом, сбалансированное чистое ионное уравнение между HCl и Na2CO3 после устранения зрительские ионы заключается в следующем:
- CO32-(Водно) + 2H+(Водно) = H2O (L) + CO2(Г)
- Сопряженным основанием HCl является Cl– поскольку HCl отдает протон с образованием Cl– ион.
- Сопряженная кислота CO32- ион HCO3– с Na2CO3 диссоциирует в воде с образованием Na+ и СО32- ионов.

- Диполь-дипольные взаимодействия и Лондонские дисперсионные силы – межмолекулярные силы, наблюдаемые в молекуле HCl.
- Ионные электростатические силы притяжения существуют между Na2CO3 Молекула.
Энтальпия реакции HCl + Na2CO3 составляет -2.2 кДж/моль.
| Соединения | Количество родинок | Энтальпия связи, ΔH⁰f (КДж / моль) |
|---|---|---|
| HCl | 2 | -167.15 |
| Na2CO3 | 1 | -1157. 3 3 |
| NaCl | 2 | -407.25 |
| H2O | 1 | -285.8 |
| CO2 | 1 | -393.5 |
- Энтальпия реакции рассчитывается по формуле: ΔH⁰ф (реакция) = ΣΔН⁰ф (продукты) – ΣΔН⁰f (реагенты)
- Изменение энтальпии = [2*(-407.25) + 1*(-285.8) + 1*(-393.5)] – [2*(-167.15) + 1*(-1157.3)] = -2.2 кДж/моль
HCl + Na2CO3 реакция не образует буферный раствор, из-за присутствия сильной кислоты, которая просто нейтрализуется основанием, что приводит к образованию соли.
HCl + Na2CO3 является полной реакцией, поскольку реагирующие соединения завершены и полностью расходуются при равновесии, образуя стабильную соль с пузырьками CO.2 выделяется газ. Таким образом, дальнейшая реакция невозможна.
HCl + Na2CO3 экзотермическая или эндотермическая реакцияHCl + Na2CO3 есть экзотермическая реакция так как изменение энтальпии этой реакции отрицательно, а энергия выделяется в виде тепла.
HCl + Na2CO3 окислительно-восстановительная реакцияHCl + Na2CO3 не является окислительно-восстановительной реакцией, поскольку не наблюдается изменения степени окисления каждого из реагирующих атомов как со стороны реагента, так и со стороны продукта.
HCl + Na2CO3 не является реакцией осаждения, так как образующийся NaCl представляет собой соль, которая легко растворяется в воде, а не образует осадок.
HCl + Na2CO3 обратимая или необратимая реакцияHCl + Na2CO3 является необратимой реакцией, поскольку полученные продукты нельзя обратить в реагенты. Образовавшийся углекислый газ свободно покидает раствор, сильно сдвигая равновесие вперед.
HCl + Na2CO3 Реакция смещенияHCl + Na2CO3 — это реакция двойного вытеснения потому что он включает обмен катионной и анионной частей молекулы.Механизм двойного перемещения
ЗаключениеРеакция Na2CO3 с HCl является хорошо известным самопроизвольным процессом нейтрализации шипения, который приводит к образованию соли NaCl. Образование солей в значительной степени используется в производстве различных химикатов в самых разных отраслях промышленности, прямо или косвенно. Он также демонстрирует медицинские приложения.
Образование солей в значительной степени используется в производстве различных химикатов в самых разных отраслях промышленности, прямо или косвенно. Он также демонстрирует медицинские приложения.
Определение содержания NaOh и Na2co3 при совместном присутствии. Статистическая обработка результатов анализа
Уфимский государственный нефтяной технический университет
Кафедра «Общая, аналитическая и прикладная химия»
Дисциплина «Аналитическая химия»
ОТЧЕТ
по лабораторной работе №4
Выполнил(а)
Студент(ка) группы__________ __КОРНАУХОВА_Д.А_
Приняла
доцент кафедры ОАПХ ______________ Чалова О.Б.
Цель работы:
— освоить методику анализа с применением двух индикаторов;
— освоить расчет результатов титрования с фиксированием двух точек эквивалентности;
— определить содержание NaOH и Na2CO3 в контрольном растворе;
— произвести обработку результатов анализа, полученных подгруппой, методами математической статистики
-освоить методику анализа каустической
и кальцинированной соды.
Для подготовки к лабораторной работе следует использовать материалы лекций [9, 21-23] и пособия [].
Теоретическое обоснование работы
Это определение основывается на методе фиксирования двух точек эквивалентности на кривой титрования.
Вследствие поглощения углекислого газа из воздуха раствор едкого натра всегда содержит примесь соды Na2CO3. На практике очень часто нужно знать содержание NaOH и Na2CO3 в растворе.
При
титровании кислотой Na2CO3 сначала превращается в NaНCO3,
а затем — в Н2CO3.
На кривой титрования образуется две
точки эквивалентности. Одна из них
соответствует образованию NaНCO 3 (рН = (рК1 + рК2)/2
= 8,34), другая — Н2CO3 (рН = 4). Вследствие этого раствор соли
Na2CO3 различно титруется с фенолфталеином и
метиловым оранжевым. Интервал перехода
фенолфталеина находится в пределах рН
= 8 — 10. Для рН ≤ 8 наблюдается окраска кислотной
формы индикатора — бесцветная, а для рН
≥ 10 наблюдается окраска щелочной формы
— малиновая. В интервале от рН = 10 до рН
= 8 малиновая окраска постепенно изменяется
до бледно-розовой. Значит с фенолфталеином
титрование заканчивается в тот момент,
когда весь Na2CO3 превратится
в NaНCO3:
Интервал перехода
фенолфталеина находится в пределах рН
= 8 — 10. Для рН ≤ 8 наблюдается окраска кислотной
формы индикатора — бесцветная, а для рН
≥ 10 наблюдается окраска щелочной формы
— малиновая. В интервале от рН = 10 до рН
= 8 малиновая окраска постепенно изменяется
до бледно-розовой. Значит с фенолфталеином
титрование заканчивается в тот момент,
когда весь Na2CO3 превратится
в NaНCO3:
СО32- + Н+ → НСО3— (I)
Когда
же Na2CO3 титруется
с метиловым оранжевым, то порозовение
индикатора наблюдается при рН = 4, когда
вся соль оттитрована полностью до Н
СО32- + 2Н+ → Н2СО3 (2)
Из
сравнения приведенных уравнений (1) и
(2) видно, что при титровании Na2CO3 с
фенолфталеином на один моль соли
затрачивается один моль соляной кислоты,
а с метиловым оранжевым — два моля. Раствор NaOH
титруется одинаково и с метиловым
оранжевым и с фенолфталеином. Таким
образом, с фенолфталеином оттитровывается
половина Na2CO3 и вся щелочь, а после добавления метилового
оранжевого оттитровывается вторая
половина Na2CO3 (рисунок).
Раствор NaOH
титруется одинаково и с метиловым
оранжевым и с фенолфталеином. Таким
образом, с фенолфталеином оттитровывается
половина Na2CO3 и вся щелочь, а после добавления метилового
оранжевого оттитровывается вторая
половина Na2CO3 (рисунок).
| NaOH + Na2CO3 | ||
фенолфталеин | метилоранж | |
Vфф | ½ Na2CO3 | |
NaOH | Na2CO3 | |
Vмо | ||
Используя результаты титрования с двумя
индикаторами, вычисляют содержание
NаОН и Na2CO3,
при совместном присутствии в растворе. Так как отношение К1/К2 ≈
9000 для H2
Так как отношение К1/К2 ≈
9000 для H2
Дайте определения следующих понятий.
На кривой титрования Na2CO3 присутствует …2……скачка;
Титрование Na2CO3 в присутствии фенолфталеина протекает по уравнению —Na2CO3 + HCl → NaHCO3 + NaCl.
Титрование Na2CO3 в присутствии метилоранжа протекает по уравнению —Na2CO3 + 2HCl → h3CO3 + 2NaCl;
Гидроксид натрия NaOH полностью оттитровывается с индикаторами — фенолфталеинДифференцированное титрование двух оснований возможно, если — K1/K2>=10^4
При титровании смеси NаОН и Na2CO3 в присутствии фенолфталеина протекают реакции — NaOH + HCl → NaCl + h3O;
Na2CO3 + HCl → NaHCO3 + NaCl
При титровании смеси NаОН и Na2CO3 в присутствии метилоранжа протекают реакции — NaOH + HCl → NaCl + h3O;
Na2CO3 + 2HCl → h3CO3 + 2NaCl
Методика проведения работы
Лабораторная работа состоит из четырех этапов:
1 этап. Подготовка контрольного
раствора образца.
Подготовка контрольного
раствора образца.
2 этап. Титрование контрольного раствора рабочим раствором кислоты.
3 этап. Расчет содержания NаОН и Na2CO3 в контрольном растворе.
4 этап. Обработка результатов анализа, полученных подгруппой, методами математической статистики
Рекомендации по хранению кальцинированной соды или карбоната натрия (Na2CO3)
Карбонат натрия представляет собой неорганическое соединение с формулой Na2CO3 и его различные гидраты. Все формы представляют собой водорастворимые соли белого цвета, имеют сильнощелочной вкус и дают умеренно щелочные растворы в воде. Исторически его добывали из золы растений, произрастающих на богатых натрием почвах.
Кальцинированная сода имеет множество разнообразных применений, которые затрагивают нашу жизнь каждый день. Производство стекла является самым распространенным применением кальцинированной соды, будь то производство контейнеров, изоляции из стекловолокна или листового стекла для жилищного строительства, коммерческого строительства и автомобильной промышленности. Кальцинированная сода также используется для очистки воздуха и смягчения воды.
Кальцинированная сода также используется для очистки воздуха и смягчения воды.
По мере роста экологических проблем растет спрос на кальцинированную соду, используемую для удаления диоксида серы и соляной кислоты из дымовых газов. Производители химической продукции используют кальцинированную соду в качестве промежуточного продукта для производства продуктов, которые подслащивают безалкогольные напитки (кукурузные подсластители), облегчают физический дискомфорт (бикарбонат натрия) и улучшают качество пищевых продуктов и туалетных принадлежностей (фосфаты). Бытовые моющие средства и бумажные изделия — еще несколько распространенных примеров легко идентифицируемых продуктов с использованием кальцинированной соды.
Компания Eastern Reliability регулярно проектирует и применяет резервуары для карбоната натрия, а также небольшие системы с резервуарами ASSMANN с открытым верхом и небольшими смесителями Cleveland мощностью от 1/2 до 1 л.с.
Технические условия хранения кальцинированной соды или карбоната натрия:
Сшитый или линейный полиэтилен. Сшивка предпочтительнее из-за долговечности, долговечности и безопасности. Резервуар должен быть рассчитан на минимальный удельный вес 1,5 или 1,9. На основе обычного химического вещества с удельным весом от 1,1 до 1,5 в зависимости от концентрации. Нержавеющая сталь и пластик, армированный волокном (FRP), часто используются для больших судов.
Сшивка предпочтительнее из-за долговечности, долговечности и безопасности. Резервуар должен быть рассчитан на минимальный удельный вес 1,5 или 1,9. На основе обычного химического вещества с удельным весом от 1,1 до 1,5 в зависимости от концентрации. Нержавеющая сталь и пластик, армированный волокном (FRP), часто используются для больших судов.
- Материал фитинга:
ПВХ или полипропилен для насадок - Прокладки:
Материал EPDM - Болтовое оборудование:
Нержавеющая сталь 316 - Особые указания:
Правильная вентиляция; электрообогрев или погружные нагреватели и изоляция для наружного хранения
Вторичная защитная оболочка
Все конечные пользователи должны ознакомиться с местными нормативными актами, чтобы соответствовать требованиям вторичной защитной оболочки. Защитная оболочка должна быть достаточной вместимости и пригодной для мочевины. Резервуары с двойными стенками или резервуары вторичной защитной оболочки обычно должны иметь размеры, равные 110 % вместимости основного резервуара.
Принимая поставку резервуара, клиент принимает на себя полную ответственность за обеспечение надлежащей и адекватной локализации хранимого материала. Компания Eastern Reliability предлагает широкий выбор бассейнов вторичной защитной оболочки.
Соединения
Соединения переборочного типа могут использоваться на резервуарах емкостью 2000 галлонов и ниже. Для резервуаров объемом более 2000 галлонов соединения боковых стенок должны быть фланцевого типа. Соединения на боковых стенках должны быть установлены на высоте не менее 7 дюймов над дном резервуара. При необходимости можно использовать внутренние сифонные дренажи. Ограничений по фитингам купола нет. Для резервуаров с двойными стенками требуются выпускные соединения из нержавеющей стали 316.
Соединения боковых стенок должны быть установлены на высоте не менее 7 дюймов над дном резервуара. При необходимости можно использовать внутренние сифонные дренажи. соединения не должны быть больше 3″. Ограничений по креплению купола нет.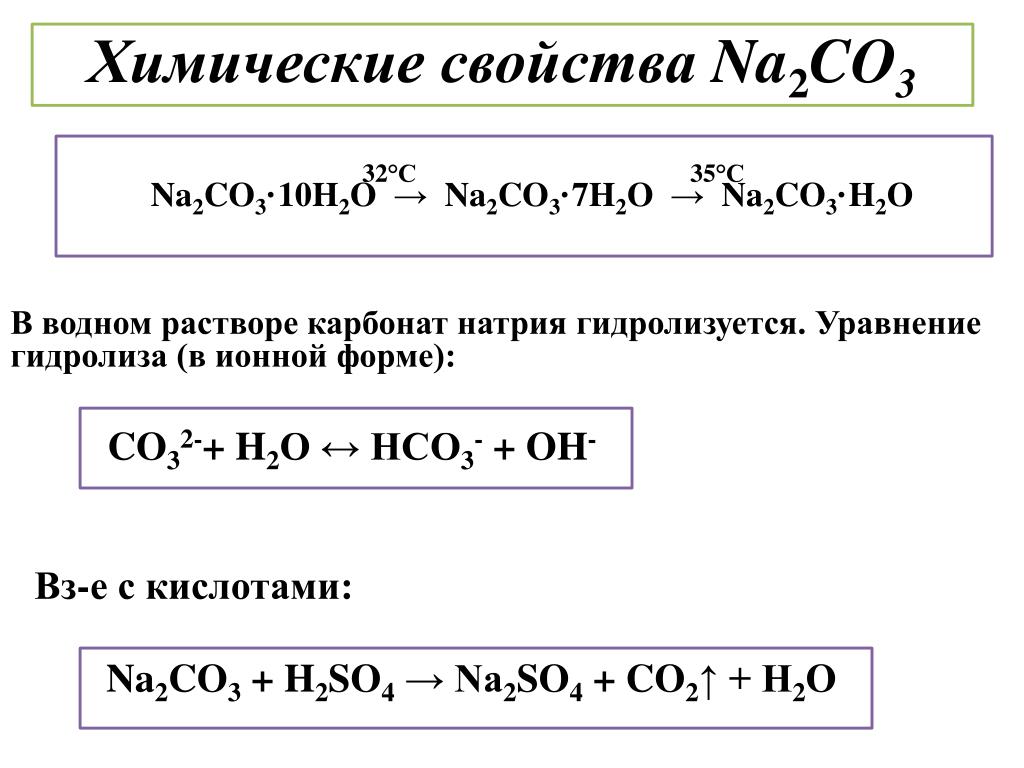
Гибкие шланги или компенсаторы
Гибкие шланги или компенсаторы должны использоваться на всех нижних 1/2 соединениях боковой стенки. Перед гибким соединением допускается установка легкого запорного клапана. Вес ниппеля и клапана не должен превышать 8 фунтов. Все трубопроводы должны поддерживаться независимо от резервуара. Опоры для труб должны быть установлены после гибкого соединения, чтобы резервуар мог расширяться и сжиматься при нормальных условиях эксплуатации. Полиэтиленовые емкости расширяются и сужаются как в поперечном, так и в вертикальном направлении; расширительный шланг или соединение должны выдерживать это расширение.
Резервуар должен поддерживать атмосферное давление. Размеры вентиляционных отверстий должны быть как минимум в два раза больше, чем самое большое входное или выходное отверстие для пневматических или насосных резервуаров. Необходимо всегда поддерживать достаточную вентиляцию. Ни при каких обстоятельствах бак не должен находиться под давлением или вакуумом.
При вентиляции и заборе воздуха в резервуар необходимо соблюдать особые меры, чтобы предотвратить попадание в резервуар пыли или мусора. Следует рассмотреть вентиляционную систему, такую как автомобильный воздушный фильтр. Следует предусмотреть электрообогрев и изоляцию при применении мочевины, когда условия хранения опускаются ниже 32°F. Для снижения температуры мочевины выше 9°С может потребоваться технологическое охлаждение.0°F для эффективности процесса и эффективной химической реакции.
Доставка
Все поставки должны регулироваться. Максимальное давление подачи не должно превышать 12 фунтов на квадратный дюйм. Ни при каких обстоятельствах бак не должен находиться под давлением или вакуумом.
Содержание предоставлено Assmann Corporation of America
Влияние добавок на разложение карбоната натрия: регенерация сорбента улавливания СО2 перед сжиганием (журнальная статья)
Влияние добавок на разложение карбоната натрия: регенерация сорбента улавливания СО2 перед сжиганием (статья в журнале) | ОСТИ. GOV
GOVперейти к основному содержанию
- Полная запись
- Другие сопутствующие исследования
- Авторов:
- Сиривардане, Ранджани V; Постон, Джеймс А; Робинсон, Кларк; Симони, Томас
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория энергетических технологий. (NETL), Питтсбург, Пенсильвания, и Моргантаун, Западная Вирджиния (США). Внутреннее исследование
- Организация-спонсор:
- Департамент ископаемой энергии Министерства энергетики США (FE)
- Идентификатор ОСТИ:
- 1137144
- Номер(а) отчета:
- ТПР-3331
- Тип ресурса:
- Журнальная статья
- Название журнала:
- ЭНЕРГИЯ И ТОПЛИВО
- Дополнительная информация журнала:
- Объем журнала: 25; Выпуск журнала: 3
- Страна публикации:
- США
- Язык:
- Английский
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Сиривардане, Ранджани В. , Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . США: Н. П., 2011.
Веб. дои: 10.1021/ef101486m.
, Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . США: Н. П., 2011.
Веб. дои: 10.1021/ef101486m.
Копировать в буфер обмена
Сиривардане, Ранджани В., Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . Соединенные Штаты. https://doi.org/10.1021/ef101486m
Копировать в буфер обмена
Сиривардане, Ранджани В., Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. 2011.
«Влияние добавок на разложение карбоната натрия: регенерация сорбента с улавливанием CO2 перед сжиганием». Соединенные Штаты. https://doi.org/10.1021/ef101486m. https://www.