Определение содержания Na2CO3 и NaOH в техническом препарате методами титриметрии с визуальной и потенциометрической индикацией конечной т
Федеральное агенство по образованию ГОУ ВПО « Уральский Федеральный университет им. первого Президента России Б.Н. Ельцина»
Кафедра «аналитической химии»
Учебно-исследовательская работа
« Определение содержания Na2CO3 и NaOH в техническом препарате методами титриметрии с визуальной и потенциометрической индикацией конечной точки титрования.»
Студент: Илбулдина А.Б.
Группа: Х-300502
Преподаватель:Марина Н.В.
Екатеринбург, 2012 г
Содержание
1.Введение
2.Характеристика объектов.
3.Кислотно-основное
3.1 .Сущность кислотно-основного титрования.
3.2.Теоретические основы.
3.3. Приготовление первичного стандарта Na2CO3.
3.4.Стандартизация раствора НСl.
3.5.Подготовка пробы к
3.6.Выполнение определения.
3.7.Обработка результатов.
3.8. Вывод по кислотно-основному титрованию.
4. Потенциометрический метод анализа.
4.1.Сущность
4.2.Теоретические основы.
4.3.Методика определения.
4.4.Таблица экспериментальных данных.
4.5.График.
4.6.Обработка результатов.
4.7.Вывод по
5.Вывод по двум методам.
6.Литература.
1.Введение
Объектом исследования является технический препарат, содержащий NaOH и Na2CO3 .
Цель исследовательской
работы: определение содержания Na2CO3 и NaOH при их совместном присутствии
в техническом препарате двумя методами-титриметрическим
анализом и потенциометрическим анализом.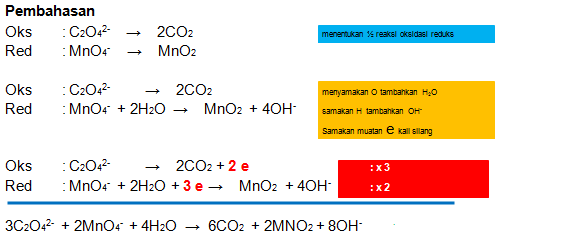
Задачи исследовательской работы:
1.Освоение методики кислотно-
2.Освоение методики
2.Характеристика объектов
Гидроксид натрия- самая распространенная щелочь, химическая формула NaOH. В год в мире производится и потребляется более 57 миллионов тонн едкого натра. NaOH –белое твердое вещество ,хорошо растворяется в воде, при этом выделяется большое количество теплоты, мылок на ощупь. Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд : в целлюлозно- бумажной промышленности (в производстве бумаги, картона) , для омыления жиров ( в производстве мыла, шампуня и др моющих средств) , в химических отраслях промышленности ( катализатор в химических реакциях) и так далее.
Tплав=65,1°C , плотность 1,829 г/см³, М(NaOH)=
39,9 г/моль. Растворимость в метаноле 23,6
г/л (t=28°C), в этаноле 14,7 г/л (t=28°C).
Растворимость в метаноле 23,6
г/л (t=28°C), в этаноле 14,7 г/л (t=28°C).
Карбонат натрия- химическое соединение, натриевая соль угольной кислоты Na2CO3 . Безводный карбонат натрия представляет собой бесцветный кристаллический порошок. Молекулярная масса 105,99 а.е.м., tплав=852 °С, не растворим в ацетоне, и сероуглероде , мало растворим в эталоне, хорошо растворим в глицерине и в воде , плотность 2,53 г/м³, M (Na2CO3)=105,8 г/моль .Карбонат натрия используют в стекольном производстве, мыловарении, в производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. На поверхности слоя карбоната натрия под действием кислорода воздуха частично образуется едкий натр. Для предотвращения этого карбонат натрия хранят в специальных сосудах, чтобы не попадал воздух.
3.Кислотно-основное титрование
3.1. Сущность кислотно –основного титрования
Этот метод применяется
для определения кислот, оснований
и солей, гидролизующихся в растворе
с образованием Нˉили ОН¯ ионов. В качестве
рабочих растворов используют растворы
сильных кислот и сильных оснований, так
как в этом случае наблюдается наиболее
заметное изменение pH в области эквивалентности
. Методика анализа сводится в основном
к приготовлению рабочего раствора титранта,
установлению его концентрации и титрованию
этим раствором исследуемого раствора
с применением какого-либо индикатора,
позволяющего зафиксировать точку эквивалентности.
В качестве
рабочих растворов используют растворы
сильных кислот и сильных оснований, так
как в этом случае наблюдается наиболее
заметное изменение pH в области эквивалентности
. Методика анализа сводится в основном
к приготовлению рабочего раствора титранта,
установлению его концентрации и титрованию
этим раствором исследуемого раствора
с применением какого-либо индикатора,
позволяющего зафиксировать точку эквивалентности.
3.2.Теоретические основы
Сначала титруют анализируемую смесь кислотой в присутствии фенолфталеина .При этом нейтрализуется весь NaOH и «наполовину» Na2СО3,превращаемый в NaНСО3. Этим путем можно установить, сколько мл кислоты (V’ HCl) идет на титрование
Затем раствор дотитровывают
кислотой в присутсвии метилового
оранжевого .Так устанавливают, сколько
мл кислоты требуется на титрование
NaHCO3 , образовавшегося из Na2CO3, т.е. половины Na2CO3.
Таким образом пользуясь двумя индикаторами, удается наблюдать две точки эквивалентности : первую, когда полностью нейтрализован NaOH и «наполовину» Na2CO3, и вторую, когда нейтрализуется NaHCO3 . В этот момент наступает полная нейтрализация смеси Na2CO3+ NaOH .
В первой точки эквивалентности
pH=1/2(pK h3CO3 +pK HCO3¯ )=1/2 ( 6,4 +10,3)= 8,35
Следовательно, когда едкий натр будет полностью нейтрализован, а карбонат натрия превратиться в бикарбонат, раствор станет слабощелочным. Этот момент фиксируют с помощью фенолфталеина , меняющего свой цвет в интервале pH=8,0-10,0
Во второй точке эквивалентности
pH=1/2 pK Н2СО3 – ½ lg С Н2СО3 =1/2 *6,4 -1/2 lg5 10¯²=3,85
Этот момент фиксируют с помощью метилового оранжевого , меняющего свою окраску в интервале pH=3,1-4,4
Выбор индикатора: кривая титрования
имеет два скачка, т.е две точки эквивалентности
1т.э при pH=8,8 ,следовательно индикатор
фенолфталеин, 2т.э. при pH=4,5 ,следовательно
индикатор метилоранж. Метилоранж- 1% водный
раствор ,изменение окраски от оранжево-желтой
до красной( цвет чайной розы).
Метилоранж- 1% водный
раствор ,изменение окраски от оранжево-желтой
до красной( цвет чайной розы).
Уравнения реакций
NaОН+Na2CO3 +2HCl 2 NaCl+NaHCO3+h3O
Индикатор фенолфталеин
NaHCO3+HCl NaCl+h3O+CO2
Индикатор метиловый оранжевый
3.3.Приготовление первичного стандарта Na2CO3
200 см³ С(1/2 Na2CO3)=0,0500 моль/дм³
Рассчитанную навеску установочного вещества взвешивают ан аналитических весах с точностью до ±0,0002 г, добавляют 30-50 мл дистиллированной воды. После полного растворения навески раствор количественно переносят в мерную колбу, доводят водой до метки и перемешивают.
3.4 Стандартизация раствора HCl по первичному стандарту Na2CO3 (метод пипетрования)
Расчет навески m(Na2CO3)= Cэ *V*Э*10¯³=0,0500*200*106/2 *10¯³=0,5300 г
Стандартизация раствора HCl проводится по следующей схеме
25,00 мл +2-3 капли титров-е HCl до цвета чайной розы
(пипетка)
индикатора (бюретка)
Исследуемый
Раствор Na2CO3
3.
200,00 см³ С(1/2 NaOH)=0,0500 моль/дм³
Расчет навески
m(NaOH)=Cэ*V*Э*10¯³=0,05*200*
Рассчитанную навеску взвешивают на аналитических весах с точностью до ±0,0002 г , добавляют 30-50 мл дистиллированной воды. После полного растворения навески раствор количественно переносят в мерную колбу вместимостью 200 см³,доводят водой до метки и перемешивают.
3.6. Выполнение определения
25,00мл +3-5 капель
(пипетка) ф-а
(бюретка)
Исследуемый
Раствор NaОН
3.7. Обработка результатов
ω (НСl)=0,0500 моль/дм³ установочное 200 см³
m (Na2CO3)=Cэ *Э*V*10¯³=0,0500*200*106/2 *10¯³=0,5300 г
m (NaOH)= Cэ *Э*V*10¯³=0,0500*200*40*10¯³=
стандартизация
V1=24,4 мл
V2=24,5 мл
Vср=24,45 мл
По закону эквивалентов С1*V1=C2*V2
C HCl=25*0,05/24,45=0,0511 моль/дм³
Методика определения
1)индикатор-фенолфталеин
V’1 (HCl)=16,5 мл
2)индикатор- метилоранж
V’’1 (HCl)=1,5 мл V’’2 (HCl)=1,5 мл
m (Na2CO3)=[ CHCl *2(V’’ (HCl)) *Э (Na2CO3)/1000]Vк/Vп=
= [0,0511*2*1,5*(106/1000)]*200/
m (NaOH)= )=[ CHCl *( V’ (HCl)- V’’ (HCl) )*Э (NaOH)/1000]Vк/Vп =
= [0,0511*(16,5-1,5)*(40/1000)]*
ω (Na2CO3)= [0,1299 /0,4]*100%=32,5%
ω (NaOH)=[ 0,245/0,4]*100%=61,25%
3. 8 Вывод по методу
кислотно-основного титрования:
8 Вывод по методу
кислотно-основного титрования:
В ходе данной лабораторной работы определили процентное содержание NaOH и Na2CO3 в техническом препарате при их совместном присутствии
ω (Na2CO3)= 32,5%
ω (NaOH)= 61,25%
4. Потенциометрический анализ.
4.1. Сущность потенциометрического анализа.
Потенциометрический анализ объединяет все методы определения концентрации ионов в растворе, основанные на измерении разности потенциалов (ЭДС) между электродами, опущенными в исследуемый раствор.
Различают прямую
потенциометрию и  К металлическим электродам
относятся электроды из серебра,
меди, ртути, свинца ,кадмия. В то же
время такие металлы, как железо, никель,
кобальт, хром, вольфрам из-за структурных
деформаций и образования окисных слоев
на поверхности не дают воспроизводимых
результатов. Ионоселективные мембранные
электроды подразделяются на стеклянные
электроды, электроды с жидкими, твердыми
или осадочными мембранами и электроды
с газочувствительным мембранным электродом
является стеклянный электрод с водородной
функцией, повсеместно используемы для
измерения pH растворов . При анализе с
участием окислительно- восстановительных
реакций в качестве электродов широко
используются окислительно-восстановительные
электроды из благородных металлов- платины,
палладия, золота, иридия, стеклоуглерода.
Эти электроды не принимают непосредственного
участия в электрохимической реакции,
их поверхности служат лишь обменной базой,
на которой идет передача электронов между
окисленной и восстановленной формами
веществ.
К металлическим электродам
относятся электроды из серебра,
меди, ртути, свинца ,кадмия. В то же
время такие металлы, как железо, никель,
кобальт, хром, вольфрам из-за структурных
деформаций и образования окисных слоев
на поверхности не дают воспроизводимых
результатов. Ионоселективные мембранные
электроды подразделяются на стеклянные
электроды, электроды с жидкими, твердыми
или осадочными мембранами и электроды
с газочувствительным мембранным электродом
является стеклянный электрод с водородной
функцией, повсеместно используемы для
измерения pH растворов . При анализе с
участием окислительно- восстановительных
реакций в качестве электродов широко
используются окислительно-восстановительные
электроды из благородных металлов- платины,
палладия, золота, иридия, стеклоуглерода.
Эти электроды не принимают непосредственного
участия в электрохимической реакции,
их поверхности служат лишь обменной базой,
на которой идет передача электронов между
окисленной и восстановленной формами
веществ.
Потенциометрическое титрование применимо для всех типов химических реакций в растворе. Важно, чтобы реакция протекала стехиометрично, а электродная система резко реагировала на момент завершения реакции титрования.
4.2. Теоретические основы.
Определение количественного содержания едкого натра и карбоната натрия т при их совместном присутствии в растворе основано на измерении pH этого раствора в процессе титрования его кислотой в электрохимической ячейке , включающей электродные системы стеклянного индикаторного электрода и хлоридсеребрянного электрода сравнения.
Ag/AgCl,HCl (0,1М)/стекло/ исследуемый раствор ,Н¯/КСl(насыщ),AgCl/Ag
Стеклянный электрод
E=const-0,059 pH
При определении pH измеряется
ЭДС электрохимической ячейки как разность
потенциалов между хлоридсеребрянным
электродом сравнения и стеклянным индикаторным
электродом.
Еэ.я.=Ех.с.е. – E
pH= Еэ.я. – Ех.с.е. +const /0,059
шкала универсального иономера ЭВ-74 градуирована в милливольтах и единицах pH. Для обеспечения правильности измерения величины pH титруемого растворов, перед началом работы производится настройка прибора по буферным растворам с точно известным значением pH.
Кривая титрования
смеси едкого натра и
Первая точка эквивалентности
соответствует нейтрализации
NaOH+HCl=NaCl+h3O
Na2CO3 +HCl=NaHCO3 +NaCl
Вторая точка эквивалентности
соответствует нейтрализации Na
NaHCO3 +HCl=NaCl+h3CO3
Раздельное титрование Na2CO3 и Na2CO3 возможно в связи с большой разницей в величинах констант ионизации Na2CO3 по первой и второй ступеням.
4.3. Методика определения.
Аналогично отбираем 20 мл
технического раствора в электрохимическую
ячейку и немного воды. Электроды
предварительно промытые дистиллированной
водой и протертые
Электроды
предварительно промытые дистиллированной
водой и протертые
4.4.Градуировочный
график, построенный по
Опытные данные титрования | ||||
Объем HCl, мл | Значения pH раствора | Объем, мл добавленной порции HCl,∆V | ∆pH | ∆pH/∆V |
0,0 0,5 1,0 1,5 2,0 | 11,9 12,0 11,9 12,0 11,9 | 0,0
2,0 | 0,0
0,5 | ∞
0,25 |
2,5 3,0 3,5 4,0 | 11,57 11,60 11,66 11,69 |
2,0 |
0,15 |
0,075 |
4,5 5,0 5,5 6,0 | 11,68 11,67 11,67 11,59 |
2,0 |
0,4 |
0,2 |
6,5 7,0 7,5 8,0 | 11,63 11,64 11,62 11,58 |
2,0 |
0,2 |
0,1 |
8,5 9,0 9,5 10,0 | 11,59 11,48 11,41 11,37 |
2,0 |
0,2 |
0,1 |
10,5 11,0 11,5 12,0 | 11,4 11,34 11,2 11,11 |
12,0-1,0 14,2-0,2 |
4,35 1,95 |
4,35 9,75 |
12,5 13,0 13,5 14,0 14,5 15,0
|
10,82 10,37 8,6 7,15 4,85 4,56 |
13,0-0,2 14,4-0,2 13,2-0,2 14,6-0,2 13,4-0,2 15,0-2,0 13,6-0,2 13,8-0,2 14,0-0,2 |
5,55 1 6,25 0,25 3 4 6,15 |
27,35 31,25 1,25 15 20 30,75 |
15,5 16,0 16,5 17,0 17,5 18,0 18,5 | 4,40 4,28 4,16 4,07 4,0 3,94 3,87 | 2,0
2,0
2,0 | 1,45
0,45
0,35 | 0,725
0,225
0,175 |
Генетический шум в циркадианном осцилляторе цианобактерий
Автор(ы)
Шабо, Джеффри Р. (Джеффри Рэймонд)
(Джеффри Рэймонд)Скачать полную версию для печати (7,606 Мб)
Другие участники
Массачусетский технологический институт. Кафедра физики.
Советник
Александр ван Ауденарден.
Условия использования
M.I.T. диссертации защищены авторским правом. Их можно просматривать из этого источника для любых целей, но воспроизведение или распространение в любом формате запрещено без письменного разрешения. См. предоставленный URL-адрес для запросов о разрешении. http://dspace.mit.edu/handle/1721.1/7582
Метаданные
Показать полную запись товараAbstract
Часы обычно считаются типичными примерами точных и точных устройств. Однако биологические часы постоянно подвергаются внутриклеточным и внеклеточным колебаниям, которые могут снизить точность этого периодического таймера. Одним фундаментальным ограничением, которое может установить верхнюю границу достоверности, является стохастический характер экспрессии генов, создающий шумную внутриклеточную среду. Циркадные ритмы, управляемые генераторами, обеспечивающими клетки внутренними часами, контролирующими программу экспрессии генов, наблюдались у широкого круга организмов, от цианобактерий до млекопитающих. Чтобы изучить влияние колебаний стохастической экспрессии на работу циркадных часов, необходимо отслеживать отдельные клетки, поскольку эксперименты с популяциями усредняют эти колебания. Цианобактерия Synechococcus elongatus PCC7942 является отличным кандидатом для этого исследования, поскольку его основной циркадный осциллятор хорошо изучен. Поэтому мы измерили в отдельных клетках колебания экспрессии флуоресцентного репортера, управляемого цианобактериальным циркадианным осциллятором. Повторные микроскопические изображения отдельных клеток и их потомков выявили устойчивый циркадный ритм, а эксперименты с клетками, лишенными предполагаемых белков центральных часов, подтверждают решающую роль, которую они играют в Synechococcus. Эксперименты, проведенные с помощью микроскопии и проточной цитометрии, установили, что большая часть генетического шума у Synechococcus возникает из-за флуктуаций, не коррелирующих между несколькими генами (и, следовательно, не возникает из-за глобального шума часов).
Циркадные ритмы, управляемые генераторами, обеспечивающими клетки внутренними часами, контролирующими программу экспрессии генов, наблюдались у широкого круга организмов, от цианобактерий до млекопитающих. Чтобы изучить влияние колебаний стохастической экспрессии на работу циркадных часов, необходимо отслеживать отдельные клетки, поскольку эксперименты с популяциями усредняют эти колебания. Цианобактерия Synechococcus elongatus PCC7942 является отличным кандидатом для этого исследования, поскольку его основной циркадный осциллятор хорошо изучен. Поэтому мы измерили в отдельных клетках колебания экспрессии флуоресцентного репортера, управляемого цианобактериальным циркадианным осциллятором. Повторные микроскопические изображения отдельных клеток и их потомков выявили устойчивый циркадный ритм, а эксперименты с клетками, лишенными предполагаемых белков центральных часов, подтверждают решающую роль, которую они играют в Synechococcus. Эксперименты, проведенные с помощью микроскопии и проточной цитометрии, установили, что большая часть генетического шума у Synechococcus возникает из-за флуктуаций, не коррелирующих между несколькими генами (и, следовательно, не возникает из-за глобального шума часов).
(продолжение) С помощью измерений проточной цитометрии мы наблюдали значительную вариабельность экспрессии генов от клетки к клетке, которая наиболее выражена в периоды чистого синтеза белка. Аналитическая модель показывает, что этот неравновесный эффект возникает, когда время жизни белка сравнимо с циркадным периодом, а среднее количество белков, транслируемых на транскрипт мРНК, велико. Стохастическое моделирование Монте-Карло подтверждает эту интерпретацию, открывая окно в генетическое поведение на уровне отдельной клетки. Разработаны оценки генетического шума, создаваемого внутренним (некоррелированным), внешним (коррелированным внутри отдельных ячеек) и «часовым» (необъяснимые источники с 24-часовым периодом) шумом. Количественное описание шумных генераторов будет необходимо для окончательного понимания точности циркадного хронометража и может вдохновить на разработку надежных синтетических генераторов.
Описание
Диссертация (докторская) — Массачусетский технологический институт, факультет физики, июнь 2005 г.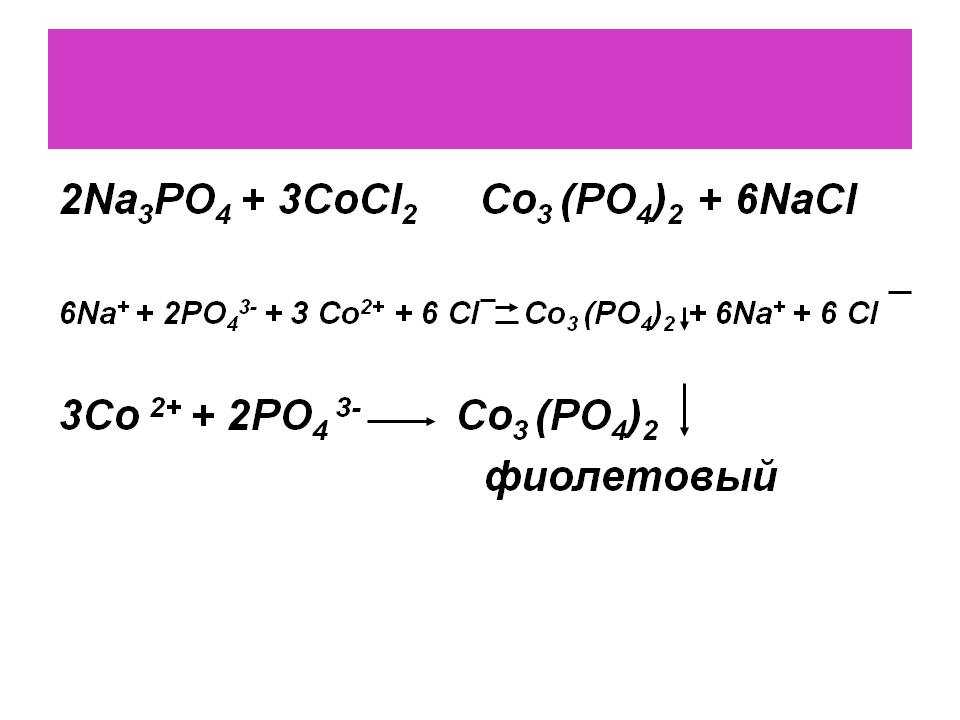
Включает библиографические ссылки (стр. 155-161).
Дата выпуска
2005URI
http://hdl.handle.net/1721.1/32302Департамент
Массачусетский Институт Технологий. Факультет физикиИздательство
Массачусетский технологический институт
Ключевые слова
Физика.
Коллекции
- Докторские диссертации
Лекция 6 — Crystallization.ppt — [PPT Powerpoint]
Лекция 6 — Crystallization.ppt — [PPT Powerpoint]из 29 /29
КРИСТАЛЛИЗАЦИЯ КРИСТАЛЛИЗАЦИЯ процесс, при котором твердые частицы образуются из гомогенной фазы процесс, при котором твердые частицы образуются из гомогенной фазы процесс разделения твердой и жидкой фаз процесс разделения твердой и жидкой фаз для контроля: для контроля: – выход кристаллов выход кристаллы – чистота кристаллов чистота кристаллов – размеры и формы кристаллов размеры и формы кристаллов
Категория:
74 скачать
Размер вставки (px) 344 x 292429 x 357514 x 422599 x 487
ОПИСАНИЕ
Лекция 6 — Кристаллизация. ppt
ppt
ВЫПИСКА
КРИСТАЛЛИЗАЦИЯпроцесс, при котором твердые частицы образуются из гомогенная фаза процесс разделения твердой и жидкой фаз для контроля: выход кристалловчистота кристалловразмеры и формы кристаллов
Кристалл представляет собой высокоорганизованный массив атомов, молекул или ионы, организованные в трехмерные пространственные решетки.
Общие методы достижения пересыщения Охлаждение (с некоторыми исключения) достигается вблизи поверхности теплообмена растворителем испарение, достигаемое вблизи поверхности теплообмена. нерастворитель, который снижает растворимость твердого вещества. Химический реакцияСнижает растворимость растворенного растворителя, что приводит до пересыщения
Процесс кристаллизации
КРИВЫЕ РАВНОВЕСНОЙ РАСТВОРИМОСТИ ДЛЯ КРИСТАЛЛИЗАЦИИРис. 18-56 (Perrys CHE Handbook, 7th Ed.) Растворимость MgSO4xh3O в воде при 1 атмРис. 12.11-1 (Геанкоплис, 4-е изд.
 ) Растворимость Na2S2O3 в
вода при 1 атмРис. 19.27 (Фоуст и др., 2-е изд.) Растворимость
Na2SO4 в воде при 1 атмРис. 19.28 (Фоуст и др., 2-е изд.)
Энтальпийно-концентрационная диаграмма системы Na2SO4 — h3O при 1
атмРис. 19.29 (Фоуст и др., 2-е изд.) Концентрация энтальпии
диаграмма для системы CaCl2 — h3O при 1 атм
) Растворимость Na2S2O3 в
вода при 1 атмРис. 19.27 (Фоуст и др., 2-е изд.) Растворимость
Na2SO4 в воде при 1 атмРис. 19.28 (Фоуст и др., 2-е изд.)
Энтальпийно-концентрационная диаграмма системы Na2SO4 — h3O при 1
атмРис. 19.29 (Фоуст и др., 2-е изд.) Концентрация энтальпии
диаграмма для системы CaCl2 — h3O при 1 атмРастворимости некоторых твердых веществ
МАТЕРИАЛЬНЫЕ БАЛАНСЫ: ВЫХОД КРИСТАЛЛОВ 10 000 кг 30% Na2CO3T = 293 КС Na2CO310h3O
SКонцентрированный растворРастворимость: 21,5 кг Na2CO3/100 кг Н3О
C = масса кристаллов в продукте магмы в единицу времени Ma = молекулярная масса безводной соли или кристалла Mh = молекулярная масса гидратированного кристаллаxF= массовая доля безводного растворенного вещества в сырье S= растворимость безводного растворенного вещества при температуре продукта = выражается как массовое отношение безводной соли к растворителю F = общее количество масса подаваемого раствора в единицу времени V = скорость испарения в массе растворителя в единицу времени S = масса насыщенного раствора, полученного в единица времени M = общая масса продукта магмы, произведенного в единицу времени = масса образовавшихся кристаллов + насыщенный раствор Solute BalanceTotal Баланс
ТЕПЛОВОЙ БАЛАНС:q= общее количество тепла, поглощаемого в процесс кристаллизации/испаренияHF= общая энтальпия поступления раствора при TF, что считывается с энтальпийно-концентрационной диаграммы HM= суммарная энтальпия кристаллов и насыщенного раствора в продукт магмы при конечной температуре, TLHV = общая энтальпия пара HC = общая теплота кристаллизации = положительная, если кристаллизация экзотермическая = оценивается как отрицательная теплота раствора
ТЕПЛОВОЙ БАЛАНС (работа в вакууме) V = скрытая теплота парообразования растворитель
HF HL= ощутимая потеря тепла
Классификация оборудования для кристаллизации в соответствии с режимом OperationBatchContinuous
В зависимости от метода определения пересыщения достигнутые кристаллизаторы, которые получают осаждение путем охлаждения концентрированный, горячий растворПеремешанная партия кристаллизаторыкристаллизаторы Swenson-Walkerкристаллизаторы, которые получают осаждение путем выпаривания раствораВысаливание испарителиВытяжные испарителиОсло-кристаллизаторы (например, Krystal кристаллизатор для производства сульфата аммония)Кристаллизаторы, получение осадков путем адиабатического испарения и охлажденияВакуум кристаллизаторы
БАК-КРИСТАЛЛИЗАТОР Горячие насыщенные растворы охлаждают в открытых баках.
 После кристаллизации маточный раствор сливают.
и кристаллы собраны. Контроль зарождения и размера
кристаллов сложно. Кристаллизация по существу
просто «позволили случиться». Змеевики теплопередачи и перемешивание могут быть
использовал. Трудозатраты высоки, поэтому этот тип кристаллизации
обычно используется только в тонкой химии или фармацевтике
отрасли, где ценность продукта и его сохранность могут оправдать
высокие эксплуатационные расходы.
После кристаллизации маточный раствор сливают.
и кристаллы собраны. Контроль зарождения и размера
кристаллов сложно. Кристаллизация по существу
просто «позволили случиться». Змеевики теплопередачи и перемешивание могут быть
использовал. Трудозатраты высоки, поэтому этот тип кристаллизации
обычно используется только в тонкой химии или фармацевтике
отрасли, где ценность продукта и его сохранность могут оправдать
высокие эксплуатационные расходы.КРИСТАЛЛИЗАТОРЫ СО СКРЕБКОМПримером может быть Кристаллизатор Свенсона-Уокера, состоящий из желоба около 2 футов. широкие с полукруглым дном. Снаружи покрыт курткой охлаждающие змеевики и лопасть мешалки осторожно проходят близко к через стенку сосуда, удаляя кристаллы, растущие на стенке сосуда.
ИСПАРИТЕЛЬ-КРИСТАЛЛИЗАТОР С ПРИНУДИТЕЛЬНОЙ ЦИРКУЛЯЦИЕЙ ЖИДКОСТИ кристаллизация и испарение, таким образом движущие силы к перенасыщение
Нагретая жидкость поступает в паровое пространство сосуд для кристаллизации.
 Происходит мгновенное испарение, снижающее
количество растворителя в растворе, что позволяет отогнать маточный раствор
в сторону перенасыщения. Перенасыщенный ликер стекает вниз
через трубку, затем вверх через псевдоожиженную область кристаллов и
раствор, где кристаллизация происходит посредством вторичного зародышеобразования.
Более крупные кристаллы продукта извлекаются, а раствор перерабатывается.
смешивают с кормом и нагревают. ПРИНУДИТЕЛЬНАЯ ЦИРКУЛЯЦИЯ ЖИДКОСТИ
ИСПАРИТЕЛЬ- КРИСТАЛЛИЗАТОР
Происходит мгновенное испарение, снижающее
количество растворителя в растворе, что позволяет отогнать маточный раствор
в сторону перенасыщения. Перенасыщенный ликер стекает вниз
через трубку, затем вверх через псевдоожиженную область кристаллов и
раствор, где кристаллизация происходит посредством вторичного зародышеобразования.
Более крупные кристаллы продукта извлекаются, а раствор перерабатывается.
смешивают с кормом и нагревают. ПРИНУДИТЕЛЬНАЯ ЦИРКУЛЯЦИЯ ЖИДКОСТИ
ИСПАРИТЕЛЬ- КРИСТАЛЛИЗАТОРВАКУУМНЫЙ КРИСТАЛЛИЗАТОР ДЛЯ ЦИРКУЛИРУЮЩЕЙ МАГМЫКристалл/раствор смесь (магма) циркулирует из корпуса сосуда. Магма осторожно нагревают и перемешивают обратно в сосуд. Вакуум в парах пространство вызывает кипение на поверхности жидкости.
ВАКУУМНЫЙ КРИСТАЛЛИЗАТОР С ЦИРКУЛЯЦИЕЙ МАГМЫ
Конструкция кристаллизатора
РАСПРЕДЕЛЕНИЕ КРИСТАЛЛОВ ПО РАЗМЕРАМ Кристаллизация проводится для максимизации рост кристаллов и ограничение зародышеобразования.
 Продукт CSD основан на
кинетика и зародышевый рост кристаллов. Если предположить, что
зародышеобразования не происходит и исходный CSD неизвестен,
можно рассчитать приблизительную оценку CSD. Закон Маккейба Л.
обычно используется для расчета окончательного CSD, если начальный CSD в
известен.
Продукт CSD основан на
кинетика и зародышевый рост кристаллов. Если предположить, что
зародышеобразования не происходит и исходный CSD неизвестен,
можно рассчитать приблизительную оценку CSD. Закон Маккейба Л.
обычно используется для расчета окончательного CSD, если начальный CSD в
известен.Закон LЕсли все кристаллы в магме растут равномерно поле пересыщения и при той же температуре и если все кристаллы растут с момента рождения со скоростью, определяемой пересыщения, то все кристаллы не только инвариантны, но и имеют одинаковую скорость роста, которая не зависит от размера. L = Gt G f(L) : скорость роста : время
Расчет CSD для кристаллизатора с затравкой LP= характеристика размер кристаллического продукта LS = характеристика затравки кристалла размерL= изменение размера; постоянным во всем диапазоне размеры присутствуют
Соотношение между массой семян (mS) и массой продукта (mP) Комбинирование: = коэффициент формы (отличается от обычной формы фактор)= плотность частиц
На всю кристаллическую массу:
MSMPRMSMPR или MIXED-SUSPENSION MIXED-SUSPENSION MIXED-PRODUCT REMOELAN идеализированная модель кристаллизатора, которая является основой для идентификации кинетические параметры и показать, как знания о них могут быть применены рассчитать производительность такого кристаллизатора.

Предположения MSMPR Устойчивое состояниеCrystallizer содержит магма смешанной взвеси все время, без продукта классификацияОднородное перенасыщение существует во всей магме. действует всегдаL закон роста кристалловНет классификации по размерам система выводаНет кристаллов в кормеМаточный раствор в магма продукта насыщена (равновесие) кристалл не распадается на конечный размер частиц
ФУНКЦИЯ ПЛОТНОСТИ НАСЕЛЕНИЯ КРИСТАЛЛАLN
Допущения: за время t изымается нл кристаллов. состав на выходе Q л/ч, такой же, как и на выходе. кристаллизатор объемом V. Вспомним закон L (уравнение 5). Если G в мм/ч: Когда и L, и n приближаются к 0, и при интегрировании, где = V/Q, которое представляет собой общее время удержания или время удержания (в часах) в кристаллизатор, n0 — заселенность зародышей при L = 0,
.Раствор 500 кг Na2SO4 в 2500 кг воды охлаждают от 333 до 283 К в перемешиваемом сосуде из мягкой стали массой 750 кг, удельная теплоемкость стали 0,5 кДж/кг-К.


 ) Растворимость Na2S2O3 в
вода при 1 атмРис. 19.27 (Фоуст и др., 2-е изд.) Растворимость
Na2SO4 в воде при 1 атмРис. 19.28 (Фоуст и др., 2-е изд.)
Энтальпийно-концентрационная диаграмма системы Na2SO4 — h3O при 1
атмРис. 19.29 (Фоуст и др., 2-е изд.) Концентрация энтальпии
диаграмма для системы CaCl2 — h3O при 1 атм
) Растворимость Na2S2O3 в
вода при 1 атмРис. 19.27 (Фоуст и др., 2-е изд.) Растворимость
Na2SO4 в воде при 1 атмРис. 19.28 (Фоуст и др., 2-е изд.)
Энтальпийно-концентрационная диаграмма системы Na2SO4 — h3O при 1
атмРис. 19.29 (Фоуст и др., 2-е изд.) Концентрация энтальпии
диаграмма для системы CaCl2 — h3O при 1 атм После кристаллизации маточный раствор сливают.
и кристаллы собраны. Контроль зарождения и размера
кристаллов сложно. Кристаллизация по существу
просто «позволили случиться». Змеевики теплопередачи и перемешивание могут быть
использовал. Трудозатраты высоки, поэтому этот тип кристаллизации
обычно используется только в тонкой химии или фармацевтике
отрасли, где ценность продукта и его сохранность могут оправдать
высокие эксплуатационные расходы.
После кристаллизации маточный раствор сливают.
и кристаллы собраны. Контроль зарождения и размера
кристаллов сложно. Кристаллизация по существу
просто «позволили случиться». Змеевики теплопередачи и перемешивание могут быть
использовал. Трудозатраты высоки, поэтому этот тип кристаллизации
обычно используется только в тонкой химии или фармацевтике
отрасли, где ценность продукта и его сохранность могут оправдать
высокие эксплуатационные расходы. Происходит мгновенное испарение, снижающее
количество растворителя в растворе, что позволяет отогнать маточный раствор
в сторону перенасыщения. Перенасыщенный ликер стекает вниз
через трубку, затем вверх через псевдоожиженную область кристаллов и
раствор, где кристаллизация происходит посредством вторичного зародышеобразования.
Более крупные кристаллы продукта извлекаются, а раствор перерабатывается.
смешивают с кормом и нагревают. ПРИНУДИТЕЛЬНАЯ ЦИРКУЛЯЦИЯ ЖИДКОСТИ
ИСПАРИТЕЛЬ- КРИСТАЛЛИЗАТОР
Происходит мгновенное испарение, снижающее
количество растворителя в растворе, что позволяет отогнать маточный раствор
в сторону перенасыщения. Перенасыщенный ликер стекает вниз
через трубку, затем вверх через псевдоожиженную область кристаллов и
раствор, где кристаллизация происходит посредством вторичного зародышеобразования.
Более крупные кристаллы продукта извлекаются, а раствор перерабатывается.
смешивают с кормом и нагревают. ПРИНУДИТЕЛЬНАЯ ЦИРКУЛЯЦИЯ ЖИДКОСТИ
ИСПАРИТЕЛЬ- КРИСТАЛЛИЗАТОР Продукт CSD основан на
кинетика и зародышевый рост кристаллов. Если предположить, что
зародышеобразования не происходит и исходный CSD неизвестен,
можно рассчитать приблизительную оценку CSD. Закон Маккейба Л.
обычно используется для расчета окончательного CSD, если начальный CSD в
известен.
Продукт CSD основан на
кинетика и зародышевый рост кристаллов. Если предположить, что
зародышеобразования не происходит и исходный CSD неизвестен,
можно рассчитать приблизительную оценку CSD. Закон Маккейба Л.
обычно используется для расчета окончательного CSD, если начальный CSD в
известен.
