ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ СВИНЦА В ЩЕЛОЧНО-КАРБОНАТНОМ РАСПЛАВЕ ИЗ ТЕХНОГЕННЫХ ОТХОДОВ АККУМУЛЯТОРНОГО ЗАВОДА
Рассмотрен способ электролитического получения свинца в щелочно-карбонатном расплаве из техногенных отходов аккумуляторного завода. Изучены свинецсодержащие отходы (оксид свинца, отходы паст, изгарь) с высоким содержанием свинца. Проведены испытания крупнолабораторного электролизера для электрохимической переработки свинецсодержащего сырья в расплавленном электролите 60—95% NaOH и 5—40% Na2CO3.
| Переведенное название | Electrolytic production of lead in alkali-carbonate melt from anthropogenic waste of accumulator production plant |
|---|---|
| Язык оригинала | Русский |
| Страницы (с-по) | 31-36 |
| Число страниц | 6 |
| Журнал | Электрометаллургия |
| Номер выпуска | 2 |
| Состояние | Опубликовано — 2017 |
- 53.

- Перечень ВАК
- APA
- Author
- BIBTEX
- Harvard
- Standard
- RIS
- Vancouver
Барбин, Н. М., & Барбина, Т. М. (2017). ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ СВИНЦА В ЩЕЛОЧНО-КАРБОНАТНОМ РАСПЛАВЕ ИЗ ТЕХНОГЕННЫХ ОТХОДОВ АККУМУЛЯТОРНОГО ЗАВОДА. Электрометаллургия, (2), 31-36.
М., & Барбина, Т. М. (2017). ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ СВИНЦА В ЩЕЛОЧНО-КАРБОНАТНОМ РАСПЛАВЕ ИЗ ТЕХНОГЕННЫХ ОТХОДОВ АККУМУЛЯТОРНОГО ЗАВОДА. Электрометаллургия, (2), 31-36.
@article{81a354941a8041f0a7318454a9ec1294,
title = «ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ СВИНЦА В ЩЕЛОЧНО-КАРБОНАТНОМ РАСПЛАВЕ ИЗ ТЕХНОГЕННЫХ ОТХОДОВ АККУМУЛЯТОРНОГО ЗАВОДА»,
abstract = «Рассмотрен способ электролитического получения свинца в щелочно-карбонатном расплаве из техногенных отходов аккумуляторного завода. Изучены свинецсодержащие отходы (оксид свинца, отходы паст, изгарь) с высоким содержанием свинца. Проведены испытания крупнолабораторного электролизера для электрохимической переработки свинецсодержащего сырья в расплавленном электролите 60—95% NaOH и 5—40% Na2CO3.»,
author = «Барбин, {Н. М.} and Барбина, {Татьяна Михайловна}»,
year = «2017»,
language = «Русский»,
pages = «31—36»,
journal = «Электрометаллургия»,
issn = «1684-5781»,
publisher = «Общество с ограниченной ответственностью {«}Наука и технологии{«}»,
number = «2»,
}
Барбин, НМ & Барбина, ТМ 2017, ‘ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ СВИНЦА В ЩЕЛОЧНО-КАРБОНАТНОМ РАСПЛАВЕ ИЗ ТЕХНОГЕННЫХ ОТХОДОВ АККУМУЛЯТОРНОГО ЗАВОДА’, Электрометаллургия, № 2, стр. 31-36.
31-36.
ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ СВИНЦА В ЩЕЛОЧНО-КАРБОНАТНОМ РАСПЛАВЕ ИЗ ТЕХНОГЕННЫХ ОТХОДОВ АККУМУЛЯТОРНОГО ЗАВОДА. / Барбин, Н. М.; Барбина, Татьяна Михайловна.
В: Электрометаллургия, № 2, 2017, стр. 31-36.
Результат исследований: Вклад в журнал › Статья › рецензирование
TY — JOUR
T1 — ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ СВИНЦА В ЩЕЛОЧНО-КАРБОНАТНОМ РАСПЛАВЕ ИЗ ТЕХНОГЕННЫХ ОТХОДОВ АККУМУЛЯТОРНОГО ЗАВОДА
AU — Барбин, Н. М.
AU — Барбина, Татьяна Михайловна
PY — 2017
Y1 — 2017
N2 — Рассмотрен способ электролитического получения свинца в щелочно-карбонатном расплаве из техногенных отходов аккумуляторного завода. Изучены свинецсодержащие отходы (оксид свинца, отходы паст, изгарь) с высоким содержанием свинца. Проведены испытания крупнолабораторного электролизера для электрохимической переработки свинецсодержащего сырья в расплавленном электролите 60—95% NaOH и 5—40% Na2CO3.
AB — Рассмотрен способ электролитического получения свинца в щелочно-карбонатном расплаве из техногенных отходов аккумуляторного завода. Изучены свинецсодержащие отходы (оксид свинца, отходы паст, изгарь) с высоким содержанием свинца. Проведены испытания крупнолабораторного электролизера для электрохимической переработки свинецсодержащего сырья в расплавленном электролите 60—95% NaOH и 5—40% Na2CO3.
Изучены свинецсодержащие отходы (оксид свинца, отходы паст, изгарь) с высоким содержанием свинца. Проведены испытания крупнолабораторного электролизера для электрохимической переработки свинецсодержащего сырья в расплавленном электролите 60—95% NaOH и 5—40% Na2CO3.
UR — http://elibrary.ru/item.asp?id=28368594
M3 — Статья
SP — 31
EP — 36
JO — Электрометаллургия
JF — Электрометаллургия
SN — 1684-5781
IS — 2
ER —
Получение буркеита из сульфатных солей Узбекистана
Цитировать:
Получение буркеита из сульфатных солей Узбекистана // Universum: технические науки : электрон. научн. журн. Кошанова Б.Т. [и др.]. 2018. № 12 (57). URL: https://7universum.com/ru/tech/archive/item/6742 (дата обращения: 20.02.2023).
Прочитать статью:
АННОТАЦИЯ
Экспериментальным изучением растворимости солей в системе Na2SO4 — Na2CO3 – Н2О установлены концентрационный и температурный интервал образования буркеита – одного из важнейших компонентов для получения синтетических моющих средств.
ABSTRACT
An experimental study of the solubility of salts in the Na2SO4 — Na2CO3 — h3O system established the concentration and temperature range for the formation of burkeite, one of the most important components for the production of synthetic detergents. This made it possible to develop an effective energy-saving technology for producing the target product — burkeite from local raw materials — mirabilite from the Tumryuk field and the Aral Sea (Uzbekistan). The results of chemical and X-ray phase analysis of the obtained samples are given, confirming their identity with the natural mineral burkeite.
Ключевые слова: буркеит, мирабилит, диаграмма растворимости, синтетические моющие средства, бинарная система.
Keywords: burkeite, mirabilite, solubility diagram, synthetic detergents, binary system.
Буркеит (2Na2SO4·Na2CO3) является важнейшим компонентом для получения эффективных и экологически безопасных синтетических моющих средств (СМС). Экспериментально установлено, что при содержании в СМС 20-40% буркеита, повышается его главная моющая функция.
Существуют различные технологии получения буркеита [1-3]. В частности, применяется способ [3], где с целью повышения содержания буркеита в продукте к раствору сульфата натрия добавляют карбонат натрия при соотношении сульфата и карбоната натрия от 95:5 до 75:25. Такая процедура позволяет достигать концентрации суммы солей 10-25 масс.%, а содержание буркеита в продукте при этом достигает более 80 %.
Вместе с тем следует отметить, что у данного метода имеются существенные недостатки, обусловленные необходимостью применения чистого сульфата натрия и высоких энергозатрат для удаления избыточной воды из 10-25% раствора.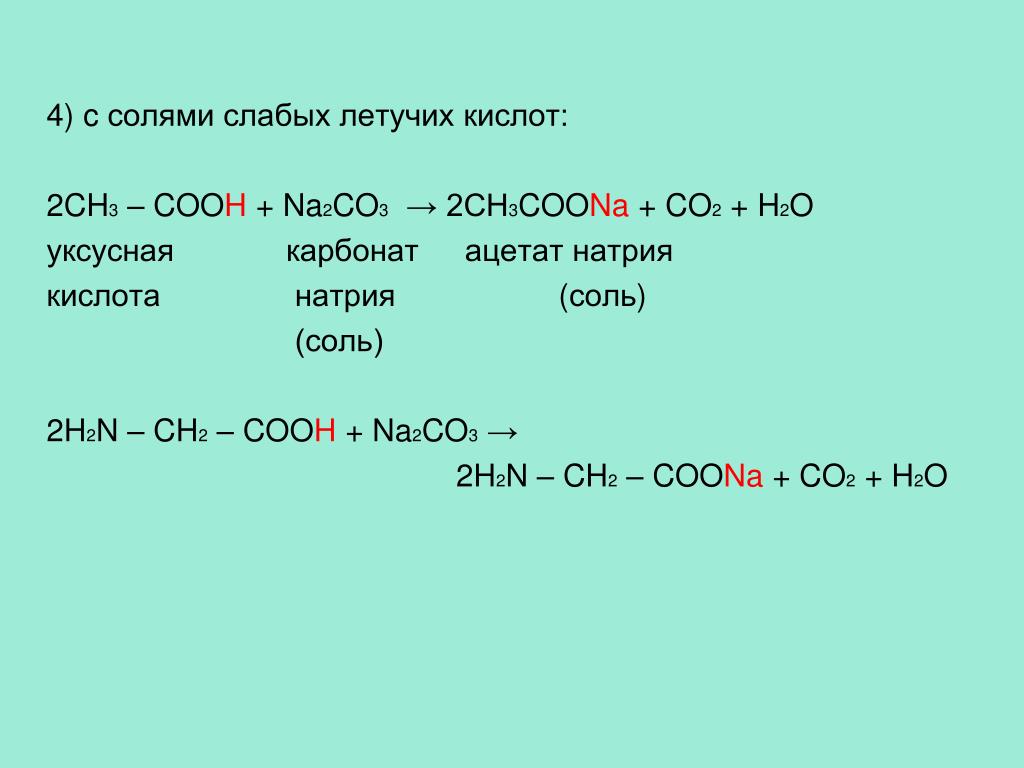 При этом выход целевого продукта –буркеита не превышает 80-85%.
При этом выход целевого продукта –буркеита не превышает 80-85%.
В другом способе [4] очистка сульфатов производится кальцинированной содой, в результате чего происходит выделение малорастворимой соли – буркеита. Затем осадок буркеита отделяют на вакуум-фильтре и промывают небольшим количеством воды, а фильтрат направляют на дальнейшее выпаривание.
Недостатками и этого способа также являются повышенные энергозатраты, недостаточная степень очистки сульфатов и невысокое содержание буркеита в готовом продукте.
Целью настоящего исследования является разработка технологии более экономичного способа получения буркеита из местных сырьевых источников.
Исходным сырьем для получения буркеита служил мирабилит Тумрюкского месторождения и Аральского моря. В работе также использовалась кальцинированная сода Унитарного предприятия (УП) «Кунградский содовый завод».
Теоретической основой разрабатываемой технологии послужил анализ и обобщение литературных данных о бинарных системах и экспериментальное исследование узловых точек тройной системы Na2CO3-Na2SO4-H2O, что, в свою очередь, позволило изучить взаимную растворимость солей в данной системе изотермическим методом при температурах 30 и 700С [5; 6].
Экспериментально было установлено, что в интервале концентрации растворов 24,81-30,80% и 0,0-7,0% сульфата и карбоната натрия, соответственно, в системе кристаллизуется тенардит. Интервалу концентраций 3,90-24,70% сульфата натрия и 8,06-28,90% карбоната натрия соответствуют области кристаллизации буркеита (2Na2SO4·Na2CO3), который занимает основную часть диаграммы растворимости. Это указывает на его малую растворимость относительно других компонентов системы. Области кристаллизации одноводного карбоната натрия соответствует раствор с содержанием 0-2,35% Na2SO4 и 29,91-31,37% Na2CO3.
Анализ диаграммы растворимости при 700С показывает, что наблюдается исчезновение полей кристаллизации мирабилита, семи- и десятиводного карбоната натрия и появление поля кристаллизации моноводного карбоната натрия.
Таким образом, по результатам анализа системы Na
Первый вариант включает четыре стадии, а другой – две.
Стадиями первого варианта являются:
- очистка раствора сульфата натрия;
- получение тенардита и растворов при 30оС и 70оС;
- получение буркеита и карбоната натрия;
- получение буркеита и растворов при 30оС и 70оС из тенардита, образующегося на третьей стадии.
Стадии второго варианта являются:
- очистка раствора сульфата натрия;
- получение буркеита и растворов при 30оС и 70оС из очищенных растворов сульфата и карбоната натрия.
Расход исходных компонентов рассчитывался по специально разработанным формулам для каждого варианта и этапа производственного процесса [7].
Как было отмечено выше, в экспериментальных исследованиях использовали природный мирабилит побережья Аральского моря состава, масс. %: Na2O — 37,41; SO4 — 57,66; CaO — 0,06; MgO — 0,02; нерастворимые вещества — 0,1; известковое молоко 5%-ной концентрации и кальцинированную соду, произведенную на УП «Кунградский содовый завод».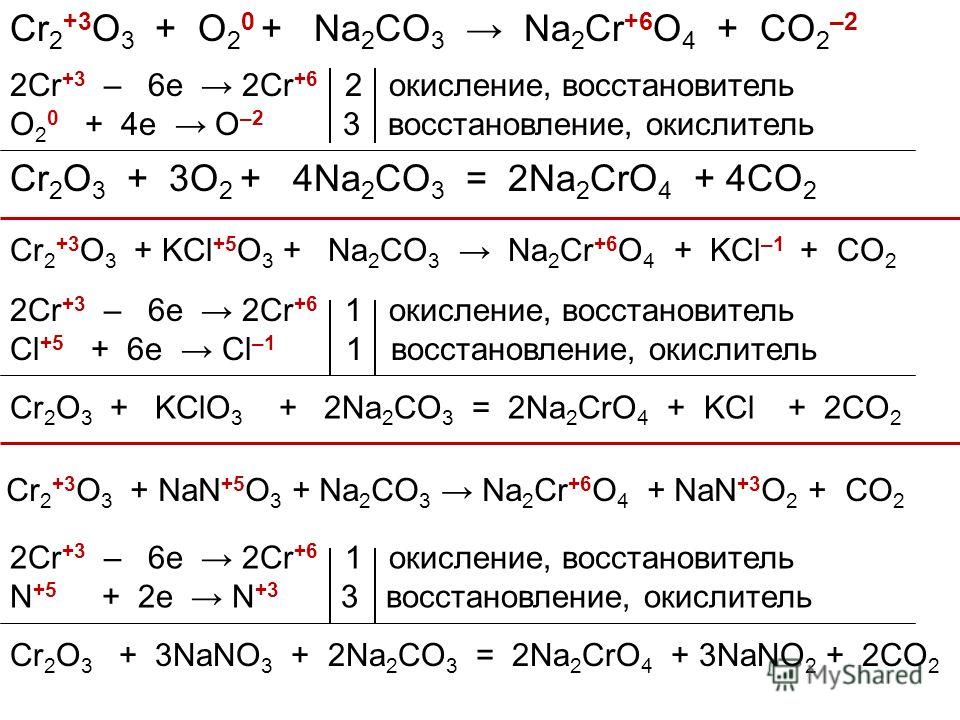
Очищенные при различных температурах растворы сульфата натрия имели следующий химический состав, масс. %:
- при 30оС: Na2SO4 – 29,15; CaO – 0,001; MgO – 0,002;
- при 70оС: Na2SO4 – 30,80; CaO – 0,001; MgO – 0,003.
При очистке 100 кг раствора при 300С и 700С получается 22,35 и 23,60, соответственно, по первому технологическому варианту получения буркеита и 42,0 и 49,69 кг буркеита – по второму варианту.
Экспериментальные данные показали, что с повышением температуры от 30 до 70оС выход буркеита повышается с 22,35 до 42,00 кг при 30оС и с 23,60 до 49,69 кг при 70оС по первому и второму варианту, соответственно. Таким образом, оптимальным можно считать второй вариант процесса, осуществляемый при 70оС.
Изучение системы Na2CO3-Na2SO4-H2O также показывает, что для получения буркеита из очищенных растворов сульфата натрия, концентрацию последнего необходимо поддерживать в интервалах 29-30 %.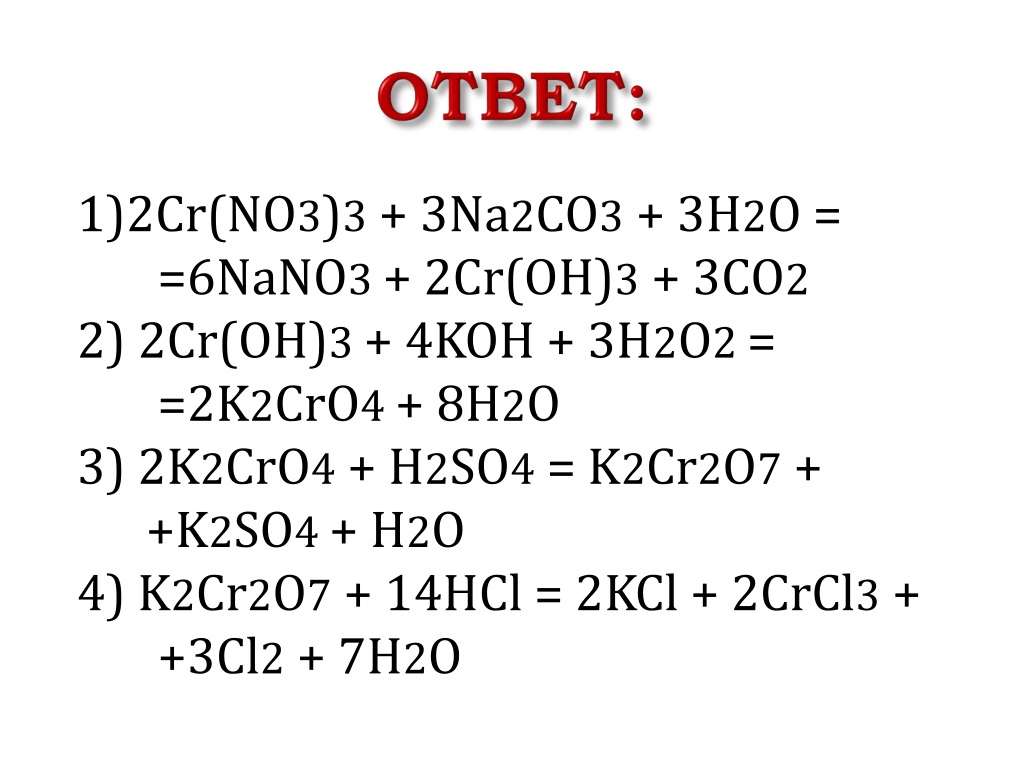
В таблице 1 приведены результаты химического анализа образцов буркеита, полученных на модельной установке при соответствующих температурных и концентрационных режимах, а на рисунке 1 представлены рентгенограммы этих образцов [8].
Таблица 1.
Результаты химического анализа образцов буркеита, полученных на модельной установке
|
№ |
t oC |
Химический состав буркеита масс.: % |
SO42-/ CO32- |
Na2CO3/ Na2SO4 |
Содер- жание буркеита, % |
Выход на первый цикл, % |
||
|
Na+ |
SO42- |
CO32- |
||||||
|
1 |
70 |
33,97 |
45,73 |
20,33 |
2,25 |
0,90 |
69,23 |
30,24 |
|
2 |
90 |
35,19 |
41,45 |
23,36 |
1,77 |
0,90 |
55,31 |
58,09 |
|
3 |
90 |
34,57 |
48,39 |
17,04 |
2,84 |
0,89 |
98,75 |
51,73 |
Образец № 1
Образец № 2
Образец № 3
Рисунок 1. Рентгенограммы образцов буркеита, полученных на модельной установке в условиях, соответствующих номерам образцов табл.1
Рентгенограммы образцов буркеита, полученных на модельной установке в условиях, соответствующих номерам образцов табл.1
Из полученных результатов химического и рентгенофазового анализов образцов на содержание в них Na2O, SO3 и CO2 следует, что состав и кристаллические характеристики полученного продукта соответствуют природному минералу буркеит — 2Na2SO4 ∙ Na2CO3.
В ранее предложенной нами технологии [7], процесс получение буркеита включал стадии растворения и очистки растворов мирабилита с отделением твердой фазы буркеита и добавления к нему кальцинированной соды, с последующим отделением буркеита из пульпы и возвращение маточного раствора в начало процесса.
На основании этой технологии нами предлагается блочная схема производства буркеита из природных марабилитов и кальцинированной соды УП «Кунградский содовый завод». На рисунке 2 приводится блочная схема, поясняющая этот технологический процесс.
Рисунок 2. Блочная схема получения буркеита:
1 – растворение; 2-конверсия; 3-кристаллизация;4-фильтрация; 5-сушка
Согласно блочной схеме получения буркеита на модельной установке, смонтированной на УП «Кунградский содовый завод», вода подавалась в процесс из линии водооборотного цикла предприятия и сюда же поступали очищенный раствор сульфата натрия, маточный раствор и твердая кальцинированная сода. Водный раствор сульфата натрия готовился в растворителе (поз. 1), при температуре 50ºС и подавался при соотношении Na2CO3:Na2SO4 = 1:(0,5-2,0) в реактор (поз. 2), снабженный паровой рубашкой и перемешивающим устройством. В реакторе (поз.3) при температуре 70-90ºС в течение 15-30 минут проводился синтез буркеита с образованием суспензии, которая поступала для разделения твердой и жидкой фазы на нутч-фильтр (поз. 4), где вакуум создавали с помощью вакуум-насоса. Жидкая фаза (маточный раствор) направлялась в сборник фильтрата и далее циркулировалась на стадию растворения или выпарки. Влажный осадок буркеита подавался на сушку (поз.5) при температуре более 100ºС. После сушки получали готовый продукт с влажностью не более 0,3-0,6%.
Жидкая фаза (маточный раствор) направлялась в сборник фильтрата и далее циркулировалась на стадию растворения или выпарки. Влажный осадок буркеита подавался на сушку (поз.5) при температуре более 100ºС. После сушки получали готовый продукт с влажностью не более 0,3-0,6%.
На основании проведенных исследований были установлены следующие оптимальные технологические параметры производства буркеита:
|
температура воды и/или циркулирующего раствора, °С |
20-40 |
|
температура процесса конверсии, °С |
75-90 |
|
продолжительность процесса растворения, мин |
30-60 |
|
массовое соотношение исходных компонентов Nа2CO3:Na2SO4:H2O |
1:(0,5-2,0) |
|
состав циркулирующего маточного раствора, % |
|
|
Na2CO3 |
13,06-28,90 |
|
Na2SO4 |
3,90-12,49 |
|
Н2О |
58,01-83,84 |
|
содержание буркеита в продукте, масс. |
88,7-92,05 |
Таким образом, на основании проведенных исследований системы Na2SO4 — Na2CO3 – Н2О были установлены концентрационный и температурный интервал образования буркеита и предложена эффективная технологическая схема получения целевого продукта — буркеита из местных сырьевых источников.
Список литературы:
1. Кошанова Б.Т., Эркаев А.У., Таиров З.К., Юлчиев М.Р. Технология получения буркеита из природного ми-рабилита // Хим.технология. Контроль и упр. – 2013. — №4. – С.30-35.
2. Сумич А.И. Получение солевых композиций для малофосфатных и бесфосфатных моющих средств агломе-рационным способом // Автореф…..канд. техн. наук. – Минск:, БГУТ, 2017. -29 с.
3. Патент RU 2430151 C2. Покрытые оболочкой частицы перкарбоната натрия / Ш. Лайнингер, Х. Якоб, У. Коттке. / Дата публикации заявки: 10.09.2010.
4. http://pandia.ru/text/78/443/15826-9. Технология растворения полидисперсной соли. (Дата обращения 14.12.2018).
5. Методические рекомендации по применению Классификации запасов месторождений и прогнозных ресур-сов твердых полезных ископаемых. Озерные соли. – Москва, 2007. – 43 с.
6. Сумич А.И., Ещенко А.И. Исследование состава солей кислот (НхAn), образующихся при «сухой» нейтра-лизации в системе Na2CO3 – HxAn – h3О // Труды БГТУ, серия 2. – 2018. — №2. – С.89-92.
7. Патент UZ — № IAP 05634. Способ получения буркеита. / А.У. Эркаев, Б.Т. Кошанова , А.К. Бегдуллаев и др. Опубликован: Расмий ахборотнома (Бюллетень интеллектуальной собственности РУз 2018. — №8(208). – С.37.
8. Ковба Л.М., Трунов В.К. Рентгенофазовый анализ.- М.: Изд-во МГУ, 1969. — 160с.
Влияние добавок на разложение карбоната натрия: регенерация сорбента улавливания CO2 перед сжиганием (журнальная статья)
Влияние добавок на разложение карбоната натрия: регенерация сорбента улавливания CO2 перед сжиганием (журнальная статья) | ОСТИ. GOV
GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
- Авторов:
- Сиривардане, Ранджани V; Постон, Джеймс А; Робинсон, Кларк; Симони, Томас
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория энергетических технологий.
 (NETL), Питтсбург, Пенсильвания, и Моргантаун, Западная Вирджиния (США). Внутреннее исследование
(NETL), Питтсбург, Пенсильвания, и Моргантаун, Западная Вирджиния (США). Внутреннее исследование
- Организация-спонсор:
- Департамент ископаемой энергии Министерства энергетики США (FE)
- Идентификатор ОСТИ:
- 1137144
- Номер(а) отчета:
- ТПР-3331
- Тип ресурса:
- Журнальная статья
- Название журнала:
- ЭНЕРГИЯ И ТОПЛИВО
- Дополнительная информация журнала:
- Объем журнала: 25; Выпуск журнала: 3
- Страна публикации:
- США
- Язык:
- Английский
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Сиривардане, Ранджани В. , Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . США: Н. П., 2011.
Веб. дои: 10.1021/ef101486m.
, Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . США: Н. П., 2011.
Веб. дои: 10.1021/ef101486m.
Копировать в буфер обмена
Сиривардане, Ранджани В., Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. Влияние добавок на разложение карбоната натрия: предварительная регенерация сорбента улавливания CO2 . Соединенные Штаты. https://doi.org/10.1021/ef101486m
Копировать в буфер обмена
Сиривардане, Ранджани В., Постон, Джеймс А., Робинсон, Кларк и Симони, Томас. 2011.
«Влияние добавок на разложение карбоната натрия: регенерация сорбента с улавливанием CO2 перед сжиганием». Соединенные Штаты. https://doi.org/10.1021/ef101486m. https://www. osti.gov/servlets/purl/1137144.
osti.gov/servlets/purl/1137144.
Копировать в буфер обмена
@статья{osti_1137144,
title = {Влияние добавок на разложение карбоната натрия: регенерация сорбента с улавливанием CO2 перед сжиганием},
автор = {Сиривардане, Ранджани В. и Постон, Джеймс А. и Робинсон, Кларк и Симони, Томас},
abstractNote = {},
дои = {10.1021/ef101486m},
URL = {https://www.osti.gov/biblio/1137144},
журнал = {ЭНЕРГИЯ И ТОПЛИВО},
номер = 3,
объем = 25,
место = {США},
год = {2011},
месяц = {3}
}
Копировать в буфер обмена
Просмотреть журнальную статью (1,59 МБ)
https://doi.org/10.1021/ef101486m
Найти в Google Scholar
Поиск в WorldCat, чтобы найти библиотеки, в которых может храниться этот журнал
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
Китайский производитель химических реагентов, реагент для печатных плат, поставщик реагентов высокой чистоты
Горячие продукты
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Рекомендуется для вас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Новое поступление
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Хорошее качество для горячей продажи
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Видео
Свяжитесь сейчас
Свяжитесь сейчас
Профиль компании
{{ util. each(imageUrls, функция(imageUrl){}}
each(imageUrls, функция(imageUrl){}}
{{ }) }}
{{ если (изображениеUrls.length > 1){ }}
{{ } }}
| Вид бизнеса: | Производитель/Фабрика | |
| Основные продукты: | Химический реагент
,
Реагент ПХБ
,
Реагент высокой чистоты
,
Пищевые добавки
,
Активный фармацевтический. .. .. | |
| Количество работников: | 462 | |
| Год основания: | 19 июля 1994 г. | |
| Сертификация системы менеджмента: | ISO 9001, ISO 14001, OHSAS/OHSMS 18001 |
Xilong Scientific Co., Ltd., основанная в 1983 году, была создана как один из крупнейших производителей и поставщиков химических реагентов в Китае. В сочетании с исследованиями и разработками, импортом и экспортом, объем бизнеса Xilong Scientific достиг более 180 миллионов долларов США в 2009 году.


 %
% (NETL), Питтсбург, Пенсильвания, и Моргантаун, Западная Вирджиния (США). Внутреннее исследование
(NETL), Питтсбург, Пенсильвания, и Моргантаун, Западная Вирджиния (США). Внутреннее исследование