Карбонат натрия химикатов алкалиа водоочистки (Na2CO3)
Miss Счастлив администраторов по сбыту
Чернь 0086-13832729634
1) Вообще infos:
No 497-19-8 CAS
Молекулярная формула Na2CO3
Карбонат натрия синонимов, зола соды
2) Физические и химически свойства:
Физическое StateSolid
OdorOdorless
SolubleWater
Плавя Point851° c
Кипя Point1633° c
3) Применение:
Светом золы соды будет важный основной промышленный химикат использован в широком массиве применений. Будет наименьшим дорогим источником ионов натрия, и таким образом, используемых для того чтобы изготовить много других химикатов натрия, как окисоводопод натрия, гидрокарбонат натрия, силикат натрия, хромат натрия, дихромат натрия, натрий, tripolyphosphate натрия, ортофосфат натрия, метафосфат натрия, percarbonate натрия, сульфит натрия, metabisulphite натрия, etc.
4) Спецификации:
APPEARANCEWhite, порошок
Na2CO3, % wtMin. 99.2
NaCl, % wtMax. 0.2
NaSO4, % wtMax. 0.2
Fe2O3, % wtMax. 0.003
Воднонерастворимо, % wtMax. 0.04
DensityMin. 400 kg/m3
5) О нас:
CO. ХИМИКАТА TIANJINSHI JINHONGWEIBANG, Ltd расположено около порта TianJin нового
Оно покрывает зону 15000 квадратных километров. Моя компания имеет мою собственную фабрику, которая принимает вверх химически дело на 11 лет. Так wehave много клиентов в demestic международных рынках marketsand. Наши главные клиенты распространенные в west-Africa, MID- востоке, Южной Америке, юговосточой Азии etc. и моей фабрике выиграли хорошую репутацию. Наш принцип является следующим: Качества престижность во-первых, сперва. Мои торговые маркы: JINHONG.
Кроме того, мы имеем независимо права exp import&. Мы можем transact серия процесса экспорта включая упаковывать опасности, опасная тщательная карточку, сертификат представления сертификат etc, CO (сертификат происхождения), SGS
Pls чувствует свободно контактировать с нами если вы заинтересованн в нашем свете золы соды
Рассчитывать построить вверх по долгосрочному взаимному выгодному сотрудничеству с вами. Мы имеем центр испытание сделать анализ и большую производственную мощность встретить заказы спешкы клиентов!
| Деталь | Спецификации | |
| Зола ISoda плотная | Свет золы IISoda | |
| Итог Alkalinity/% | 99.5Min | 99.2Min |
| Содержание хлорида (NaCl)/% | 0.30Max | 0.70Max |
| Утюг Content/% | 0.003Max | 0.003Max |
| Сульфат Content/% | 0.03Max | 0.03Max |
| Воднонерастворимое Matter/% | 0.02Max | 0.03Max |
| Потеря на зажигании a/% | 0.8Max | 0.5Max |
| Навальная плотность /g/ml | 1.0Max | ——— |
| ВВЕРХ ПО 180MM% | 75.0Min | ———- |
| Granularity вверх по 1.18MM/% | 2.0Max | ———- |
Контакт
Miss Счастлив администраторов по сбыту
чернь 0086-13832729634
Как из NaHCO3 получить Na2CO3?
Объяснение:
2HgO=3Hg+O2. реакция разложения
реакция разложения
Ch5 — метан, простейший алкан.
Фейерверк-2 слога
ф → [ф’]—согласный,мягк., глух.
е → [и]—гласный, безударн.
й → [й’]—согласный,мягк.,звонк., сонорн.
е → [и]—гласный, безударн.
р → [р]—согласный,тв.,звонкий, сонорн.
в → [в’]—согласный,мягк.,звонк., сонорн.
е → [э]—гласный, ударн.
р → [р]—согласный,тв.,звонк., сонорн.
к → [к]—согласный,тв.,глух.
————————————————
9 букв,9 звуков
Удачи 🙂
Решение в прикрепленной фотографии.
Специально для учительницы:
BaOH+HCl=BaCl+h3O
Решение до n(BaOH) будет таким же.
n(BaOH)=n(HCl)=0.9 моль
m вещества(BaOH)=n*M=0.9*154=138.6 г.
m раствора(BaOH)=m вещества*100%/w=138.6*100%/20=693 г.
V(BaOH)=m раствора/p=693/1.12=618.75 мл.
Свинец Pbнаходится в 4 группе главной подгруппы,в 9 ряду,в 6 периоде, порядковый номер 82,электроотрицательность1,55, орбитальный радиус атома 0,122, относительная атомная масса 207,19, степень окисления +4.
соли 2х валентного свинца реагируют с щелочами, образуя почти не растворимый гидроксид свинца:Pb+OH=Pb(OH)2.
Реагирует с кислотами: Pb+2HCl=PbCl2+h3
Свинец имеет довольно низкую теплопроводность. мягкий металл режется ножом. на поверхности обычно покрыт более или менее толстой пленкой оксидов, при резании которой образуется блестящая поверхность, которая на воздухе со временем тускнеет. температура плавления 600,61К, кипит при 2022К, относится к группе тяжелых металлов, плотность 11,3415г/см3
температура плавления 600,61К, кипит при 2022К, относится к группе тяжелых металлов, плотность 11,3415г/см3
Натрий сернистый 9-водный ЧДА — База химической продукции Югреактив
Натрий сернистокислый безводный
Синонимы: Натрия сульфит безводный, Натрий сульфит, сульфит натрия, натрий сернистокислый безводный
Мы предлагаем Натрий сернистокислый, Натрий сульфит по выгодным ценам с доставкой по всей России.
Спецификация |
|
|---|---|
Содержание сульфита натрия (Na2SO3) | 97.36 % |
Нерастворимых в воде веществ | 0,011 % |
Щелочи в пересчете на Na2CO3 | 0,21 % |
Содержание тиосульфата (S2O3) | 0. |
Содержание железа (Fe) | 0,003 % |
Содержание тяжелых металлов (Pb) | 0.002 % |
Натрий сернистокислый безводный, натрий сульфит Na2SO3 — бесцветные кристаллы, соль натрия и сернистой кислоты. Натрий сульфит растворяется в воде, образует кристаллогидраты. Натрия сульфит — сильный восстановитель. При обычной температуре из водных растворов кристаллизуется Na2SO3×7h3O. В водных растворах легко окисляется кислородом воздуха. В водных растворах Na2SO3 присоединяет при нагревании серу с образованием тиосульфата натрия.
Получение
Безводный сульфит натрия или натрий сернистокислый можно получить несколькими способами, например:
• взаимодействием растворов Na2CO3 с SO2
Na2CO3 + SO2 → Na2SO3 + CO2↑
• нейтрализацией раствора NaHSO3 раствором гидроксида натрия при 38—40 °C с последующим охлаждением и кристаллизацией гептагидрата
NaHSO3 + NaOH → Na2SO3 + h3O
• реакцией гидроксида натрия и диоксида серы
2NaOH + SO2 → Na2SO3 + h3O
Применение
Безводный сульфит натрия ( натрий сернистокислый) предназначается
• для кожевенной,
• медицинской,
• фармацевтической,
• химической промышленности,
• кинопромышленности,
• для флотации руд цветных металлов и других отраслей промышленности.
— Как рассчитать молярность раствора Na2CO3?
Возникает вопрос о молярной концентрации данного вещества после разбавления с помощью приведенных значений. Первый шаг к ответу — преобразование заданного веса $ \ ce {Na2CO3.10h3O} $ в количество вещества. Для этого у нас есть формула \ begin {align} \ text {количество вещества} & = \ frac {\ text {масса вещества}} {\ text {молекулярная масса вещества}} \\ \ text {количество вещества} & = \ frac { \ pu {1 г} ~ \ ce {Na2CO3.10h3O}} {\ pu {286 г} ~ \ ce {Na2CO3.10h3O}} = \ pu {0,003447 моль}. \\ \ end {align} Мы использовали этот первый шаг для определения количества вещества $ \ ce {Na2CO3.10h3O} $, присутствующего в растворе. Это необходимо, потому что даже после разбавления раствора количество вещества останется постоянным.
Второй шаг — это преобразование количества вещества в молярность. В качестве,
\ begin {align}
\ text {молярность} & = \ frac {\ text {количество вещества}} {\ text {объем в л}} \\
\ text {молярность} & = \ frac {\ pu {0. 003447 моль}} {\ pu {0,020 л}} = \ pu {0,174825 моль} \\
\ end {align}
003447 моль}} {\ pu {0,020 л}} = \ pu {0,174825 моль} \\
\ end {align}
Второй шаг делается для определения концентрации вещества с точки зрения молярности, поскольку вопрос требует от нас дать ответ в виде молярности после разбавления.
После этого данный раствор разбавляется до $ \ pu {250 мл} $, поэтому необходимо использовать формулу разбавления
$$ \ begin {multline}
\ text {начальная концентрация} \ times \ text {начальный объем раствора} = \\
\ text {конечная концентрация} \ times \ text {конечный объем раствора}.\ end {multline} $$
Итак, мы предполагаем, что конечная концентрация раствора составляет $ x $, и у нас есть значения для других сущностей.
\ begin {align}
(\ pu {0,174825 M}) (\ pu {0,020 L}) & = (\ pu {0,250 L}) (x) \\
x & = \ pu {0,013986 M} \\
\ end {align}
Этот последний шаг выполняется потому, что после разбавления изменяется молярность раствора, но не количество вещества, как я говорил ранее. Таким образом, мы приравниваем уравнение как $$ \ text {начальное количество вещества} = \ text {конечное количество вещества}. $$
И окончательный ответ — $ \ pu {0.013986 M} $.
$$
И окончательный ответ — $ \ pu {0.013986 M} $.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Amazon.com: Duda Energy, 8 унций чистого карбоната натрия, плотная кальцинированная сода Na2CO3, Регулировка pH, Химическая чистка бассейна в спа-салоне Посудомоечная машина: бакалея и изысканная еда
| Марка | Дуда Энерджи |
| Рекомендации по поверхности | Стакан |
| Вес предмета | 0. 5 фунтов 5 фунтов |
- Убедитесь, что это подходит введя номер вашей модели.
- Кальцинированная сода промышленного качества (карбонат натрия) Na2CO3 99,8 +% кальцинированная сода, 0,2% воды
- Может использоваться для смягчения воды, изготовления стекла, регулирования уровня pH.
- Отличная основа для очистки разливов химикатов, маслопоглотитель.
- Отлично подходит для домашних моющих средств для стирки и мытья посуды.
- Используется как относительно прочная база для различных настроек.Может использоваться для регулирования pH
Реакция карбоната натрия и HCL
Вода из крана
Кредит изображения: Jupiterimages / Stockbyte / Getty Images
Карбонат натрия более известен как стиральная сода. Подобно похожему по звучанию соединению бикарбонат натрия — пищевая сода — он является основным и может вступать в реакцию с кислотами. HCl или соляная кислота — это сильная кислота, которая реагирует с карбонатом натрия. В результате реакции образуются большие количества газообразного диоксида углерода, воды и поваренной соли.
Подобно похожему по звучанию соединению бикарбонат натрия — пищевая сода — он является основным и может вступать в реакцию с кислотами. HCl или соляная кислота — это сильная кислота, которая реагирует с карбонатом натрия. В результате реакции образуются большие количества газообразного диоксида углерода, воды и поваренной соли.
Карбонат натрия
Карбонат натрия имеет химическую формулу Na2CO3. Он имеет несколько различных применений, одно из которых — производство определенных видов стекла. Однако на бытовом уровне карбонат натрия используется в повседневной жизни в качестве смягчителя воды.Во многих сообществах в воде содержится большое количество ионов кальция и магния — положительно заряженных частиц, которые не позволяют детергенту работать так же эффективно. Карбонат натрия, добавленный в воду, помогает удалить ионы магния и кальция и увеличивает эффективность моющего средства.
HCl
HCl — это химическая формула соляной кислоты, которая является сильной неорганической — то есть не углеродной — кислотой, — объясняет д-р Мартин Зильберберг в своей книге «Химия: молекулярная природа материи и изменений».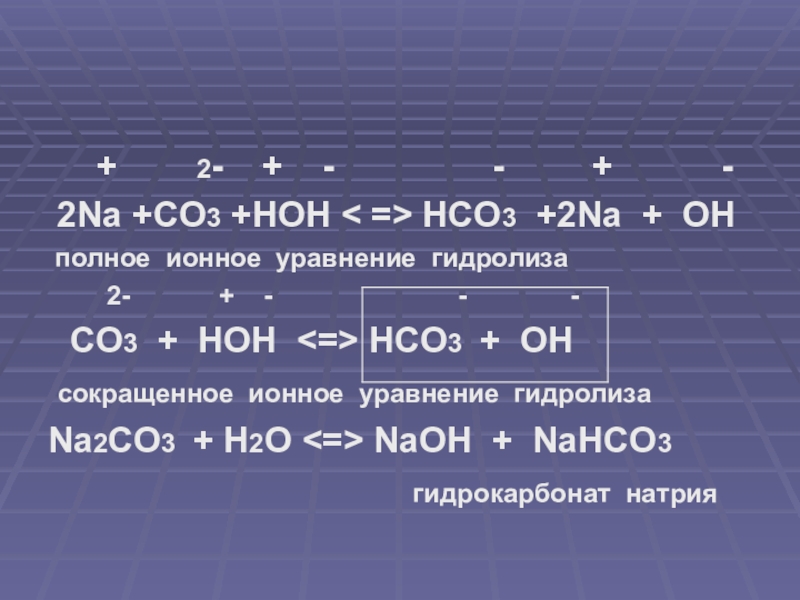 «Как и все кислоты, HCl имеет способность терять атом водорода в растворе на водной основе. Если присутствует основание, HCl отдает свой водород основанию. Это дает два новых соединения, ни одно из которых не является сильной кислотой или сильное основание, и называется реакцией нейтрализации.
«Как и все кислоты, HCl имеет способность терять атом водорода в растворе на водной основе. Если присутствует основание, HCl отдает свой водород основанию. Это дает два новых соединения, ни одно из которых не является сильной кислотой или сильное основание, и называется реакцией нейтрализации.
Карбонат натрия и HCl
Когда вы смешиваете карбонат натрия и HCl, две молекулы HCl отдают свои атомы водорода карбонату натрия. В результате образуется угольная кислота с формулой h3CO3.Натрий из карбоната натрия образует соль с частицами хлорида из HCl, образуя хлорид натрия или поваренную соль. Угольная кислота довольно нестабильна, — объясняет доктор. Реджинальд Гаррет и Чарльз Гришем в своей книге «Биохимия» распадаются на углекислый газ — СО2 — и воду.
Полезность реакции
Поскольку соляная кислота — это не то, что вы, вероятно, будете иметь дома, вы редко будете сами смешивать карбонат натрия и HCl.Однако эта реакция имеет некоторую полезность в промышленном масштабе, поскольку карбонат натрия может использоваться для удаления избытка HCl из раствора.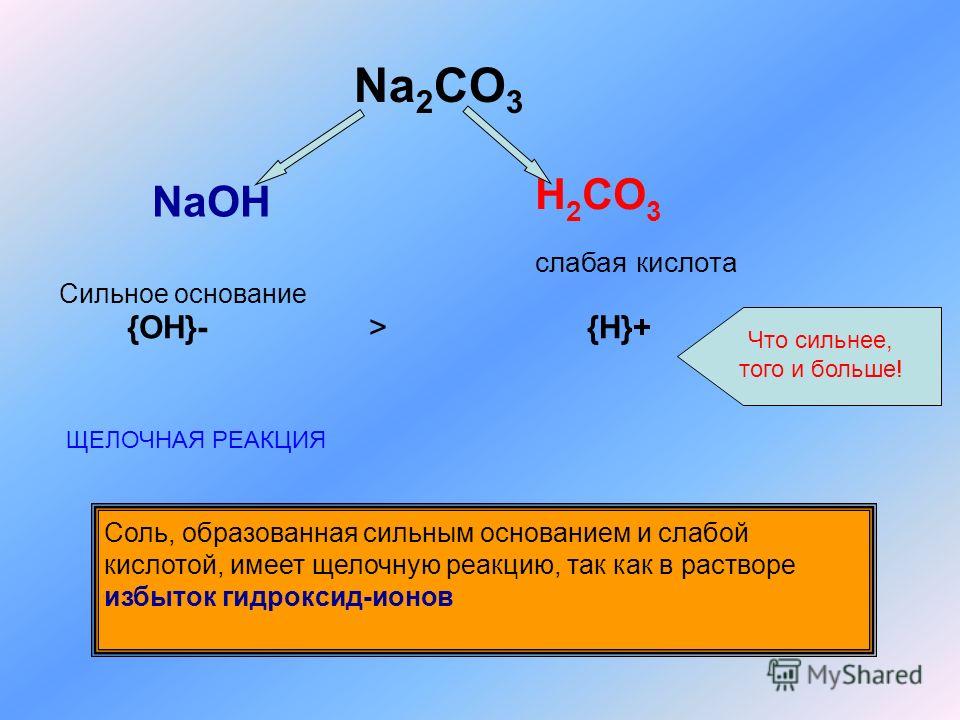 Выборочное удаление определенного количества кислоты из раствора для контроля pH — уровня кислотности — конечного раствора является обычным делом в промышленности.
Выборочное удаление определенного количества кислоты из раствора для контроля pH — уровня кислотности — конечного раствора является обычным делом в промышленности.
Карбонатные соли | CAMEO Chemicals
Лист данных реактивной группы
Что такое реактивные группы?
Реактивные группы — это категории химических веществ, которые обычно реагируют одинаково. способами, потому что они похожи по своей химической структуре.Каждое вещество с химическая таблица была отнесена к одной или нескольким реакционным группам, и CAMEO Chemicals использует назначения реактивных групп для определения своей реакционной способности. предсказания. Подробнее о прогнозах реактивности …
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности.
Есть
13 химических паспортов
назначен этой реактивной группе.
Описание
Воспламеняемость
Карбонатные соли — негорючие материалы.
Реакционная способность
Карбонатные соли действуют как слабые основания и поэтому участвуют в кислотно-основных реакциях, которые выделяют тепло и выделяют углекислый газ. Производство CO2 может вызвать повышение давления в сосудах, содержащих карбонаты.
Токсичность
В целом нетоксичен. Бикарбонат натрия используется как антикислотное лекарство.
Прочие характеристики
Карбонаты образуются в результате реакции между угольной кислотой (водный диоксид углерода) и основанием (или щелочью). Они имеют формулу Mx (CO3) y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями, и они становятся синей лакмусовой бумажкой. Карбонаты находят множество применений в стекольном производстве, производстве целлюлозы и бумаги, химикатах для очистки воды, текстильном производстве, чистящих составах, пищевых добавках и т.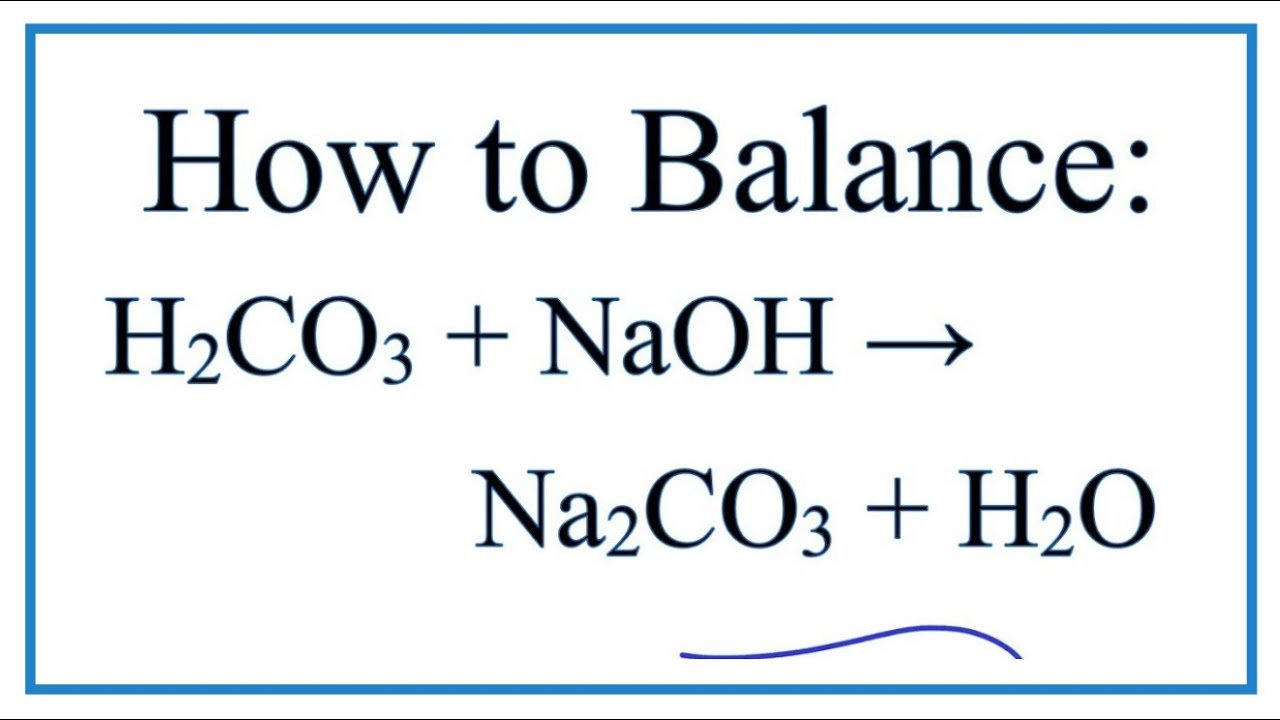 Д.
Д.
Примеры
Бикарбонат аммония, карбонат бария, карбонат кальция, магнезит, перкарбонаты натрия, карбонат натрия, бикарбонат натрия.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любыми реактивных групп в базе данных.
Прогнозируемые опасности и побочные газы для каждой пары реактивных групп будут будет отображаться, а также документация и ссылки, которые использовались для сделать прогнозы реактивности.
Смесь карбонатных солей с:
- Ацетали, кеталы, полуацетали и полуацетали
- Кислоты карбоновые
- Кислоты сильные неокисляющие
- Кислоты сильные окисления
- Кислоты, слабые
- Акрилаты и акриловые кислоты
- Ацилгалогениды, сульфонилгалогениды и хлорформиаты
- Спирты и полиолы
- Альдегиды
- Алкины с ацетиленовым водородом
- Алкины без ацетиленового водорода
- Амиды и имиды
- Ароматы ароматические
- Амины, фосфины и пиридины
- Ангидриды
- Арилгалогениды
- Азо, диазо, азидо, гидразин и азидные соединения
- Основания, Strong
- Базы слабые
- Карбаматы
- Карбонатные соли
- Хлорсиланы
- Конъюгированные диены
- Цианиды неорганические
- Диазониевые соли
- Эпоксиды
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
- Эфиры
- Фторидные соли растворимые
- Фторированные органические соединения
- Галогенированные органические соединения
- Галогенирующие агенты
- Углеводороды алифатические насыщенные
- Углеводороды алифатические ненасыщенные
- Углеводороды ароматические
- Недостаточно информации для классификации
- Изоцианаты и изотиоцианаты
- Кетоны
- Гидриды металлов, алкилы металлов, арилы металлов и силаны
- Металлы, щелочи, очень активные
- Металлы, элементы и порошок, Active
- Металлы, менее реактивные
- Соединения нитратов и нитритов неорганические
- Нитриды, фосфиды, карбиды и силициды
- Нитрилы
- Нитро, нитрозо, нитраты и нитритные соединения, органические
- Не окислительно-восстановительные неорганические соединения
- Не реагирует химически
- Металлоорганика
- Окислители сильные
- Окисляющие агенты, слабые
- Оксимы
- Пероксиды органические
- Фенольные соли
- Фенолы и крезолы
- Полимеризуемые соединения
- Четвертичные соли аммония и фосфония
- Восстановители сильные
- Восстанавливающие агенты, слабые
- Соли кислые
- Соль, основная
- Силоксаны
- Сульфиды неорганические
- Сульфиды органические
- Сульфитные и тиосульфатные соли
- Сульфонаты, фосфонаты и тиофосфонаты органические
- Сложные эфиры и соли тиокарбамата / сложные эфиры и соли дитиокарбамата
- Вода и водные растворы
% PDF-1. 4
%
331 0 объект
>
эндобдж
xref
331 125
0000000016 00000 н.
0000004137 00000 н.
0000004353 00000 п.
0000004482 00000 н.
0000004540 00000 н.
0000005185 00000 н.
0000005292 00000 н.
0000006020 00000 н.
0000006170 00000 п.
0000006702 00000 н.
0000006850 00000 н.
0000007284 00000 н.
0000007432 00000 н.
0000008111 00000 п.
0000008259 00000 н.
0000008917 00000 н.
0000009065 00000 н.
0000009743 00000 н.
0000009891 00000 н.
0000010493 00000 п.
0000010643 00000 п.
0000011317 00000 п.
0000011465 00000 п.
0000012192 00000 п.
0000012342 00000 п.
0000013069 00000 п.
0000013217 00000 п.
0000013376 00000 п.
0000013526 00000 п.
0000014102 00000 п.
0000014453 00000 п.
0000014595 00000 п.
0000014632 00000 п.
0000014742 00000 п.
0000015170 00000 п.
0000015458 00000 п.
0000015566 00000 п.
0000016014 00000 п.
0000016306 00000 п.
0000016811 00000 п.
0000016954 00000 п.
0000017207 00000 п.
0000017394 00000 п.
0000017595 00000 п.
0000017714 00000 п.
0000018566 00000 п.
4
%
331 0 объект
>
эндобдж
xref
331 125
0000000016 00000 н.
0000004137 00000 н.
0000004353 00000 п.
0000004482 00000 н.
0000004540 00000 н.
0000005185 00000 н.
0000005292 00000 н.
0000006020 00000 н.
0000006170 00000 п.
0000006702 00000 н.
0000006850 00000 н.
0000007284 00000 н.
0000007432 00000 н.
0000008111 00000 п.
0000008259 00000 н.
0000008917 00000 н.
0000009065 00000 н.
0000009743 00000 н.
0000009891 00000 н.
0000010493 00000 п.
0000010643 00000 п.
0000011317 00000 п.
0000011465 00000 п.
0000012192 00000 п.
0000012342 00000 п.
0000013069 00000 п.
0000013217 00000 п.
0000013376 00000 п.
0000013526 00000 п.
0000014102 00000 п.
0000014453 00000 п.
0000014595 00000 п.
0000014632 00000 п.
0000014742 00000 п.
0000015170 00000 п.
0000015458 00000 п.
0000015566 00000 п.
0000016014 00000 п.
0000016306 00000 п.
0000016811 00000 п.
0000016954 00000 п.
0000017207 00000 п.
0000017394 00000 п.
0000017595 00000 п.
0000017714 00000 п.
0000018566 00000 п. 0000018884 00000 п.
0000019222 00000 п.
0000020566 00000 п.
0000021869 00000 п.
0000022329 00000 п.
0000022549 00000 п.
0000023287 00000 п.
0000024000 00000 п.
0000024527 00000 п.
0000024686 00000 п.
0000026695 00000 п.
0000027064 00000 н.
0000027467 00000 п.
0000027608 00000 п.
0000027705 00000 н.
0000028263 00000 п.
0000029098 00000 н.
0000030423 00000 п.
0000031792 00000 п.
0000031975 00000 п.
0000032282 00000 п.
0000032366 00000 п.
0000033021 00000 п.
0000033318 00000 п.
0000034445 00000 п.
0000034804 00000 п.
0000034987 00000 п.
0000035294 00000 п.
0000035462 00000 п.
0000035551 00000 п.
0000035856 00000 п.
0000036981 00000 п.
0000037127 00000 п.
0000038561 00000 п.
0000039639 00000 п.
0000046205 00000 п.
0000048855 00000 п.
0000048925 00000 п.
0000049011 00000 п.
0000061395 00000 п.
0000061668 00000 п.
0000062144 00000 п.
0000072233 00000 п.
0000072319 00000 п.
0000083544 00000 п.
0000083841 00000 п.
0000084296 00000 п.
0000096680 00000 п.
0000018884 00000 п.
0000019222 00000 п.
0000020566 00000 п.
0000021869 00000 п.
0000022329 00000 п.
0000022549 00000 п.
0000023287 00000 п.
0000024000 00000 п.
0000024527 00000 п.
0000024686 00000 п.
0000026695 00000 п.
0000027064 00000 н.
0000027467 00000 п.
0000027608 00000 п.
0000027705 00000 н.
0000028263 00000 п.
0000029098 00000 н.
0000030423 00000 п.
0000031792 00000 п.
0000031975 00000 п.
0000032282 00000 п.
0000032366 00000 п.
0000033021 00000 п.
0000033318 00000 п.
0000034445 00000 п.
0000034804 00000 п.
0000034987 00000 п.
0000035294 00000 п.
0000035462 00000 п.
0000035551 00000 п.
0000035856 00000 п.
0000036981 00000 п.
0000037127 00000 п.
0000038561 00000 п.
0000039639 00000 п.
0000046205 00000 п.
0000048855 00000 п.
0000048925 00000 п.
0000049011 00000 п.
0000061395 00000 п.
0000061668 00000 п.
0000062144 00000 п.
0000072233 00000 п.
0000072319 00000 п.
0000083544 00000 п.
0000083841 00000 п.
0000084296 00000 п.
0000096680 00000 п.

 02 %
02 %
