Формула Карбоната натрия структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: CNa2O3
Химический состав Карбоната натрия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 1 | 11,3% |
| Na | Натрий | 22,99 | 2 | 43,4% |
| O | Кислород | 15,999 | 3 | 45,3% |
Молекулярная масса: 105,988
Карбона́т на́трия Na
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная (лат. Salsola soda), из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры). Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·H
- натрит (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида: Na 2SO4 + 2C → Na2S + 2CO2↑. Сульфид натрия реагирует с карбонатом кальция: Na2S + СаСО3 → Na2CO3 + CaS. Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием. Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой: 2NaCl + H2SO4 → Na2
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день. В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углеродадиоксида углерода, то есть как бы вводят гидрокарбонат аммония NH 4HCO3: NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl. Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия: 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O. Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2: 2Nh5Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O, и полученный NH3 также возвращают в производственный цикл. Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц. Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция. По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH 4Cl вместо CaCl2 по методу Сольве. Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl. Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами. В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
Свойства карбоната натрия
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °С | Растворимость, г Na2CO3 на 100 г H2O |
|---|---|
| 0 | 7 |
| 10 | 12,2 |
| 20 | 21,8 |
| 25 | 29,4 |
| 30 | 39,7 |
| 40 | 48,8 |
| 50 | 47,3 |
| 60 | 46,4 |
| 80 | 45,1 |
| 100 | 44,7 |
| 120 | 42,7 |
| 140 | 39,3 |
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах. В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii. Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью Также используется для приготовления проявителя фотоматериалов.
Формула карбоната натрия в химии
Определение и формула карбоната натрия
Формула –
Молярная масса равна г/моль.
Сода (гидрат), сода кальцинированная, или стиральная (безводный).
Физические свойства – белый, плавится без разложения, при дальнейшем нагревании разлагается.
Хорошо растворяется в воде (сильный гидролиз по аниону), создает сильнощелочную среду:
Химические свойства карбоната натрия
Получение
Карбонат натрия можно получать взаимодействием гидроксида натрия и углекислого газа:
Также можно привести способ получения из гидрокарбоната натрия при его нагревании до :
Применение
Карбонат натрия находит широкое применение в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; применяется для уменьшения жёсткости воды. Карбонат натрия — исходный реагент для получения гидроксида натрия. Также он используется в качестве пищевой добавки (разрыхлитель).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Na2CO3 графическая формула
Возьмем по 1 молю газов.М
М(С3Н8) = 44 г/моль
М(С4Н10) = 58 г/моль
масса смеси будет 44 + 58 = 102 г
и займет объем 2*22,4 л = 44,8 л
масса одного литра будет = 102/44,8 = 2,28 г
n(Fe) = 3.2/56=0,057моль
n(Zn) = 2.85/65 = 0,044 моль
Ответ: количество в-ва железа 0,057 моль; а цинка — 0,044 моль
В решении задачи: Примем массу железа за х г, а массу меди, которая выделится в реакции за у г, тогда масса цинка будет (6,05-х) г, а масса выделившейся в реакции меди — (6,4 — у) г.
Составляем уравнения реакций.
Затем — составляем систему двух уравнений.
Реакция алкилирования бензола пропилбромидом рисунок
M(KOH) = 40. —> n(KOH) = 196/40 =4,9 моль
N = n*Nа —-> N = 4,9 * 2,9 * 10^246,02*10^23 = 2,9 * 10^24 … Ионы K+ и OH- будут содержаться в кол-ве по 2,9*10^24
………………………………………………………………………………………………………………..
Эмпирические формулы дают информацию о качественном и количественном составе соединений. Взаимное расположение атомов в молекуле вещества отражают структурно-графические формулы, однако они не показывают пространственное расположение атомов.
При составлении структурно-графических формул можно руководствоваться следующими правилами:
1. Элементы соединяются в соответствии с их валентностью.
2. Черточка в формуле обозначает единичную химическую связь, количество черточек соответствует валентности, например:
K2O записывается так: K‑O ‑K .
3. Состав кислот и оснований следует начинать изображать с центрального атома,
| например — Ca(OH)2 H4SiO4 | 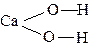
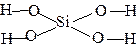
|
4. Если в молекуле кислоты содержится больше атомов кислорода, чем водорода, то «избыточные» атомы кислорода соединены с центральным атомом двойной связью,
| например: HClO4 | 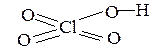
|
5. При написании графических формул солей исходят из графических формул кислот, заменяя атомы водорода на атомы металла, учитывая его валентность, например:
| Na3PO4 | 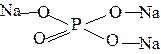
| Fe2(SO4)3 |
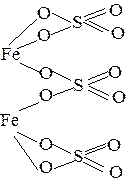
|
| KHCO3 | 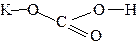
| ||
| CaOHNO3 | 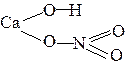
|
Структурно-графические формулы некоторых кислот приведены в табл. 5.
2.4. Общие химические свойства основных классов
неорганических веществ
Оксиды ‑ вещества, состоящие из атомов двух элементов, один из которых – кислород в степени окисления (–2). По химическим свойствам их подразделяют на индифферентные, или несолеобразующие (CO, NO), и солеобразующие, которые бывают основными, кислотными и амфотерными.
Химические свойства основных оксидов
1. Взаимодействуют с кислотами с образованием соли и воды, например:
MgO + 2HCl = MgCl2 + H2O.
2. Взаимодействие с кислотными оксидами с образованием солей:
CaO + CO2 = CaCO3.
3. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием растворимых в воде оснований – щелочей:
K2O + H2O = 2KOH.
Химические свойства кислотных оксидов
1. Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды:
СО2 + 2NaOH = Na2CO3 + Н2О.
2. Кислотные оксиды взаимодействуют с основными оксидами с образованием солей.
3. Большинство кислотных оксидов взаимодействует с водой с образованием кислот:
SО3 + Н2О = H2SO4.
Очень немногие кислотные оксиды не взаимодействуют с водой. Наиболее известный из них оксид кремния (SiO2).
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды.
ZnO + 2HNO3 = Zn(NO3)2 + 2Н2О.
В этих реакциях амфотерные оксиды играют роль основных.
2. Амфотерные оксиды взаимодействуют с щелочами с образованием солей и воды.
ZnO + 2КОН 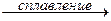 K2ZnO2 + Н2О,
K2ZnO2 + Н2О,
ZnO + 2КОН + H2O 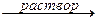 K2[Zn(OH)4].
K2[Zn(OH)4].
В этих реакциях амфотерные оксиды играют роль кислотных.
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей:
ZnO + CO2 = ZnCO3.
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей:
ZnO + Na2O = Na2ZnO2.
Получение оксидов
Оксиды могут быть получены различными способами:
1. Взаимодействием простых веществ с кислородом:
2Mg + О2 = 2MgO;
2. Разложением некоторых оксокислот:
H2SO3 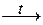 = SO2 + Н2О.
= SO2 + Н2О.
3. Разложением нерастворимых оснований:
Сu(OH)2 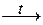 CuO+ H2O.
CuO+ H2O.
4. Разложением некоторых солей:
СаСО3 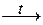 СаО + СО2.
СаО + СО2.
Основания ‑сложные вещества, при диссоциации которых в воде образуются гидроксид-ионы и никаких других анионов.
По растворимости в воде основания делятся на две группы: нерастворимые [Fe(OH)3, Си(ОН)2 и др.] и растворимые в воде [КОН, NaOH, Са(ОН)2, Ва(ОН)2 ], или щелочи.
Химические свойства оснований
Общие свойства оснований объясняются наличием в растворах анионов ОН—, которые образуются в результате электролитической диссоциации молекул оснований:
NaOH  Na+ + OH—.
Na+ + OH—.
1. Водные растворы щелочей изменяют окраску индикаторов.
Таблица 6 ‑ Изменение цвета индикаторов в растворах
щелочей и кислот
| Индикатор | Цвет индикатора | Цвет индикатора в растворе щелочи (рН > 7) | Цвет индикатора в растворе кислоты (рН < 7) |
| Лакмус | Фиолетовый | Синий | Красный |
| Фенолфталеин | Бесцветный | Малиновый | Бесцветный |
| Метилоранж | Оранжевый | Желтый | Красный |
2. Основания взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации). Например:
КОН + НС1= КС1 + Н2О;
Fe(OH)2 +2HNO3 = Fe(NO3)2 + 2Н2О.
3. Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды:
Са(ОН)2 + СО2 = СаСО2 + Н2О.
4. Растворы щелочей взаимодействуют с растворами солей, если в результате образуется нерастворимое основание или нерастворимая соль. Например:
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4;
Ва(ОН)2 + Na2SO4 = 2NaOH + BaSO4↓.
5. Нерастворимые основания при нагревании разлагаются на основный оксид и воду.
2Fе(ОН)3 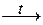 Fе2О3 + ЗН2О.
Fе2О3 + ЗН2О.
6. Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды (Zn, Al и др.).
2AI + 2КОН + 6Н2О = 2K[A1(OH)4] + 3H2↑.
Получение оснований
1. Получение растворимых оснований:
а) взаимодействием щелочных и щелочноземельных металлов с водой:
2Na + 2Н2О = 2NaOH + Н2↑;
б) взаимодействием оксидов щелочных и щелочноземельных металлов с
водой:
Na2O + Н2О = 2NaOH.
2. Получение нерастворимых оснований действием щелочей на растворимые соли металлов:
2NaOH + FeSO4 = Fe(OH)2↓ + Na2SO4.
Кислоты ‑ сложные вещества, при диссоциации которых в воде, образуются ионы водорода (гидроксония) и никаких других катионов.
Химические свойства
Общие свойства кислот в водных растворах обусловлены присутствием ионов Н+ (вернее H3O+), которые образуются в результате электролитической диссоциации молекул кислот:
1. Кислоты одинаково изменяют цвет индикаторов (табл. 7).
2. Кислоты взаимодействуют с основаниями. Например:
Н3РО4 + 3NaOH=Na3PO4+ЗН2О;
Н3РО4 + 2NaOH = Na2HPO4 + 2Н2О;
Н3РО4 + NaOH = NaH2PO4 + Н2О;
2НС1 + Сu(ОН)2 = СuС12 + 2Н2О;
НС1 + Сu(ОН)2 = СuОНСl + Н2О.
3. Кислоты взаимодействуют с основными оксидам:
2НСl + СаО = СаС12 + Н2О;
H2SO4 +Fe2O3=Fe2(SO4)3+ ЗН2О.
4. Кислоты взаимодействуют с амфотерными оксидами:
2HNO3 + ZnO = Zn(NO3)2 + Н2О.
5. Кислоты взаимодействуют с некоторыми средними солями с образованием новой соли и новой кислоты, реакции возможны в том случае, если в результате образуется нерастворимая соль или более слабая (или более летучая) кислота, чем исходная. Например:
2НС1+Na2CO3=2NaCl+H2CO3;
NaCl + H2SO4 = HCl + Na2SO4.
6. Кислоты взаимодействуют с металлами. Характер продуктов этих реакций зависит от природы и концентрации кислоты и от активности металла. Например, разбавленная серная кислота, хлороводородная кислота и другие кислоты‑неокислители взаимодействуют с металлами, которые находятся в электрохимическом ряду напряжения левее водорода. В результате реакции образуются соль и газообразный водород:
H2SO4 (разб)) + Zn = ZnSO4 + Н2↑;
НС1 + Mg = MgО + H2↑.
Кислоты-окислители (концентрированная серная кислота, азотная кислота HNO3 любой концентрации) взаимодействуют и с металлами, стоящими в ряду напряжения после водорода с образованием соли и продукта восстановления кислоты. Например:
2H2SO4 (конц) + Zn = ZnSO4 +SO2↑+ 2H2O;
Получение кислот
1. Бескислородные кислоты получают путем синтеза из простых веществ и последующим растворением продукта в воде.
S + Н2 = Н2S.
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
SO3 + Н2О = H2SО4.
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Na2SiО3 + H2SO4 = H2SiО3 + Na2SO4.
При графическом изображении формул веществ указывается последовательность расположения атомов в молекуле с помощью, так называемых валентных штрихов (термин «валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил сцепления атомов), иначе называемых валентной чертой (каждая валентная черта, или валентный штрих, эквивалентны одной паре электронов в ковалентных соединениях или одному электрону, участвующему в образовании ионной связи). Часто неправильно принимают графическое изображение формул за структурные формулы, приемлемые только для соединений с ковалентной связью и показывающие взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе). В узлах кристаллической решетки NаСI находятся ионы, причем каждый Nа+ окружен шестью хлорид-ионами. Это графическое изображение формулы вещества, показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не соединяются между собой и хлорид-ионы, они соединены с ионами натрия.Покажем это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько столбцов и выполняем действия согласно алгоритмам по графическому изображению формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое изображение формул оксидов (например, Аl2O3)
III II
1. Определяем валентность атомов элементов в Аl2O3
2. Записываем химические знаки атомов металлов на первое место (первый столбец). Если атомов металлов больше одного, то записываем и в один столбец и обозначаем валентность (число связей между атомами) валентными штрихами
З. Второе место (столбец), тоже в один столбец, занимают химические знаки атомов кислорода, причем к каждому атому кислорода должно подходить по два валентных штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1. Определяем валентность атомов элементов Fе(ОН)3
2. На первом месте (первый столбец) пишем химические знаки атомов металла, обозначаем их валентность Fе
З. Второе место (столбец) занимают химические знаки атомов кислорода, которые присоединяются одной связью к атому металла, вторая связь пока «свободна»
4. Третье место (столбец) занимают химические знаки атомов водорода, присоединяющихся на «свободную» валентность атомов кислорода
Графическое изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем валентность атомов элементов Н2SO4.
2. На первом месте (первый столбец) пишем химические знаки атомов водорода в один столбец с обозначением валентности
Н—
Н—
З. Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной связью к атому водорода, при этом вторая валентность каждого атома кислорода пока «свободна»
Н— О —
Н— О —
4. Третье место (столбец) занимают химические знаки атомов кислотообразователя с обозначением валентности
5. На «свободные» валентности атома кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Графическое изображение формул солей
Средние соли (например, Fe2SO4)3) В средних солях все атомы водорода кислоты замещены на атомы металла, поэтому при графическом изображении их формул первое место (первый столбец) занимают химические знаки атомов металла с обозначением валентности, а далее — как в кислотах, то есть второе место (столбец) занимают химические знаки атомов кислорода, третье место (столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Кислые соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать как продукты частичного замещения атомов водорода в кислоте атомами металла, поэтому при составлении графических формул кислых солей на первое место (первый столбец) записывают химические знаки атомов металла и водорода с обозначением валентности
Н—
Н—
Ва =
Н—
Н—
Второе место (столбец) занимают химические знаки атомов кислорода
Третье место (столбец) — химические знаки атомов кислотообразователя, на «свободные» валентности кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Основные соли (например, А1ОНSO4) Основные соли определяем, чем как продукт частичного замещения группы ОН основания на кислотный остаток. При составлении графических формул основных солей первое место (столбец) занимают химические знаки атомов металлов с обозначением валентности, второе (столбец) — химические знаки атомов металлов кислорода, третье — химические знаки атомов водорода и кислотообразователя с обозначением соответствующей валентности. На «свободные» валентности атома кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По графическому изображению формул веществ можно судить об их свойствах, определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1 или в органических соединениях
Структурная формула Фосфата кальция Ca3(PO4)2 Ca+23(P+5O-24)2
Молекулярный вес Na2CO3
Молярная масса Na2CO3 = 105,98844 г / моль
Это соединение также известно как карбонат натрия.
Преобразовать граммы Na2CO3 в моли или моли Na2CO3 в граммы
Расчет молекулярной массы:
22,98977 * 2 + 12.0107 + 15.9994 * 3
| Элемент | Символ | Атомная масса | # атомов | Массовый процент |
| Натрий | Na | 22.989770 | 2 | 43,382% |
| Углерод | С | 12.0107 | 1 | 11,332% |
| Кислород | O | 15.9994 | 3 | 45,286% |
Обратите внимание, что все формулы чувствительны к регистру.
Вы хотели найти молекулярный вес одной из этих похожих формул?
Na2CO3
Na2Co3
В химии вес формулы — это величина, вычисленная умножением атомного веса (в атомных единицах массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов.
Нахождение молярной массы начинается с единиц грамма на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моле этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная масса формулы представляет собой молекулярную массу. Массовый процент любого атома или группы атомов в соединении можно рассчитать путем деления общего веса атома (или группы атомов) в формуле на вес формулы и умножения на 100.
Распространенный запрос на этом сайте — конвертировать граммы в родинки. Чтобы завершить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что молярная масса вещества влияет на конверсию. Этот сайт объясняет, как найти молярную массу.
Веса формулы особенно полезны при определении относительных весов реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют уравнительными весами.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и рассчитать молекулярный вес вещества.
Используемые на этом сайте атомные веса получены из NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Это как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая является массой одной молекулы четко определенных изотопов.Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
,Преобразование родинок na2co3 в граммы
›› Перевести моль na2co3 в грамм
Пожалуйста, включите Javascript использовать конвертер
›› Больше информации от конвертера
Сколько родинок na2co3 в 1 грамме?
Ответ 0.0094349912122492.
Мы предполагаем, что вы конвертируете между моль na2co3 и грамм .
Вы можете просмотреть более подробную информацию о каждой единице измерения:
молекулярный вес na2co3 или
грамм
Молекулярная формула для Na2CO3 является Na2CO3.
Базовая единица СИ для количества вещества — моль.
1 моль равен 1 моль na2co3, или 105,98844 грамма.
Обратите внимание, что могут возникнуть ошибки округления, поэтому всегда проверяйте результаты.
Используйте эту страницу, чтобы узнать, как конвертировать моль na2co3 в грамм.
Введите свои числа в форме для преобразования единиц!
›› Подобные химические формулы
Обратите внимание, что все формулы чувствительны к регистру.
Вы хотели преобразовать одну из этих похожих формул?
моль Na2CO3 до грамма
моль Na2CO3 до грамма
›› Таблица быстрых конверсий родинок na2co3 в граммы
1 моль na2co3 до граммов = 105.98844 грамм
2 моля na2co3 до грамма = 211,97688 грамм
3 моля na2co3 до грамма = 317,96532 грамма
4 моля na2co3 до грамма = 423,95376 грамма
5 молей na2co3 до грамма = 529,9422 грамма
6 молей na2co3 до грамма = 635,93064 грамма
7 молей na2co3 до грамма = 741,91908 грамм
8 молей na2co3 до грамма = 847,90752 грамма
9 молей na2co3 до грамма = 953,89596 грамм
10 молей Na2CO3 до граммов = 1059.8844 грамм
›› Хотите другие юниты?
Вы можете сделать обратное преобразование единиц из грамм na2co3 в моли или введите другие единицы для преобразования ниже:
›› Общее количество веществ преобразования
моль na2co3 в пикомол
моль na2co3 в моль
моль na2co3 в сантимол
моль na2co3 в молекулу
моль na2co3 в атом
молей na2co3 в микромол
молей na2co3 в моль на 2co3 в моль моль
›› Подробности расчета молекулярной массы
В химии формула веса — это величина, вычисленная умножением атомного веса (в атомных единицах массы) каждого элемента в химической формуле на число атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Нахождение молярной массы начинается с единиц грамма на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моле этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Используемые на этом сайте атомные веса получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Это как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая является массой одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Веса формулы особенно полезны при определении относительных весов реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют уравнительными весами.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и рассчитать молекулярный вес вещества.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная масса формулы представляет собой молекулярную массу. Массовый процент любого атома или группы атомов в соединении может быть вычислен путем деления общего веса атома (или группы атомов) в формуле на вес формулы и умножения на 100.
Распространенный запрос на этом сайте — конвертировать грамм в родинки. Чтобы завершить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать.Причина в том, что молярная масса вещества влияет на конверсию. Этот сайт объясняет, как найти молярную массу.
›› Метрические преобразования и многое другое
ConvertUnits.com предоставляет онлайн калькулятор преобразования для всех типов единиц измерения. Вы можете найти таблицы преобразования метрик для единиц СИ, а также как английские единицы, валюта и другие данные. Введите в единицу символы, сокращения или полные имена для единиц длины, площадь, масса, давление и др. типы.Примеры включают в себя мм, дюйм, 100 кг, жидкая унция США, 6’3 «, 10 камень 4, куб. см, метров в квадрате, граммы, родинки, футы в секунду и многое другое!
,Какая молярная масса карбоната натрия (Na2CO3)?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра
na2co3 карбонат натрия для промышленности
Спецификация
1.белые гранулы кристаллического порошка.
2.2.Hs код: 28362000
3.Cas № 497-19-8
4. Молекулярная формула: Na2CO3
Предметы | Стандарты (класс А) | Результаты испытаний | Индивидуальные результаты испытаний |
Общее количество щелочи (в пересчете на сухой процент Na2CO3)% | 99.20мин. | 99,20 | проход |
Общее количество щелочи (подсчитанное в процентах от влажного основания Na2CO3)% | 97,9 мин. | 98,9 | проход |
NaCl (в пересчете на сухое вещество NaCl)% | 0,70 макс. | 0,6 | проход |
Fe% (в пересчете на сухое вещество)% | 0.0035max. | 0,003 | проход |
Нерастворимые в воде% | 0,03макс. | 0,02 | проход |
Хранение
Хранить вдали от солнечных лучей и влаги, хранить в проветриваемом сухом месте.
Использует
Кальцинированная сода является одним из основных материалов для химической промышленности, в основном используется для металлургии, стекла, текстиля, красок, медицины, синтетических моющих средств, нефтяной и пищевой промышленности и т. Д.
Предупреждения
Хранить вдали от солнечных лучей и влаги, хранить в проветриваемом сухом месте.
Наше преимущество
1. Чистота: 99,2%
2. Прямая цена завода
3.OEM опыт, поставка 5000 т / месяц
4.CIQ деталь, сертификат качества SGS, ISO
Сервис, который мы можем предоставить:
1. бесплатный образец для тестирования.перед отправкой.
2. Контроль качества перед отгрузкой.
3. Упаковка в соответствии с требованиями клиента.
4 .. Смешанный контейнер, мы можем смешивать разные предметы в одном контейнере.
5. Оперативная отгрузка с правильной линией отгрузки.
6.Опыт в разработке документов D / P и L / C.
Сода кальцинированная картина:
Добро пожаловать, свяжитесь с нами в любое время
,