кислые соли
Кислые соли — это соли, которые образуются при неполном замещении атомов водорода в молекулах кислот атомамиметаллов.Они содержат в своём составе два вида катионов: катион металла (или аммония) и катион водорода, и многозарядный анион кислотного остатка. Катион водорода даёт к названию соли приставку «гидро», например, гидрокарбонат натрия. Такие соли диссоциируют в водных растворах на катионы металлов, катионы водорода и анионы кислотных остатков. Они образуются при избытке кислоты и содержат в своём составе атомы водорода. Кислые соли образуются только многоосновными кислотами и проявляют свойства как солей, так и кислот. Кислые соли сильных кислот (гидросульфаты, дигидрофосфаты) при гидролизе дают кислую реакцию среды (с чем и связано их название). В то же время растворы кислых солей слабых кислот (гидрокарбонаты, тартраты) могут обладать нейтральной или щелочной реакцией среды.
Содержание |
Физические свойства
Кислые соли – твёрдые кристаллические вещества, обладающие различной растворимостью, и характеризующиеся высокими температурами плавления. Окраска солей зависит от металла, входящего в их состав.
Химические свойства
1. Кислые соли реагируют с металлами, стоящими в ряду стандартных электродных потенциалов (ряд Бекетова) левее атома водорода:
2KНSO4 + Mg = H2 + MgSO4 + K2SO4,
2NaHCO3 + Fe = H2 + Na2CO3 + Fe2(CO3)3
Так как эти реакции протекают в водных растворах, для опытов нельзя применять такие металлы как литий
, натрий, калий, барий и другие активные металлы, которые при обычных условиях реагируют с водой.2. Кислые соли реагируют с кислотами, в случае если образующаяся в результате реакции кислота более слабая или летучая, чем кислота, вступающая в реакцию:
NaHCO3 + HCl = NaCl + H2O + CO2
Для проведения таких реакций обычно берут сухую соль и действуют на нее концентрированной кислотой.
3. Кислые соли реагируют с водными растворами щелочей c образованием средней соли и воды:
1) Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
2) 2KHSO4 + 2NaOH = 2H2O + K2SO4 + Na2SO4,
3) NaHCO3 + NaOH = H2O + Na2CO3
Такие реакции используют для получения средних солей. 4. Кислые соли реагируют с растворами солей, в случае, если в результате реакции выпадает осадок, выделяется газ или образуется вода:
1) 2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 + MgSO4,
2) 2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
3) 2NaHCO3 + BaCl2 = BaCO3 + Na2CO3 + 2HCl
Указанные реакции используются, в том числе, для получения практически нерастворимых солей.
5. Некоторые кислые соли при нагревании разлагаются:
1) Ca(HCO3)2 = CaCO3 + CO2 + H2O
2) 2NaHCO3 = CO2 + H2O + Na2CO3
6. Кислые соли реагируют с основными оксидами с образованием воды и средних солей:
1) 2KHSO 4 + MgO = H2O + MgSO4 + K2SO4,
2) 2NaHCO3 + CuO = H2O + CuCO3 + Na2CO3
7. При гидролизе кислые соли распадаются на катионы металла и кислые анионы: КHSO4 → К+ + НSO4–
Образующиеся кислые анионы, в свою очередь, обратимо диссоциируют: HSO4– → H+ + SO42–
Получение
Кислые соли образуются при воздействии избытка кислоты на щелочь. В зависимости от количества молей кислоты (в данном случае — ортофосфорной) могут образовываться дигидроортофосфаты (1) и гидроортофосфаты (2):
Ba(OH)2 + 2H3PO4 → Ba(H2PO4)2 + 2H2O
Ba(OH)2 + H3PO4 → BaHPO4 + 2H2
При получении кислых солей важны молярные соотношения исходных веществ. Например, при молярном соотношении NaOH и H2SO4 2:1 образуется средняя соль:
2NaOH + H2SO4 = Na2SO4 + 2H2O А при соотношении 1:1 — кислая: NaOH + H2SO4 = NaHSO4 + H2O
1. Кислые соли образуются в результате взаимодействия растворов кислот с металлами, стоящими в ряду активности металлов левее водорода:
Zn + 2H2SO4 = H2 + Zn(HSO4)2,
2. Кислые соли образуются в результате взаимодействия кислот с основными оксидами:
1) CaO + H3PO4 = CaHPO4+ H2O,
2) CuO + 2H2SO4 = Cu(HSO4)2 + H2O
3. Кислые соли образуются в результате взаимодействия кислот с основаниями (реакция нейтрализации):
1) NaOH + H2SO4 = NaHSO4 + H2O
2) H2SO4 + KOH = KHSO4 + H2O
3) Mg(OH)2 + 2H2SO4 = Mg(HSO4)2 + 2H2O
В зависимости от соотношений концентраций кислот и оснований, участвующих в реакциях нейтрализации, можно получать средние, кислые и основные соли.
4. Кислые соли можно получить в результате взаимодействия кислот и средних солей:
Ca3(PO4)2 + H3PO4 = 3CaHPO4
5. Кислые соли образуются в результате взаимодействия оснований с избытком кислотного оксида:
Ca(OH)2 + 2CO2 = Ca(HCO3)2
Соли
Соли-продукт замещения атомов водорода в кислоте на металл. Растворимые соли в соде диссоцируют на катион металла и анион кислотного остатка. Соли делят на:
· Средние
· Кислые
· Основные
· Комплексные
· Двойные
· Смешанные
Средние соли. Это продукты полного замещения атомов водорода в кислоте на атомы металла, или на группу атомов (NH4+): MgSO4,Na2SO4,NH4Cl, Al2(SO4)3.
Названия средних солей происходят от названия металлов и кислот:CuSO4-сульфат меди,Na3PO4-фосфат натрия,NaNO2-нитрит натрия,NaClO-гипохлорит натрия,NaClO 2-хлорит натрия,NaClO3-хлорат натрия,NaClO4-перхлорат натрия,CuI- йодид меди(I), CaF2-фторид кальция. Так же надо запомнить несколько тривиальных названий: NaCl-поваренная соль, KNO3-калийная селитра, K2CO3-поташ, Na2CO3-сода кальцинированная,Na2CO3∙10h3O-сода кристаллическая, CuSO4- медный купорос,Na2B4O7.10H2O- бура,Na2SO4.10H2O-глауберова соль.Двойные соли. Это соли, содержащие два типа катионов (атомы водорода многоосновной кислоты замещены двумя различными катионами): MgNH4PO4,KAl(SO4)2,NaKSO4.Двойные соли как индивидуальные соединения существуют только в кристаллическом виде. При растворении в воде они полностью диссоциируют на ионы металлов и кислотные остатки (если соли растворимые), например:
NaKSO4
Примечательно, что диссоциация двойных солей в водных растворах проходит в 1 ступень. Для названия солей данного типа нужно знать названия аниона и двух катионов:MgNH4PO4— фосфат магния-аммония.
Комплексные соли.Это частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемомукомплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Комплексные соли делятся на:
1) Катионные комплексы
[Zn(NH3)4]Cl2 — дихлоридтетраамминцинка(II)
[Co(NH3)6]Cl2 — дихлоридгексаамминкобальта(II)
2) Анионные комплексы
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH 4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
Теорию строения комплексных соединений разработал швейцарский химик А. Вернер.
Кислые соли – продукты неполного замещения атомов водорода в многоосновных кислотах на катионы металла.
Например: NaHCO3
Химические свойства:
Реагируют с металлами, стоящими в ряду напряжений левее водорода.
2KHSO4+Mg→H2↑+Mg(SO)4+K2
(SO)4
Заметим, что для таких реакций опасно брать щелочные металлы, ибо они вначале прореагируют с водой с большим выделением энергии, и произойдёт взрыв, так как все реакции происходят в растворах.
2NaHCO3+Fe→H2↑+Na2 CO3+Fe2 (CO3 ) 3↓
Кислые соли реагируют с растворами щелочей и образуют среднюю(ие) соль(ли) и воду:
NaHCO3+NaOH→Na2 CO3+H2O
2KHSO4+2NaOH→2H2O+K2 SO4+Na2 SO4
Кислые соли реагируют с растворами средних солей в том случае, если выделяется газ, выпадает осадок, или выделяется вода:
2KHSO4+MgCO3→MgSO4+K2 SO4+CO2↑+H2O
2KHSO4+BaCl2→BaSO4↓+K2 SO4+2HCl
Кислые соли реагируют с кислотами, если кислота-продукт реакции будет более слабая или летучая, чем добавленная.
NaHCO3+HCl→NaCl+CO2↑+H2O
Кислые соли реагируют с основными оксидами с выделением воды и средних солей:
2NaHCO3+MgO→MgCO3↓+Na2 CO3+H2O
2KHSO4+BeO→BeSO4+K2 SO4+H2O
Кислые соли (в частности гидрокарбонаты) разлагаются под действием температуры:
2NaHCO3 → Na2
CO3+CO2+H2O
Получение:
Кислые соли образуются при воздействии на щёлочь избытком раствора многоосновной кислоты (реакция нейтрализации):
NaOH+H2 SO4→NaHSO4+H2O
Mg(OH)2+2H2 SO4→Mg(HSO4 ) 2+2H2O
Кислые соли образуются при растворении основных оксидов в многоосновных кислотах:
MgO+2H2 SO4→Mg(HSO4 ) 2+H2O
Кислые соли образуются при растворении металлов в избытке раствора многоосновной кислоты:
Mg+2H2 SO4→Mg(HSO4 )2+H2↑
Кислые соли образуются в результате взаимодействия средней соли и кислоты, которой образован анион средней соли:
Ca3 (PO4 )2+H3 PO4→3CaHPO4
Основные соли:
Основные соли – продукт неполного замещения гидроксогруппы в молекулах многокислотных оснований на кислотные остатки.
Пример: MgOHNO3,FeOHCl.
Химические свойства:
Основные соли реагируют с избытком кислоты, образуя среднюю соль и воду.
MgOHNO3+HNO3→Mg(NO3 )2+H2O
Основные соли разлагаются температурой:
[Cu(OH) ]2 CO3 →2CuO+CO2↑+H2O
Получение основных солей:
Взаимодействие солей слабых кислот со средними солями:
2MgCl2+2Na2 CO3+H2O→[Mg(OH) ]2
CO3+CO2↑+4NaCl
Гидролиз солей, образованных слабым основанием и сильной кислотой:
ZnCl2+H2O→[Zn(OH) ]Cl+HCl
Большинство основных солей являются малорастворимыми. Многие из них являются минералами, напримермалахитCu2CO3(OH)2и гидроксилапатит Ca5(PO4)3OH.
Свойства смешанных солей не рассматриваются в школьном курсе химии, но определение важно знать.
Смешанные соли – это соли, в составе которых к одному катиону металла присоединены кислотные остатки двух разных кислот.
Наглядный пример -Ca(OCl)Cl белильная известь (хлорка).
Номенклатура:
1. Соль содержит комплексный катион
Сначала называют катион, затем входящие в внутреннюю сферу лиганды- анионы, с окончанием на «о» (Cl—— хлоро, OH—-гидроксо), затем лиганды, представляющие собой нейтральные молекулы (NH3-амин,h3O-акво).Если одинаковых лигандов больше 1, о их количество обозначают греческими числительными:1 — моно, 2 — ди,3 — три, 4 — тетра, 5 — пента, 6 — гекса, 7 — гепта, 8 — окта, 9 — нона, 10 — дека. Последним называют ион-комплексообразователь, в скобках указывая его валентность, если она переменная.
[Ag(NH3)2](OH)-гидроксид диамин серебра (I)
[Co(NH3)4Cl2]Cl2-хлорид дихлорoтетраамин кобальта (III)
2. Соль содержит комплексный анион.
Сначала называют лиганды -анионы, затем входящие в внутреннюю сферу нейтральные молекулы с окончанием на «о», указывая их количество греческими числительными. Последним называют ион-комплексообразователь на латинском, с суффиксом «ат», указывая в скобочках валентность. Далее пишется название катиона, находящегося в внешней сфере, число катионов не указывается.
K4[Fe(CN)6]-гексацианоферрат (II) калия(реактив на ионы Fe3+)
K3[Fe(CN)6]- гексацианоферрат (III) калия(реактив на ионы Fe2+)
Na2[Zn(OH)4]-тетрагидроксоцинкат натрия
Большинство ионов комплексообразователей- металлы. Наибольшую склонность к комплексообрзованию проявляют d элементы. Вокруг центрального иона-комплексообразователя находятся противоположно заряженные ионы или нейтральные молекулы- лиганды или адденды.
Ион-комплексообразователь и лиганды составляют внутреннюю сферу комплекса (в квадратных скобочках), число лигандов, координирующихся вокруг центрального иона называют координационным числом.
Ионы, не вошедшие в внутреннюю сферу, образуют внешнюю сферу. Если комплексный ион- катион, то во внешней сфере анионы и наоборот, если комплексный ион-анион, то во внешней сфере- катионы. Катионами обычно являются ионы щелочных и щёлочноземельных металлов, катион аммония. При диссоциации комплексные соединения дают сложные комплексные ионы, которые довольно устойчивы в растворах:
K3 [Fe(CN) 6]↔3K++[Fe(CN)6 ]3-
Если речь идёт о кислых солях, то при чтении формулы произносится приставка гидро-, например:
Гидросульфид натрия NaHS
Гидрокарбонат натрия NaHCO3
С основными солями же используется приставка гидроксо- или дигидроксо-
(зависит от степени окисления металла в соли), например:
гидроксохлорид магнияMg(OH)Cl, дигидроксохлорид алюминия Al(OH)2Cl
Способы получения солей:
1. Прямое взаимодействие металла с неметаллом. Этим способом можно получают соли бескислородных кислот.
Zn+Cl2→ZnCl2
2. Взаимодействие кислоты и основания (реакция нейтрализации). Реакции этого типа имеют большое практическое значение (качественные реакции на большинство катионов), они всегда сопровождаются выделением воды:
NaOH+HCl→NaCl+H2O
Ba(OH)2+H2 SO4→BaSO4↓+2H2O
3. Взаимодействие основного оксида с кислотным:
SO3+BaO→BaSO4↓
4. Взаимодействие кислотного оксида и основания:
2NaOH+2NO2→NaNO3+NaNO2+H2O
NaOH+CO2→Na2 CO3+H2O
5. Взаимодействие основного оксида и кислота:
Na2 O+2HCl→2NaCl+H2O
CuO+2HNO3=Cu(NO3 ) 2+H2O
6. Прямое взаимодействие металла с кислотой. Эта реакция может сопровождаться выделением водорода. Будет ли выделяться водорода или нет зависит от активности металла, химических свойств кислоты и ее концентрации (см. Свойства концентрированной серной и азотной кислот).
Zn+2HCl=ZnCl2+H2↑
H2 SO4+Zn=ZnSO4+H2↑
7. Взаимодействие соли с кислотой. Эта реакция будет происходить при условии, что кислота, образующая соль слабее или более летуча, чем кислота, вступившая в реакцию:
Na2 CO3+2HNO3=2NaNO3+CO2↑+H2O
8. Взаимодействие соли с кислотным оксидом. Реакции идут только при нагревании, поэтому, вступающий в реакцию оксид должен быть менее летучим, чем образующийся после реакции:
CaCO3+SiO2=CaSiO3+CO2↑
9. Взаимодействие неметалла с щелочью. Галогены, сера и некоторые другие элементы, взаимодействуя с щелочами дают бескислородную и кислородосодержащую соли:
Cl2+2KOH=KCl+KClO+H2O(реакция идёт без нагревания)
Cl2+6KOH=5KCl+KClO3+3H2O (реакция идёт с нагреванием)
3S+6NaOH=2Na2 S+Na2 SO3+3H2O
10. Взаимодействие между двумя солями. Это наиболее распространённыйспособ получения солей. Для этого обе соли, вступившие в реакцию должны бать хорошо растворимы, а так как это реакция ионного обмена, то, для того, чтобы она прошла до конца, нужно чтобы 1 из продуктов реакции был нерастворим:
Na2 CO3+CaCl2=2NaCl+CaCO3↓
Na2 SO4+ BaCl2=2NaCl+BaSO4↓
11. Взаимодействие между солью и металлом. Реакция протекает в том случае, если металл стоит в ряду напряжения металлов левее того, который содержится в соли:
Zn+CuSO4=ZnSO4+Cu↓
12. Термическое разложение солей. При нагревании некоторых кислородосодержащих солей образуются новые, с меньшим содержанием кислорода, или вообще его не содержащие:
2KNO3 → 2KNO2+O2↑
4KClO3 → 3KClO4+KCl
2KClO3 → 3O2↑+2KCl
13. Взаимодействие неметалла с солью. Некоторые неметаллы способны соединяться с солями, с образованием новых солей:
Cl2+2KI=2KCl+I2↓
14. Взаимодействие основания с солью. Так как это реакцияионного обмена, то, для того, чтобы она прошла до конца, нужно чтобы 1 из продуктов реакции был нерастворим (это реакция так же пользуются для перевода кислых солей в средние):
FeCl3+3NaOH=Fe(OH)3↓ +3NaCl
NaOH+ZnCl2= (ZnOH)Cl+NaCl
KHSO4+KOH=K2 SO4+H2O
Так же таким способом можно получать и двойные соли:
NaOH+ KHSO4=KNaSO4+H2O
15. Взаимодействие металла с щелочью. Металлы, которые являются амфотерными реагируют с щелочами, образуя комплексы:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
16. Взаимодействие солей(оксидов, гидроксидов, металлов) с лигандами:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
AgCl+3NH4OH=[Ag(NH3 )2]OH+NH4 Cl+2H2O
3K4 [Fe(CN) 6]+4FeCl3=Fe3 [Fe(CN) 6]3+12KCl
AgCl+2NH4 OH=[Ag(NH3 )2]Cl+2H2O
Авторы статьи: Симкин Егор Андреевич, Каштанов Артём Денисович
Редактор: Харламова Галина Николаевна
www.teslalab.ru
Соли
Кроме катионов металлов в солях могут находиться катионы аммония Nh5+, фосфония Ph5+ и их органические производные, а также комплексные катионы и т. д
Если рассматривать соли как продукты протонов в кислотах или гидроксогрупп в основаниях, то можно выделить следующие типы солей:
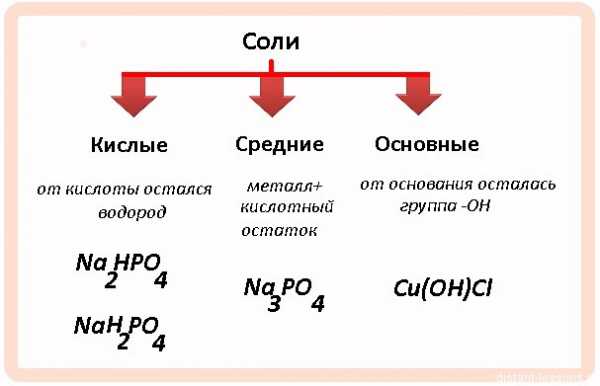
— Средние (нормальные) соли — продукты замещения всех катионов водорода в молекулах кислоты на катионы металла (Na2CO3, K3PO4).
— Кислые соли — продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO3, K2HPO4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты).
— Основные соли — продукты неполного замещения гидроксогрупп основания (OH—) кислотными остатками ((CuOH)2CO3). Они образуются в условиях избытка основания или недостатка кислоты.
— Простые соли — соли, состоящие из одного вида катионов и одного вида анионов (NaCl).
— Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
— Смешанные соли — соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl).
Также различают гидратные соли (кристаллогидраты), в состав которых входят молекулы кристаллизационной воды, например, Na2SO4·10 H2O, и комплексные соли, содержащие комплексный катион или комплексный анион (K4[Fe(CN)6], [Cu(NH3)4](OH)2. Внутренние соли образованы биполярными ионами, то есть молекулами, содержащими как положительно заряженный, так и отрицательно заряженный атом.
Названия солей, как правило, связаны с названиями соответствующих кислот. Поскольку многие кислоты в русском языке носят тривиальные, или традиционные, названия, подобные названия (нитраты, фосфаты, карбонаты и др.) также сохраняются и для солей.
Традиционные названия солей состоят из названий анионов в именительном падеже и названий катионов в родительном падеже[10]. Названия анионов строятся на основе русских или латинских названий кислотообразующих элементов. Если кислотообразующий элемент может иметь одну степень окисления, то к его названию добавляют суффикс — ат:
CO32- — карбонат,
GeO32- — германат.
Если кислотообразующий элемент может принимать две степени окисления, то для аниона, образованного этим элементом в более высокой степени окисления, применяют суффикс -ат, а для аниона с элементов в меньшей степени окисления — суффикс -ит:
SO42- — сульфат,
SO32- — сульфит.
Если элемент может принимать три степени окисления, то для высшей, средней и низшей степени окисления используют соответственно суффиксы -ат, -ит и суффикс -ит с приставкой гипо-:
NO3- — нитрат,
NO2— — нитрит,
NO22- — гипонитрит.
Наконец, в случае элементов, принимающих четыре степени окисления, для высшей степени окисления применяют приставку пер- и суффикс -ат, далее (в порядке понижения степени окисления) суффикс -ат, суффикс -ит и суффикс -ит с приставкой гипо-:
ClO4— — перхлорат,
ClO3— — хлорат,
ClO2— — хлорит,
ClO— — гипохлорит.
Приставки мета-, орто-, поли-, ди-, три-, пероксо- и т. п., традиционно присутствующие в названиях кислот, сохраняются также и в названиях анионов.
Названия катионов соответствуют названиям элементов, от которых они образованы: при необходимости указывается число атомов в катионе (катион диртути(2+) Hg22+, катион тетрамышьяка(2+) As42+) и степень окисления атома, если она переменная.
Названия кислых солей образуются путём добавления приставки гидро- к названию аниона. Если на один анион приходится больше одного атома водорода, то его количество указывают при помощи умножающей приставки (NaHCO3 — гидрокарбонат натрия, NaH2PO4 — дигидрофосфат натрия). Аналогично, для образования названий основных солей используются приставки гидроксо- ((FeOH)NO3 — гидроксонитрат железа(II)).
Кристаллогидратам дают названия, добавляя слово гидрат к традиционному или систематическому названию соли (Pb(BrO3)2·H2O — гидрат бромата свинца(II), Na2CO3·10H2O — декагидрат карбоната натрия). Если известна структура кристаллогидрата, то может применяться номенклатура комплексных соединений ([Be(h3O)4]SO4 — сульфат тетрааквабериллия(II)).
Для некоторых классов солей существуют групповые названия, например, квасцы — для двойных сульфатов общего вида MIMIII(SO4)2·12H2O, где MI — катионы натрия, калия, рубидия, цезия, таллия или аммония, а MIII — катионы алюминия, галлия, индия, таллия, титана, ванадия, хрома, марганца, железа, кобальта, родия или иридия.
Для более сложных или редких солей применяются систематические названия, образующиеся по правилам номенклатуры комплексных соединений. Согласно данной номенклатуре, соль подразделяется на внешнюю и внутреннюю сферы (катион и анион): последняя состоит из центрального атома и лигандов — атомов, связанных с центральным атомом. Название соли формируют следующим образом. Вначале записывают название внутренней сферы (аниона) в именительном падеже, состоящее из названий лигандов (приставок) и центрального элемента (корня) с суффиксом -ат и указанием его степени окисления. Затем к названию добавляют названия атомов внешней сферы (катионов) в родительном падеже.
LiBO3 — триоксоборат(III) лития
Na2Cr2O7 — гептаоксодихромат(VI) натрия
NaHSO4 — тетраоксосульфат(VI) водорода-натрия
Для образования названий солей бескислородных кислот пользуются общими правилами составления названий бинарных соединений: применяются либо универсальные номенклатурные правила с указанием числовых приставок, либо способ Штока с указанием степени окисления, причём второй способ является предпочтительным.
Названия галогенидов составляются из названия галогена с суффиксом -ид и катиона (NaBr — бромид натрия, SF6 — фторид серы(VI), или гексафторид серы, Nb6I11 — ундекаиодид гексаниобия). Кроме того, существует класс псевдогалогенидов — солей, которые содержат анионы с галогенидоподобными свойствами. Их названия образуются подобным образом (Fe(CN)2 — цианид железа(II), AgNCS — тиоцианат серебра(I)).
Названия галогенидов составляются из названия галогена с суффиксом -ид и катиона (NaBr — бромид натрия, SF6 — фторид серы(VI), или гексафторид серы, Nb6I11 — ундекаиодид гексаниобия). Кроме того, существует класс псевдогалогенидов — солей, которые содержат анионы с галогенидоподобными свойствами. Их названия образуются подобным образом (Fe(CN)2 — цианид железа(II), AgNCS — тиоцианат серебра(I)).
Халькогениды, содержащие в качестве аниона серу, селен и теллур, называют сульфидами, селенидами и теллуридами. Сероводород и селеноводород могут образовывать кислые соли, которые называют гидросульфидами и гидроселенидами соответственно (ZnS — сульфид цинка, SiS2 — дисульфид кремния, NaHS — гидросульфид натрия). Двойные сульфиды называют, указывая два катиона через дефис: (FeCu)S2 — дисульфид железа-меди.
Практически все соли являются сильными электролитами, т.е. в водных растворах полностью диссоциируют на ионы. Характер диссоциации зависит от типа соли.
Нормальные (средние) соли:
NaCl → Na+ + Сl— хлорид натрия
Al2(SO4)3 → 2Al3++ 3SO42- сульфат алюминия
NH4NO3 → NH4+ + NO3— нитрат аммония
Кислые соли:
KHCO3 → К+ + НСО3— гидрокарбонат калия
Ca(H2PO4)2 → Са2+ + 2Н2РO42- дигидрофосфат кальция
NH4HS → NH4+ + HS— гидросульфид аммония
Основные соли:
CuOHBr → CuOH+ + Br—гидроксобромид меди (II) (бромид гидроксомеди (II))
Fe(OH)2NO3 → Fe(OH)2+ + NO3— дигмдроксонитрат железа (III)
(Ni(OH))2SO4 → 2NiOH+ + SO42- гидроксосульфат никеля (II)
Двойные соли:
K2SO4 • Al2(SO4)3 → 2K+ + 2Al3+ + 4SO42- сульфат калия-алюминия
или:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соли:
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl— хлорид диаммин серебра (I)
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3- гексацианоферрат (III) калия
Большинство солей являются твердыми веществами с ионной кристаллической решеткой. Соли s- и р-металпов, как правило, бесцветны. Многие соли d- элементов окрашены.
Растворимость солей в воде варьируется в широких пределах. (См. таблицу растворимости.) Хорошо растворимыми являются практически все соли натрия, калия, аммония; соли азотной кислоты (нитраты), соляной кислоты (хлориды), уксусной кислоты (ацетаты). Плохо растворимы в воде многие фосфаты (соли Н3РO4), карбонаты (соли Н2СO3), сульфиды (соли H2S).
Характерными для солей являются следующие типы реакций:
1) реакции ионного обмена, в ходе которых катионы или анионы солей образуют малодиссоциирующие или малорастворимые вещества при связывании с ионами реагентов;
2) окислительно-восстановительные реакции, в ходе которых катионы или (и) анионы солей выступают либо в роли окислителей, либо в роли восстановителей;
3) реакции разложения солей, происходящие без переноса электронов.
Реакции данного типа возможны, если хотя бы один из продуктов реакции представляет собой:
а) слабый электролит;
б) осадок;
в) газообразное вещество.
— Взаимодействие с растворами щелочей (возможны для растворимых солей)
(1) CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Сu2+ + 2OH— = Cu(OH)2
(2) NH4NO3 + KOH = KNO3 + NH3↑ + H2O
NH4+ +OH— = NH3↑ + H2O
(3) Na2CO3 + Ba(OH)2 = 2NaOH + BaCO3↓
CO32- + Ba2+ = BaCO3↓
(4) KHCO3 + KOH = K2CO3 + H2O
HCO3— + OH— = CO32- + H2O
(5) Fe(OH)2Cl + NaOH = Fe(OH)3↓ + NaCl
Fe(OH)2+ + OH— = Fe(OH)3↓
— Взаимодействие с кислотами
(6) Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
(7) CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
(8) NaHCO3 + HCl = NaCl + CO2↑ + H2O
HCO3— + H+ = CO2↑ + H2O
(9) Na2S + H2S = 2NaHS
S2- + H2S = 2HS—
(10) MgOHCl + HCl = MgCl2 + H2O
MgOH+ + Н+ = Mg2+ + H2O
(11) AgNO3 + HCl = AgCl↓ + HNO3
Ag+ + Сl— = AgCl↓
(12) BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Ba2+ + SO42- = BaSO4↓
(13) Pb(NO3)2 + H2S = PbS↓ + 2HNO3
Pb2+ + H2S = PbS↓ + 2H+
— Взаимодействие солей друг с другом (возможны для растворимых солей)
(14) AgNO3 + NaCl = AgCl↓ + NaNO3
Ag+ + Сl— = AgCl↓
(15) Ba(NO3)2 + K2SO4 = BaSO4↓ + 2K(NO3
Ba2+ + SO42- = BaSO4↓
(16) CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Ca2+ + CO32- = CaCO3↓
(17) Zn(NO3)2 + K2S = ZnS↓ + 2KNO3
Zn2+ + S2- = ZnS↓
(18) NH4HCO3 + NaCl = NaHCO3↓ + NH4CI
HCO3— + Na+ = NaHCO3↓
(19) 2К3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2 + 3K2SO4,
2[Fe(CN)6]3- + 3Fe2+ = Fe3[Fe(CN)6]2
(20) FeCl3 + 3NH4SCN ↔ Fe(SCN)3 + 3NH4Cl
Fe3+ + 3SCN— ↔ Fe(SCN)3 (слабый электролит)
Многие обменные реакции являются качественными реакциями на катионы и анионы:
реакция (2) — на катион Nh5+; реакции (6, 7, 8) — на анион СO32- ; реакции (11,14) — на катион Аg+ и анион Сl—; реакции (12,15) — на катион Ва2+ и анион SO42- ; реакция (13) — на анион S2-; реакция (19) — на катион Fe2+; реакция (20) — на катион Fe3+.
Реакции, в которых катион соли играет роль окислителя
а) взаимодействие растворов солей с металлами (более активные металлы восстанавливают менее активные металлы из растворов их солей):
Cu+2SO4 + Fe = Сu0 + FeSO4
Hg+2(NO3)2 + Сu = Hg0 + Cu(NO3)2
б) взаимодействие растворов солей с другими восстановителями:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + l2 + 2KCl
8AgNO3 + PH3 + 4H2O = 8Ag + h4PO4 + 8 HNO3
— Реакции, в которых катион соли играет роль восстановителя
2Fe+2Cl2 + Cl2 = 2Fe+3Cl3
4Cr+2Cl2 + 4HCl + O2 = 4Cr+3Cl3 + 2H2O
10Fe+2SO4 + 2KMnO4 + 8H2SO4 = 5Fe+32(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
2Cr+3Cl3 + 3NaBiO3 + 7NaOH + H2 = 2Na2CrO4 + 3Bi(OH)3 + 6NaCl
— Реакции, в которых анион соли играет роль окислителя
2KMn+7O4 + 16HCl = 2Mn+2Cl2 + 5Cl2↑ + 2KCl + 8H2O
K2Cr+72O7 + 3H2O2 + 4H2SO4 = Cr+32(SO4)3 + 3O2 + K2SO4 + 7H2O
2KMn+7O4 + 3C2H4 + 4H2O = 2Mn+4O2↓ + 3C2H4(OH)2 + 2KOH
2KN+5O3 + 3C + S = N02↑ + 3CO2↑ + K2S
2KN+5O3 + 3C + S — черный порох
— Реакции, в которых анион соли играет роль восстановителя
2KI-1 + Cl2 = I02 + 2KCl
3PbS-2+ 8HNO3 = 3PbS+6O4 + 8NO + 4Н2O
Na2S+4O3 + I2 + Н2O = Na2S+6O4 + 2HI
2КСr+3O2 + ЗPbO2 + 2КОН = 2K2Cr+6O4 + ЗРbО + Н2O
5KN+3O2 + 2КМnO4 + 3H2SO4 = 5KN+5O3 + 2MnSO4 + K2SO4 + 3H2O
— Реакции, в которых и катион и анион соли играют роль восстановителей
4Fe+2S-12 + 11O2 = 2Fe+32O3 + 8S+4O2
10Fe+2S-1 + 36HNO3(разб.) = 10Fe+3(NO3)3 + 10S0/sup> + 3N2 + 18H2O
— Реакции внутримолекулярного окисления-восстановления
N-3H4N+3O2 = N02↑ + 2H2O
N-3H4N+5O3 = N+12O↑+ 2H2O
2KCl+5O-23 = 2KCl-1 + 3O02↑
2KN+5O-23 = 2KN+3O2 + O02↑
2Cu(N+5O-23)2 = 2CuO + 4N+4O2↑ + O02↑
Ag+1N+5O-23 = 2Ag0 + 2N+4O2↑ + O02↑
2KMn+7O-24 = K2MnO4 + Mn+4O2 + O02↑
Если анион соли не проявляет окислительных свойств, то такие соли, как правило, разлагаются без изменения степеней окисления:
СаСО3 = CaO + CO2↑
Са(HCO3)2 = СаСО3↓ + H2O + CO2↑
Mg(HCO3)2 = Mg(ОH)2↓ + 2CO2↑
(CuOH)2CO3 = 2CuO + CO2↑ + H2O
ZnSO4 = ZnO + SO3↑
(NH4)2SO4 = NH3↑ + NH4HSO4
NH4Cl = NH3↑ + HCl↑
Ниже представлены способы получения солей на примере растворимой соли бескислородной кислоты (хлорид натрия) и нерастворимой соли кислородсодержащей кислоты (сульфат бария).
1) основание + кислота: NaOH + HCl = NaCl + H2O
2) основной оксид + кислота: Na2O + 2HCl = 2NaCl + H2O
3) металл + кислота: 2Na + 2HCl = 2NaCl + H2↑
4) щелочь + соль: 2NaOH + CuCl2 = 2NaCl + Cu(OH2)↓
5) соль + кислота: Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
6) соль + соль: Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
7) металл + неметалл: 2Na + Cl2 = 2NaCl
8) гидрид + кислота: NaH + HCд = NaCд + H2↑
1) основание + кислота: Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
2) основной оксид + кислота: BaO + H2SO4 = BaSO4↓ + H2O
3) металл + кислота: Ba + H2SO4(разб.) = BaSO4↓ + H2↑
4) щелочь + соль: Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH
5) соль + кислота: BaCl2 + H2SO4 = BaSO4↓ + 2HCl
6) соль + соль: Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
7) основной оксид + кислотный оксид: BaO + SO3 = BaSO4↓
8) щелочь + кислотный оксид: Ba(OH)2 + SO3 = BaSO4↓ + H2O
Первые 6 способов получения являются идентичными для обеих солей.
examchemistry.com
Соли: классификация и химические свойства
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
 Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Кислые соли
Если в кислоте один или все атомы водорода замещены другим катионом, то такое химическое вещество называют соль. Металл или аммонийная группа в такой молекуле всегда имеют положительную степень окисления и называются катионом. Кислотный остаток называется анионом. Все соли, образованные металлами, которые относятся к группе Ia периодической таблицы Менделеева, являются растворимыми. Что касается солей, образованных металлами группы IIa, то их растворимость меняется.
Бывают средние, если весь водород в молекуле многоосновной кислоты замещен другим катионом, а также кислые соли, если наряду с катионами металла или аммония присутствует положительно заряженный водород. В качестве примера средних солей можно привести:
— сернокислый магний MgSO4;
— сернокислый алюминий Al2(SO4)3;
— фосфорнокислый аммоний (Nh5)3PO4;
— углекислый натрий Na2CO3.
Диссоциация средних солей происходит на положительные катионы металла и отрицательные анионы кислотного остатка. Наименование средней соли происходит от названия кислоты и катиона ее образующих.
Кислые соли образуются в результате неполного замещения водорода на металл или аммонийную группу. Таким образом, они состоят из металла, водорода и кислотного остатка. Образование их возможно только для многоосновных кислот. Примеры таких соединений:
— гидрокарбонат натрия NaHCO3;
— дигидрофосфат натрия Nah3PO4;
— гидрофосфат натрия Na2HPO4;
— гидросульфат калия KHSO4.
В названии их присутствуют приставки «гидро-» (при наличии одного незамещенного катиона водорода) или «дигидро-» (при наличии двух незамещенных катионов водорода).
В водных растворах кислые соли диссоциируют на отрицательные анионы в виде кислотных остатков, а также на два вида положительных катионов (ионы металла и водорода): NaHSO4 ↔ Na+ + H+ + SO4ˉ ˉ. При гидролизе кислых солей, образованных сильными кислотами, среда водного раствора имеет рН менее 7, отсюда и пошло название этих солей. При гидролизе кислых солей, полученных из слабых кислот (например, гидрокарбонаты), раствор будет нейтральным или даже щелочным, то есть рН не менее 7.
Если средние соли могут получаться в результате взаимодействия металла с кислотой и другими способами, то получение кислых солей основано на взаимодействии с избытком:
многоосновной кислоты со средней солью. Так получают гидросульфат натрия: h3SO4 + Na2SO4 → 2NaHSO4, водорастворимый гидрофосфат аммония (Nh5)2HPO4: h4PO4 + 2Nh4 → (Nh5)2HPO4 или гидрокарбонат кальция: CO2 + CaCO3 + h3O → Ca(HCO3)2;
многоосновной кислоты со щелочью. Например, в основе получения дигидрофосфата бария лежит уравнение реакции: 2h4PO4 + Ba(OH)2 → Ba(h3PO4)2 + 2h3O. Воздействуя на кислые соли щелочью, так как они являются продуктами неполной нейтрализации, можно получить снова среднюю соль;
кислотного оксида со щелочью, так получают гидрокарбонат кальция: 2CO2 + Ca(OH)2 → Ca(HCO3)2.
Известно, что гидрокарбонаты не существуют у элементов, стоящих в таблице Менделеева правее группы IIa, а твердые гидрокарбонаты получены только для группы элементов Ia.
Соли широко применяют в различных отраслях, но каких-то общих направлений их использования нет, так как все индивидуально. Применение данного вида солей зависит от свойств химического соединения и определяется экономической целесообразностью.
Так, например, гидрофосфат аммония (Nh5)2HPO4 используется в качестве сложного фосфорно-аммонийного удобрения в сельском хозяйстве. Кроме того, это соединение применяют в борьбе с пожарами: для защиты от огня им обрабатывают различные сооружения. Также (Nh5)2HPO4 используют в качестве добавки при производстве некоторых сортов сигарет.
Натрия гидросульфит NaHSO3 применяют для отбеливания различных материалов и в фотографии.
Кальция гидросульфит Ca(HSO3)2 является ценным сырьем для производства целлюлозы из древесины.
Бисульфиты, что являются кислыми солями кислоты сернистой h3SO3, входят в состав препарата эпинефрин, а также используются в молекулярной биологии.
Гидросульфаты калия KHSO4 и натрия NaHSO4 применяются в качестве флюса в цветной металлургии.
Натрия гидрокарбонат NaHCO3 — вещество, наиболее известное из кислых солей. Его выпускают в г. Стерлитамак (на предприятии «Сода») по техническим условиям, изложенным в ГОСТе 2156-76. Натрия гидрокарбонат находит применение в пищевой, химической, фармацевтической промышленности, в медицине и в быту.
fb.ru
Кислые и средние соли | Дистанционные уроки
09-Дек-2014 | комментария 2 | Лолита Окольнова
Задания на соли встречаются в ЕГЭ не только в части А, но и в части С.
Давайте разберем основные примеры задач на
1. Определите, какое вещество, и в каком количестве образуется, если прореагировали (н.у.):
а) 0,2 моль Н2S и 0,2 моль КОН;
б) 2,24 л SO2 и 4 г NaOH;
в) 4,48 л СО2 и 7,4 г Са(ОН)2;
г) 4,48 л аммиака и 19,6 г серной кислоты;
д) 0,3 моль гидроксида натрия и 0,3 моль фосфорной кислоты;
е) 4,48 л аммиака и 100 г 9,8 %-ного раствора фосфорной кислоты;
ж) 14,2 г Р2О5 и 0,4 моль КОН;
з) 5,6 г оксида кальция и 0,2 моль серной кислоты.
Итак, как образуются кислые и средние соли?
Обычно это взаимодействие основного оксида или основания с кислотой или кислотным оксидом.
Какая соль образуется — зависит от соотношения реагентов
LiOH + h3SO3 = LiHSO3 + h3O (образовалась кислая соль)
(1 моль щелочи : 1 моль кислоты)
2LiOH + h3SO4 = Li2SO4 + 2h3O (образовалась средняя соль)
(2 моль щелочи : 1 моль кислоты)
Вывод:
- если в избытке основание, то образуется средняя соль;
- при эквимолярном соотношении — кислая соль
Обратите внимание — сравнивать нужно именно количества веществ — моли!
В нашем задании:
а) соотношение сероводорода и гидроксида калия 1:1, значит, получится кислая соль KHS;
б) 0,1 моль SO2 и 0,1 моль NaOH (формулы: n=m\Mr и т=V\V м). Соль — NaHSO3
в) 0,2 моль CO2 и 0,1 моль Ca(OH)2:
CO2 + Ca(OH)2 = CaCO3 + h3O
Т.к. реагируют двухвалентный кальций и кислотный остаток имеет заряд -2, то образуется карбонат кальция — средняя соль
г) 0,2 моль Nh4 и 0.2 моль h3SO4. Соотношение 1:1, значит, получится соль — Nh5HSO4 — гидросульфат аммония;
д) NaOH и h4PO4. Соотношение 1:1. Получится Nah3PO4 — дигидрофосфат натрия — кислая соль;
e) 0.2 моль Nh4 и 0.1 моль (см. формулу массовой доли ω). Аммиак в избытке, значит, получится средняя соль — (Nh5)2SO4
ж) 0.1 моль P2O5 и 0,4 моль КОН
3KOH + h4PO4 = K3PO4 + 3h3O
Гидроксид калия дан в значительном избытке, значит, получится фософат калия — средняя соль
з) 0.1 моль CaO и 0.2 моль h3SO4
CaO + 2h3SO4 = Ca(НSO4)2 + h3O
2. Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
а) 1,12 л углекислого газа;
б) 2,24 л сернистого газа;
в) 3,36 л сероводорода;
г) 4,48 л углекислого газа;
д) 20 г SO3.
n(NaOH)=m(раствора)*ω \Mr = 200 г*0.04 \40 г\моль = 0.2 моль
Выпишем все уравнения:
CO2 + 2NaOH = Na2CO3 + h3O
0,05 0.2 —> 0,05 моль
SO2 + 2NaOH = Na2SO3 + h3O
0.1 0.2 —> 0.1 моль
h3S + NaOH = NHS + h3O
0,15 0.2 моль —> 0,15 моль
CO2 + NaOH = NaHCO3
0.2 0.2 —> 0.2 моль
SO3 + NaOH = NaHSO4
0.25 0.2 —> 0.2 моль
Количества вещества продукта реакции находим традиционно по недостатку.
Еще на эту тему:
Обсуждение: «Кислые и средние соли»
(Правила комментирования)distant-lessons.ru
NaCl, Na2CO3,CaCO3???? — 22 ответа
В разделе Школы на вопрос Практические значение солей!Помогите! Практические значение солей : NaCl, Na2CO3,CaCO3???? заданный автором Ache лучший ответ это Многие соли имеют большое практическое значение. Например, хлорид натрия NaCl или поваренная соль, каменная соль, пищевая соль – ценнейшее химическое сырьё. Его используют при получении соды, хлороводорода. При электролизе водного раствора хлорида натрия получают гидроксид натрия, хлор и, попутно, водород, а при электролизе расплава хлорида натрия получают металлический натрий и хлор. Хлорид натрия применяют при первичной обработке кож, при подготовке тканей к крашению, как консервант в пищевой промышленности, как вкусовую добавку в пищу. В дорожном хозяйстве для предотвращения обледенения асфальта. Всего хлорид натрия используют более чем в 1500 производствах различных веществ и материалов.
Карбонат натрия Na2CO3 или кальцинированная сода, сода, стиральная сода. Его применяют при производстве стекла, мыла и моющих средств, при варке целлюлозы, как нейтрализующее вещество при обработке кислых растворов.
Карбонат калия, K2CO3 поташ применяют при варке оптического стекла, жидкого мыла, минеральных красок, получении многих соединений калия.
Карбонат кальция CaCO3 – распространённое в природе вещество: минерал кальцит, горная порода известняк и его разновидности – мел, мрамор, туф. Применяется для производства негашёной извести, цемента, стекла, минеральных удобрений, как наполнитель при изготовлении «мелованной» бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осаждённого порошка – для изготовления школьных мелков, зубных порошков и паст, в побелке помещений.
Привет! Вот подборка тем с ответами на Ваш вопрос: Практические значение солей!Помогите! Практические значение солей : NaCl, Na2CO3,CaCO3????
Ответ от хлебосол[гуру]
1-соль которое мы употреб2—это сода тоже в бытовухе польз. 3—-медицине и в быту.
Ответ от Вровень[новичек]
1- Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий
2- Карбона́т на́трия — химическое соединение Na2CO3, натриевая соль угольной кислоты
3- Карбонат кальция (мел, углекислый кальций, кальциевая селитра) — неорганическое химическое соединение соли угольной кислоты и кальция. Химическая формула — . В природе встречается в виде минералов — кальцита, арагонита и ватерита
(всё)
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Карбонат натрия на Википедии
Посмотрите статью на википедии про Карбонат натрия
Ответить на вопрос:
22oa.ru
