Угольная кислота — это… Что такое Угольная кислота?
У́гольная кислота́ — слабая двухосновная кислота с химической формулой . В чистом виде неустойчива[2]. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- , константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- , константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- , константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- , где L = 0,034 моль/л — растворимость CO 2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- (конц.)
- (разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
См. также
Примечания
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
dic.academic.ru
Угольная кислота: общие сведения
Угольная кислота (формула Н2СО3) – слабая двухосновная кислота. При нагревании растворов разлагается на диоксид углерода и воду. Эта кислота имеет огромное значение не только для животных, но и для растений. В организме человека Н2СО3, а также ее соли входят в состав буферных систем крови. С помощью буферных систем поддерживается кислотно-щелочной баланс в организме, что необходимо для нормальной жизнедеятельности. Диссоциация кислот в водной среде приводит к образованию анионов и катионов. Концентрация ионов имеет огромное значение для течения многих биохимических процессов в организме животных и растений. При некоторых заболеваниях активная реакция крови сдвигается в кислую (при язве двенадцатиперстной кишки и желудка) или щелочную (при сепсисе, пневмониях) стороны. При ацидозе увеличивается концентрация ионов водорода. Такие изменения в свою очередь провоцируют развитие коматозного состояния, что в конечном результате приводит к гибели самого животного. При алкалозе в крови возрастает концентрация катионов, что приводит столбнячному состоянию и гибели животного.
Угольная кислота образуется в процессе взаимодействия СО2 с Н2О. Большинство исследователей верит в то, что неимоверное развитие растительности в первобытном мире связано со значительной концентрацией угольной кислоты в атмосфере. Наиболее интенсивный рост отмечался у тех растений, которые выращивались с повышенной (5-10%) концентрацией угольной кислоты в атмосфере.
Следует отметить, что растения состоят наполовину из углерода. Угольная кислота питает растение, при этом способствует растворимости минеральных компонентов почвы. Поэтому в данном случае это необходимый компонент почвы. Поскольку угольна кислота ингибирует нитрифицирующие микроорганизмы, почва должна содержать минимальную ее концентрацию.
Поэтому для получения высоких урожаев необходимо сбалансировать концентрацию указанной кислоты. Ученые в своих опытах установили, что при ежедневном введении в почву угольной кислоты (400 см3) и воздуха (1200 см3) она производит вдвое больше растений по сравнению с той, которая не содержала в себе эти соединения.
Деревенская почва характеризуется обилием воздуха, поэтому в ней процессы нитрификации и гниения проходят очень интенсивно. Установлено, что листья в лесу полностью разлагаются в течение года. Такая энергичная нитрификация происходит и в степях. В процессе разложения органических веществ выделяется значительное количество угольной кислоты. Последняя в полтора раза тяжелее воздуха, поэтому угольная кислота в почву проникает глубже, чем воздух, и там оказывает благотворное влияние на минеральные компоненты.
При глубокой вспашке органические остатки попадают в более глубокие слои почвы, где отсутствует О2, но наблюдается изобилие угольной кислоты. В данном случае нитрификация происходит чрезвычайно медленно. В этих условиях не разлагаются минеральные компоненты и не образуются азотистые соединения. Огромные куски навоза годами лежат в земле, не перегнивая. Землевладельцы вынуждены покупать синтетические удобрения (каинит, суперфосфат, чилийскую селитру). Инновационные технологии обработки почвы позволяют повысить урожайность растений. Это связано в первую очередь с тем, что в процессе обработки земли в верхних слоях почвы остаются органические остатки. Создаются оптимальные условия для развития и размножения нитрифицирующих микроорганизмов.
Фосфор, который находится в почве, не всегда усваивается растениями. Трехосновной фосфорнокислый кальций – труднорастворимое соединение. Поэтому почва, богатая фосфорнокислыми соединениями, превращается в неплодородную.
fb.ru
Угольная кислота и карбонаты | khimie.ru
Водный раствор диоксида углерода обладает свойствами слабой кислоты: он окрашивает (очень слабо) лакмус в красный цвет. На основании этого свойства можно заключить, что в растворе диоксид углерода находится частично в форме угольной кислоты (Н2СО3), которая в свою очередь частично диссоциирует на ионы:
СО2 + Н2О ↔ Н2СО3,
Н2СО3 ↔ 2Н
Угольная кислота может реагировать с одним или двумя эквивалентами сильного основания, образуя первичные, или кислые карбонаты (гидрокарбонаты) и вторичные, или нейтральные (нормальные) карбонаты:
H2СО3 + МOН → MHСО3 + Н2О;
Н2СО3 + 2МОH → М2СО3 + 2Н2О.
Угольная кислота, как двухосновная кислота, диссоциирует в две стадии:
H2СО3 ↔ Н+ + HСО3—
НСО3— ↔ Н+ + СО32-.
Соли, угольной кислоты, карбонаты; в водном растворе гидролитически расщеплены. В их растворах устанавливаются равновесия:
M2CO3 + H2O ↔ MOH + MHCO3
MHCO3 + H2O ↔ MOH + H2CO3
Поэтому карбонаты обнаруживают щелочную реакцию, причем это справедливо не только для вторичных или «нейтральных», но и для первичных или «кислых» карбонатов (гидрокарбонатов). Только по отношению к таким индикаторам, для которых, как для фенолфталеина, цветовой переход щелочь → кислота протекает тогда, когда раствор является еще слабо основным, первичные карбонаты (гидрокарбонаты) реагируют на холоду (0 °С и немного выше) как «кислоты».
Гидролитическое расщепление (вторичного) карбоната натрия составляет, по данньм Аусрбаха, при 18 °С в 0,1 н. растворе 3,5 % в 0,01 н. − 12,4 %. В 0,1 н. растворе карбоната натрия концентрация гидроксид-ионов составляет, следовательно, при 18 °С 3,5-10-3 моль/л. В растворе гидрокарбоната натрия он составляет при той же температуре 1,5∙10-6 моль/л.
Известны первичные карбонаты (гидрокарбонаты) щелочных, щелочноземельных и некоторых других двухвалентных металлов. Все они легко растворимы в воде. Исключением является гпдрокарбонат натрия, на малой растворимости которого основан метод Сольве получения соды. При кипячении растворов гидрокарбонатов происходит превращение их в нормальные карбонаты с отщеплением СО
Вторичные или нормальные карбонаты, образуются главным образом одно- и двухвалентными металлами. Нормальные карбонаты, за исключением карбонатов щелочных металлов, трудно растворимы в воде.
Помимо карбонатов щелочных металлов, легко растворим также карбонат аммония. Достаточно легко растворим и карбонат одновалентого таллия.
Все карбонаты разлагаются нелетучими кислотами. Очень слабые кислоты (такие, как борная и кремневая, и соответственно их ангидриды) разлагают карбонаты только при прокаливании.
Карбонаты щелочных металлов можно расплавить без разложения. Прочие карбонаты разлагаются при нагревании, отщепляя СО2: М2СО3 = М2О + СО2.
Этому разложению способствует удаление образующейся СО2
(понижение давления) или устранение оксида М2О из смеси. Последнее можно достигнуть добавлением термостойкой кислоты или ее ангидрида, например SiO2, которая образует соль с основным оксидом. На этом свойстве основано разложение карбонатов при прокаливании их с ангидридами очень слабых, однако термостойких кислот, таких, как борная и кремневая.Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
Угольная кислота — WiKi
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре -30 градусов Цельсия, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 году австрийскими химиками
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- CO2⋅h3O(p)⇄h3CO3(p){\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows H_{2}CO_{3(p)}}}} , константа равновесия при 25 °C Kp=[h3CO3][CO2⋅h3O]=1,70⋅10−3{\displaystyle K_{p}={\frac {\mathsf {[H_{2}CO_{3}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=1,70\cdot 10^{-3}}
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
- CO2⋅h3O(p)⇄CO2↑+ h3O{\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows CO_{2}\uparrow +\ H_{2}O}}}
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- h3CO3+ h3O⇄HCO3−+ h4O+{\displaystyle {\mathsf {H_{2}CO_{3}+\ H_{2}O\rightleftarrows HCO_{3}^{-}+\ H_{3}O^{+}}}} , константа кислотности при 25 °C Ka1=[HCO3−]⋅[h4O+][h3CO3]=2,5⋅10−4{\displaystyle K_{a1}={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[H_{2}CO_{3}]}}}=2,5\cdot 10^{-4}}
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
- Ka′=[HCO3−]⋅[h4O+][CO2⋅h3O]=4,27⋅10−7{\displaystyle K_{a}’={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=4,27\cdot 10^{-7}}
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- HCO3−+ h3O⇄CO32−+ h4O+{\displaystyle {\mathsf {HCO_{3}^{-}+\ H_{2}O\rightleftarrows CO_{3}^{2-}+\ H_{3}O^{+}}}} , константа кислотности при 25 °C Ka2=[CO32−]⋅[h4O+][HCO3−]=4,68⋅10−11{\displaystyle K_{a2}={\frac {\mathsf {[CO_{3}^{2-}]\cdot [H_{3}O^{+}]}}{\mathsf {[HCO_{3}^{-}]}}}=4,68\cdot 10^{-11}}
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
- CO2↑⇄h3OCO2⋅h3O⇄h3CO3⇄−H+HCO3−⇄−H+CO32−(∗){\displaystyle {\mathsf {CO_{2}\uparrow {\stackrel {H_{2}O}{\rightleftarrows }}CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}{\stackrel {-H^{+}}{\rightleftarrows }}HCO_{3}^{-}{\stackrel {-H^{+}}{\rightleftarrows }}CO_{3}^{2-}(*)}}}
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- pH≈−12lg(Ka′⋅L)=3,9{\displaystyle {\mathsf {pH}}\approx -{\frac {1}{2}}\lg(K_{a}’\cdot L)=3,9} , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
- h3CO3⟶h3O+ CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+\ CO_{2}\uparrow }}}
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- h3CO3+2 NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+2\ NaOH}}} (конц.)⟶Na2CO3+2 h3O{\displaystyle {\mathsf {\longrightarrow Na_{2}CO_{3}+2\ H_{2}O}}}
- h3CO3+ NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+\ NaOH}}} (разб.)⟶NaHCO3+ h3O{\displaystyle {\mathsf {\longrightarrow NaHCO_{3}+\ H_{2}O}}}
- h3CO3+ Ca(OH)2⟶CaCO3↓+2 h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ Ca(OH)_{2}\longrightarrow CaCO_{3}\downarrow +2\ H_{2}O}}}
- h3CO3+ Nh4⋅h3O⟶Nh5HCO3+ h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ NH_{3}\cdot H_{2}O\longrightarrow NH_{4}HCO_{3}+\ H_{2}O}}}
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
- h3CO3+ Na2CO3⟶2 NaHCO3{\displaystyle {\mathsf {H_{2}CO_{3}+\ Na_{2}CO_{3}\longrightarrow 2\ NaHCO_{3}}}}
- h3CO3+ CaCO3⟶Ca(HCO3)2{\displaystyle {\mathsf {H_{2}CO_{3}+\ CaCO_{3}\longrightarrow Ca(HCO_{3})_{2}}}}
Угольная кислота образуется при растворении в воде диоксида углерода:
- CO2+h3O⇄CO2⋅h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}}}}
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
- Na2CO3+2 HCl⟶2 NaCl+ h3CO3{\displaystyle {\mathsf {Na_{2}CO_{3}+2\ HCl\longrightarrow 2\ NaCl+\ H_{2}CO_{3}}}}
- h3CO3⟶h3O+ CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+\ CO_{2}\uparrow }}}
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора. Также применяется для производства хладагента, солнечных генераторов и морозильников.
ru-wiki.org
что нам о ней известно? :: SYL.ru
Чем больше человек узнает об окружающем его мире, тем больше осознает ограниченность и несовершенство своих знаний. Возьмем, к примеру, газированную воду. Как известно, данный напиток отличается от других тем, что в нем содержится в небольших дозах угольная кислота, которая сразу же начинает распадаться, как только мы открутим пробку на бутылке.  Поэтому у нас не вызывает сомнений утверждение в учебнике химии о том, что данное вещество является крайне неустойчивым. В газовой фазе оно очень быстро превращается в смесь обычной воды и привычного углекислого газа. Однако, как показали последние исследования, с этим вполне можно поспорить. Но вначале давайте вспомним, что представляет собой данное вещество.
Поэтому у нас не вызывает сомнений утверждение в учебнике химии о том, что данное вещество является крайне неустойчивым. В газовой фазе оно очень быстро превращается в смесь обычной воды и привычного углекислого газа. Однако, как показали последние исследования, с этим вполне можно поспорить. Но вначале давайте вспомним, что представляет собой данное вещество.
Что такое угольная кислота?
Формула этого химического соединения выглядит довольно просто: Н2СО3. Наличие двух атомов водорода указывает на то, что эта кислота является двухосновной, а ее неустойчивость говорит о ее слабости. Как известно, в воде происходит диссоциация кислот, и рассматриваемое соединение не подпадает под исключение. Впрочем, здесь есть одна особенность: из-за наличия двух оснований данный процесс происходит в два этапа:
H2СО3 ↔ Н+ + НСО3—,
НСО3— ↔ Н+ + СО32-.
При взаимодействии с сильным основанием угольная кислота образовывает нормальные или кислые карбонаты. Последние отличаются тем, что у них замещается не два, а всего лишь один атом водорода. Ярким примером нормального карбоната является стиральная сода (Na2CO3), а роль образца гидрокарбоната может играть пищевая сода (NaHCO3).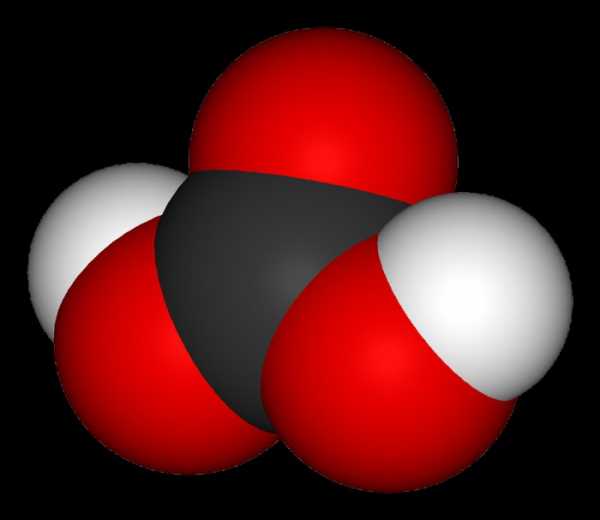
Что удалось обнаружить ученым?
При протонировании безводного бикарбоната калия (КНСО3) при температуре -110oC водород выбивает атом К. В результате получается очень чистая угольная кислота. Позже был найден еще более легкий способ – нагрев в вакууме NH4HCO3. В результате такого разложения бикарбоната аммония выделяется аммоний и формируется безводная угольная кислота. Последняя проявляет удивительную стабильность при сублимации в вакууме. Когда ученые начали исследовать данный парадокс, оказалось, что причина кроется в значении энергетического барьера. Для безводного соединения Н2СО3 он составляет 44 ккал/моль, а когда есть вода, его величина оказывается почти в два раза ниже – 24 ккал/моль. Так что при соответствующих условиях угольная кислота вполне может пребывать в свободном виде. Впрочем, данное открытие интересно не только с точки зрения теории химии. Его практическая ценность в том, что оно позволило по-новому изучить процесс дыхания. Теперь ученые считают, что формирование в живом организме угольной кислоты ускоряется при помощи особого фермента, и как раз это и позволяет быстро удалять углекислый газ из клеток сначала в кровь, а затем в легкие.  Данным открытием также не преминули воспользоваться астрономы: свободное состояние углекислоты позволило им провести ее спектральный анализ, и теперь это соединение можно будет идентифицировать в атмосфере окружающих нас планет. Все это наводит на мысль о том, что в мире еще полно различных тайн и секретов. Похоже, современные учебники не раз придется переписывать, уточняя старые и открывая новые знания.
Данным открытием также не преминули воспользоваться астрономы: свободное состояние углекислоты позволило им провести ее спектральный анализ, и теперь это соединение можно будет идентифицировать в атмосфере окружающих нас планет. Все это наводит на мысль о том, что в мире еще полно различных тайн и секретов. Похоже, современные учебники не раз придется переписывать, уточняя старые и открывая новые знания.
www.syl.ru
что такое карбонаты,гидрокарбонаты и силикаты?
Карбонаты и гидрокарбонаты — это соли двухосновной угольной кислоты. Поскольку эта кислота содержит 2 атома водорода (Н2СО3), гидрокарбонаты образуются при замещении одного атома водорода: КНСО3, а карбонаты — при замещении обоих атомов: К2СО3 Силикаты — это соли кремниевой кислоты K2SiO3
это анионы. гидрокарбонат это HCO3
это соли образованные углеродными кислотами
Карбонаты- соли угольной кислоты, гидрокарбонаты — соли угольнойц кислоты, где замещен только один атом водорода. силикаты- соли кремнекислоты -CO3 -HCO3 -SiO4
корбонаты это вещества имеющие в своем составе группу СО об остальном в следуещей серии программы «о химии».
Карбонаты — соли угольной кислоты, где оба атома водорода (Н2СО3 — угольная кислота двуосновна, является неорганическим соединением) замещены радикалом (напримаер ионами натрия Na+, тогда соль будет выглядеть как Na2CO3). Гидрокарбонаты — соли угольной кислоты, в которых из двух атомов водорода радикалом замещён только один (нпример NaHCO3 — гидрокарбонат натрия) . Так же карбонатами и гидрокарбонатами называют анионы угольной кислоты СО3^2-(карбонат-анион) и HCO3- (гидрокарбонат-анион) . Сликатами называют соли кремниевой кслоты h3SiO4. По аналогии с угольной кислотой разделяют силикаты и гидросиликаты. Кремниевая кислота в отличии от угольной в воде не растворима и к тому же намного слабее 2-й. Более подробно о угольной и кремниевой кислотах вам расскажут в курсе химии углерода и кремния (IVA-группа).
Нормальные карбонаты широко распространены в природе, например: кальцит СаСО3, доломит CaMg(CO3)2, магнезит MgCO3, сидерит FeCO3, витерит ВаСО3, баритокальцит BaCa(CO3)2 и др. Существуют и минералы, представляющие собой основные карбонаты, например, малахит CuCO3•Cu(ОН) 2. Гидрокарбонаты натрия, кальция и магния встречаются в в природе в растворённом виде в минеральных водах, и в небольшой концентрации, во всех природных водах, кромеатмосферных осадков и ледников. Гидрокарбонаты кальция и магния обуславливают так называемую временную жёсткость воды. При сильном нагревании воды (выше 60 °C) гидрокарбонаты кальция и магния расщепляются на углекислый газ и малорастворимые карбонаты, которые выпадают в осадок на нагревательных элементах, дне и стенках посуды, внутренних поверхностях баков, бойлеров, труб, запорной арматуры и т. д., образуя накипь. К карбонатам относится, например, сода. Стиральную соду еще называют углекислый натрий или карбонат натрия. В состав соды питьевой входит еще элемент — водород. Питьевую соду называют гидрокарбонат натрия. Это сода, содержащая водород. Еще одним из карбонатов является мел. Если обработать соляной кислотой кусочек мела, то по вспениванию можно определить, что мел тоже выделяет углекислый газ. Вещество, из которого состоит мел, называется углекислый кальций или карбонат кальция.
touch.otvet.mail.ru
Угольная кислота — это… Что такое Угольная кислота?
- Угольная кислота
- H2CO3, слабая двухосновная кислота, при нормальных условиях существующая только в разбавленных водных растворах. У. к. образуется при растворении в воде двуокиси углерода: 2, при нормальных условиях не превышает 1% от содержания CO2. Константы диссоциации: K1= 4,0․10-7, K2 = 5,2․10-11 при 18°C. У. к. при нагревании её растворов полностью распадается с выделением CO2. В соответствии с основностью У. к. даёт два ряда солей: средние — Карбонаты с анионом Гидрокарбонаты с анионом
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Уголь
- Угольная промышленность
Смотреть что такое «Угольная кислота» в других словарях:
Угольная кислота — Угольная кислота … Википедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Дает соли карбонаты и гидрокарбонаты … Большой Энциклопедический словарь
УГОЛЬНАЯ КИСЛОТА — (h3CO3) очень слабая и непрочная двухосновная кислота, образующаяся при растворении в воде диоксида углерода (углекислого газа) CO2. Дает 2 ряда солей: карбонаты и бикарбонаты (гидрокарбонаты). В природе широко распространены нормальные карбонаты … Российская энциклопедия по охране труда
Угольная кислота — УГОЛЬНАЯ КИСЛОТА, h3CO3, образуется при растворении углерода диоксида в воде. Важнейшие производные карбонаты, мочевина (карбамид). … Иллюстрированный энциклопедический словарь
угольная кислота — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Даёт соли карбонаты и гидрокарбонаты. * * * УГОЛЬНАЯ КИСЛОТА УГОЛЬНАЯ КИСЛОТА, Н2СО3, очень слабая и непрочная двухосновная кислота.… … Энциклопедический словарь
УГОЛЬНАЯ КИСЛОТА — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Даёт соли карбонаты и гидрокарбонаты … Естествознание. Энциклопедический словарь
Угольная кислота — (медико санит.) см. Углерод … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
УГОЛЬНАЯ КИСЛОТА — h3CO3, образуется при растворении CO2 в воде. Проявляет св ва слабой к ты. Равновесие CO2+h3O h3CO3 смещено влево, поэтому меньшая часть CO2 находится в р ре в виде h3CO3. Для У. к. константы диссоциации K1=4,27 … Химическая энциклопедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3 очень слабая к та, существующая только в водном р ре. У. к. образуется при растворении углерода диоксида в воде (h3О + CO2<=>h3CO3). Как двухосновная к та У. к. даёт 2 ряда солей: средние карбонаты и кислые гидрокарбонаты … Большой энциклопедический политехнический словарь
УГОЛЬНАЯ КИСЛОТА, h3CO3 — УГОЛЬНАЯ КИСЛОТА, h3CO3, образуется при растворении углерода диоксида в воде. Важнейшие производные карбонаты, мочевина (карбамид) … Современная энциклопедия
dic.academic.ru
