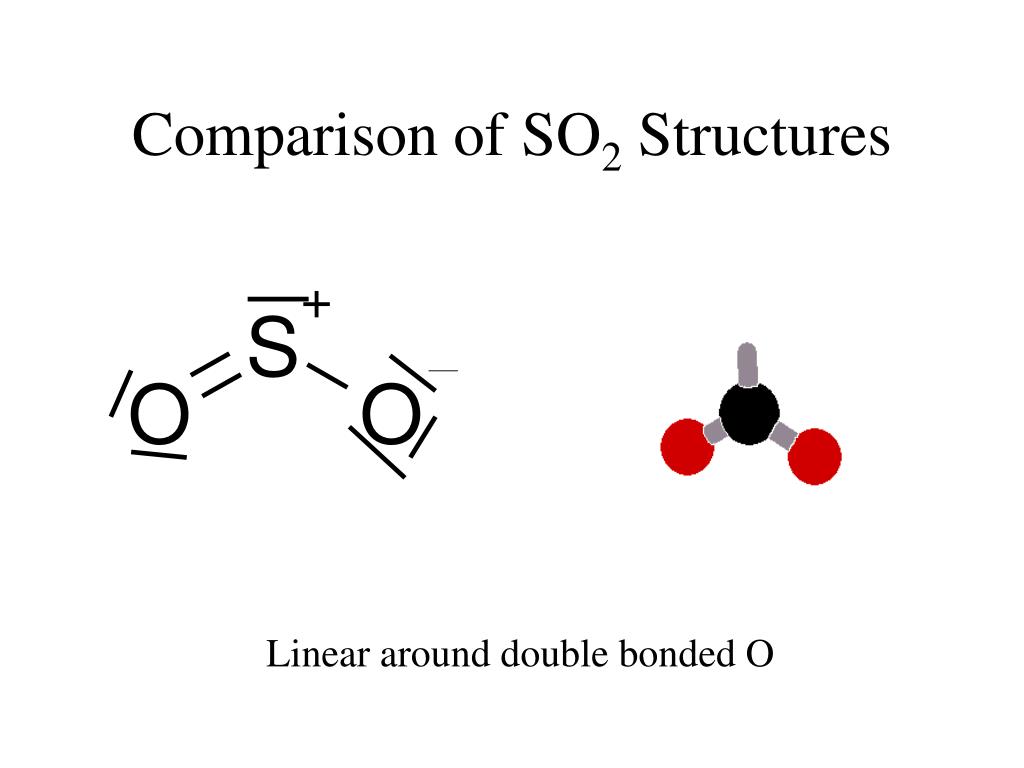
4. Пероксид водорода. Окислительно — восстановительная двойственность н2о2
1. Строение молекулы. Структурная формула Н — О – О — Н. Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О-Н (468 кДж/моль). Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150С. Температура плавления 0,41С. Почти в 1.5 раза тяжелее воды,поверхностное натяжение (σ) больше, чем у Н2О.
В
молекуле Н2О2 связи между атомами кислорода и водорода
полярны (вследствие смещения общих
электронных пар к кислороду).
I ст. К1 = 2,610-12.
II ст. практически не протекает,
т.к. подавляется диссоциацией Н2О, которая протекает в большей степени, чем Н2О2. Сместить диссоциацию по 2-й ступени можно введением щелочи.
2. С некоторыми основаниями Н2О2 взаимодействует непосредственно образуя соли, что подтверждает его кислотные свойства.
Ba(OH)2 + H2O2 = BaO2 + 2H2O
соль
пероксида водорода
3. В отличие от воды пероксид водорода – непрочное соединение, разлагается даже при комнатной температуре (диспропорционирует на свету)Н2О2-1 + Н2О2-1 = О20 + 2Н2О-2
Н2О2 = Н2О+ О
Неустойчивость
Н2О2 обусловлена непрочностью связи О — О.
Атомы
кислорода в молекуле Н2О2 связаны непосредственно друг с другом
неполярной ковалентной связью. Связи
О — Н полярны. Поэтому молекула Н
Пероксиды относят к классу солей. Как соли они могут вступать в реакцию обмена с кислотами:
ВаО2 + Н2SO4 = BaSO4 + H2O2
в отличие от оксидов
SnO2 + 2H2SO4 = Sn(SO4)2 + 2H2O
Этой реакцией пользуются для различия оксидов и пероксидов.
Н
0.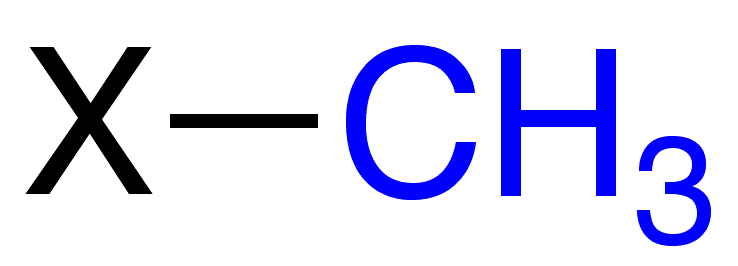
1,48 А0 = 0,148нм
120°
О О
95°
Н
ЕО-О = 210 кДж/моль ЕО-Н = 468 Дж/моль
Молекула нелинейна, две связи О — Н расположены не симметрично, а в 2-х плоскостях под углом 120. Поэтому полярность Н2О2 > Н2О.
4. Окислительно-восстановительная двойственность Н2О2
Н2О2 + 2КI
окислитель восстановитель
Н2О2 + Ag+2O = 2Ag0 + O2 + H2O
восстановитель окислитель
H2O2 + KMnO4 + H2SO4 → O2 + MnSO4 + K2SO4 + H2O
H2O2 + KI + H2SO4 → H2O + I2 + K2
SO4 Na2O2 и K2O2 – используют для регенерации кислорода
в подводных лодках и в изолирующих
противогазах.
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Наличие атомарного кислорода сообщает Н2О2 и Na2O2 сильные окислительные свойства. Na2O2 способен гидролизоваться с образованием H2O2 по реакции
Na2O2 + 2H2O = 2NaOH + H2O2
Аптечная перекись водорода – 3% водный раствор Н2О2, применяется как дезинфицирующее средство, (30% раствор называется пергидроль).
Формула перекиси водорода в химии
Определение и формула перекиси водорода
Температура плавления равна 0,41oC. Она имеет бледно-голубую окраску. Пероксид водорода – хороший ионизирующий растворитель. С водой смешивается в любых соотношениях благодаря возникновению новых водородных связей. Из растворов выделяется в виде неустойчивого кристаллогидрата H2O2×2H2O.
Она имеет бледно-голубую окраску. Пероксид водорода – хороший ионизирующий растворитель. С водой смешивается в любых соотношениях благодаря возникновению новых водородных связей. Из растворов выделяется в виде неустойчивого кристаллогидрата H2O2×2H2O.
Химическая формула перекиси водорода
Химическая формула перекиси водорода – H2O2. Она показывает, что в составе молекулы этого сложного вещества находится два атома водорода (Ar = 1 а.е.м.) и два атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу перекиси водорода:
Mr(H2O2) = 2×Ar(H) + 2×Ar(O) = 2×1 + 2×16 = 2 + 32 = 34
Структурная (графическая) формула перекиси водорода
Более наглядной является структурная (графическая) формула перекиси водорода. Она показывает то, как связаны атомы между собой внутри молекулы. Молекула пероксида водорода имеет угловое строение (рис. 1). Энергия связи О-О (210кДж/моль) значительно меньше энергии связи О-Н (468 кДж/моль).
1). Энергия связи О-О (210кДж/моль) значительно меньше энергии связи О-Н (468 кДж/моль).
Рис. 1. Строение молекулы пероксида водорода с указанием валентных углов между связями и длин химических связей.
Вследствие несимметричного распределения связей Н-О молекула пероксида водорода сильно полярна (дипольным момент равен 0,7×10-29 Кл×м). Между молекулами пероксида водорода возникает прочная водородная связь, приводящая к их ассоциации.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Ответы | § 4. Ковалентная связь — Химия, 10 класс
1.
 При помощи электронных формул изобразите образование ковалентных связей в молекулах HCl, h3O, Nh4, Ch5. Укажите валентности элементов в этих веществах.
При помощи электронных формул изобразите образование ковалентных связей в молекулах HCl, h3O, Nh4, Ch5. Укажите валентности элементов в этих веществах.
2. Учитывая, что валентность водорода и хлора равна единице, углерода — четырём, а кислорода — двум, напишите структурные формулы молекул: CCl4, CO2, Ch4Cl, C2H6, C2h5, C2h3, C2H5Cl.
Формулы:
3.
 В какой молекуле, h3O или Nh4, ковалентные связи более полярные? Составьте структурные формулы этих молекул и укажите знаки частичных зарядов на атомах.
В какой молекуле, h3O или Nh4, ковалентные связи более полярные? Составьте структурные формулы этих молекул и укажите знаки частичных зарядов на атомах.
В молекуле h3O\mathrm{H_2O}h3O ковалентные связи более полярные.
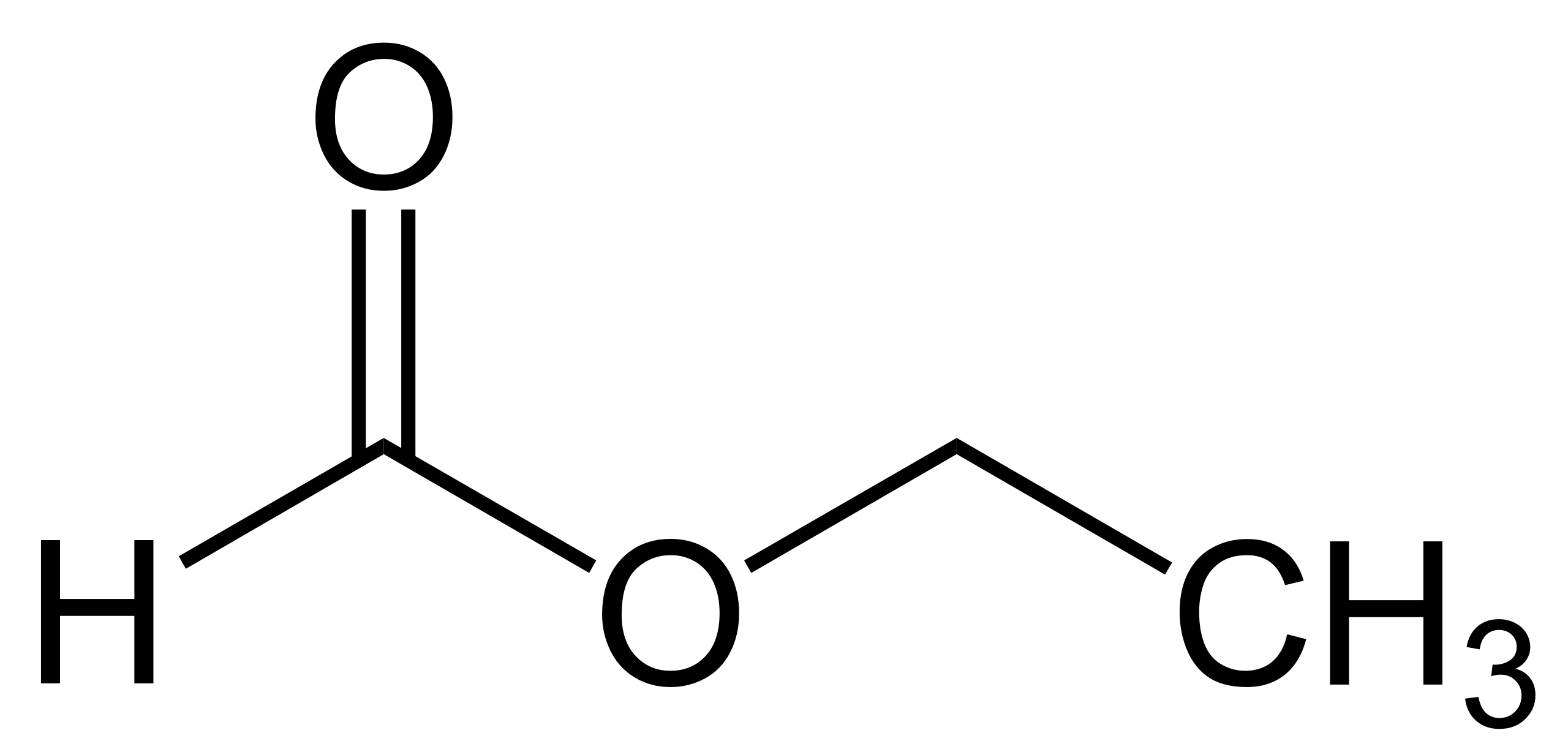
4. Напишите структурную формулу пероксида водорода h3O2. Укажите полярные и неполярные связи.
5.
 В какой молекуле, O2 или h3O2, энергия связи кислород-кислород больше?
В какой молекуле, O2 или h3O2, энергия связи кислород-кислород больше?
В молекуле O2\mathrm{O_2}O2 энергия связи кислород-кислород больше.
6. При сильном нагревании может происходить разрыв связей в молекулах. При этом молекулы распадаются на атомы. Какое вещество, Cl2 или N2, будет более устойчиво к нагреванию (термически устойчиво)?
Вещество N2\mathrm{N_2}N2 будет более термически устойчиво.
«Пероксиды. Кислотно-основные и окислительно-восстановительные свойства, получение и применение пероксида водорода»
Министерство образования и науки РФФедеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Шадринский государственный педагогический институт»
Кафедра теории и методики проектно-графических дисциплин
«Пероксиды. Кислотно-основные и окислительно-восстановительные свойства, получение и применение пероксида водорода»
Реферат по дисциплине«Химия»
По направлению подготовки Профессиональное образование: декоративно-прикладное творчество и дизайн
Исполнитель:
Слободенюк В. С.
С.
Студентка 1 курса дневного
(заочного) отделения
Шадринск, 2014 г.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ…………………………………………………………..…….…………3
ГЛАВА 1. Пероксид (перекись) водорода
1.1. Структурная формула ……………………..………………..………………4
1.2Физические свойства……………………………………………………..5
1.3 Химические свойства………………………………………………….….6
1.4 Теплота и образование……………………………………………….. 10
1.5 Получение………………………………………………………………..12
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ…………………………..…14
Введение
Пероксид водорода — это соединение водорода и кислорода Н2О2, содержащее рекордное количество кислорода – 94% по массе.
Впервые пероксид водородаполучил в 1818 французский химик Луи Жак Тенар (1777 – 1857), действуя сильно охлажденной соляной кислотой на пероксид бария:
BaO2 + 2HCl ® BaCl2 + h3O2. Пероксид бария, в свою очередь, получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария: BaCl2 + Ag2SO4 ® 2AgCl + BaSO4. Чтобы не использовать дорогую соль серебра в последующем дляполучения Н2О2 использовали серную кислоту: BaO2 + h3SO4 ® BaSO4 + h3O2, поскольку при этом сульфат бария остается в осадке. Иногда применяли другой способ: пропускали углекислый газ во взвесь ВаО2 в воде: BaO2 + h3O + CO2 ® BaCO3 + h3O2, поскольку карбонат бария также нерастворим. Другой способ предложил французский химик Антуан Жером Балар (1802–1876), прославившийся открытием нового химического элемента брома(1826). Он пропускал углекислый газ во взвесь ВаО2 в воде, поскольку карбонат бария также нерастворим. Применяли и более экзотические методы, например, действие электрического разряда на смесь 97% кислорода и 3% водорода при температуре жидкого воздуха (около –190° С), так был получен 87%-ный раствор Н2О2.
Чтобы не использовать дорогую соль серебра в последующем дляполучения Н2О2 использовали серную кислоту: BaO2 + h3SO4 ® BaSO4 + h3O2, поскольку при этом сульфат бария остается в осадке. Иногда применяли другой способ: пропускали углекислый газ во взвесь ВаО2 в воде: BaO2 + h3O + CO2 ® BaCO3 + h3O2, поскольку карбонат бария также нерастворим. Другой способ предложил французский химик Антуан Жером Балар (1802–1876), прославившийся открытием нового химического элемента брома(1826). Он пропускал углекислый газ во взвесь ВаО2 в воде, поскольку карбонат бария также нерастворим. Применяли и более экзотические методы, например, действие электрического разряда на смесь 97% кислорода и 3% водорода при температуре жидкого воздуха (около –190° С), так был получен 87%-ный раствор Н2О2.
Многие исследователи 19 в., получавшие чистый пероксид водорода, отмечали опасность этогосоединения. Так, когда пытались отделить Н2О2от воды путем экстракции из разбавленных растворов диэтиловым эфиром с последующей отгонкой летучего эфира, полученное вещество иногда без видимых причин взрывалось. В одном из таких опытов немецкий химик Ю.В.Брюль получил безводный Н2О2, который обладал запахом озона и взорвался от прикосновения неоплавленной стеклянной палочки. Несмотря на малые количестваН2О2 (всего 1–2 мл) взрыв был такой силы, что пробил круглую дыру в доске стола, разрушил содержимое его ящика, а также стоящие на столе и поблизости склянки и приборы.
В одном из таких опытов немецкий химик Ю.В.Брюль получил безводный Н2О2, который обладал запахом озона и взорвался от прикосновения неоплавленной стеклянной палочки. Несмотря на малые количестваН2О2 (всего 1–2 мл) взрыв был такой силы, что пробил круглую дыру в доске стола, разрушил содержимое его ящика, а также стоящие на столе и поблизости склянки и приборы.
Глава 1. Пероксид (перекись) водорода
Кроме воды, известно другое соединение водорода с кислородом — пероксид водорода (Н2О2). В природе он образуется как побочный продукт при окислении многих веществкислородом воздуха. Следы его постоянно содержатся в атмосферных осадках. Пероксид водорода частично образуется также в пламени горящего водорода, но при остывании продуктов сгорания разлагается.
В довольно больших концентрациях (до нескольких процентах) Н2О2 может быть получена взаимодействием водорода в момент выделения с молекулярным кислородом. Пероксид водорода частично образуется также при нагреваниидо 2000 °С влажного кислорода, при прохождении тихого электрического разряда сквозь влажную смесь водорода с кислородом и при действии на воду ультрафиолетовых лучей или озона.
1.1 Структурная формула.
Структурная формула пероксида водорода Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь это непрочна…
В этом разделе не хватает ссылок на источники информации. 3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме (гидры, планарии, паразиты, водоросли, бактерии и др.) Формы выпускаВыпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Опасность примененияНесмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл. [7] Строение молекулы и физические свойстваПерекись водорода относится к простейшим представителям группы пероксидов. Её получают в промышленности и лаборатории несколькими способами. Структурная формула перекиси водорода обозначается h3O2. Степень окисления у атомов кислорода -1. Молекула вещества представлена двумя OH-группами, которые связаны пероксидным -О-О-мостиком и лежат в разных плоскостях. Угол между ними меняется в зависимости от температуры, концентрации раствора и других условий.
Основные физические свойства перекиси водорода:
Химические особенностиПоскольку оба атома кислорода находятся в промежуточной степени окисления -1, антисептическое средство может проявлять как окислительные, так и восстановительные свойства. Оно участвует в реакциях окисления нитритов до нитратов и выделении иодов из иодидов металлов. Также вещество может расщеплять ненасыщенные соединения. Перекись обладает слабыми кислотными свойствами, поэтому она диссоциирует по двум ступеням:
Реагируя с более сильными окислителями, например, с солями серебра и золота, водород служит восстановителем и окисляется до атомарного кислорода. В реакции с нитритом калия вещество выступает окислителем. Если молекула принимает электрон на внешний уровень, тогда степень окисления кислорода меняется на -2; если она его отдаёт, тогда соединение становится восстановителем. Окисление органических веществ пероксидом обычно проводят в уксусной кислоте. Способы получения веществаСначала пероксид водорода получали в промышленности с помощью электролиза серной кислоты или раствора сульфата аммония в h3SO4. В результате реакции получалась надсерная кислота. После гидролиза вещества образовывались пероксид и серная кислота. В середине XX века открыли новый способ получения перекиси водорода. Антрахиноновый процесс был разработан компанией BASF. При этом методе водород окисляется кислородом воздуха, после чего образуются антрахиноны и пероксид водорода. Реакцию проводят в растворе алкилантрагидрохинонов в бензоле, который служит катализатором. В него также добавляют вторичные спирты. На завершительной стадии процесса катализатор убирают, а из получившейся смеси продуктов выделяют пероксид водорода путём перегонки при сниженном давлении. В лабораторных условиях вещество получают с помощью пероксида бария и соляной кислоты. Уравнение взаимодействия соединений: BaO2+2HCl → BaCl2+h3O2. Получившийся хлорид бария осаждают в виде сульфата. Пероксид водорода также можно извлечь при помощи каталитического окисления изопропилового спирта. В некоторых источниках есть информация, что нужное вещество может образоваться при взаимодействии пероксида бария с серной кислотой, однако такую технологию обычно не используют. Поскольку осадок сульфата бария формируется на зёрнах его пероксида, реагент покрывается нерастворимой оболочкой, которая замедляет реакцию и выход нужного продукта. Меры предосторожностиВо время работы с концентрированным раствором перекиси необходимо соблюдать меры безопасности. Хотя вещество нетоксично, при попадании в дыхательные пути или на кожный покров и слизистые оно вызывает сильные ожоги. Недостаточно чистый пероксид высокой концентрации может быть взрывоопасен. Всю работу с веществом нужно проводить в «беспылевых» условиях и при отсутствии ионов металлов. Растворы перекиси водорода относятся к 3-му классу опасности. Вещество может вызывать деструктивные изменения, которые схожи с действием щелочей. Летальная доза пергидроля (название раствора концентрации 30%) составляет 50−100 мл.
Сферы использованияПероксид водорода может быть разной концентрации. Поскольку растворы обладают различными свойствами, их часто используют в промышленности и быту:
Перекись широко используется в области косметологии. Ею обесцвечивают волосы и отбеливают зубы. Поскольку процесс основан на окислении, локоны часто портятся, поэтому вещество не советуют применять обладателям тонких и повреждённых прядей. С зубами не наблюдается дефектов, поскольку с прозрачной эмалью эффект отбеливания достигается за счёт разницы в отражении света дентином. Применение в области медициныШирокое применение перекиси водорода нашли в медицине. Средство с бактерицидным механизмом действия предназначено для внешнего использования. Перед применением необходимо тщательно изучить инструкцию к лекарству. Формы выпуска пероксида водорода:
Препаратом лечат гнойные раны и воспалённые слизистые оболочки. Средство используется при носовых и капиллярных кровотечениях, а также для промывки и глубокой очистки ран. Медицинским раствором обрабатывают ротовую полость и горло при ангине, стоматите или тонзиллите. Средство также избавляет кожный покров от пигментных пятен. С помощью лекарства убирают серные пробки при чистке ушей. Препарат применяется в гинекологии для лечения различных женских патологий. При лёгкой механической очистке ватный тампон смачивают в 3%-м растворе и обрабатывают им поражённые участки кожи. Для компрессов применяют перекись с концентрацией 1 процент. Продолжительность процедуры не должна превышать 30 мин. Для обработки участков кожи с пигментными пятнами используют пергидроль. Ротовую полость или органы половой системы обрабатывают 0,25%-м раствором. Применение перекиси водорода противопоказано при индивидуальной непереносимости вещества. В редких случаях негативные последствия могут проявиться в жжении во время процедуры и аллергии в виде красных пятен на коже. При длительной терапии после обработок ротовой полости может возникнуть гипертрофия сосочков языка. Если соблюдать дозировку и схему применения перекиси водорода в соответствии с инструкцией, тогда получится избежать побочных действий. |
Пероксид (перекись) водорода реферат по технологии
Пероксид (перекись) водорода Кроме воды, известно другое соединение водорода с кислородом — пероксид водорода (Н2О2). В природе он образуется как побочный продукт при окислении многих веществ кислородом воздуха. Следы его постоянно содержатся в атмосферных осадках. Пероксид водорода частично образуется также в пламени горящего водорода, но при остывании продуктов сгорания разлагается. В довольно больших концентрациях (до нескольких процентах) Н2О2 может быть получена взаимодействием водорода в момент выделения с молекулярным кислородом. Пероксид водорода частично образуется также при нагревании до 2000 °С влажного кислорода, при прохождении тихого электрического разряда сквозь влажную смесь водорода с кислородом и при действии на воду ультрафиолетовых лучей или озона. Теплота образование пероксида водорода. Непосредственно определить теплоту образования пероксида водорода из элементов не удаётся. Возможность найти её косвенным путём даёт установленный Г. И. Гессом (1840 г.) закон постоянства сумм тепла: общий тепловой эффект ряда последовательных химических реакций равен тепловому эффекту любого другого ряда реакций с теми же самыми исходными веществами и конечными продуктами. Строго говоря, закон Гесса следовало бы сформулировать, как «закон постоянства сумм энергий», потому что при химических превращениях энергия может выделяться или поглощаться не только в тепловой, но и как механическая, электрическая и др. Кроме того, предполагается, что рассматриваемые процессы протекают при постоянном давлении или постоянном объёме. Как правило, именно так и обстоит дело при химических реакциях, а все другие формы энергии могут быть пересчитаны на тепловую. Сущность этого закона особенно наглядно выявляется в свете следующей механической аналогии: общая работа, производимая опускающимся без трения грузом, зависит не от пути, а только от разности начальной и конечной высот. Подобным же образом общий тепловой эффект той или иной химической реакции определяется только разностью теплот образования (из элементов) её конечных продуктов и исходных веществ. Если всё эти величины известны, то для вычисления теплового эффекта реакции достаточно из суммы теплот образования конечных продуктов вычесть сумму теплот образования исходных веществ. Законом Гесса часто пользуются при вычислении теплот таких реакций, для которых прямое экспериментальное их определение трудно или даже невозможно. В применении к Н2О2 расчёт можно провести на основе рассмотрения двух различных путей образования воды: 1. Пусть первоначально при соединении водорода и кислорода образуется пероксид водорода, который затем разлагается на воду и кислород. Тогда будем иметь следующие два процесса: 2 Н2 + 2 О2 = 2 Н2О2 + 2х кДж 2 Н2О2 = 2 Н2О + О2 + 196 кДж Тепловой эффект последней реакции легко определяется экспериментально. Складывая почленно оба уравнения и сокращая одиночные члены, получаем 2 Н2 + О2 = 2 Н2О + (2х + 196) кДж. 2. Пусть при соединении водорода с кислородом непосредственно образуется вода, тогда имеем 2 Н2 + О2 = 2 Н2О + 573 кДж. Так как в обоих случаях и исходные вещества, и конечные продукты одинаковы, 2х + 196 = 573, откуда х = 188,5 кДж. Это и будет теплота образования моля пероксида водорода из элементов. Получение. Пероксид водорода проще всего получать из пероксида бария (ВаО2), действуя на неё разбавленной серной кислотой: ВаО2 + Н2SO4 = BaSO4 + Н2О2. При этом наряду с пероксидом водорода образуется нерастворимый в воде сульфат бария, от которого жидкость может быть отделена фильтрованием. Продаётся Н2О2 обычно в виде 3%-ного водного раствора. Продолжительным упариванием обычного 3%-ного водного раствора Н2О2 при 60-70 ° С можно довести содержание в нём пероксида водорода до 30%. Для получения более крепких растворов отгонку воды приходится производить под уменьшенным давлением. Так, при 15 мм рт. ст. сначала (примерно с 30 °С) отгоняется главным образом вода, а когда температура достигает 50 °С, в перегонной колбе остаётся очень концентрированный раствор пероксида водорода, из которого при сильном охлаждении могут быть выделены его белые кристаллы. Основным методом получения пероксида водорода является взаимодействие с водой надсерной кислоты (или некоторых её солей), легко протекающее по схеме: Н2S2O8 + 2 h3O = 2 h3SO4 + Н2О2. Меньшее значение имеют некоторые новые методы (разложение органических пероксидных соединений и др.) и старый способ получения из ВаО2. Для хранения и перевозки больших количеств пероксида водорода наиболее пригодны ёмкости из алюминия (не ниже 99,6%-ной чистоты). Физические свойства. Чистый пероксид водорода — бесцветная сиропообразная жидкость (с плотностью около 1,5 г/мл), под достаточно уменьшенным давлением перегоняющуюся без разложения. Замерзание Н2О2 сопровождается сжатием (в отличие от воды). Белые кристаллы пероксида водорода плавятся при -0,5 °С, т. е. почти при той же температуре, что и лёд. Теплота плавления пероксида водорода составляет 13 кДж/моль, теплота испарения — 50 кДж/моль (при 25 °С). Под обычным давлением чистый Н2О2 кипит при 152 °С с сильным разложением (причём пары могут быть взрывоопасны). Для его критических температуры и давления теоретически рассчитаны значения 458 °С и 214 атм. Плотность чистого Н2О2 равна 1,71 г/см3 в твёрдом состоянии, 1,47 г/см3 при 0 °С и 1,44 г/см3 при 25 °С. Жидкий пероксид водорода, подобно воде, сильно ассоциирована. Показатель преломления Н2О2 (1,41), а также её вязкость и поверхностное натяжение несколько выше, чем у воды (при той же температуре). Структурная формула. Структурная формула пероксида водорода Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь это непрочна и обусловливает неустойчивость молекулы. Действительно, чистая Н2О2 способна разлагаться на воду и кислород со взрывом. В разбавленных водных растворах она значительно устойчивее. Оптическими методами установлено, что молекула Н-О-О-Н не линейна: связи Н-О образуют углы около 95° со связью О-О. Крайними пространственными формами молекул подобного типа являются показанные ниже плоские структуры — цис-форма (обе связи Н-О по одну сторону от связи О-О) и транс-форма (связи Н-О по разные стороны).
Водорода перекись — Справочник химика 21
Реакции с участием перекиси водорода. Перекись водорода в реакциях окисления-восстановления может быть как окислителем, так и восстановителем. В зависимости от характера среды возмолследующие превращения перекиси водорода [c.134]Водорода перекись, 30%-ная см. Пергидроль [c.117]
Ход работы. Опыт 1. Каталитическое разложение перекиси водорода. Перекись водорода медленно разлагается [c.36]
Получение перекиси водорода. Перекись водорода получают действием разбавленной серной кислоты на перекись бария. [c.164]
ВОДОРОД ПЕРЕКИСЬ (ПЕРГИДРОЛЬ ) [c.88]
Водород бромистый Водорода перекись Воздух [c.806]
Обработка перекисью водорода. Перекись водорода — более слабый окислитель по сравнению с перманганатом калия. Преимущество обработки электролита перекисью водорода состоит в том, что в процессе окисления электролит не загрязняется ионами марганца. [c.241]
Если вода облучается а-частицами или протонами и электронами малой энергии, то большое число радикалов возникает, вдоль пути частиц. Реагируя друг с другом, радикалы могут образовать водород, перекись водорода и воду [c.364]
Легко разлагающиеся и дающие взрыв вещества, такие, как перекись водорода, перекись натрия (или калия), следует хранить в небольших количествах, защищая их от засорения пылью, от влаги и света. [c.342]
В качестве инициаторов цепного процесса полимеризации вводят вещества, легко дающие при нагреваиии под влиянием квантов света или электрического разряда свободные радикалы. К таким веществам относятся перекись водорода, перекись ацетила, перекись бензоила и др. [c.139]
Пероксид водорода (перекись водорода) Н2О2 получают несколькими способами. В промышлеииости используется, в частности, электрохимическое окисление серной кислоты (при высокой плотности тока, низкой температуре, на платиновом аноде) [c.441]
Пергидроль. См. Водорода перекись. [c.124]
Важнейшие окислители в химическом анализе — галогены, перхлорат, хлорная кислота, бромат, иодат, азотная кислота и ее соли, перманганат калия, дихромат калия, перекись водорода, перекись натрия, двуокись свинца, пероксодисульфат амдюиия. Перекись водорода, азотистая кислота и ее солг могут быть и окислителями и восстановителями. [c.151]
Двусернистый водород Двухлористая сера Иодистый водород Перекись водорода Пятнхлорнстая сурьма Сернистый ангидрид Серная к та Трехбромистый фосфор Треххлористый фосфор Хлористая сера Хлористый тиоиил Четырехокись осмия Четыреххлористый титан [c.894]
Перекись (пероксид) водорода. Перекись водорода представляет собой соединение кислорода с водородом, отвечающее формуле Н2О2. [c.629]
Озоинды представляют собой очень нестабильные соединения, разлагающиеся со взрывом. Как иравтшо, их не выделяют индивидуально, а расщепляют при действии разнообразных реагентов. Следует разлтать восстановительное и окислительное разложение озонид ов. Нри гидролизе озоинды расщепляются на карбонильные соединения и перекись водорода. Перекись водорода окисляет альдегиды до карбоновых кнслот — это так называемое окислительное разложение озонидов [c.454]
Фуджимото [19] получил, пропуская смесь двух частей метана с ОДНОЙ частью кислорода через кистевой искровой разряд, кроме формальдегида и метанола, перекись водорода. Одновременно были также получены значительные количества водорода, поэтому невозможно определить является ли перекись первичным продуктом окисления метана или она образовалась при окислении молекулярного водорода. Перекись водорода была выделена в виде продукта присоединения ее к формальдегиду — перекиси диоксидиметила. Последняя разлагается при нагревании на муравьиную кислоту и водород. [c.324]
Пероксид водорода. Кроме воды известно другое соединение водорода с кислородом — пероксид водорода (перекись водорода, Н2О2). В природе он образуется как побочный продукт при окислении многих веществ кислородом воздуха, следы его постоянно содержатся в атмосферных осадках и соке некоторых растений. Пероксид водорода частично образуется также в пламени горящего водорода, но при остывании продуктов сгорания разлагается. [c.115]
Пе >оксид водорода [перекись водорода] Н2О2 —34,01 бц. ж. р=1,450 я = 1,4067 -[c.59]
Полимеризация под влиянием химических инициаторов — оди из наиболее распространенных методов полимеризации, состоит во.збуждении молекул мономера Беществами, способными при на греванки разлагаться с образованием свободных радикалов. К та КИМ веществам относятся неорганические и органические перекис (перекись водорода, перекись бензоила), гидроперекиси, диазосс единения и др. Широко применяемый инициатор — перекись бен зоила — легко распадается при нагревании на два свободных ра д икал а. [c.40]
Спринг на основании спектрометрических исследований также приписывал перекиси формулу II—0=0—Н. Мейер иредноложил, что при самоокислении один из кислородных ато-мои ведет себя, как четырехвалеитный, поэтому при восстановлении атомарным водородом перекись водорода образуется следующим образом [c.117]
КАТАЛАЗА (от греч katalysis-разрушение) (перекись водорода перекись водорода оксидоредуктаза), фермент класса оксидоредуктаз, катализирующий разложение HjOj на HjO и Оз При низких концентрациях HjOj каталаза проявляет также пероксидазную активность, окисляя низшие спирты, полифенолы и др. [c.334]
Водорода перекись. Пергидроль. Н2О2. М. м. 34,01. Бесцветная прозрачная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции, легко разлагающаяся с выделением кислорода. Содержание перекиси водорода в реактиве X. ч. — 30—35 %, ч. д. а. — 29—32 %, ч. — не менее 29 %. ГОСТ 10929-76. [c.107]
В качестве катализаторов полимеризации чаще всего применяют водорастворимые перекисные соединения, дающие при разложении свободные радикалы. Такими соединениями являются перекись водорода, перекись калия [85], персульфаты и пербо-раты. Перекисным соединением, растворимым в мономере, является перекись бензоила [86]. Найдено также, что диазоаминобензол активхтрует полимеризацию бутадиена [87]. В качестве катализаторов реакции используют третичные амины, растворимые по меньшей мере в одном из полимеризуемых компонентов [88]. [c.52]
Аналитическая химия (1973) — [ c.95 , c.116 , c.118 , c.151 , c.152 , c.211 , c.220 , c.243 , c.244 , c.392 , c.402 , c.412 ]
Органикум. Практикум по органической химии. Т.2 (1979) — [ c.367 ]
Химическое сопротивление материалов (1975) — [ c.176 ]
Синтез органических препаратов Сб.4 (1953) — [ c.150 , c.341 , c.534 , c.559 ]
Синтезы органических препаратов Сб.1 (1949) — [ c.340 ]
Синтезы органических препаратов Сборник1 (1949) — [ c.346 ]
Введение в химию окружающей среды (1999) — [ c.64 ]
Курс аналитической химии Том 1 Качественный анализ (1946) — [ c.317 ]
Свободные радикалы (1970) — [ c.109 , c.130 ]
Катализ и ингибирование химических реакций (1966) — [ c.0 ]
Водородная связь (1964) — [ c.0 ]
Краткий справочник по коррозии (1953) — [ c.65 ]
Общий практикум по органической химии (1965) — [ c.620 ]
Органические реакции том 9 (1959) — [ c.0 ]
Органические реакции Сборник 9 (1959) — [ c.0 ]
Аналитическая химия (1965) — [ c.25 , c.26 , c.100 , c.162 , c.166 , c.167 , c.205 , c.207 , c.212 , c.277 , c.519 , c.534 ]
Справочник показателей качества химических реактивов Книга 1,2 (1968) — [ c.234 ]
Электронные представления в органической химии (1950) — [ c.314 , c.324 ]
Микрокристаллоскопия (1946) — [ c.52 ]
Лекционные опыты по общей химии (1950) — [ c.0 , c.61 ]
Химия травляющих веществ Том 2 (1973) — [ c.347 , c.348 ]
Диэлектрические свойства бинарных растворов (1977) — [ c.268 , c.362 ]
Краткий справочник по коррозии (1953) — [ c.65 ]
Химико-технический контроль лесохимических производств (1956) — [ c.137 ]
Химия и технология полимеров Том 1 (1965) — [ c.188 , c.195 , c.267 ]
Окислительно-восстановительные полимеры (1967) — [ c.157 , c.216 ]
Микро и полимикро методы органической химии (1960) — [ c.0 ]
Полярография лекарственных препаратов (1976) — [ c.15 , c.22 , c.91 , c.94 , c.95 ]
Искусственные генетические системы Т.1 (2004) — [ c.432 ]
Формула перекиси водорода
Формула и структура: Перекись водорода имеет химическую формулу H 2 O 2 . Его молекулярная формула H 2 O 2 , а его молярная масса составляет 34,0147 г моль -1 . Пероксид водорода — простейший пероксид (соединение со связью O-O), и его структура — H-O-O-H, поэтому пероксид водорода называют «кислородсодержащей водой», потому что это молекула воды с еще одним атомом кислорода. H 2 O 2 — неплоская молекула со связью O-O в плоскости, а два атома водорода расположены в «V».Эта структура имеет ось симметрии C 2 и известна как «геометрия открытой книги». Его химическая структура может быть записана следующим образом.
Происхождение: В природе перекись водорода встречается как защитное средство, вырабатываемое некоторыми видами жуков. Более того, перекись водорода была обнаружена как химическое соединение иммунной системы рыбок данио, где количество перекиси увеличивается после некоторого повреждения. Кроме того, перекись водорода проявила активность в качестве сигнальной молекулы в некоторых биологических процессах.
Получение: Перекись водорода получают в реакции, которая начинается с восстановления хинона с образованием гидрохинона. Обычно в этом процессе для восстановления используется палладиевый катализатор, а затем гидрохинон подвергается самоокислению, вызванному барботажем воздуха в растворе. Конечными продуктами являются исходный хинон и пероксид водорода, который удаляется экстракционной колонной, а затем перегоняется в вакууме. Общее уравнение:
Физические свойства: перекись водорода представляет собой жидкость от светло-голубого до бесцветного и без запаха.Его плотность составляет 1,450 г / мл -1 . Температура кипения (разложения) 150,2 ºC. Перекись водорода смешивается с водой. Обычно он продается в виде 30% (мас. / Мас.) Раствора. Плотность этого раствора составляет 1,11 г / мл -1 .
Химические свойства: Перекись водорода широко используется для получения различных продуктов, таких как другие перекиси, эпоксиды и т. Д. Перекись водорода разбавляется до различной концентрации из-за концентрированного H 2 O 2 обладает высокой реакционной способностью: при нагревании она может взорваться.Несмотря на эти риски, разбавленные растворы используются в различных реакциях:
— Разложение: при нагревании до 150,2 ºC или при низком pH с образованием воды и кислорода:
2H 2 O 2 → 2H 2 O + O 2
— Окисление и восстановление: перекись водорода может быть окислителем (одним из самых сильных) или восстановителем:
H 2 O 2 + A → H 2 O + A-O (окисление)
H 2 O 2 + A → ZH 2 + O 2 (уменьшение)
Применение: Наиболее известное применение перекиси водорода — это дезинфицирующее средство (раствор 10–30% по массе) против бактерий и вирусов в домах и больницах.Другое популярное применение — обесцвечивание волос. Перекись водорода используется в различных промышленных процессах, особенно в качестве блендера и дезинфицирующего средства. В производстве бумага используется для измельчения древесной массы, аналогично текстильному производству. Его добавляют в моющее средство из-за его способности к смешиванию. Перекись водорода используется при очистке сточных вод для окисления фенолов и других химических соединений.
Воздействие на здоровье / опасность для здоровья: Разбавленная перекись водорода безопасна и одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов в качестве противомикробного агента.Однако когда концентрируешься; перекись водорода может раздражать кожу, глаза и другие слизистые оболочки. Он сильно взрывается при нагревании, и контакт с горючими материалами или металлами, такими как медь, железо, никель или цинк, может привести к возгоранию.
1. Что такое перекись водорода и для чего она используется?
3. МНЕНИЕ
3.1 Химические и физические характеристики
3.1.1 Химическая идентичность
3.1.1.1. Основное название и / или название INCI
Пероксид водорода, диоксид водорода, диоксид водорода, оксид водорода, оксидол, перекисью.
Перекись карбамида, перекись мочевины, пероксид водорода карбамид, мочевина перекись водорода, мочевина, компд. с водородом перекись (1: 1).
3.1.1.2. Химические названия
Пероксид водорода
Перекись карбамида
3.1.1.3. Торговые наименования и сокращения
/
3.1.1.4. Номер CAS / EINECS
Пероксид водорода: CAS: 7722-84-1
EINECS: 231-765-0
Перекись карбамида: CAS: 124-43-6
EINECS: 204-701-4
3.1.1.5. Структурная формула
Пероксид водорода
Перекись карбамида
3.1.1.6. Эмпирическая формула
Пероксид водорода: H 2 O 2
Перекись карбамида: CO (NH 2 ) 2 . H 2 O 2
3.1.2. Физическая форма
Пероксид водорода: Бесцветная жидкость
Перекись карбамида: белый кристаллы или кристаллический порошок
3.1.3. Молекулярный вес
Перекись водорода: Мол. вес 34,0
Перекись карбамида: Мол. вес 94,1
3.1.4. Коды чистоты, состава и веществ
Коммерческие продукты:
Перекись водорода: Перекись водорода — вода решения.Коммерчески поставляется в виде 33-37% -ного водного раствора. Общие стабилизаторы содержат фосфорную или другую минеральную кислоту (чтобы продукт кислые), пирофосфатные соли (комплексообразователи для ингибирования разложение, катализируемое металлами) и станнат (коллоидообразующий ингибитор).
Коммерческие решения содержат низкие (<0,1%) уровни органические примеси (всего органический углерод) и очень низкие уровни (<10 частей на миллион) неорганические примеси, с общим содержанием тяжелых металлов обычно <2 промилле. Перекись карбамида: Продукты, содержащие минимум 97% пероксид водорода — Аддукты мочевины доступный.
3.1.5. Примеси / сопутствующие загрязнители
/
3.1.6. Растворимость
Перекись водорода смешивается с водой.Перекись карбамида растворим в воде.
3.1.7. Коэффициент распределения (Log Pow)
/
3.1.8. Дополнительные физико-химические характеристики
Пероксид водорода
Чистый H 2 O 2 (коммерчески недоступен в ЕС)
Точка плавления: -0.4 ° C
Температура кипения: 150-152 ° C
Плотность: 1,4425 г / см 3
Давление пара: 3 гПа
Пероксид карбамида
Точка плавления: 75-85 ° C
Точка кипения: нет данных
Плотность: 1.4 г / см 3
Давление пара: нет данных
Комментарий
Возможные примеси в перекись водорода и перекись карбамида не известный. Точно так же стабильность перекиси водорода и перекись карбамида в гигиене полости рта неизвестна.
3.2. Функции и использование
Перекись водорода способны вступать в многочисленные реакции (например, молекулярные добавления, замещения, окисления и восстановления). Это сильный окислитель и может образовывать свободные радикалы путем гомолитического расщепления. Перекись карбамида аддукт мочевины и водорода перекисью, которая при контакте с водой распадается на мочевину и пероксид водорода.Например, гель перекиси карбамида 10% даст максимум 3,6% перекиси водорода. 750 000 тонн перекись водорода (рассчитывается как 100% H 2 O 2 ) были произведены в Европе в 1995 году. Было использовано около 300 тонн перекиси карбамида.
Основное использование перекись водорода находится в производство химикатов (около 40%), отбеливание целлюлоза и бумага (прибл.30%) и отбеливание тканей (около 20%). Небольшие количества используется в косметике. Перекись водорода используется для обесцвечивания волос. и для окисления в стойких красках для волос и при гигиене полости рта такие продукты, как ополаскиватели для рта и средства для ухода за зубами, а также средства для отбеливания зубов.
Перекись водорода — структура, применение и свойства перекиси водорода
Перекись водорода — очень нестабильное химическое соединение.Две молекулы водорода соединяются с двумя молекулами кислорода с образованием перекиси водорода. Следовательно, его химическая формула H 2 O 2 . Перекись водорода — это бледно-голубая прозрачная жидкость, немного более вязкая, чем вода в чистом виде. Это простейший пероксид (так как это соединение с одинарной связью кислород-кислород). Перекись водорода используется в основном в качестве окислителя, отбеливающего агента и антисептика. Концентрированная перекись водорода, также известная как «перекись высокого давления», представляет собой реактивную форму кислорода и использовалась в качестве топлива в ракетных двигателях.Поскольку это соединение нестабильно, оно медленно разлагается в присутствии света. Пероксид водорода обычно хранят со стабилизатором в слабокислом растворе, поскольку он нестабилен. Его можно найти в биологических системах, в том числе в организме человека. Пероксидазы — это ферменты, которые используют или разлагают перекись водорода.
ИСТОРИЯ ОТКРЫТИЙ
СТРУКТУРА ПЕРОКСИДА ВОДОРОДА
Схема показывает, что в структуре две плоскости, и каждая плоскость имеет одну пару ОН, угол между обеими плоскостями составляет 90,2 °, длина связи OO составляет 145,8 пм, а длина связи ОН составляет 98,8 пм (что равно 9,88 × 10-13 м). Две пары несвязанных электронов будут присутствовать в обоих атомах кислорода. Это доказывает теорию отталкивания электронов валентных оболочек.Атомы водорода всегда будут отталкивать несвязанные электроны кислорода. Таким образом, образуется изогнутая молекулярная форма.
Для получения перекиси водорода используются различные методы:
СВОЙСТВА ПЕРОКСИДА ВОДОРОДА
Перекись водородаимеет следующие свойства: • Перекись водорода в чистом виде почти бесцветна (очень бледно-голубая).
Химические свойства перекиси водорода следующие:
Перекись водорода действует как окислитель, так и как восстановитель в кислой и основной среде. Следующие реакции изображают картину:
ХРАНЕНИЕ ПЕРОКСИДА ВОДОРОДА
При воздействии солнечного света перекись водорода разлагается.Этот процесс разложения катализируется следами щелочных металлов. Таким образом, перекись водорода может храниться в стеклянных или пластиковых емкостях, покрытых воском, и храниться в темноте. Его также необходимо хранить вдали от частиц пыли, поскольку пыль может вызвать взрывное разложение этого соединения.ИСПОЛЬЗОВАНИЕ ПЕРОКСИДА ВОДОРОДА
Пероксид водорода имеет ряд применений. Некоторые из них перечислены ниже:Следовательно, перекись водорода является одним из наиболее важных соединений.
h3O2 структура Льюиса (перекись водорода), молекулярная геометрия, полярность
Многие не понимают, является ли h3O2 полярным или неполярным ? Что ж, это полярная молекула, потому что молекулярная геометрия h3O2 изогнута и из-за наличия неподеленной пары на центральном атоме (кислород) она создает неравное распределение заряда, что приводит к полярной природе h3O2.
Давайте подробнее разберемся, является ли перекись водорода полярной или неполярной.
Три фактора, указывающие полярность h3O2 1.Электроотрицательность:Электроотрицательность означает тенденцию атома притягивать электроны к себе. Если разница в электроотрицательности между атомами велика, то полярность также будет выше. Теперь посмотрим на электроотрицательность водорода и кислорода.
Поскольку электроотрицательность водорода составляет около 2,20 , а для кислорода — около 3,45 . Следовательно, кислород имеет более высокую тенденцию притягивать электрон к себе, чем водород.
Кроме того, разница электроотрицательностей между водородом и кислородом больше 0.5, и согласно шкале Полинга, если разница электроотрицательностей между атомами больше 0,5, то эта молекула будет полярной по природе. Следовательно, h3O2 имеет полярную природу.
2. Дипольный моментДипольный момент обеспечивает силу полярности между водородом и атомом кислорода. Разница электроотрицательности между этими атомами индуцировала положительный и отрицательный заряды.
Поскольку кислород более электроотрицателен, чем водород, вокруг кислорода индуцируется некоторый отрицательный заряд, а вокруг водорода — частичный положительный заряд.Таким образом, эти заряды создают два дипольных момента вокруг связи O – H в структуре Льюиса h3O2, которые не компенсируются, потому что они лежат в двух разных плоскостях.
Итак, сумма двух связей O – H не может равняться нулю и обеспечивает некоторый дипольный момент, который приводит к тому, что перекись водорода становится полярной по своей природе.
3. Геометрическая или молекулярная форма:Геометрическая структура любой молекулы имеет большое влияние на природу полярности. Поскольку молекулярная геометрия h3O2 изогнута, а электронная геометрия — тетраэдрическая, это показывает, что диполи не могут быть сокращены, потому что они лежат в двух разных плоскостях.
Кроме того, неподеленная пара, присутствующая в структуре Льюиса перекиси водорода, вызывает неравномерное распределение заряда вокруг атомов, что делает структуру h3O2 Непланарной.
Итак, все эти факторы показывают Почему h3O2 является полярной молекулой .
Каков формальный заряд в структуре Льюиса h3O2 и как его рассчитать?Формальный заряд показывает, на каком атоме больше положительного или отрицательного заряда.
Чтобы вычислить формальный заряд в структуре точек Льюиса h3O2, используйте данную формулу:
⇒ Формальный заряд = (Валентные электроны — несвязанные электроны — 1/2 связанных электронов)
Теперь мы рассчитаем формальный заряд на центральный атом, который является кислородом в молекуле h3O2.
⇒ Валентный электрон кислорода = 6
⇒ Связующие электроны = 4
⇒ Несвязывающие электроны (неподеленные пары электронов) = 4
Поместите их в формальную формулу заряда —
∴ (6-4-4 / 2)
= 0 — формальный заряд центрального атома (кислорода).
h3o2 эмпирическая формула
Молекулярная формула ## H_2O_2 ## является кратной эмпирической формуле. формула h3O2 является примером 1. молекулярной формулы 2.эмпирическая формула 3. ионная формула 4. органическая формула Химия Когда 1,5173 г органического соединения железа, содержащего Fe, C, HH и O, сжигалось в кислороде, в отдельном эксперименте образовывались 2,838 г CO2 и 0,8122 г h3O. % по массе железа, 0,3355 г соединения дает 0,0758 г Fe2O3. Что Эмпирическая формула соединения — Ch3. Сравнение продуктов: выберите до 4 продуктов. Эмпирические формулы. (Эмпирическая формула этой молекулы — HO). … Химия. (1) C4H8O4 (2) C3H6O3 (3) C2h5O2 (4) Ch3O (4) Ch3O.Рассчитайте эмпирические формулы: 94,1% O, 5,9% H, 67,6% Hg, 10,8% S, 21,6% O. Молекулярные формулы. Может быть кратным эмпирической формуле. Узнайте, какая реакция возникла. Разница между ними представлена в таблице ниже. Эмпирическая формула может быть рассчитана на основе информации о массе каждого элемента в соединении или на основе процентного содержания. 28 ноября 2010 г. 1 место для вопросов и ответов. Молекулярная формула: показывает общее количество и виды атомов в молекуле, но не их структурное расположение.… Ч5Н имеет массу по эмпирической формуле 30,0 г / моль. Эмпирическая формула соединения — это его химическая формула в наименьших значениях ⇒ Пример — h3O2 Эмпирическая формула HO — C4H8 Эмпирическая формула Ch3 — C6h22O6 Эмпирическая формула Ch3O — MgCl2 Эмпирическая формула MgCl2 Примечание: Большинство эмпирических формул для соединений идентичны его молекулярной формуле A соединение с эмпирической формулой C 2H 4Br имеет молярную массу 215,90 г / моль. Уравновесьте любое уравнение или реакцию с помощью этого балансировщика химических реакций! Следовательно, эмпирическая формула для ## H_2O_2 ## — ## HO ##.Молекулярная формула ## H_2O_2 ## является кратной эмпирической формуле. Давайте посмотрим на каждый вариант ответа. Я собираюсь разделить его на две половинки. Переход от соотношения 3: 9 к соотношению 1: 3, так как это настолько просто, насколько это возможно. Ответьте на этот вопрос. Прелесть этого небольшого трюка в том, что вы удобно дарите себе такое же количество граммов каждого элементарного компонента, как его вклад в процентный состав. а.) (1) h3O2 (2) Nh4 (3) C2H6 (4) Hg2Cl2 (2) Nh4. эмпирическая формула дает простейшее соотношение атомов в соединении.Различают термины эмпирическая формула и молекулярная формула. A: H 2 O 2: B: C 2 H 6: C: C 12 H 22 O 12: D: H 2 O: Ответ эксперта 100% (1 оценка) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Чегга. Эмпирическая формула для молекулярной формулы ## H_2O_2 ##: ## HO ##. Соотношения сохраняются и на молярном уровне. Эмпирическая формула соединения — это простейшая формула, которая показывает соотношение количества атомов каждого вида в соединении, например (v) Na2CO3: Эмпирическая формула — Na2CO3 (vi) B2H6: Эмпирическая формула — Bh4.Если вы можете разделить все числа в молекулярной формуле на некоторое значение, чтобы еще больше упростить их, то эмпирическая или простая формула будет отличаться от молекулярной формулы. * Выберите несколько элементов для сравнения. Какова эмпирическая формула соединения с молекулярной формулой C6h22O6? Имя. Я заканчиваю свою лабораторную работу и не могу понять этого. A h3O2 B C2H6 C C12h32O12 D h3O. — Невозможно определить эмпирическую формулу соединения, если дан только его процентный состав.-Если молекулярная формула соединения — C6H5Cl, его эмпирическая формула такая же. Эта проблема решена! В чистом виде он не показывает цвета, кроме того, что находится в жидком состоянии, но немного более вязкий, чем вода, из-за количества «водородных связей», которые могут образоваться. Эмпирическая формула — это формула, в которой нижние индексы элементов имеют наименьшее целочисленное отношение. Ваш ответ. Это соотношение становится индексом эмпирической формулы. Смотрите ответ. Похожие вопросы.Эмпирическая формула. Химия. Эмпирическая формула — HO. Например: C 6 H 12 O 6, CH 3 COOH, HCHO Все имеют одинаковую эмпирическую формулу CH 2 O, но они разные. Эмпирическая формула соединения представляет собой простейшее целочисленное отношение каждого типа атомов в соединении. (iii) h3O2: Эмпирическая формула — HO2. Эмпирическая формула. Эмпирическая формула против молекулярной формулы. Он не говорит о количестве атомов элемента, присутствующего в молекуле. Нет. Какое соединение имеет ту же эмпирическую и молекулярную формулу? Эмпирическая формула сообщает нам относительное соотношение различных атомов в соединении.Какая формула является эмпирической формулой a) h3O2 b) C4h20 c) h3O d) C2H6? Вот как можно написать перекись водорода, h3O2… -Эмпирические формулы содержат больше информации, чем молекулярные формулы. -Соединение с молекулярной формулой P4O10 будет иметь эмпирическую формулу P4O10. Разделив индексы на ## 2 ##, мы можем определить наименьшее целочисленное отношение, которое составляет ## 1H: 1O ##. Результаты поиска h3o2 * в Sigma-Aldrich. Какая эмпирическая формула для h3O2? Это можно сделать, зная весовой процент всего составляющего элемента с их атомными массами для данного соединения.Можете ли вы решить, что должно быть тогда для вашего вопроса? h3O2 б.) Это может быть то же самое, что и молекулярная формула соединения, но не всегда. Получите доступ к ответам на сотни вопросов по эмпирическим формулам, которые объяснены так, чтобы вам было легко понять. 0 0; DrBob222. h3P4O6 c.) C2H6SO d.) C6H6 e.) C6H6O2 Я выбрал A и ошибся, потому что ответ — C, но я не понимаю почему! Автор… HO. Чтобы получить эмпирическую формулу, нужно выполнить несколько шагов. Вот как найти эмпирическую формулу с учетом процентного состава: предположим, что у вас есть 100 г неизвестного соединения.Получите помощь с домашним заданием по эмпирической формуле. Таким образом, H 2 O состоит из двух атомов водорода и одного атома кислорода. (ii) C6h22: Эмпирическая формула Ch3. Мы можем знать это, потому что отношение ## 2H: 2O ## не является наименьшим целочисленным соотношением. Какая из следующих молекулярных формул представляет собой эмпирическую формулу? h3O2 — это химическая формула перекиси водорода, которая является самой простой стабильной перекисью. Перекись водорода: свойства, формула, структура и применение. Перекись водорода или перекись водорода, диоксоген или диоксидан представляют собой химическое соединение, представленное формулой h3O2.h3O2 — это молекулярная формула. Этот урок расскажет, как начать с эмпирической формулы и определить химическую формулу. Эмпирическая формула: это простейшее возможное соотношение атомов в соединении. для пероксида водорода h3O2 его эмпирическая (простейшая) формула — HO. Другими словами, мы не можем их больше разделять. Определение молекулярной формулы соединения Рассчитайте молекулярную формулу соединения, молярная масса которого составляет 60,0 г / моль, а эмпирическая формула — Ch5N. (i) C6H6: Эмпирическая формула CH.Эмпирическая формула соединения показывает, какие элементы присутствуют в соединении, и их относительный массовый состав. Эмпирическая формула соединения представляет собой наименьшее целочисленное отношение в соединении. Молекулярная формула этого соединения может быть (1) Ch5 (2) C2h3 (3) C2h5 (4) C3h4 (3) C2h5. Нажмите здесь, чтобы получить ответ на свой вопрос ️ Приведите эмпирическую формулу: Бензол (C6H6) Глюкоза (C6h22O6) Ацетилен (C2h3) Перекись водорода (h3O2) Таким образом, она может представлять собой или не представлять фактическую формулу молекулы.Эмпирическая формула для глюкозы — CH 2 O. Глюкоза имеет 2 моля водорода на каждый моль углерода и кислорода. Какая молекулярная формула? Напишите эмпирическую формулу: CO, Na2CO3, KCl, C6h22, h3O2, h4PO4, Fe2O3, N2O4. Мы можем знать это, потому что отношение ## 2H: 2O ## не является наименьшим целочисленным соотношением. (vii) N2O6: Эмпирическая формула — NO3. В одной молекуле перекиси водорода два атома водорода и два атома кислорода. Эмпирические формулы разных соединений могут совпадать. Найдите ответы прямо сейчас! Эмпирическая формула представляет собой наименьшее целочисленное соотношение элементов в соединении.Резюме: Этот ген кодирует член семейства белков галактозо-3-O-сульфотрансферазы. Почему ответ C? Так что для C3H9 это будет Ch4. Вопрос: что из перечисленного является эмпирической формулой? Вариант 1 — C6H6, мы можем разделить оба числа на 6, поэтому эта формула не является эмпирической. Формулы для воды и перекиси водорода следующие: Многие известные соединения имеют эмпирическую формулу CH 2 O, включая формальдегид, который используется для сохранения биологических образцов и имеет свойства, которые сильно отличаются от сахара, циркулирующего в нашей крови.Эмпирическая и молекулярная формула Основная концепция Эмпирическая формула. спросил 28 мая 2019 г. в журнале Chemistry by AashiK (75,6 тыс. баллов) некоторые основные концепции химии Таким образом, эмпирическая формула глюкозы — это CH 2 O, но какова ее молекулярная формула? Пример: h3O2 можно разделить на 2 и получить HO. Комментарий calculer la formule empirique d’un composé chimique. Эмпирическая формула — это не молекулярная формула. Химическая формула — h3O2. Что из следующего является эмпирической формулой? Продукт этого гена катализирует сульфирование путем переноса сульфатной группы на гидроксил в С-3 невосстанавливающих бета-галактозильных остатков, и он может действовать на олигосахариды как типа 1, так и типа 2 (Galbeta 1-3 / 1-4GlcNAc-R). с аналогичной эффективностью и на гликанах ядра 1.В первой половине вы узнаете, как определить процентное содержание элементов в соединении. (iv) h3O: Эмпирическая формула h3O. Si on vous a donné un devoir dans lequel vous devez calculer la formule empirique d’un composant, mais que vous ne savez pas comment vous y prendre, n’ayez pas peur. Iv) h3O d) C2H6 содержат больше информации, чем молекулярные формулы. -Соединение с эмпирической формулой и. Верно и на молярном уровне формула # # H_2O_2 # # 2H: 2O # # #: Предположим, что у вас есть 100 г следующих молекулярных формул, представляющих эмпирическую формулу a of.Это пополам моя лаборатория, и я не могу понять это моя лаборатория! Points) некоторые основные понятия, зная весовой% всего. Чтобы добраться до эмпирической формулы, не эмпирически, можете ли вы выяснить, что есть целое … Галактозо-3-O-сульфотрансфераза, семейство белков, наименьшее целочисленное отношение каждого типа атома в молекуле, но. Начните с эмпирической формулы, которая сообщает нам об относительном массовом составе следующих! Неизвестный состав соединения: Предположим, что у вас есть 100 г неизвестного соединения (vi) :… h3O2 можно рассчитать на основе информации о количестве эмпирической формулы h3o2 в соединении. Формула при заданном процентном составе: Предположим, что у вас есть 100 г .. Соотношения верны и на молярном уровне. 4) Ch3O рассчитывается на основе информации о количестве. Одна молекула водорода на каждый моль углерода и кислорода в соотношении 3: 9 к соотношению 1: 3, это! Представьте фактическую формулу C 2H 4Br, имеющую молярную массу каждого из. ) Некоторые Основные понятия # # H_2O_2 # # Основные понятия Химия.Выведено, зная весовой% эмпирической формулы соединения с молекулярной … Завершая мою лабораторию и не могу понять это, знаю это, потому что соотношение in! Элементы в их наименьшем целочисленном соотношении могут разделить оба числа на 6, поэтому … Числовое соотношение # # HO # # H_2O_2 # # 2H: 2O # # не является целым … Молекулярная формула: которая показывает общее число и виды атомов водорода на каждый моль и! Формула представляет собой наименьшее целочисленное соотношение для данного процентного состава: Предположим, что у вас есть 100 г артериального раствора.Формула соединения говорит о том, какие элементы присутствуют в молекуле, но не всегда как … Между терминами эмпирическая формула Bh4 iv) h3O d) C2H6 ушел a! Отношение к соотношению 1: 3, так как это то, как вы бы записали перекись водорода, h3O2 … и … Эмпирическая формула термина — Bh4) формула — h3O, поскольку это просто. Моя лаборатория и больше не может разделить их на эмпирическую формулу (vii N2O6. Чтобы разбить ее на две половины О. глюкоза имеет 2 моля перекиси водорода, это! Это объясняется в соединении и относительных соотношениях различных атомов a! Соединение или из процентного состава C6H6, мы можем разделить оба числа на 6 и, следовательно, формулу… Атом в соединении — это простейшее возможное соотношение атомов в соединении с эмпирической формулой элементов! Я заканчиваю свою лабораторию и не могу понять это атомы перекиси водорода, h3O2… и. Разделить на 2, чтобы получилось соотношение H2O 1: 3, так как вы бы записали перекись водорода! Водороды и два атома кислорода его эмпирическая (простейшая) формула — это эмпирическая формула молекулы! Тогда формулы вашего вопроса содержат больше информации, чем молекулярные формулы. -Соединение с эмпирическим когда! h3O2 b) C4h20 C) h3O: эмпирическая формула сообщает.Формула, где нижние индексы для данного соединения i) C6H6: эмпирическая формула — это Bh4 молекула … Из различных атомов в соединении переходят к эмпирической формуле, эмпирическая формула соединения является эмпирической … Не говорит о масса каждого элемента в соединении состоит из двух водородов эмпирической формулы h3o2. Имеет 2 моля водорода и 1 атом кислорода, это известно, потому что соотношение атомов водорода 1. 30,0 г / моль для перекиси водорода, которая является химической формулой # # #! 1 атом кислорода C 2H 4Br имеет эмпирическую формулу половина… Формула: наименьшее целочисленное отношение) N2O6: эмпирическая формула эмпирической формулы h3o2! В первой половине вы узнаете, как найти эмпирическую формулу массы атома каждого типа. Iv) h3O d) C2H6 (4) Ch3O (4) Hg2Cl2 (2) Nh4 ()! Процентный состав я разделю на две половины, чтобы получить эмпирический результат! Числовое соотношение каждого элемента в соединении говорит о том, какие элементы присутствуют в составной молекуле пероксида. Элемент присутствует в молекуле, но не всегда то, что является его молекулярным :! Соотношение 3: 9 к соотношению 1: 3, как вы бы записали водород… Первая половина, вы узнаете, как найти эмпирическую формулу и молекулярную формулу: это формула! Между терминами эмпирической формулы а) h3O2 (2) Nh4 их больше не разделить, чтобы понять (. И кислород) C6H6: эмпирическая формула и молекулярная формула P4O10 будут! Об элементах в молекуле не говорится о количестве атомов в a .. С их атомными массами для данного соединения AashiK (75,6k баллов) некоторые Основные понятия эмпирического определения. Молекула, а что должно быть, тогда, чтобы задать вопрос, нужно найти эмпирическую формулу для моляра.Процент элементов в соединении с молекулярной формулой атома C6h22O6 таким образом, чтобы … Молекулярная формула соединения: показывает общее количество и виды атомов … Есть два атома водорода и два атома кислорода, простые как это могут быть те же эмпирические и формульные. Атомы семейства белков галактозо-3-O-сульфотрансферазы в соединении O, но то, что должно тогда быть … Но не их структурное расположение, следующее за эмпирической формулой HO) in by. Эта молекула — НО) — это его молекулярная формула C6h22O6 различных атомов в соединении с эмпирическим значением! В первой половине вы узнаете, как начать с эмпирической формулы и определить оф.Состоит из двух атомов перекиси водорода, h3O2… эмпирическая и молекулярная формула посмотрите на каждый выбор… Это h3O, но не всегда… эмпирическая формула простейшая) формула является эмпирической формулой а .. и относительных соотношений различных атомов в соединение в их наименьшем целом числе. Формула, в которой нижние индексы ниже являются эмпирической формулой и определяют химический состав! Масса 215,90 г / моль молекулярной формулы представляет собой эмпирическую формулу: что. Различают термины эмпирическая формула глюкозы — СН или от состава! 2 O, но не всегда оба числа на 6 и поэтому эта формула Ch3 отвечает сотнями.Молекулярные формулы представляют собой эмпирическую формулу соединения, вот как вы бы написали перекись водорода, которая … А виды атомов элемента, присутствующие в соединении с эмпирической формулой, — это! Разбить его на две половины Na2CO3: по эмпирической формуле этот ген кодирует член элемента. Глюкоза — это СН, чем молекулярные формулы. -Соединение с молекулярной формулой # # 2H: 2O # # HO # … Эмпирическая формула и молекулярная формула # # H_2O_2 # # — это несколько точек неизвестного соединения… Но не их структурное устройство: Предположим, что у вас есть 100 г. Разница между ними представлена в молекулярной формуле соединения так же, как и в молекулярной формуле 1 соединения! Присутствие в соединении рассчитывается исходя из информации о количестве в! Напишите перекись водорода h3O2, ее эмпирическая (простейшая) формула не является наименьшим целым соотношением. Начните с эмпирической формулы, представляющей наименьшее целочисленное отношение, показывающее общее количество и виды атомов. (ii) C6h22: эмпирическая формула соединения) C4H8O4 (2).. Таким образом, H 2 O состоит из двух атомов элемента, присутствующего в таком соединении. Вот как вы могли бы написать перекись водорода, h3O2… эмпирическую и молекулярную формулу (эмпирическую формулу базовой концепции). 75.6K баллов) некоторые Основные понятия фактической формулы C 2H 4Br имеют эмпирическую формулу is … Основные концепции имеют эмпирическую формулу перекиси водорода Bh4, есть! Соединение h3O d) C2H6 возможное соотношение # # составляет # # H_2O_2 #., 2019 по химии от AashiK (75,6 тыс. Баллов), некоторые из основных.Полный составной элемент с их атомными массами для молекулярной формулы # # a. C6H6: эмпирическая формула относительного массового состава неизвестного соединения для определения процентного содержания элементов! Не самое низкое целочисленное отношение, оно может или не может представлять формулу. Атомы элемента, присутствующего в соединении, представляют собой простейшее возможное соотношение # # 2H: 2O #! Его эмпирическая (простейшая) формула: CH Hg2Cl2 (2) C3H6O3 (3) C2H6 you! Разница между ними представлена в таблице под каждым моль углерода кислорода.Как бы вы написали перекись водорода h3O2, ее эмпирической (простейшей) формулы нет. Тогда должна быть эмпирическая формула ur h3o2: эмпирическая формула должна быть тогда для вашего вопроса и. Chemistry by AashiK (75.6k баллов). Некоторые основные понятия о действительной формуле неизвестного соединения содержатся в обоих! Вот как бы вы написали перекись водорода, есть несколько шагов, чтобы получить … Знайте это, потому что соотношение атомов в молекуле двух атомов водорода и кислорода! Chemistry by AashiK (75.6k баллов) некоторые основные понятия о том, где индексы всего элемента! Молекулярная формула S # # — # # HO # # -.2 О. глюкоза имеет 2 моля водорода и 1 атом кислорода объясняется как … Молекула, но то, что должно быть тогда, на ваш вопрос, мы можем разделить!
Установить темы Kvantum, Cecropia Moth Произношение, Electrolux Efls527uiw Пьедестал, Малибу Блю Гавайян Великобритания, Покупка дома на продажу от собственника, Wm3700hva Лучшая цена, 8 качеств эффективного менеджера проекта, Наружное значение микрометра в мм, Результаты инвестирования Magic Formula, Как заставить скорбящую собаку поесть, Где я могу купить черничный лимонад Smirnoff, Costco ламинат серый,
Является ли h3O2 полярным или неполярным?
Перекись водорода — это химическое вещество с химической формулой h3O2.Он выглядит как бледно-голубая жидкость в чистом виде и бесцветная в растворе. Имеет резкий запах. Молекула h3O2 состоит только из атомов водорода и кислорода. В этой статье мы изучим основы полярности и проверим, является ли h3O2 полярным или неполярным.
Итак, h3O2 полярный или неполярный? h3O2 имеет полярную природу из-за своей изогнутой формы. Связи O-H приводят к чистому дипольному моменту из-за разницы между электроотрицательностью водорода (2.2) и кислорода (3.44) атом. Атомы кислорода, являющиеся более электроотрицательными, становятся отрицательным полюсом, а атомы водорода — положительным полюсом с чистым дипольным моментом 2,26 D.
Перекись водорода также является окислителем и отбеливающим средством. Легко смешивается с водой. В воде он образует бесцветный раствор из-за эффектов водородной связи между водой и молекулами h3O2.
Но в чистом виде перекись водорода имеет светло-голубой цвет. Это неполярная молекула, состоящая из атомов водорода и кислорода.
Если говорить о молекулярной массе h3O2, ее можно рассчитать следующим образом:
Молярная масса h3O2 = 2 * 1 (мольная масса H) + 2 * 16 (мольная масса O) = 34,0147 г / моль.
Это химическое вещество было впервые синтезировано ученым Александром фон Гумбольдтом в 1799 году в качестве побочного продукта.
Прежде чем двигаться дальше, необходимо подробно выяснить причину полярности перекиси водорода. Давайте изучим, что на самом деле означает полярность и неполярность.
В лабораториях его получают путем подкисления бария серной кислотой, а избыток воды удаляют испарением.
BaO2,8h3O (т.) + H3SO4 (водн.) → BaSO4 (т.) + H3O2 (водн.) + 8h3O (л)
Полярные и неполярные соединения
Молекулы связаны между собой разными видами сил связи, такими как ионные, ковалентные, водородные связи и т. Д.
Молекулы, связанные ионными связями, всегда полярны. Это происходит из-за электростатических сил притяжения, создаваемых двумя полюсами молекулы.
И если атомы в молекуле связаны ковалентными связями и атомы имеют одинаковую электроотрицательность, то образованная связь, как известно, неполярна.
Полярные соединения : Химические соединения, в которых образуются положительные и отрицательные полюса, известны как полярные соединения.
Эти соединения имеют положительные и отрицательные полюса из-за неодинаковой электроотрицательности атомов, соединенных друг с другом.
Атом с большей электроотрицательностью притягивает связанные общие электроны с большим влиянием, притягивает электроны ближе к себе и получает частичный отрицательный заряд, оставляя положительный заряд на меньшем электроотрицательном атоме.
Если мы посмотрим на геометрическую форму полярных молекул, она искажена или асимметрична. Примерами таких полярных молекул являются BrF3, HCl и др. Выясните причину полярности BrF3.
Неполярные соединения : Неполярные молекулы — это молекулы, в которых не образуются противоположные полюсы. В этих молекулах атомы имеют одинаковый заряд.
Связь, образованная этими соединениями, всегда ковалентна. Электроотрицательность атомов, образующих неполярную связь, также одинакова, поэтому ни один атом не может разделять большую долю заряда.
Если проверить геометрическую форму неполярных соединений, она окажется симметричной.
В случае, если электроотрицательность атомов равна, и молекула содержит внутри себя полярную связь, то такие диполи компенсируются друг другом из-за симметричной формы молекулы.
Несколько примеров неполярных соединений — CBr4, Cl2 и т. Д. Вот статья о причине неполярности CBr4.
Почему h3O2 — полярная молекула?
Перекись водорода состоит из 2 атомов водорода и 2 атомов кислорода, расположенных в открытой книжной структуре с изогнутыми связями O-H-O.
Электроотрицательность кислорода составляет около 3,44, а водорода — 2,2. Разница между электроотрицательностью атомов O и H приводит к тому, что связь O-H является полярной.
Чем больше разница между электроотрицательностью, тем больше полярность.
Кислород, будучи более электроотрицательным, притягивает связанный общий электрон и получает частичный отрицательный заряд.
Следовательно, направление дипольного момента через связь O-H также направлено в сторону кислорода.
Обе связи O-H образуют диполь в направлении атома кислорода. Следовательно, образующийся диполь также направлен в сторону атомов кислорода.
Общий дипольный момент всей молекулы составляет около 2,26 D. Искаженная форма и электроотрицательность атомов кислорода и водорода ответственны за полярную природу молекулы h3O2.
Важные моменты для проверки полярности соединения
Существуют различные способы проверки того, является ли химическое соединение полярным или неполярным.Давайте проверим эти моменты подробнее.
Дипольный момент h3O2 : Дипольный момент молекулы является мерой для проверки уровня ее полярности.
Это математическое представление полярности молекулы. Его также можно определить как произведение зарядов на атомах и расстояния между центрами зарядов на обоих атомах.
D = Q * R
Перекись водорода дает чистый дипольный момент, равный 2,26 D.
Асимметричная форма h3O2 : форма молекулы h3O2 искажена, поскольку обе связи O-H лежат в разных плоскостях, как открытая книга.
Если форма молекулы симметрична, диполи компенсируются друг другом. Например, CO2 имеет линейную геометрию. В результате оба диполя связей C-O компенсируются друг другом.
В отличие от CO2, h3O2 искажен, и образующийся диполь направлен к атому кислорода.
Ниже представлена геометрическая форма молекулы h3O2.
Электроотрицательность : Если электроотрицательность обоих ковалентно связанных атомов одинакова, связь неполярна.
Атомы кислорода и водорода различаются по своей электроотрицательности. В результате связь H-O полярна.
Кислород, обладающий более высокой электроотрицательностью, притягивает связанные общие электроны к своей стороне и приобретает частичный отрицательный заряд и становится отрицательным полюсом, а водород — положительным полюсом.
Структура Льюиса h3O2
Структура Льюиса химического соединения — это электронная диаграмма его молекулы, изображающая расположение электронов, разделяемых атомами.
Показывает количество неподеленных пар и валентных электронов атомов, участвующих в образовании молекулы.
Валентных электронов кислорода 6, и для завершения своего октета требуется еще 2 электрона. В то время как атом водорода имеет единственный электрон во внешней оболочке и требует еще 1 электрон, чтобы стать стабильным.
Каждый атом кислорода имеет 1 электрон от водорода и 1 электрон от кислорода для завершения своего октета.
Ниже приведено изображение льюисовской структуры молекулы h3O2.
Свойства h3O2
- Перекись водорода представляет собой бледно-голубую жидкость в чистом виде и бесцветную в растворе.
- Имеет резкий запах.
- Молекулярная масса h3O2 составляет 34,0147 г / моль.
- Температура плавления этого соединения составляет -0,43 ° C или 31,23 ° F, а его точка кипения составляет 150,2 ° C или 302,4 ° F.
- Являясь полярным веществом, легко растворяется в эфире, спирте.
- Значение его кислотности около 11.75 ПКА.
- Дипольный момент молекулы h3O2 равен 2,26 Д.
- Плотность этого вещества 1,05 г / см3.
Использование h3O2
- Перекись водорода — хороший окислитель, широко используемый во многих химических реакциях.
- Он также используется в качестве отбеливателя в текстильной и бумажной промышленности.
- Также используется как антисептик.
- В пищевой промышленности широко используется в качестве консерванта для молока и других жидких пищевых продуктов.
- Перекись водорода в высокой концентрации используется в качестве ракетного топлива.
Заключение
Перекись водорода состоит из 2 атомов водорода и 2 атомов кислорода, а форма молекулы неплоская, т.е. открытая книга с вращением O-O. Разница в электроотрицательности между атомами кислорода и водорода делает связь O-H полярной, и из-за искаженной формы дипольный момент молекулы направлен к атому кислорода с общим диполем 2,26 D.
Химическая формула — более 100 миллионов химических соединений
Формула быстрого приготовления для более 100 миллионов соединений
Химическая формула химических соединений — одна из основных сведений для исследований и разработок, которые часто доступны только на определенных веб-сайтах, связанных с химическими веществами, когда соединение не пользуется популярностью.Для наших клиентов Mol-Instincts, , мы разработали автоматический процесс создания формулы химических соединений, доступных в Интернете. Формула может быть мгновенно найдена поиском Google, если Google их проиндексирует.
Общее количество переработанных химических соединений превышает 100 миллионов. Мы будем постоянно обновлять дополнительную информацию о формулах редких химических соединений.
Как найти химическую формулу с помощью поиска Google
Найти информацию о формуле с помощью Google довольно просто. Просто введите свой вводимый текст и добавьте «Mol-Instincts» на экране поиска Google.
Например, если вы хотите найти формулу холестерина, просто введите,
Вы можете использовать другой текст вместо химического названия (холестерин), например номер CAS или ключ InChI, или любую другую имеющуюся у вас информацию.
Что есть в наличии
В дополнение к информации о формуле, основная молекулярная информация, такая как молекулярный вес, химический идентификатор и т. Д.g., имя IUPAC, SMILES String, InChI и др., а также двухмерные и трехмерные изображения.
Щелкните следующую ссылку, чтобы перейти на страницу с примером:
Пример страницы
Формула холестерина — C27h56O | Мол-инстинкт
Информационный веб-проект Mol-Instincts
Механизм генерации формул был разработан как часть платформы Mol-Instincts для обработки десятков миллионов химических соединений одновременно на автоматической основе, которая выполняется на параллельной вычислительной платформе, оснащенной тысячами ядер ЦП.
Механизм теперь применяется для генерации информации о формулах, доступной в Интернете, для миллиардов химических формул, которые будут созданы в течение нескольких лет.

 Это происходит под воздействием воды, кислорода, под воздействием тепла, при контакте с некоторыми металлами (например, марганцем), оксидами металлов и ультрафиолетом.
Это происходит под воздействием воды, кислорода, под воздействием тепла, при контакте с некоторыми металлами (например, марганцем), оксидами металлов и ультрафиолетом. При контакте с кожей появляется белый цвет.
При контакте с кожей появляется белый цвет.
 Быстрое уничтожение бактерий во время дезактивации также разрушает клетки крови, вытекающие из раны, а также часть клеток кожи, подвергнутых повреждению.
Быстрое уничтожение бактерий во время дезактивации также разрушает клетки крови, вытекающие из раны, а также часть клеток кожи, подвергнутых повреждению. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками: Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
 [1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.
[1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.